È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Dissezione e colorazione di Drosophila Larvali ovaie
In questo articolo
Riepilogo
Come nicchie e le cellule staminali si formano durante lo sviluppo è una questione importante con implicazioni pratiche. Nel Drosophila, germe di cellule staminali e la loro linea di nicchie somatiche formano durante lo sviluppo larvale. Questo video mostra come sezionare, macchia e montare gonadi femminili dalla fine del III instar (LL3) Drosophila Larve.
Abstract
Molti organi dipendono da cellule staminali per il loro sviluppo durante l'embriogenesi e per la manutenzione o la riparazione durante la vita adulta. Capire come le cellule staminali forma, e come interagiscono con l'ambiente è quindi cruciale per la comprensione dello sviluppo, l'omeostasi e malattia. Dell'ovaio del moscerino della frutta Drosophila melanogaster ha servito come modello influente per l'interazione delle cellule staminali della linea germinale (GSCs) con le loro cellule somatiche di supporto (di nicchia) 1, 2. La posizione nota della nicchia e la GSCs, unita alla capacità di manipolare geneticamente, ha permesso ai ricercatori di chiarire una serie di interazioni tra cellule staminali e le loro nicchie 3-12.
Nonostante la ricchezza di informazioni sui meccanismi che controllano la manutenzione GSC e differenziazione, relativamente poco si sa su come GSCs e le loro nicchie di somatico forma durante lo sviluppo. Circa 18 nicchie somatiche, il cui cellulare componenti includono filamento terminale e cellule tappo (Figura 1), si formano durante la terza larvale instar 13-17. GSCs originano dalle cellule germinali primordiali (PGC). PGC proliferano in primi stadi larvali, ma in seguito alla formazione della nicchia un sottogruppo di PGC diventa GSCs 7, 16, 18, 19. Insieme, le cellule somatiche di nicchia e la GSCs fare una unità funzionale che produce uova per tutta la vita dell'organismo.
Molte domande riguardanti la formazione del gruppo GSC rimangono senza risposta. Processi quali il coordinamento tra le cellule precursore per nicchie e precursori di cellule staminali, o la generazione di asimmetria all'interno PGC man mano che diventano GSCs, può essere meglio studiato nella larva. Tuttavia, uno studio metodico di sviluppo dell'ovaio larvale è fisicamente impegnativo. In primo luogo, le ovaie sono piccole larve. Anche al fine di stadi larvali sono solo 100μm di diametro. Inoltre, le ovaie sono trasparenti e sono integrati in un corpo grasso bianco. Qui si descrive passo per passo il protocollo per isolare ovaie da fine del III instar (LL3) larve di Drosophila, seguita dalla colorazione con anticorpi fluorescenti. Vi offriamo alcune soluzioni tecniche a problemi quali localizzare le ovaie, colorazione e lavaggio dei tessuti che non affondare, e fare in modo che gli anticorpi penetrano nel tessuto. Questo protocollo può essere applicato a stadi precedenti larvali e di testicoli larvale pure.
Protocollo
1. La deposizione delle uova
- Cinque giorni prima della dissezione: permette femmine accoppiate per deporre le uova per 2-4 ore con cibo fresco integrato con il lievito. Per ottenere larve sincronizzato e ben sviluppato, è importante non avere colto sovraffollamento (circa 30 uova / fiala 25mm). Tipicamente, 7-16 femmine sono utilizzati per flaconcino, a seconda di quanto bene laici.
2. Selezione larve
- Preparare un 9-ben piatto di vetro riempita con mezzo di dissezione Ringer (128mm NaCl, 2mM KCl, CaCl 2 1,8 mm, 4mm MgCl 2, 35.5mm saccarosio, 5mm Hepes pH 6,9).
- Preparare filtri cella in una sei pozzetti contenenti medio di Ringer e posizionarlo sul ghiaccio. In alternativa, possiamo utilizzare stampi appositamente dotato di una rete di nylon.
- Scegli larve tempo dalle pareti fiala usando bene le pinzette biologici (forcipe) e metterli in un piatto contenente sezionare la suoneria di.
- Trasferire una larva femminile per un pozzo pulito. Si distinguono i maschi dalle femmine per la loro gonadi. Testicoli maschili sono facilmente identificabili come grandi ovali chiare incorporato nel terzo posteriore del corpo grasso. Ovaie femminili, che si trova alla stessa parte del grasso corporeo, può essere identificato come un molto più piccolo, chiaro, sfere rotonde.
3. Dissezione di larva
- Tenere la larva giù appena posteriore al cervello con una pinza e togliere la testa con un secondo paio di pinze.
- Mettere la restante parte posteriore sul lato dorsale, con la trachea verso il basso.
- Tenere la larva dagli spiracoli posteriori con un paio di pinze e spingerlo lentamente verso l'interno, mentre l'altra coppia sta scivolando la cuticola posteriormente fino a circa la metà del grasso corporeo larvale emerge.
- Tengono saldamente l'estremità posteriore e usare l'altra coppia di pinze a tenere liberamente la cuticola. Delicatamente e lentamente tirare via le estremità posteriore in modo che la cuticola e la diapositiva intestino collegato attraverso la fessura. Alla fine di questo processo, il grasso corporeo dovrebbe essere completamente separato dal intestino e la cuticola. Scollegare l'intestino dalla parte anteriore del corpo grasso. Per rendere la colorazione e montaggio più semplice, è importante che il corpo di grasso rimarrà intatto.
- Wet una pipetta pascolo a fondo con medie di Ringer, preferibilmente da un pozzetto contenente larve sezionato. Questo aiuta a cappotto la pipetta e impedisce al corpo di grasso di attaccarsi ad essa. Utilizzare la pipetta pascolo per trasferire il grasso corporeo in media il Ringer ghiacciata nella cella di filtro.
4. Fissazione e colorazione
Tutti i passaggi vengono eseguiti a temperatura ambiente, fatta eccezione per l'incubazione con il primo anticorpo, a 4 ° C.
- Incubare il grasso corporeo in 5% di formaldeide in media di Ringer. per 20 minuti con agitazione.
- Lavare per 5 minuti con 1% PBT (1% Triton X-100 in PBS). Ripetere questo passaggio per 10 minuti e una terza volta per 45 minuti. 1% Triton X-100 è necessario per perforare l'ovaio larvale e anticorpi permettono di penetrare in esso.
- Blocco con PBTB 0,3% (0,3% Triton X-100 e 1% BSA in PBS) per 1 ora e scuotendo con cautela
- Incubare con l'anticorpo desiderato 1 ° diluito in 0,3% PBTB durante la notte a 4 ° C con agitazione. Questo passo è di solito eseguita in provette da 0,2 ml su un rullo.
- Trasferimento di grasso corporeo indietro filtri cellulare.
- Lavare 3 volte, a 30 minuti ciascuno, con il 0,3% PBTB scuotendo con cautela.
- Blocco con il 0,3% PBTB integrato con asino siero normale al 5% per 1 ora e scuotendo con cautela.
- Incubare con un anticorpo secondario diluito appropriato (secondo le specifiche del produttore) nella soluzione bloccante (0,3% PBTB arricchito con 5% di siero asino normale nello 0,3% PBT) per 2 ore con agitazione. Se l'anticorpo è fluorescente, incubare al buio da questo punto in avanti. Questo passo è di solito eseguita in provette da 0,2 ml su un rullo.
- Lavare 3 volte per 30 minuti ciascuno con 0,3% PBT e scuotendo con cautela.
5. Montaggio
- Trasferire il grasso corporeo in una provetta eppendorf pulita. Con molta attenzione rimuovere tutti i liquidi lontani e coprire immediatamente con i media Vectashield montaggio. Noi usiamo Vectashield routine, dato che non si indurisce, mentre le ovaie vengono separati dal grasso corporeo.
I campioni possono essere memorizzati in supporti di montaggio a 4 ° C per un massimo di una settimana. - Tagliare l'estremità di un puntale e utilizzarlo per trasferire con attenzione il grasso corporeo, con volume minimo di supporti di montaggio (circa 30 microlitri per 30 millimetri di copertura antiscivolo) su un vetrino da microscopio.
- Utilizzare due titolari pin placcato nichel, tenendo 0,1 mm di diametro perni per diffondere il grasso corporeo. Le ovaie sono situate al terzo posteriore del corpo grasso. Il corpo di grasso che li circonda di solito a forma come un 'fiore'. Questo aiuta a identificare la posizione delle ovaie. Sezionare i 'fiori' dal resto del corpo il grasso ed eliminare il secondo.
- Togliere il grasso corporeo SurroINANZIAMENTO della gonade attraversando i due perni con attenzione intorno ad esso. Posizionare la gonade isolato sul scivolare via dal residuo di grasso corporeo.
- Coprire con un vetrino e sigillare con smalto.
- Visualizzare direttamente utilizzando un microscopio confocale. Campioni possono essere conservati a 4 ° C per un massimo di tre settimane.
6. Rappresentante Risultati
Abbiamo usato il protocollo di sopra di seguire la creazione di linee cellulari diverse all'interno dell'ovaio somatiche, tra cui GSCs e le loro nicchie di somatico. A questo scopo si utilizza anticorpi specifici e indicatori di distinguere tra i diversi tipi di cellule della gonade via di sviluppo. Qui vi mostriamo un esempio di due LL3 ovaie colorati con diverse combinazioni di anticorpi. Figura 1A evidenzia filamento terminale e cellule cappuccio (verde), che insieme formano le cellule somatiche della nicchia. Figura 1B, mostra le cellule Interlacciati (IC, magenta), che direttamente in contatto con le cellule germinali (blu).
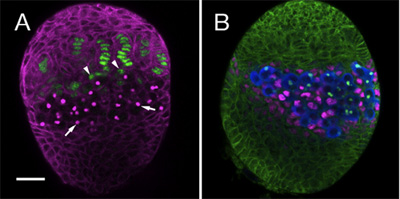
Figura 1. LL3 ovaie. (A) 1B1 anticorpo monoclonale (magenta) delinea le cellule somatiche e le macchie della fusome, un organello intracellulare all'interno di PGC (frecce). La trappola enhancer HH-lacZ (anti β-galattosidasi, verde) è espresso in filamenti terminale. Alla base del filamento di cellule somatiche tappo (punte di freccia) possono essere osservati. (B) anticorpi 1B1 (verde) delinea tutte le cellule somatiche nell'ovaio. Anti-Vasa (blu) etichette tutti i PGC. PGC contattare direttamente le cellule Interlacciati (IC, anti-ingorgo, magenta). Bar (per A e B) è di 20 micron.
Discussione
Questo video dimostra un isolamento e il protocollo di colorazione della fine del III instar ovaie larvale. Per eseguire questo protocollo di routine e in modo affidabile, l'attenzione dovrebbe essere prestata ai seguenti punti:
- Per le larve sincronizzati e ben sviluppato, oltre affollamento deve essere evitato.
- Per evitare la perdita delle ovaie piccole traslucido, assicurarsi di sezionare il corpo di grasso intatto. Questo aiuterà anche a trovare le ovaie in fase di montaggio, in particolar...
Divulgazioni
Riconoscimenti
IM è supportato dal Marie Curie di reintegrazione di sovvenzione. Questo lavoro è stato sostenuto dal Fondo non Scienza Israele Grant. 1146-1108, da Helen e Martin Kimmel Istituto per la ricerca sulle cellule staminali presso il Weizmann Institute of Science e la Fondazione Leir beneficenza.
Materiali
| Name | Company | Catalog Number | Comments |
| NaCl | JT Baker | ||
| Kcl | Merck & Co., Inc. | ||
| CaCl2 | Sigma-Aldrich | ||
| MgCl2 | Merck & Co., Inc. | ||
| Sucrose | JT Baker | ||
| Hepes | Sigma-Aldrich | ||
| PBS | Sigma-Aldrich | ||
| Triton X-100 | Sigma-Aldrich | ||
| Albumin Bovine Fraction V | MP Biomedicals | 160069 | |
| Dumont biology tweezers 5 dumstar polished | Fine Science Tools | 11295-10 | |
| Nickel plated pin holder | Fine Science Tools | 26018-17 | |
| s.s minutien pins 0.1mm diam, 10mm long | Fine Science Tools | 26002-10 | |
| 9 well plates 85X100 mm, 22mm o.d.x7mm deep | Corning | 7220-85 | |
| Stereo Microscope MZ 16.5 with a standard transmitted light base TL ST | Leica Microsystems | ||
| 6 well plates | Costar | 3516 | |
| Slides | Menzel-Glaser | 798 | |
| Cover slips | Corning | 2940-223 | |
| Mounting media | Vectashield | H-1200 | |
| Cell strainer | Falcon BD | FAL352350 | |
| 1B1 antibody | Developmental Studies Hybridoma Bank | ||
| Anti-Traffic Jam | Laboratory of Dr. Dorothea Godt | ||
| Anti-Vasa | Laboratory of Dr. Ruth Lehmann | ||
| Anti β-Galactosidase | Cappel | ||
| Secondary Antibodies | Jackson ImmunoResearch |
Riferimenti
- Fuller, M. T., Spradling, A. C. Male and female Drosophila germline stem cells: two versions of immortality. Science. 316, 402-404 (2007).
- Li, L., Xie, T. Stem cell niche: structure and function. Annual review of cell and developmental biology. 21, 605-631 (2005).
- Chen, D., McKearin, D. Gene circuitry controlling a stem cell niche. Curr Biol. 15, 179-184 (2005).
- Kai, T., Spradling, A. An empty Drosophila stem cell niche reactivates the proliferation of ectopic cells. Proceedings of the National Academy of Sciences of the United States of America. 100, 4633-4638 (2003).
- Kai, T., Spradling, A. Differentiating germ cells can revert into functional stem cells in Drosophila melanogaster ovaries. Nature. 428, 564-569 (2004).
- Lopez-Onieva, L., Fernandez-Minan, A., Gonzalez-Reyes, A. Jak/Stat signalling in niche support cells regulates dpp transcription to control germline stem cell maintenance in the Drosophila ovary. Development. 135, 533-540 (2008).
- Song, X., Zhu, C. H., Doan, C., Xie, T. Germline stem cells anchored by adherens junctions in the Drosophila ovary niches. Science. 296, 1855-1857 (2002).
- Tazuke, S. I. A germline-specific gap junction protein required for survival of differentiating early germ cells. Development. 129, 2529-2539 (2002).
- Xie, T., Spradling, A. C. decapentaplegic is essential for the maintenance and division of germline stem cells in the Drosophila ovary. Cell. 94, 251-260 (1998).
- Xie, T., Spradling, A. C. A niche maintaining germ line stem cells in the Drosophila ovary. Science. , 290-328 (2000).
- Guo, Z., Wang, Z. The glypican Dally is required in the niche for the maintenance of germline stem cells and short-range BMP signaling in the Drosophila ovary. Development. 136, 3627-3635 (2009).
- Wang, X., Harris, R. E., Bayston, L. J., Ashe, H. L. Type IV collagens regulate BMP signalling in Drosophila. Nature. 455, 72-77 (2008).
- Godt, D., Laski, F. A. Mechanisms of cell rearrangement and cell recruitment in Drosophila ovary morphogenesis and the requirement of bric a brac. Development. 121, 173-187 (1995).
- Sahut-Barnola, I., Godt, D., Laski, F. A., Couderc, J. L. Drosophila ovary morphogenesis: analysis of terminal filament formation and identification of a gene required for this process. Developmental biology. 170, 127-135 (1995).
- Song, X., Call, G. B., Kirilly, D., Xie, T. Notch signaling controls germline stem cell niche formation in the Drosophila ovary. 134, 1071-1080 (2007).
- Zhu, C. H., Xie, T. Clonal expansion of ovarian germline stem cells during niche formation in Drosophila. Development. 130, 2579-2588 (2003).
- Ward, E. J. Stem cells signal to the niche through the Notch pathway in the Drosophila ovary. Curr Biol. 16, 2352-2358 (2006).
- Gilboa, L., Lehmann, R. Repression of primordial germ cell differentiation parallels germ line stem cell maintenance. Curr Biol. 14, 981-986 (2004).
- Gilboa, L., Lehmann, R. Soma-germline interactions coordinate homeostasis and growth in the Drosophila gonad. Nature. 443, 97-100 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon