Accedi
Ibridazione in situ a fluorescenza a montaggio intero per studiare la spermatogenesi nella zanzara Anopheles
In This Article
Summary
Data la loro semplice anatomia, i testicoli Anopheles offrono un buon modello citologico per lo studio della spermatogenesi. Questo protocollo descrive l'ibridazione in situ a fluorescenza intera , una tecnica utilizzata per studiare questo processo biologico, nonché il fenotipo di ceppi transgenici che ospitano mutazioni nei geni coinvolti nella produzione di spermatozoi.
Abstract
La spermatogenesi è un complesso processo biologico durante il quale le cellule diploidi subiscono una successiva divisione mitotica e meiotica seguita da grandi cambiamenti strutturali per formare spermatozoi aploidi. Oltre all'aspetto biologico, lo studio della spermatogenesi è di fondamentale importanza per la comprensione e lo sviluppo di tecnologie genetiche come il gene drive e le distorsioni sintetiche del rapporto tra i sessi, che, alterando rispettivamente l'ereditarietà mendeliana e il rapporto tra i spermatozoi tra i sessi, potrebbero essere utilizzati per controllare le popolazioni di insetti nocivi. Queste tecnologie si sono dimostrate molto promettenti in laboratorio e potrebbero potenzialmente essere utilizzate per controllare le popolazioni selvatiche di zanzare Anopheles , che sono vettori della malaria. Grazie alla semplicità dell'anatomia del testicolo e alla sua importanza medica, l'Anopheles gambiae, uno dei principali vettori della malaria nell'Africa sub-sahariana, rappresenta un buon modello citologico per lo studio della spermatogenesi. Questo protocollo descrive come l'ibridazione in situ a fluorescenza a montaggio intero (WFISH) può essere utilizzata per studiare i drammatici cambiamenti nella struttura nucleare cellulare attraverso la spermatogenesi utilizzando sonde fluorescenti che colorano specificamente i cromosomi X e Y. La FISH di solito richiede la distruzione degli organi riproduttivi per esporre cromosomi mitotici o meiotici e consentire la colorazione di specifiche regioni genomiche con sonde fluorescenti. La WFISH consente di preservare la struttura citologica nativa del testicolo, insieme a un buon livello di rilevamento del segnale da sonde fluorescenti mirate a sequenze di DNA ripetitive. Ciò consente ai ricercatori di seguire i cambiamenti nel comportamento cromosomico delle cellule sottoposte a meiosi lungo la struttura dell'organo, dove ogni fase del processo può essere chiaramente distinta. Questa tecnica potrebbe essere particolarmente utile per studiare l'appaiamento meiotico dei cromosomi e studiare i fenotipi citologici associati, ad esempio, a distorsioni sintetiche del rapporto tra i sessi, sterilità maschile ibrida e knock-out di geni coinvolti nella spermatogenesi.
Introduction
La malaria impone un enorme onere alla salute e al benessere della popolazione umana mondiale. Nel 2021, l'Organizzazione Mondiale della Sanità (OMS) ha stimato che la malaria ha causato 619.000 decessi, di cui il 96% si è verificato nell'Africa subsahariana1. La malattia è trasmessa da zanzare appartenenti al genere Anopheles e, nell'Africa subsahariana, tre specie, ovvero Anopheles gambiae (An. gambiae), Anopheles coluzzi (An, coluzzi) e Anopheles arabiensis (An. arabiensis) hanno un ruolo sproporzionatamente grande nella trasmissione della malaria, rappresentando il 95% dei casi di malaria a livello globale. I programmi di controllo basati su metodi tradizionali come insetticidi e farmaci antimalarici hanno salvato milioni di vite; Tuttavia, negli ultimi anni, la crescente resistenza a questi metodi di controllo ne ha messo in discussione l'efficacia 1,2. Inoltre, le restrizioni imposte dalla pandemia di COVID-19 hanno influito sulla disponibilità di interventi chiave per il controllo della malaria, che, secondo il World Malaria Report 2022 dell'OMS, ha aumentato l'incidenza della malaria1. Negli ultimi due decenni, sono stati sviluppati nuovi metodi di controllo genetico in laboratorio per colpire le zanzare Anopheles 3,4,5,6,7,8,9,10. Tra queste strategie, quelle basate su sistemi di gene drive (GDS) e distorsioni sintetiche del rapporto tra i sessi (SD) sembrano promettenti. I GDS si basano sulla possibilità di trasmettere, ad altissima frequenza, una modificazione genetica che influisce sulla fertilità femminile o compromette il ciclo vitale del parassita nella zanzara 5,11,12. Le SD, invece, agiscono distorcendo il rapporto tra i sessi della progenie di una zanzara verso i maschi, il che porta, nel tempo, al collasso di una popolazione bersaglio a causa della mancanza di femmine 4,6,13. I componenti principali di questi sistemi genetici agiscono principalmente sugli organi riproduttivi delle zanzare, dove vengono prodotti i gameti, le uova e gli spermatozoi dopo la divisione meiotica14.
In questo protocollo, i progressi nelle tecniche citogenetiche sono impiegati per esplorare la spermatogenesi in An. gambiae, concentrandosi sul comportamento dei cromosomi in situ. La struttura del testicolo della zanzara e i processi biologici che avvengono al suo interno sono stati precedentemente studiati utilizzando una serie di metodi citologici, come l'immunofluorescenza, i transgeni reporter fluorescenti e l'ibridazione in situ a fluorescenza di DNA e RNA (FISH)15,16,17,18,19,20; Gli organi mostrano una forma a fuso, in cui il polo inferiore è attaccato a un condotto deferente collegato alle ghiandole accessorie maschili. Nel polo superiore, la nicchia delle cellule staminali germinali prolifera e si differenzia in cellule spermatogone incorporate all'interno di spermatocisti formate da cellule somatiche. A seguito di più cicli di divisione mitotica, gli spermatogoni si differenziano in spermatociti, che entrano in meiosi. Alla profase, gli autosomi e i cromosomi sessuali si accoppiano con i loro omologhi e avviene il crossing over. Dopo le divisioni meiotiche, vengono generati spermatidi aploidi rotondi che entrano in spermiogenesi, e questo processo porta alla formazione di spermatozoi aploidi maturi in cui il citoplasma è stato rimosso, la cromatina nucleare viene condensata e i flagelli emergono nella parte basale dei nuclei21,22 (Figura 1 e Figura 2).
In generale, la spermiogenesi inizia intorno allo stadio intermedio della pupa e gli spermatozoi maturi possono essere rilevati nella fase tardiva della pupa nel serbatoio spermatico23. Il processo di maturazione delle spermatocisti continua durante la vita adulta23,24,25. Nei testicoli di Anopheles, ogni fase della spermatogenesi può essere facilmente identificata osservando la morfologia nucleare delle cellule in ciascuna spermatocisti (Figura 2). L'ibridazione in situ a fluorescenza a montaggio intero (WFISH), descritta in questo protocollo, consente ai ricercatori di etichettare in modo specifico una regione cromosomica e di seguirla durante la spermatogenesi, preservando la struttura nativa dell'organo e la posizione dei nuclei cellulari; questo rappresenta un vantaggio rispetto al protocollo standard DNA FISH in cui l'organo viene solitamente schiacciato, portando a danni tissutali19. Nel protocollo attuale, le sonde fluorescenti vengono utilizzate per colorare le sequenze ripetitive sui cromosomi sessuali e, quindi, tracciare il loro comportamento durante la spermatogenesi, dalle cellule diploidi che si dividono agli spermatozoi aploidi maturi. La WFISH può essere particolarmente utile per studiare l'appaiamento meiotico dei cromosomi sessuali e studiare i fenotipi citologici associati, ad esempio, a distorsioni sintetiche del rapporto tra i sessi, sterilità maschile ibrida e knock-out dei geni coinvolti nella spermatogenesi 4,19,26,27.
Dato il loro ruolo di vettori della malaria, le zanzare Anopheles sono il bersaglio di un numero crescente di strategie di controllo dei vettori genetici, che spesso agiscono negli organi riproduttivi di questi organismi. Sono stati generati diversi mutanti di zanzare e fenotipi citologici che richiedono nuove tecniche citologiche per essere studiati26,27,28,29. Il metodo descritto in questo studio fa luce sulla comprensione della spermatogenesi, nonché sui meccanismi citologici alla base delle strategie genetiche che hanno il potenziale per controllare le zanzare che trasmettono la malaria.
Protocol
1. Etichettatura della sonda del DNA
NOTA: Di seguito sono riportati i passaggi tecnici per generare sonde di DNA fluorescenti che etichettano specificamente i cromosomi sessuali delle zanzare An. gambiae.
- Etichettatura delle sonde mediante PCR
- Estrarre il DNA genomico da pupe o maschi adulti per marcare i cromosomi X o Y utilizzando un kit di estrazione del DNA genomico disponibile in commercio (vedere Tabella dei materiali).
- Preparare la miscela di reazione della PCR: 200 ng di DNA genomico, 0,05 mM di nucleotide non marcato (dATP, dCTP, dGTP), 0,015 mM di dTTP e 1 uL di dUTP marcato con fluorescenza (Cy3, Cy5 o un altro fluorocromo), 50 pmol di primer diretto e inverso (Tabella 1), 5 μL di tampone PCR 10x e 10 U di DNA polimerasi Taq (vedere Tabella dei materiali).
- Per marcare l'rDNA 18S e il satellite AgY53B (Tabella 1), eseguire una reazione PCR utilizzando i seguenti parametri PCR: un ciclo di 95 °C per 10 min; 35 cicli di 95 °C per 30 s, 52 °C per 30 s e 72 °C per 45 s; un ciclo di 72 °C per 5 min; e una tenuta finale a 4 °C.
NOTA: Per ottenere una buona concentrazione della sonda con il metodo di marcatura PCR (~1 μg in 5 μL), che è fondamentale per il successo di un WFISH, la reazione PCR deve essere altamente efficiente. Per questo motivo, prima di etichettare la sonda, si consiglia vivamente di testare l'efficacia dei primer selezionati per l'amplificazione. Inoltre, l'inclusione di un controllo positivo nella reazione di PCR (senza il dUTP fluorescente) aiuterà a verificare l'efficacia della reazione di marcatura. - Conservare la sonda a −20 °C in un luogo buio.
- Ottenimento di sonde oligonucleotidiche fluorescenti da 3'
- Ottenere sonde di oligonucleotidi fluorescenti disponibili in commercio come oligo modificati aggiungendo fluorocromi Cy3 o Cy5 (o qualsiasi altro fluorocromo) all'estremità 3' della sequenza nucleotidica (vedere Tabella dei materiali). Vedere primer/oligonucleotidi nella Tabella 1 per le sequenze di riferimento utilizzate per marcare la regione di giunzione del satellite legato all'Y AgY477-AgY53B e il satellite legato all'X dell'Contig_240.
NOTA: Non ci sono impedimenti tecnici relativi alla concentrazione di oligonucleotidi marcati con estremità 3', in quanto l'utente di solito può sceglierlo prima dell'acquisto. Si consiglia di diluire ~800 ng di soluzione di sonda oligo nel tampone di ibridazione per un'etichettatura efficiente utilizzando la sonda oligo. Le sonde oligo-specifiche per X e Y sono state precedentemente utilizzate per la WFISH da Liang e Sharakhov19, e la sequenza di riferimento può essere trovata nella Tabella 1.
- Ottenere sonde di oligonucleotidi fluorescenti disponibili in commercio come oligo modificati aggiungendo fluorocromi Cy3 o Cy5 (o qualsiasi altro fluorocromo) all'estremità 3' della sequenza nucleotidica (vedere Tabella dei materiali). Vedere primer/oligonucleotidi nella Tabella 1 per le sequenze di riferimento utilizzate per marcare la regione di giunzione del satellite legato all'Y AgY477-AgY53B e il satellite legato all'X dell'Contig_240.
2. Preparazione della soluzione di ibridazione
NOTA: Le sonde fluorescenti generate nella fase 1 devono essere incorporate in una soluzione chimica che si ibrida con le sequenze target.
- Precipitazione della sonda prima dell'ibridazione fluorescente in situ
- A una provetta da 1,5 mL, aggiungere 5 μL di sonda di DNA marcata (se ottenuta con il metodo di marcatura PCR) o 2,2 μL di sonda oligo modificata 3' (~800 ng di sonda) dalla fase 1 e 5 μL di DNA di spermatozoi di salmone (vedere Tabella dei materiali). Combina le sonde specifiche per diverse regioni genomiche nella stessa provetta e utilizzale come soluzione unica nei passaggi successivi.
- Precipitare la sonda di DNA aggiungendo 0,1 volumi di acetato di sodio 3 M e 2 volumi di etanolo al 100%. Conservare a -20 °C per almeno 2,5 h (aumentando il tempo di incubazione a -20 °C si aumenta la resa finale). In questa fase, le sonde possono anche essere conservate durante la notte prima della centrifugazione.
- Centrifugare a 17.000 x g a 4 °C per 20 min, rimuovere l'etanolo e asciugare il pellet all'aria a RT al buio per ~20 min.
- Soluzione di ibridazione
- Prima di procedere con la dissezione testicolare (fase 3), preparare il tampone di ibridazione mescolando i seguenti reagenti in una provetta da 1,5: 500 μL di formammide, 0,2 g di destrano solfato, 100 μL di citrato salino di sodio 20x (SSC) e 200 μL di H20 sterile (vedi Tabella dei materiali). Agitare la soluzione di ibridazione per 1 minuto e lasciare sciogliere il destrano solfato a 37 °C per 30 minuti.
- Sciogliere il pellet del passaggio 2.1.3 in 20-30 μL di tampone di ibridazione (vortice per circa 1 minuto, eseguire una rapida rotazione e conservare le provette a 37 °C al buio) per ottenere la soluzione di ibridazione.
3. Dissezione e fissazione del testicolo
- A temperatura ambiente (RT), sezionare21 almeno ~20 testicoli di pupe o adulti di 1 giorno in soluzione salina sterile tamponata con fosfato (PBS) e trasferirli in un vetrino da microscopio pulito contenente una goccia fresca di soluzione 1x PBS.
- Trasferire i testicoli utilizzando una punta filtrata P1.000 a foro largo o la punta di un ago da dissezione dalla goccia 1x PBS in una capsula embrionale contenente il 3,7% di formaldeide in 1x PBS con 0,1% Tween-20 (PBST) e incubare per 10 minuti a RT.
- Lavare i testicoli in 1x PBST per 5 minuti a RT. Incubare i testicoli in 0,1 mg/mL di RNAsi A (vedere Tabella dei materiali) diluito in 1x PBS sterile per 30 minuti a 37 °C.
- Rimuovere la soluzione di RNAsi, aggiungere la soluzione penetrante (1% Tritone/0,1 M HCl in 1x PBST) e incubare a RT per 10 minuti.
NOTA: La proteinasi K può essere utilizzata come agente penetrante ad una concentrazione finale di 10 μg/mL in 1x PBST per aumentare la permeabilizzazione dei testicoli. - Lavare i testicoli in 1x PBST due volte per 5 minuti ciascuna a RT.
4. Ibridazione
NOTA: Questa sezione descrive le fasi finali per l'ibridazione in situ .
- Dopo la fase di lavaggio (fase 3.5), trasferire i testicoli in una provetta da 1,5 mL con 20-30 μL di soluzione di ibridazione contenente la sonda precedentemente preparata (fase 2.2.2). Utilizzare la punta della pipetta per mescolare delicatamente la soluzione. Muovere delicatamente il tubo cinque volte prima di procedere ai passaggi successivi.
- Incubare per 5 minuti a 75 °C per la denaturazione del DNA.
- Incubare per una notte a 37 °C (se possibile, con oscillazione a meno di 100 giri/min) per l'ibridazione DNA-DNA.
- Trasferire nuovamente i testicoli in una capsula per embrioni utilizzando una punta filtrata P1.000 a foro largo e lavarli in 2x SSC preriscaldato a 50 °C per 5 minuti.
NOTA: Dopo la fase di ibridazione, è necessaria una fase di lavaggio finale utilizzando 2x SSC; Questo svolge un ruolo importante nella rimozione di qualsiasi segnale di fondo causato dalla presenza di sonde non ibridate all'interno del tessuto dell'organo. Se è presente un forte segnale di fondo, si consiglia di ripetere la fase finale di lavaggio. - Rimuovere il 2x SSC e montare i testicoli utilizzando un mezzo di montaggio disponibile in commercio con 4′,6-diamidino-2-fenilindolo (DAPI) (vedere la tabella dei materiali) su un vetrino smerigliato, sigillare con sigillante per vetrini coprioggetti e incubare per almeno 2 ore a RT al buio.
- Eseguire l'imaging confocale. L'intero testicolo può essere visualizzato utilizzando obiettivi a immersione in olio 40x o 63x. Se viene eseguito uno z-stack, si consiglia di utilizzare un passo z di 1,25 μm.
Representative Results
In questo lavoro, WFISH è stato utilizzato per studiare il comportamento cromosomico durante la spermatogenesi in An. gambiae. Il primo passo fondamentale per l'applicazione di questo protocollo è l'ottenimento di testicoli che mostrino un basso livello di alterazione morfologica dopo la dissezione. Per eseguire con successo una dissezione testicolare è necessaria una conoscenza di base dell'anatomia della zanzara e, di seguito, vengono fornite alcune indicazioni per questa procedura. Nella zanzara Anopheles , i testicoli maturi si trovano nel sesto segmento addominale degli stadi pupa e adulto21. Come mostrato nella Figura 1, il dotto deferente collega i testicoli alle ghiandole accessorie maschili (MAG), che si trovano nell'ultimo segmento dell'addome. Le MAG sono collegate a un dotto eiaculatorio unico che trasporta gli spermatozoi e i liquidi seminali all'organo copulatore e alla parte esterna dell'apparato genitale maschile21. L'intero apparato genitale maschile interno può essere sezionato utilizzando diversi approcci a seconda dello stadio di vita della zanzara. Durante la fase pupale, i testicoli possono essere facilmente identificati utilizzando uno stereomicroscopio in tutta la cuticola leggera osservando il lato ventrale dell'addome in prossimità del sesto segmento (Figura 1). Per sezionare i testicoli, la parte inferiore dell'addome, compreso il sesto segmento, può essere isolata dal resto del corpo utilizzando un paio di aghi e trasferita in una goccia pulita di PBS 1x. Dopo la rimozione dell'ultimo segmento, l'intero apparecchio può essere schiacciato dall'addome applicando una leggera pressione con gli aghi da dissezione. Per sezionare i testicoli dai maschi adulti, il primo passo consiste nell'isolare l'intero addome in una nuova goccia di PBS 1x e poi estrarre l'ultimo segmento che porta i fermagli, che sono le strutture copulatorie maschili (Figura 1). A questo punto, la parte inferiore dei MAG dovrebbe emergere ed essere facilmente identificabile grazie al loro colore giallo. L'intero apparato maschile può quindi essere estratto lentamente con l'aiuto di un ago o di una pinza in una goccia di 1x PBS fino a quando la coppia di testicoli attaccati al dotto deferente non è visibile. Prima di procedere con la fissazione, è importante isolare i testicoli dalle altre parti dell'apparato maschile tagliando in prossimità della parte inferiore dei dotti deferenti (Figura 1).
L'età delle pupe o dei maschi adulti è un fattore importante da considerare a seconda dello stadio di spermatogenesi in esame. In An. gambiae, la spermatogenesi inizia allo stadio iniziale/medio pupale e continua per tutta la vita dell'individuo24. Tra le 3 e le 10 ore dopo l'impupamento, gli stadi premeiotico e meiotico sono più rappresentati nel testicolo (profase meiotica, divisioni meiotiche), il DNA degli spermatidi è relativamente non condensato e gli spermatozoi maturi non si sono ancora formati. Le pupe tardive e gli adulti di 1 giorno di età offrono un buon equilibrio tra gli stadi premeiotico, meiotico e post-meiotico (Figura 2 e Figura 3). Negli adulti che hanno più di 4 giorni di vita, gli stadi premeiotici e le spermatocisti sono meno rappresentati e i testicoli sono occupati principalmente da spermatozoi maturi contenuti nel serbatoio spermatico.
Per studiare il comportamento dei cromosomi sessuali durante le diverse fasi della spermatogenesi, la WFISH è stata eseguita su testicoli sezionati allo stadio di pupa tardiva per garantire una buona rappresentazione dell'intero processo. Per seguire il comportamento di questi cromosomi, sono state utilizzate sonde fluorescenti specifiche per sequenze ripetitive situate esclusivamente sul cromosoma X o Y. Le sonde fluorescenti possono essere generate utilizzando la PCR o ottenute commercialmente come oligonucleotidi marcati con estremità 3'. Si consiglia l'utilizzo di un oligo con una lunghezza di >40 bps per consentire un buon rilevamento del segnale dalla sonda fluorescente per oligo. In base alla nostra esperienza, gli oligo marcati con estremità 3' hanno prestazioni migliori rispetto alle sonde marcate con PCR in termini di rilevamento del segnale. Inoltre, il numero di copie della sequenza target è un fattore che può influenzare l'efficacia della WFISH. Se la marcatura non ha successo, si suggerisce di utilizzare il metodo di marcatura PCR su un frammento più lungo o di progettare diversi oligo specifici per la regione bersaglio.
I metodi attuali, basati sull'utilizzo di una soluzione penetrante (1% Tritone/0,1 M HCl in 1x PBST), consentono un buon livello di permeabilizzazione testicolare e penetrazione delle sonde, con conseguente reazione di ibridazione di successo. Le sonde oligo specifiche per le sequenze ripetitive dei cromosomi sessuali possono essere progettate sulla base dell'ampia caratterizzazione degli elementi ripetitivi eseguita da Hall et al.20. Inoltre, le sequenze di consenso specifiche per gli elementi ripetitivi legati all'X o all'Y possono essere ottenute utilizzando una piattaforma bioinformatica come la pipeline RedKmer30. È importante notare che le sonde dei cromosomi sessuali possono colpire elementi ripetitivi come satelliti e retrotrasposoni, e possono avere un diverso livello di ibridazione con i cromosomi X o Y a seconda della specie in esame 20,31,32. Come mostrato in Figura 3, un buon livello di ibridazione delle sonde e un basso background hanno permesso la visualizzazione dei cromosomi bersaglio durante la spermatogenesi. L'appaiamento dei cromosomi sessuali marcati potrebbe essere visto nelle fasi premeiotica e meiotica. Questo è stato seguito dal rilevamento dei cromosomi X o Y nei nuclei delle cellule aploidi, cromosomi risultanti da divisioni meiotiche. Successivamente, gli spermatidi portatori di X o Y potrebbero essere seguiti durante la spermiogenesi, caratterizzata da diversi livelli di condensazione del DNA, fino alla fase finale degli spermatozoi maturi a forma di freccia. Nell'attuale configurazione sperimentale, sono state utilizzate Z-stack confocali per acquisire informazioni riguardanti l'organizzazione spaziale 3D delle cellule durante questo processo (Video 1).
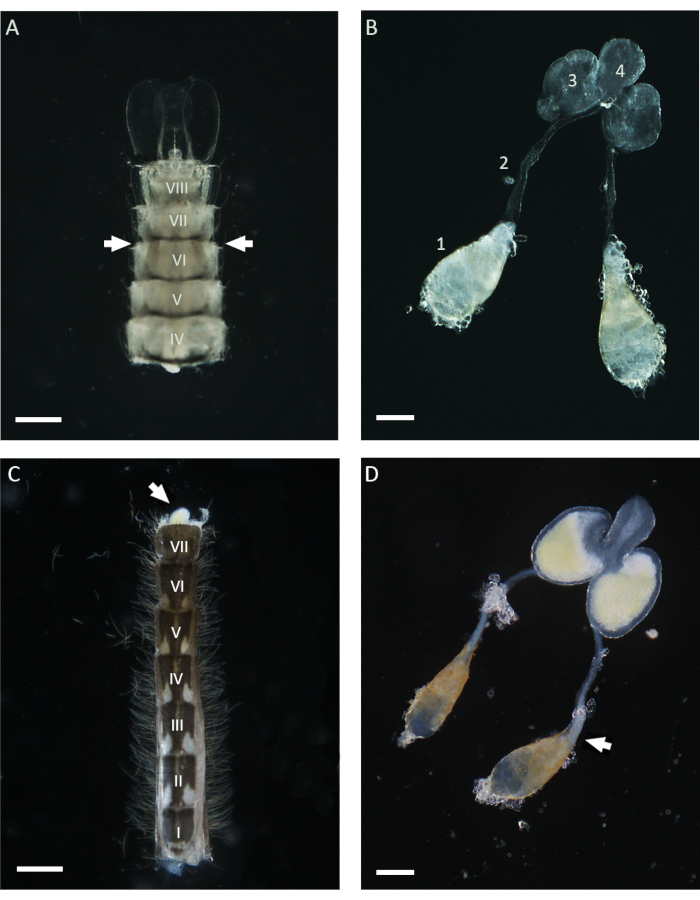
Figura 1: Testicoli sezionati da pupe e maschi adulti di Anopheles gambiae di 1 giorno. (A) Un addome sezionato alla fase tarda della pupa che mostra la posizione dei testicoli in prossimità del sesto segmento addominale. I testicoli possono essere identificati in tutta la cuticola e appaiono come strutture brunastre su entrambi i lati dell'addome (con frecce). (B) Testicoli sezionati allo stadio di pupa, mostrando i testicoli maturi (1), i dotti deferenti (2), i MAG (3) e il dotto eiaculatorio (4). (C) Un addome sezionato da un maschio adulto di 1 giorno dopo aver rimosso il segmento basale della fibbia. I MAG possono essere schiacciati dall'addome applicando una leggera pressione (freccia bianca). (D) Apparato riproduttivo interno maschile sezionato da un maschio adulto di 1 giorno. La freccia bianca indica la posizione occupata dagli spermatozoi maturi, che appaiono come un aggregato bianco al polo basale del testicolo. Barre di scala: (A,C) 200 μm; (B,D) 100 μm. I numeri romani da I a VIII indicano i segmenti addominali. Fare clic qui per visualizzare una versione più grande di questa figura.
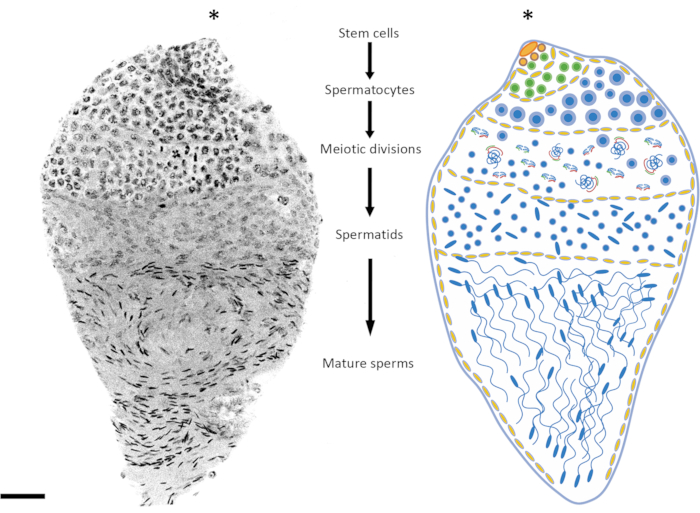
Figura 2: Rappresentazione della spermatogenesi in Anopheles gambiae. L'immagine a sinistra mostra un testicolo tardivo della pupa di An. gambiae dopo la colorazione DAPI a montaggio intero. A destra c'è una versione schematica per una migliore visualizzazione. Osservando la forma nucleare e il livello di condensazione, è relativamente facile seguire tutte le fasi della spermatogenesi dalle cellule diploidi agli spermatozoi aploidi. La nicchia delle cellule staminali è situata nel polo superiore dell'organo, dove inizia la differenziazione in spermatogoni. Le cellule spermatogone aumentano di numero dopo la divisione mitotica (cellule verdi) e le spermatocisti aumentano di dimensioni (cellule gialle). Le cellule degli spermatogoni si differenziano in spermatociti dopo più cicli di divisioni mitotiche (cellule blu). Gli spermatociti, che sono caratterizzati da nuclei relativamente più grandi rispetto alle cellule delle altre fasi del processo, sono le cellule che subiranno la divisione meiotica. Le cellule sottoposte a meiosi possono essere rilevate osservando la presenza di cromosomi in diversi stadi meiotici; I chiasmi e i cromosomi in metafase possono essere rilevati anche a basso ingrandimento. Gli stadi premeiotici sono sovrarappresentati nei testicoli sezionati allo stadio iniziale di pupa. Dopo la prima e la seconda divisione meiotica, vengono prodotti gli spermatidi che di solito si trovano al centro del testicolo. I nuclei degli spermatidi mostrano un certo grado di variazione nella loro forma, da una forma rotonda a una forma a freccia. Gli spermatidi entrano nel processo di spermiogenesi, durante il quale i nuclei iniziano a condensarsi e la loro struttura cambia in punti simili a frecce. Quando le zanzare maturano sessualmente dopo essere emerse, le spermatocisti contenenti spermatozoi maturi possono occupare la maggior parte del volume del testicolo a spese delle spermatocisti in un diverso stadio di sviluppo. Barra graduata: 20 μm. L'asterisco (*) indica la parte apicale del testicolo. Fare clic qui per visualizzare una versione più grande di questa figura.
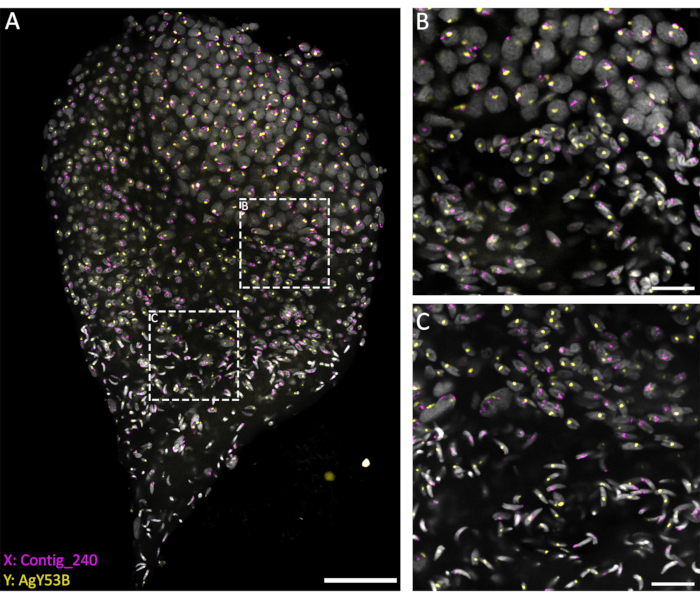
Figura 3: WFISH su un testicolo di An. gambiae sezionato a partire dalla fase tardiva di pupa. La WFISH è stata eseguita utilizzando sonde specifiche per i cromosomi X (Contig_240) e Y (sonda oligo specifica per AgY53B). (A) WFISH permette di seguire il comportamento del cromosoma sessuale durante la spermatogenesi da cellule diploidi a spermatozoi aploidi. In questa immagine è possibile apprezzare i drammatici cambiamenti che i nuclei subiscono durante la spermatogenesi. L'etichettatura dei cromosomi sessuali consente la discriminazione tra cellule diploidi e aploidi. Nelle cellule diploidi, il segnale proveniente dai cromosomi sessuali è legato agli stessi nuclei. Nelle cellule aploidi (spermatidi e spermatozoi), il segnale dei cromosomi sessuali è scollegato a causa della divisione meiotica riduttiva. (B,C) Un'immagine con un ingrandimento maggiore (63x) del testicolo è mostrata in (A). Sono stati acquisiti in diverse posizioni lungo l'asse Z. Le cornici bianche punteggiate indicano l'area di acquisizione. (B) La fase di transizione tra spermatociti e spermatidi, che mostra la formazione di cellule aploidi e la separazione dei segnali dai cromosomi sessuali in nuclei separati. (C) La fase di transizione tra spermatidi aploidi e spermatozoi maturi. Questa fase mostra le variazioni del livello di condensazione nucleare; Gli spermatozoi maturi mostrano una forma più condensata e allungata rispetto agli spermatidi. Barre graduate: (A), 30 μm; (B,C), 10 μm; Grigio: DAPI. Fare clic qui per visualizzare una versione più grande di questa figura.
| Sequenza di destinazione | Sequenza del primer e consenso dell'oligo-sonda | Riferimento |
| Contig_240 (X) | 5'-CAATAAATTTCCTTTTTTTTTGATGC AAAATCTACGTCTCTAGC-3'-[Fluorocromo] | 19 |
| AgY53B (Y) | 5'AGAAGAATAGAATCAGAATAGTCGG TTTCTTCATCCTGAAAGCC-3'-[Fluorocromo] | Questo studio |
| AgY477- AgY53B giunzione regione (Y) | 5'-TTCTAAGTTTCTAGGCTTTAAGGAT GAAGAAACCGACTATTC-3'-[Fluorocromo] | 19 |
| 18S rDNA (X) | F: AACTGTGGAAAAGCCAGAGC R: TCCACTTGATCCTTGCAAAA | 19 |
| AgY53B (Y) | F: CCTTTAAACACATGCTCAAATT R: GTTTCTTCATCCTTAAAGCCTAG | 19 |
Tabella 1: Elenco delle sonde oligo specifiche per il cromosoma X o Y in An. gambiae.
Video 1: Una pila 3D su WFISH eseguita su un testicolo di An. gambiae sezionato dallo stadio tardivo di pupa. Per ottenere una rappresentazione 3D del processo di spermatogenesi, è possibile eseguire una pila 3D confocale su testicoli che presentano un basso numero di alterazioni strutturali. In questo studio, le pile sono state eseguite con un intervallo di 1,25 μm tra due sezioni ottiche sotto una lente a olio 63x o 40x per non perdere informazioni sull'organizzazione spaziale 3D delle cellule. Grigio: DAPI, giallo: Contig_240 (X), magenta: AgY53B (Y). Clicca qui per scaricare questo video.
Discussion
Comunemente, i protocolli FISH richiedono lo schiacciamento dell'organo di interesse per consentire la colorazione cromosomica. Ciò provoca una perdita di informazioni sulla disposizione spaziale delle cellule all'interno di quell'organo33. Questo protocollo descrive come i processi biologici, come la spermatogenesi, possono essere studiati in situ mantenendo intatta la struttura nativa del testicolo e la sua organizzazione citologica interna. Le sonde che hanno come bersaglio diversi elementi ripetitivi del DNA, che sono particolarmente arricchiti nei cromosomi sessuali20, possono essere utilizzate simultaneamente per rivelare la dinamica della maturazione degli spermatozoi. A seconda dei tempi della dissezione testicolare, WFISH offre l'opportunità di studiare diversi stadi della spermatogenesi attraverso lo sviluppo delle zanzare. La WFISH è utile per lo studio di fenomeni specifici come l'incompatibilità ibrida, che, nelle zanzare Anopheles, è dovuta alla presenza di difetti meiotici come il fallimento premeiotico e la non disgiunzione dei cromosomi sessuali 19,34,35. Oltre all'aspetto biologico, la spermatogenesi è l'obiettivo di una serie di strategie genetiche sviluppate per controllare gli insetti nocivi come le zanzare Anopheles. In questo contesto, il locus dell'rDNA legato all'X di An. gambiae è stato utilizzato come bersaglio per sviluppare un distorcente sintetico del rapporto tra i sessi, che, danneggiando gli spermatozoi portatori di X, orienta la progenie verso i maschi 4,8,13.
Questa tecnologia rispecchia l'azione delle pulsioni meiotiche naturali del rapporto tra i sessi che sono state identificate in diversi taxa, tra cui le zanzare, ma che rimangono ancora poco comprese 28,36,37,38,39,40,41. WFISH offre l'opportunità di studiare questo fenomeno e apre la strada al perfezionamento o al miglioramento delle strategie genetiche basate sulla distorsione sessuale, ad esempio fornendo informazioni su come la citologia della produzione di spermatozoi sia influenzata dalla scelta dei siti bersaglio utilizzati per la triturazione dei cromosomi sessuali. Sebbene, secondo la nostra esperienza, il WFISH mostri alte probabilità di successo, il fallimento può ancora verificarsi. Ciò potrebbe essere dovuto a un livello inefficiente di permeabilizzazione tissutale, che può essere superato aumentando il tempo di incubazione della soluzione penetrante. In alternativa, la proteinasi K può essere utilizzata durante la fase di permeabilizzazione. In alcuni casi, abbiamo notato un livello non uniforme di penetrazione della sonda, con un segnale più alto nei nuclei degli spermatociti e un segnale più basso o assente nelle fasi meiotiche e di spermiogenesi. Ciò potrebbe essere dovuto a una differenza nel livello di permeabilizzazione a seconda dello stadio cellulare. Inoltre, WFISH si è dimostrato prezioso quando si utilizzano sonde fluorescenti progettate per colpire sequenze di DNA presenti in un numero elevato di copie. Quando si prendono di mira geni a singola copia, il rilevamento del segnale potrebbe non essere sufficiente. In questo caso, devono essere integrati metodi per l'amplificazione del segnale, come l'amplificazione del segnale della tiramide (TSA)42.
Questo protocollo potrebbe essere accoppiato con l'immunocolorazione o con ceppi reporter transgenici che ospitano marcatori fluorescenti specifici per la linea germinale16,18, in quanto ciò aggiungerebbe informazioni sulla localizzazione delle proteine e sull'espressione genica in situ. In questo lavoro, il WFISH è descritto come una tecnica per studiare la spermatogenesi nelle zanzare Anopheles; Tuttavia, data l'anatomia condivisa degli organi riproduttivi maschili, questo protocollo potrebbe essere applicato ad altre specie di zanzare che svolgono un ruolo nella trasmissione della malattia. Allo stesso modo, la gametogenesi femminile potrebbe essere studiata utilizzando questa tecnica. Inoltre, potrebbero essere esplorati studi citologici in organi o tessuti di interesse, come l'intestino medio della zanzara, che è un bersaglio per l'invasione del parassita, o background genetici atipici, come quelli nelle zanzare ibride43. Inoltre, questa tecnica può essere potenzialmente trasferita ad altri organismi all'interno dell'ordine dei Ditteri.
Disclosures
Gli autori non hanno nulla da rivelare.
Acknowledgements
Questo lavoro è stato sostenuto da una sovvenzione della Bill & Melinda Gates Foundation e di Open Philanthropy. Si ringrazia la Facility for Imaging by Light Microscopy (FILM) dell'Imperial College di Londra per l'analisi microscopica. La Figura 2 è stata creata con Biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| Amersham CyDye Fluorescent Nucleotides, Cy3-dUTP | Cytiva | PA53022 | |
| Amersham CyDye Fluorescent Nucleotides, Cy5-dUTP | Cytiva | PA55022 | |
| ART Wide Bore Filtered Pipette Tips | ThermoFisher Scientific | 2079GPK | |
| CytoBond Removable Coverslip Sealant | SciGene | 2020-00-1 | |
| Dextran sulfate sodium salt from Leuconostoc spp. | Sigma-Aldrich | D8906-5G | |
| DNeasy Blood & Tissue Kits | Qiagen | 69504 | |
| Embryo Dishes | VWR | 70543-30 | |
| Ethanol, molecular grade | Sigma-Aldrich | 51976 | |
| Formamide | ThermoFisher Scientific | 17899 | |
| GoTaq G2 DNA Polymerase | Promega | M7841 | |
| Hydrochloric acid, 37% | Sigma-Aldrich | 320331 | |
| Microscope slides, SuperFrost | VWR | 631-0114 | |
| PBS (10x), pH 7.4 | ThermoFisher Scientific | 70011044 | |
| Pierce 16% Formaldehyde (w/v), Methanol-free | ThermoFisher Scientific | 28906 | |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P36941 | |
| RNase A/T1 Mix | ThermoFisher Scientific | EN0551 | |
| Set of dATP, dCTP, dGTP, dTTP | Promega | U1330 | |
| Sodium Acetate Solution | ThermoFisher Scientific | R1181 | |
| SP8 inverted confocal microscope | Leica | ||
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| TWEEN 20 | Sigma-Aldrich | P1379 | |
| UltraPure Salmon Sperm DNA Solution | ThermoFisher Scientific | 15632011 | |
| UltraPure SSC 20x | ThermoFisher Scientific | 15557044 | |
| Primer sequences | |||
| 5’-CAATAAATTTCCTTTTTAATGATGC AAAATCTACGTCTCTAGC-3’-[Fluorochrome] | Eurofins Genomics | Contig_240 (X) | |
| 5’AGAAGAATAGAATCAGAATAGT CGG TTTCTTCATCCTGAAAGCC-3’-[Fluorochrome] | Eurofins Genomics | AgY53B (Y) | |
| 5’-TTCTAAGTTTCTAGGCTTTAAGGA T GAAGAAACCGACTATTC-3’-[Fluorochrome] | Eurofins Genomics | AgY477- AgY53B junction region (Y) | |
| F: AACTGTGGAAAAGCCAGAGC R: TCCACTTGATCCTTGCAAAA | Eurofins Genomics | 18S rDNA (X) | |
| F: CCTTTAAACACATGCTCAAATT R: GTTTCTTCATCCTTAAAGCCTAG | Eurofins Genomics | AgY53B (Y) |
References
- World Malaria Report. World Health Organization Available from: https://www.who.int/teams/global-malaria-programme/reports/world-malaria-report-2022 (2022)
- Bhatt, S., et al. The effect of malaria control on Plasmodium falciparum in Africa between 2000 and 2015. Nature. 526 (7572), 207-211 (2015).
- Hammond, A., et al. A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae. Nature Biotechnology. 34 (1), 78-83 (2016).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5 (1), 3977 (2014).
- Kyrou, K., et al. A CRISPR-Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Nature Biotechnology. 36 (11), 1062-1066 (2018).
- Simoni, A., et al. A male-biased sex-distorter gene drive for the human malaria vector Anopheles gambiae. Nature Biotechnology. 38 (9), 1054-1060 (2020).
- Gantz, V. M., et al. Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. Proceedings of the National Academy of Sciences of the United States of America. 112 (49), E6736-E6743 (2015).
- Bernardini, F., Kriezis, A., Galizi, R., Nolan, T., Crisanti, A. Introgression of a synthetic sex ratio distortion system from Anopheles gambiae into Anopheles arabiensis. Scientific Reports. 9 (1), 5158 (2019).
- Hammond, A. M., Galizi, R. Gene drives to fight malaria: Current state and future directions. Pathogens and Global Health. 111 (8), 412-423 (2017).
- Garrood, W. T., et al. Driving down malaria transmission with engineered gene drives. Frontiers in Genetics. 13, 891218 (2022).
- Hoermann, A., et al. Gene drive mosquitoes can aid malaria elimination by retarding Plasmodium sporogonic development. Science Advances. 8 (38), (2022).
- Nash, A., et al. Integral gene drives for population replacement. Biology Open. 8 (1), (2019).
- Galizi, R., et al. A CRISPR-Cas9 sex-ratio distortion system for genetic control. Scientific Reports. 6 (1), 31139 (2016).
- Terradas, G., Hermann, A., James, A. A., McGinnis, W., Bier, E. High-resolution in situ analysis of Cas9 germline transcript distributions in gene-drive Anopheles mosquitoes. G3: Genes, Genomes, Genetics. 12 (1), (2022).
- Durant, A. C., Donini, A. Ammonium transporter expression in sperm of the disease vector Aedes aegypti mosquito influences male fertility. Proceedings of the National Academy of Sciences of the United States of America. 117 (47), 29712-29719 (2020).
- Taxiarchi, C., et al. High-resolution transcriptional profiling of Anopheles gambiae spermatogenesis reveals mechanisms of sex chromosome regulation. Scientific Reports. 9 (1), 14841 (2019).
- Pompon, J., Levashina, E. A. A new role of the mosquito complement-like cascade in male fertility in Anopheles gambiae. PLoS Biology. 13 (9), e1002255 (2015).
- Papathanos, P. A., Windbichler, N., Menichelli, M., Burt, A., Crisanti, A. The vasa regulatory region mediates germline expression and maternal transmission of proteins in the malaria mosquito Anopheles gambiae: A versatile tool for genetic control strategies. BMC Molecular Biology. 10 (1), 13 (2009).
- Liang, J., Sharakhov, I. V. Premeiotic and meiotic failures lead to hybrid male sterility in the Anopheles gambiae complex. Proceedings of the Royal Society B. 286 (1906), 20191080 (2019).
- Hall, A. B., et al. Radical remodeling of the Y chromosome in a recent radiation of malaria mosquitoes. Proceedings of the National Academy of Sciences of the United States of America. 113 (15), E2114-E2123 (2016).
- Clements, A. N. . The Biology of Mosquitoes. Volume 1: Development, Nutrition and Reproduction. , (1992).
- Demarco, R. S., Eikenes, &. #. 1. 9. 7. ;. H., Haglund, K., Jones, D. L. Investigating spermatogenesis in Drosophila melanogaster. Methods. 68 (1), 218-227 (2014).
- Helinski, M. E., Parker, A. G., Knols, B. G. Radiation biology of mosquitoes. Malaria Journal. 8, S6 (2009).
- Huho, B. J., et al. A reliable morphological method to assess the age of male Anopheles gambiae. Malaria Journal. 5 (1), 62 (2006).
- Fabian, L., Brill, J. A. Drosophila spermiogenesis. Spermatogenesis. 2 (3), 197-212 (2012).
- Li, M., et al. Suppressing mosquito populations with precision guided sterile males. Nature Communications. 12 (1), 5374 (2021).
- Thailayil, J., Magnusson, K., Godfray, H. C., Crisanti, A., Catteruccia, F. Spermless males elicit large-scale female responses to mating in the malaria mosquito Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13677-13681 (2011).
- Haghighat-Khah, R. E., et al. Cellular mechanisms regulating synthetic sex ratio distortion in the Anopheles gambiae germline. Pathogens and Global Health. 114 (7), 370-378 (2020).
- Yamamoto, D. S., et al. A synthetic male-specific sterilization system using the mammalian pro-apoptotic factor in a malaria vector mosquito. Scientific Reports. 9 (1), 8160 (2019).
- Papathanos, P. A., Windbichler, N. Redkmer: An assembly-free pipeline for the identification of abundant and specific X-chromosome target sequences for X-shredding by CRISPR endonucleases. The CRISPR Journal. 1 (1), 88-98 (2018).
- Sharma, A., Kinney, N. A., Timoshevskiy, V. A., Sharakhova, M. V., Sharakhov, I. V. Structural variation of the X chromosome heterochromatin in the Anopheles gambiae complex. Genes. 11 (3), 327 (2020).
- Krzywinski, J., Sangaré, D., Besansky, N. J. Satellite DNA from the Y chromosome of the malaria vector Anopheles gambiae. Genetics. 169 (1), 185-196 (2005).
- Timoshevskiy, V. A., Sharma, A., Sharakhov, I. V., Sharakhova, M. V. Fluorescent in situ hybridization on mitotic chromosomes of mosquitoes. Journal of Visualized Experiments. (67), e4215 (2012).
- Liang, J., Hodge, J. M., Sharakhov, I. V. Asymmetric phenotypes of sterile hybrid males from reciprocal crosses between species of the Anopheles gambiae complex. Frontiers in Ecology and Evolution. 9, 660207 (2021).
- Slotman, M., Torre, A. D., Powell, J. R. The genetics of inviability and male sterility in hybrids between Anopheles gambiae and An. arabiensis. Genetics. 167 (1), 275-287 (2004).
- Wood, R. J., Newton, M. E. Sex-ratio distortion caused by meiotic drive in mosquitoes. The American Naturalist. 137 (3), 379-391 (1991).
- Cazemajor, M., Joly, D., Montchamp-Moreau, C. Sex-ratio meiotic drive in Drosophila simulans is related to equational nondisjunction of the Y chromosome. Genetics. 154 (1), 229-236 (2000).
- Jaenike, J. Sex chromosome meiotic drive. Annual Review of Ecology and Systematics. 32 (1), 25-49 (2001).
- Courret, C., Chang, C. H., Wei, K. H., Montchamp-Moreau, C., Larracuente, A. M. Meiotic drive mechanisms: Lessons from Drosophila. Proceedings of the Royal Society B. 286 (1913), 20191430 (2019).
- Zanders, S. E., Unckless, R. L. Fertility costs of meiotic drivers. Current Biology. 29 (11), R512-R520 (2019).
- Newton, M. E., Wood, R. J., Southern, D. I. A cytogenetic analysis of meiotic drive in the mosquito, Aedes aegypti (L.). Genetica. 46 (3), 297-318 (1976).
- Carabajal Paladino, L. Z., Nguyen, P., Šíchová, J., Marec, F. Mapping of single-copy genes by TSA-FISH in the codling moth, Cydia pomonella. BMC Genomic Data. 15, S15 (2014).
- Bernardini, F., et al. Cross-species Y chromosome function between malaria vectors of the Anopheles gambiae species complex. Genetics. 207 (2), 729-740 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Tutti i diritti riservati
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.