Progettazione e costruzione di un microscopio a fluorescenza personalizzabile, monoobiettivo, a foglio luminoso per la visualizzazione di reti di citoscheletri
In questo articolo
Riepilogo
Questo protocollo descrive in dettaglio come costruire un microscopio a fluorescenza a singolo obiettivo e il suo utilizzo per la visualizzazione di reti di citoscheletro.
Abstract
I compositi del citoscheletro ricostituito sono emersi come un valido sistema modello per lo studio della materia soffice di non equilibrio. L'acquisizione fedele della dinamica di queste reti 3D e dense richiede il sezionamento ottico, che è spesso associato ai microscopi confocali a fluorescenza. Tuttavia, i recenti sviluppi della microscopia a fluorescenza a foglio luminoso (LSFM) l'hanno resa un'alternativa economica e, a volte, superiore. Per rendere LSFM accessibile ai ricercatori di citoscheletri che hanno meno familiarità con l'ottica, presentiamo una guida passo passo per principianti alla costruzione di un microscopio a fluorescenza versatile a foglio luminoso da componenti standard. Per consentire il montaggio del campione con i tradizionali campioni di vetrini, questo LSFM segue il design SOLS (single-objective light-sheet), che utilizza un unico obiettivo sia per l'eccitazione che per la raccolta delle emissioni. Descriviamo la funzione di ogni componente del SOLS in modo sufficientemente dettagliato da consentire ai lettori di modificare la strumentazione e progettarla in base alle loro esigenze specifiche. Infine, dimostriamo l'uso di questo strumento SOLS personalizzato visualizzando gli astri in reti di microtubuli guidate dalla chinesina.
Introduzione
La microscopia a fluorescenza a foglio luminoso (LSFM) rappresenta una famiglia di tecniche di imaging a fluorescenza ad alta risoluzione in cui la luce di eccitazione è modellata in un foglio 1,2, tra cui la microscopia a illuminazione piana selettiva (SPIM), l'eccitazione planare ad allineamento confocale (SCAPE) e la microscopia a piano obliquo (OPM)3,4,5,6,7. A differenza di altre modalità di microscopia come l'epifluorescenza, la microscopia a fluorescenza a riflessione interna totale (TIRFM) o la microscopia confocale, la fototossicità è minima nella LSFM e i campioni possono essere sottoposti a imaging su scale temporali più lunghe perché solo il piano del campione oggetto dell'imaging attivo è illuminato 8,9,10. Pertanto, le tecniche LSFM sono estremamente utili per l'imaging di campioni 3D per periodi di tempo prolungati, in particolare anche quelli troppo spessi per le tecniche di microscopia confocale. Per questi motivi, dal suo sviluppo originale nel 2004, LSFM è diventata la tecnica di imaging preferita da molti fisiologi, biologi dello sviluppo e neuroscienziati per la visualizzazione di interi organismi come pesci zebra vivi ed embrioni di Drosophila 3,4,6,11 . In questi ultimi due decenni, i vantaggi di LSFM sono stati sfruttati per visualizzare la struttura e la dinamica su scale progressivamente più piccole, tra cui la scalatissutale 11,12, cellulare e subcellulare, sia in vivo che in vitro13,14,15,17.
Nonostante le segnalazioni di casi d'uso di successo in letteratura, l'elevato costo dei sistemi LSFM commerciali (~0,25 milioni di dollari al momento della stesura di questo articolo)18,19 impedisce l'uso diffuso della tecnica. Per rendere le build fai-da-te un'alternativa fattibile per i ricercatori, sono state pubblicate diverse guide alla compilazione 8,13,20,21, tra cui lo sforzo ad accesso aperto OpenSPIM 22. Tuttavia, ad oggi, i ricercatori con un'esperienza ottica minima possono utilizzare solo progetti LSFM precedenti, che sono incompatibili con i tradizionali campioni montati su vetrino (Figura 1A). La recente implementazione SOLS (single-goal, light-sheet) utilizza un unico obiettivo sia per l'eccitazione che per il rilevamento (Figura 1C), superando così la limitazione relativa alla compatibilità 5,6,8,13,20. Tuttavia, il costo per la versatilità del progetto SOLS è un aumento sostanziale della complessità della costruzione a causa della necessità di due obiettivi aggiuntivi per trasmettere, de-inclinare e ricreare l'immagine del piano dell'oggetto sulla fotocamera per l'imaging (Figura 1D). Per facilitare l'accesso alle complesse configurazioni in stile SOLS, questo documento presenta una guida passo passo sulla progettazione, la costruzione, il processo di allineamento e l'uso di un sistema SOLS compatibile con le diapositive, che sarebbe utile ai ricercatori con conoscenza solo di un corso di ottica entry-level.
Sebbene il protocollo stesso sia succinto, i lettori devono fare riferimento ad altre risorse durante le fasi di preparazione per saperne di più su parti particolari del progetto o considerazioni sull'hardware. Tuttavia, se un lettore intende seguire le specifiche di questo progetto, potrebbe non essere necessario capire come selezionare particolari componenti ottici.
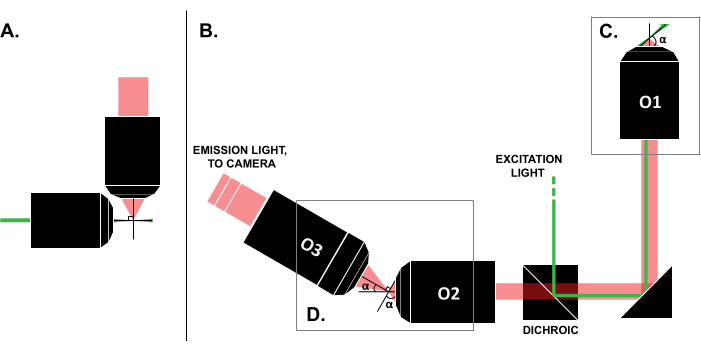
Figura 1: Caratteristiche delle diverse configurazioni LSFM. (A) La configurazione con due obiettivi ortogonali comuni nei primi progetti LSFM. In questa configurazione, per contenere il campione viene utilizzato un tubo capillare o un cilindro di gel, che non è compatibile con le tradizionali tecniche di montaggio del vetrino. (B) Uno schema di un progetto di foglio luminoso SOLS che mostri quanto segue: (C) l'unico obiettivo utilizzato sia per l'eccitazione che per la raccolta delle emissioni sul piano del campione (O1); ciò consente di montare una slitta tradizionale sulla parte superiore e (D) il sistema di obiettivi a relè nel percorso di emissione SOLS. O2 raccoglie la luce di emissione e ingrandisce l'immagine. O3 riprende l'aereo con l'angolo di inclinazione corretto sul sensore della fotocamera. Abbreviazioni: LSFM = microscopia a fluorescenza a foglio luminoso; SOLS = foglio luminoso monoobiettivo; O1-O3 = obiettivi. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocollo
1. Preparazione per l'allineamento
- Prima di iniziare la compilazione, eseguire tutte le revisioni della letteratura necessarie per avere un'idea chiara del caso d'uso previsto (ad esempio, i fluorofori da sottoporre a imaging, il volume di imaging necessario, i requisiti di risoluzione). In particolare, fare riferimento alla sezione dei risultati rappresentativi riportata di seguito per decidere se è appropriato seguire l'esatto progetto qui descritto. In caso affermativo, andare al passaggio 1.2. In caso contrario, trova suggerimenti e indicazioni per la selezione dell'hardware nella Guida alla compilazione di Sheunglab SOLS23.
NOTA: L'utente può trovare ulteriori informazioni sulle specifiche di questo particolare sistema nella sezione di discussione. - Raccogli tutti i componenti ottici, optomeccanici ed elettrici necessari come dettagliato nella Tabella dei materiali. Per gli utenti che modificano il sistema, raccogliere tutte le parti equivalenti.
- Costruire il laser di allineamento come illustrato nella Figura 2A. Verificare che la trave sia collimata utilizzando la piastra di taglio.
- Costruire la gabbia di allineamento del disco a doppio vetro smerigliato come illustrato nella Figura 2B.
- Preparare il campione di prova rivestito di colorante fluorescente.
- Creare una soluzione satura di colorante di rodamina aggiungendo gradualmente 1 ml di acqua distillata a 0,2 g di polvere liofilizzata fino a quando non è completamente disciolta. Vortice per omogeneizzare.
NOTA: Questa soluzione è sensibile alla luce. Sebbene non ci siano precauzioni necessarie durante la preparazione, assicurarsi che la soluzione sia conservata in un'area buia dopo essere stata preparata.
ATTENZIONE: Indossare sempre guanti e maschera quando si maneggia la polvere di rodamina. - Pipettare 10 μL al centro di un vetrino da analizzare.
- Posizionare un vetro di copertura di 22 mm x 22 mm sopra il liquido, assicurandosi che lo strato di fluorescenza sia il più sottile possibile.
- Sigillare con smalto trasparente.
NOTA: questo campione è sensibile alla luce. Per massimizzare la durata del campione, assicurarsi che il vetrino sia conservato in un'area buia quando non è in uso.
- Creare una soluzione satura di colorante di rodamina aggiungendo gradualmente 1 ml di acqua distillata a 0,2 g di polvere liofilizzata fino a quando non è completamente disciolta. Vortice per omogeneizzare.
- Preparare il campione di microsfere 3D (perline da 1 μm incorporate nel gel).
- Utilizzare del nastro biadesivo per creare un canale verticale largo 4-5 mm su un vetrino campione alto tre strati di nastro.
- Posiziona un vetro di copertura di 22 mm x 22 mm sopra il nastro al centro del vetrino. Premere con decisione sulle regioni nastrate per garantire una buona tenuta tra il nastro e il vetro di copertura.
- Usa una lama di rasoio per rimuovere il nastro in eccesso.
- Preparare 125 ml di soluzione satura di gomma di gellano aggiungendo gradualmente acqua deionizzata a 1 g di gomma di gellano in polvere. Questa soluzione sarà solida a temperatura ambiente e liquida a 65 °C.
- Introdurre 1 mL di soluzione di gomma di gellano in una provetta per microcentrifuga. Scaldare un contenitore d'acqua su una piastra calda a 65 °C e riscaldare la provetta della microcentrifuga fino a quando la gomma di gellano è visibilmente viscosa.
- Preparare 10 μL di una diluizione 1:1.000 di perline in una soluzione di gomma di gellano riscaldata.
- Pipettare con cautela la soluzione nella camera fino a riempirla. Usa uno stuzzicadenti per tamponare una piccola quantità di resina epossidica su entrambi i lati del canale, coprendo completamente le aperture da sigillare. Per garantire una corretta tenuta, ispezionare visivamente entrambe le estremità per assicurarsi che la resina epossidica sia leggermente penetrata in ciascuna estremità del canale.

Figura 2: Foto degli strumenti di allineamento. (A) Laser di allineamento collimato. AL1: Lente di allineamento 1, −50 mm; AL2: Lente di allineamento 2, 100 mm (B) Gabbia di allineamento del disco a doppio vetro satinato. Abbreviazioni: RMS CP = piastra a gabbia filettata RMS; SM1 CP = Piastra a gabbia filettata SM1. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Allineamento del percorso di eccitazione
- Abbozza la disposizione del microscopio sulla superficie del tavolo ottico. Misurare tutte le distanze nel modo più accurato possibile.
NOTA: Fare riferimento alla Figura 3 per la posizione dei componenti all'interno del sistema. - Montare il laser di eccitazione sul tavolo. Impostare due iridi all'altezza prevista del laser e montarle a 2-3 piedi di distanza sulla linea di fori desiderata dietro la posizione dello specchio 1 (M1). Utilizzare queste iridi per assicurarsi che il fascio sia a livello della superficie del tavolo e centrato sulla linea dei fori sul tavolo ottico.
NOTA: Indossare occhiali di sicurezza laser per la protezione degli occhi e bloccare eventuali raggi laser vaganti con schermi di sicurezza laser come precauzione di sicurezza. Fino a quando tutti i componenti non sono bloccati in modo permanente, è possibile una deriva dell'ordine delle ore. Imposta un'iride nel punto più lontano dell'allineamento alla fine di ogni giornata come rapido controllo visivo per la deriva quando torni alla build. Le vibrazioni, un tavolo ottico flottante in modo improprio e le correnti d'aria sono le cause più comuni di deriva ottica. - Montare l'otturatore laser il più vicino possibile al laser di eccitazione. Utilizza questo otturatore per bloccare rapidamente la luce laser durante l'allineamento, piuttosto che accendere e spegnere ripetutamente il laser.
- Assemblare i filtri ND nella ruota portafiltri ND (ND 0.5, 1.0, 2.0, 3.0, 4.0 e uno slot vuoto) e montarli dopo l'otturatore laser.
- Commutare l'attuatore motorizzato su uno stadio di traslazione (TS1), quindi inserire il tavolino sotto la posizione di M1. Assicurarsi che il tavolino trasli assialmente lungo la stessa linea di fori seguita dalla luce laser. Posiziona il tavolino al centro del suo raggio d'azione per il posizionamento iniziale.
- Nei seguenti passaggi 2.6-2.10, inserire i componenti ottici riflettenti nel percorso del fascio uno alla volta per dirigere il laser lungo il percorso come disegnato sul tavolo. Utilizzare la coppia di diafrasi impostati all'altezza esatta per definire il percorso del fascio di uscita desiderato e guidare il posizionamento e l'allineamento di ciascun elemento riflettente. Per ogni elemento, regolare l'altezza e la posizione del supporto per assicurarsi che il raggio in arrivo colpisca il centro. Quindi, ruotare la base del supporto per dirigere il raggio lungo il percorso del fascio allungato sul tavolo in modo che passi attraverso entrambe le iridi e regolare con precisione l'inclinazione del raggio in uscita con le manopole sul retro di ciascun supporto.
NOTA: Dopo che ogni elemento è stato allineato all'altezza corretta, aggiungere un collare slip-on al palo per fissare l'altezza.
- Nei seguenti passaggi 2.6-2.10, inserire i componenti ottici riflettenti nel percorso del fascio uno alla volta per dirigere il laser lungo il percorso come disegnato sul tavolo. Utilizzare la coppia di diafrasi impostati all'altezza esatta per definire il percorso del fascio di uscita desiderato e guidare il posizionamento e l'allineamento di ciascun elemento riflettente. Per ogni elemento, regolare l'altezza e la posizione del supporto per assicurarsi che il raggio in arrivo colpisca il centro. Quindi, ruotare la base del supporto per dirigere il raggio lungo il percorso del fascio allungato sul tavolo in modo che passi attraverso entrambe le iridi e regolare con precisione l'inclinazione del raggio in uscita con le manopole sul retro di ciascun supporto.
- Montare e allineare M1 sulla parte superiore di TS1.
- Montare e allineare la dicroica sul tavolo.
- Seguendo le istruzioni del produttore, collegare il galvo all'alimentatore e al generatore di funzioni.
- Montare il galvo in modo tale che il laser sia incidente sul centro esatto dello specchio. Accendere il galvo, quindi tenere premuto il pulsante AM sul generatore di forme d'onda per impostare l'inclinazione dello specchio su una corrente di 0 V CC (centro dell'intervallo). Ora, allinea il galvo alle iridi.
- Montare e allineare lo specchio 2 (M2).
- Inserire lo specchio cilindrico grande nel supporto dello specchio cilindrico. Utilizzare 1 nelle aste della gabbia per collegare un adattatore della gabbia da 30-60 mm sopra lo specchio 3 (M3). Utilizzare le manopole sul supporto dello specchio per appiattire l'inclinazione dello specchio M3 per il posizionamento iniziale.
- Montare la gabbia di allineamento in vetro satinato doppio nell'adattatore della gabbia sopra M3; Assicurarsi di serrare le viti di fermo sull'adattatore della gabbia che tengono in posizione la gabbia di allineamento ogni volta che viene utilizzata per l'allineamento. Montare M3 sul tavolo e regolare l'altezza e la posizione fino a quando la trave non è approssimativamente centrata su entrambi i dischi di allineamento in vetro smerigliato. Clamp M3 al tavolo e utilizzare un supporto per palo, 3 in post, 90° clamp e 2 in post su entrambi i lati di M3 per aggiungere supporto utilizzando i fori nastrati su entrambi i lati del supporto dello specchio. Utilizzare le manopole sul retro dello specchio per regolare con precisione il raggio.
NOTA: Tutti gli elementi riflettenti nel percorso di eccitazione sono ora impostati e non devono essere toccati. - Montare l'obiettivo 1 (L1) sul tavolo. Per tutti i posizionamenti iniziali dell'obiettivo, utilizzare un target dell'obiettivo avvitato per centrare il raggio in entrata sulla parte anteriore dell'obiettivo. Regolare l'inclinazione e la posizione laterale della lente 1 (L1) fino a quando il raggio non è centrato su entrambe le lastre di vetro smerigliato sulla gabbia di allineamento sopra M3.
- Montare l'obiettivo 2 (L2) nella rispettiva posizione per creare un sistema 4f con L1. Spostare L2 assialmente per ottenere un fascio collimato e utilizzare il laser di eccitazione e la piastra di taglio per controllare la collimazione. Regolare l'inclinazione e la posizione laterale di L2 per centrare la trave su entrambi i dischi di vetro smerigliato sopra M3.
- Montare il foro stenopeico in un supporto di traslazione xy. Montalo sopra uno stadio di traslazione 1D per fornire una traslazione assiale fine. Montare il foro stenopeico e il tavolino su un palo e un supporto per palo e posizionarlo nel punto focale condiviso tra L1 e L2. Regolare manualmente il foro stenopeico fino a quando la luce laser non può essere vista attraverso il foro stenopeico.
- Montare il sensore del misuratore di potenza subito dopo il foro stenopeico e utilizzare il pulsante della lunghezza d'onda sulla console digitale del misuratore di potenza per selezionare la lunghezza d'onda del laser di eccitazione. Regolare la posizione xy del foro stenopeico per massimizzare la trasmissione e ottenere un profilo del fascio vicino a TEM00. Quindi, regolare assialmente il foro stenopeico con lo stadio 1D per massimizzare ulteriormente la trasmissione.
- Montare l'obiettivo 4 (L4) sul tavolo nella sua posizione e regolare il supporto all'altezza corretta. Regolare L4 assialmente in modo che il fascio di eccitazione sia focalizzato sulla superficie del galvo. Regolare l'inclinazione e la posizione laterale di L4 per centrare la trave su entrambi i dischi di vetro smerigliato sopra M3.
- Montare l'obiettivo 3 (L3) sul tavolo nella sua posizione e regolare il supporto all'altezza corretta. Utilizzare il laser di eccitazione e la piastra di taglio per controllare la collimazione di L3 e L4. Regolare l'inclinazione e la posizione laterale di L3 per centrare la trave su entrambi i dischi di vetro smerigliato sopra M3.
- Rimuovere temporaneamente L3. Montare la lente di scansione 1 (SL1) sul tavolo e regolare la distanza assiale per formare un telescopio collimato con L4, misurato con la piastra di taglio. Regolare l'inclinazione e la posizione laterale di SL1 per centrare la trave su entrambi i dischi di vetro smerigliato sopra M3.
- Reinserire L3. Montare la lente del tubo 1 (TL1) e utilizzare il fascio di eccitazione e la piastra di taglio per collimare SL1 e TL1. Regolare l'inclinazione e la posizione laterale di TL1 per centrare la trave su entrambi i dischi di vetro smerigliato sopra M3.
- Utilizzando un anello adattatore, avvitare l'obiettivo 1 (O1) nella piastra della gabbia sopra M3. Rimuovere temporaneamente SL1 e lasciare che la trave colpisca il soffitto. Regolare l'altezza (distanza assiale) di O1 sul sistema a gabbia fino a quando la trave non forma un disco di Airy sul soffitto, quindi continuare a regolare fino a quando le dimensioni del disco non sono ridotte al minimo.
- Con O1 in posizione, montare lo stadio campione nella posizione appropriata.
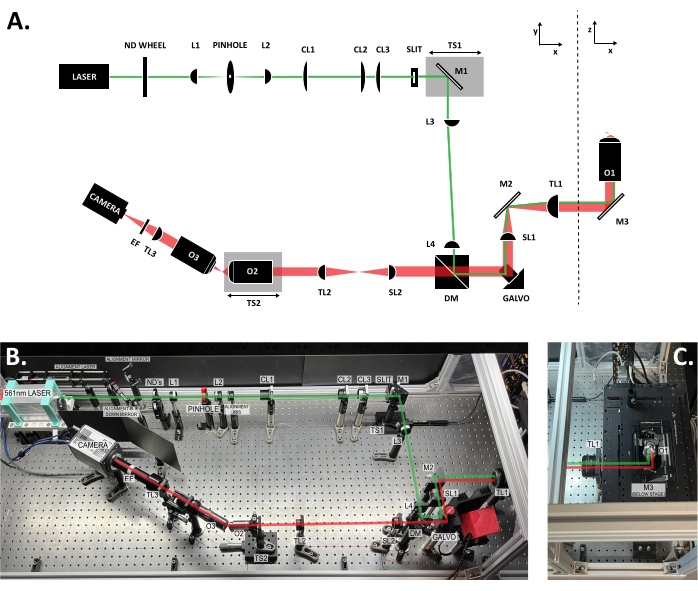
Figura 3: Posizione dei componenti all'interno del sistema SOLS. (A) Layout schematico del sistema SOLS con tutti i componenti etichettati. (B) Foto dall'alto verso il basso del sistema SOLS fisico sul tavolo ottico, esclusa l'area dello stadio del campione. (C) Foto dall'alto verso il basso dell'area dello stadio campione (estensione alla Figura 3B). Il percorso di eccitazione è mostrato in verde. Il percorso di emissione è mostrato in rosso. Lunghezze focali delle lenti: L1: 100 mm; L2: 45 mm; CL1: 50 mm; CL2: 200 mm; CL3: 100 mm; L3:150 mm; L4: 100 mm; SL1: 75 mm; TL1: 200 mm; SL2: 150 mm; TL2: 125 mm; TL3: 200 mm. Vedere la Tabella dei materiali per specifiche più dettagliate delle parti. Abbreviazioni: SOLS = foglio luminoso monoobiettivo; ND Wheel = ruota portafiltri a densità neutra variabile; L1-L4 = lenti acromatiche piano-concave; CL1-CL3 = lenti cilindriche; M1-M3 = specchi; TS1-TS2 = fasi di traduzione; DM = specchio dicroico; Galvo = galvanometro a scansione; SL1-SL2 = lenti di scansione; TL1-TL2 = lenti tubolari; O1-O3 = obiettivi; EF = filtro emissioni. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Allineamento del percorso di emissione
- Impostare il laser di allineamento.
- Montare due piastre a gabbia vuote accanto al laser di eccitazione alla stessa altezza del laser. Utilizzare queste piastre a gabbia per montare il laser di allineamento facendo scorrere le aste a gabbia del laser di allineamento nei fori vuoti nelle due piastre a gabbia. Assicurarsi che il laser possa essere impostato in posizione di accensione, fissandolo con del nastro adesivo attorno al pulsante di accensione o cablando un interruttore di accensione/spegnimento.
- Rimuovere O1 e reinserire la gabbia di allineamento in vetro smerigliato. Utilizzare un supporto per specchio cinematico e uno specchio a discesa per allineare il raggio di allineamento al percorso del fascio di eccitazione.
- Utilizzare il misuratore di potenza per massimizzare il segnale del raggio di allineamento dopo il foro stenopeico regolando con precisione i due specchi. Assicurarsi che la trave rimanga centrata sulla gabbia di allineamento in vetro smerigliato.
- Rimuovere la gabbia di allineamento e reinserire O1. Posizionare lo specchio quadrato sul tavolino campione di O1 e regolare lo specchio assialmente fino a quando la dimensione del profilo del fascio non viene ridotta al minimo dopo la dicroica.
- Montare un diaframma nel percorso di emissione e sufficientemente indietro in modo che la lente di scansione 2 (SL2), la lente tubolare 2 (TL2) e l'obiettivo 2 (O2) possano essere inseriti senza interferenze. Allineare il diaframma al laser di allineamento. Montare un disco di vetro smerigliato di almeno 1 pollice dietro il diaframma e assicurarsi che anche questo sia allineato alla luce laser.
- Inserire SL2 alla distanza corretta, misurata dal galvo con un righello. Regolare l'inclinazione e la posizione laterale di SL2 in modo che il raggio di allineamento in entrata sia centrato su SL2 e il raggio in uscita passi attraverso il diaframma e il disco di vetro smerigliato.
- Inserire TL2 alla distanza corretta, misurata da SL2 con un righello. Regolare l'inclinazione e la posizione laterale di TL2 in modo che la trave di allineamento in entrata sia centrata su TL2 e la trave in uscita passi attraverso il diaframma e il disco di vetro smerigliato.
- Montare TS2 sul tavolo. Assicurarsi che il tavolino trasli lungo l'asse ottico di O2.
- Avvitare O2 su un supporto di traslazione xy. Collegare un palo sotto il supporto xy per montare O2 sul tavolino di traslazione. Utilizzare un bersaglio a vite per centrare la parte posteriore di O2 sul laser rosso.
- Regolare le manopole xy e l'inclinazione di O2 in modo che il raggio di allineamento rosso passi attraverso il diaframma e il disco di vetro smerigliato.
- Spostare il laser di allineamento al di sopra di O1 e dirigerlo verso il basso nel percorso di emissione. Accendere il laser e assicurarsi che questo raggio sia centrato su tutte le lenti nel percorso di emissione.
- Coniugare i piani pupillari di O1 e O2 aprendo il diaframma e rimuovendo il disco di vetro smerigliato in modo che il fascio di allineamento in uscita da O2 continui senza ostacoli fino a una superficie o a una parete lontana (>0,5 m) (Figura 4). Regolare TS2 fino a quando il raggio non forma un piccolo disco di Airy sulla superficie, quindi continuare a regolare TS2 per ridurre al minimo le dimensioni del disco di Airy.
NOTA: Un raggio fortemente divergente indica il posizionamento errato di O2. Tuttavia, poiché questo raggio passa attraverso due obiettivi, è intrinseca una piccola quantità di divergenza. In quanto tale, il disco di Airy è la migliore guida. - Ottimizza il galvo per la scansione inclinabile: premere il pulsante FSK sul generatore di forme d'onda per selezionare un segnale d'onda triangolare per il galvo e impostarlo su una frequenza bassa (~1 Hz). Osservare la trave di allineamento sulla stessa superficie o parete lontana.
NOTA: Se il galvo è posizionato in modo errato, il raggio si sposterà orizzontalmente sulla superficie insieme al movimento del galvo. Questo problema può essere risolto regolando con precisione (a mano) l'inclinazione e la posizione xy della base galvo fino a quando lo spostamento del fascio non è rilevabile a occhio nudo. - Verificare la qualità del sistema mediante imaging a 0°.
- Avvitare O3 in un supporto di traslazione xy. Avvitare un tubo dell'obiettivo da 1 pollice nello stadio di traslazione della gabbia e avvitare lo stadio di traslazione xy nel tubo. Utilizzare due aste a gabbia per collegare la parte anteriore dello stadio di traslazione a gabbia a una piastra a gabbia e montare la piastra a gabbia su un palo. Montare l'obiettivo 3 (O3) vicino alla parte anteriore di O2 (~4-5 mm) a 0° e regolare l'altezza in modo che corrisponda.
- Montare un disco di allineamento in vetro smerigliato sul piano focale condiviso tra SL2 e TL2, misurato con un righello. Montare il vetrino di prova fluorescente acrilico sul tavolino e illuminare il vetrino con il laser di eccitazione. Guardare attraverso la parte posteriore di O3, regolare sia l'altezza che la posizione assiale di O3 per trovare la luce di emissione, quindi regolare O3 assialmente fino a quando la luce di emissione non riempie l'apertura posteriore (Figura 5).
- Avvitare due aste a gabbia da 8 pollici nella parte posteriore dello stadio di traslazione O3. Far scorrere una piastra a gabbia con un disco di vetro smerigliato montato sulle aste, quindi regolare con precisione O3 utilizzando il supporto xy per assicurarsi che la luce di emissione esca da O3 centrata. Quindi, rimuovere le aste della gabbia.
- Montare un disco di vetro smerigliato nella posizione approssimativa del sensore della fotocamera e allineare l'altezza e la posizione del disco alla luce di emissione.
- Avvitare la lente del tubo 3 (TL3) in una piastra a gabbia e montarla immediatamente dietro O3. Centrare TL3 sulla luce di emissione in entrata, quindi regolare l'inclinazione di TL3 per allineare la luce in uscita al disco di vetro smerigliato.
- Montare la fotocamera alla distanza corretta dall'obiettivo del tubo, misurata con un righello.
- Avvitare entrambi i tubi dell'obiettivo da 2 pollici e il filtro di emissione sulla fotocamera.
- Rimontare il disco di allineamento in vetro smerigliato sul piano focale condiviso tra SL2 e TL2. Montare il campione di prova del colorante fluorescente e illuminare il campione con il fascio di eccitazione.
- Accendere la fotocamera, quindi aprire il programma Micromanager sul computer collegato. Fare clic su Live per accedere alla visualizzazione in diretta. Fare clic su Auto una volta per impostare le impostazioni iniziali dell'esposizione, quindi ripristinare l'esposizione in base alle esigenze durante l'imaging.
NOTA: Micromanager non funzionerà correttamente a meno che non venga aperto dopo che la fotocamera è stata accesa. - Regolare le manopole di traslazione xy sul supporto O3 fino a quando il piccolo foro nel disco di allineamento del vetro non è centrato all'interno del campo visivo (FoV). Regolare O3 assialmente con lo stadio di traslazione della gabbia fino a quando il foro non è a fuoco; i bordi dovrebbero apparire nitidi (Figura 6).
- Immagini di perline fluorescenti per verificare la qualità del sistema.
- Rimuovere il disco di allineamento in vetro smerigliato, montare il campione di microsfere 3D e illuminare il campione con il fascio di eccitazione.
- Regolare l'altezza del campione rispetto a O1 fino a quando le perle fluorescenti non riempiono una regione circolare al centro del campo visivo.
- Regolare con precisione la posizione di O3 utilizzando lo stadio xy e lo stadio di traslazione assiale fino a quando le funzioni di diffusione del punto (PSF) non sono rotonde (indicative di aberrazioni minime) e luminose (indicative di un buon rapporto segnale/rumore) (Figura 7). Se ciò non può essere ottenuto regolando l'O3, è molto probabile che il sistema ottico tra i componenti O1 e O2 sia allineato in modo non ottimale; Seguire i controlli diagnostici al punto 3.13 di seguito.
- Se è possibile ottenere PSF rotondi , saltare la fase diagnostica e passare all'inclinazione del sistema di imaging.
- Se necessario, eseguire controlli diagnostici.
NOTA: Una volta ottenuti buoni PSF, il resto dei passaggi diagnostici può essere saltato.- Montare la luce in campo chiaro (BF) sopra O1. Montare il target di prova a griglia positiva sul tavolino di campionamento alla stessa altezza assiale dello specchio di allineamento. Centrare la griglia da 10 μm e illuminarla con la luce BF.
- Visualizzare l'immagine della griglia sulla fotocamera e traslare il campione fino a quando la griglia non è a fuoco. Usa l'immagine della griglia per confermare che il campo attraverso il FoV è piatto: in caso contrario, la griglia apparirà distorta e arcuata. Per correggere un'immagine della griglia errata, regolare la posizione xyz e l'inclinazione di O3, quindi regolare il TL3 e la fotocamera di conseguenza.
NOTA: Se è possibile ottenere una griglia piatta, ripetere il passaggio 3.12.10, quindi passare all'inclinazione del sistema di imaging. - Impostare la telecamera di allineamento o la fotocamera per la ripresa alla distanza corretta in modo che SL2 metta a fuoco l'immagine sul sensore. Visualizzare la destinazione della griglia sul piano intermedio (Figura 8). Se anche questa griglia è inclinata, è molto probabile che il sistema ottico tra i componenti O1 e SL2 sia allineato in modo non ottimale e debba essere rivisitato. Ottimizza l'allineamento se necessario prima di procedere.
NOTA: Se la fotocamera non si inserisce tra SL2 e TL2, utilizzare uno specchio aggiuntivo per far rimbalzare l'immagine di 90° dopo SL2 e sulla fotocamera. - Controllare le FPF sul piano intermedio: dopo aver controllato la griglia, un altro buon controllo diagnostico consiste nel controllare le FPF sullo stesso piano intermedio. Una buona immagine su questo piano, che è simile alla Figura 7 ma con un ingrandimento diverso (Figura 9), indica un buon allineamento attraverso SL2.
NOTA: Se è possibile ottenere una griglia piatta e PSF rotondi sul piano intermedio, ripetere il passaggio 3.13.2, quindi il passaggio 3.12.10, quindi passare all'inclinazione del sistema di imaging.
- Inclinare il sottosistema di imaging O3 a 30°.
- Rimuovere O3, TL3 e la fotocamera.
- Reinserire O3 a 30° sull'asse ottico di O2 utilizzando le linee sulla tabella come guida.
- Montare un disco di allineamento in vetro smerigliato sul piano focale condiviso tra SL2 e TL2. Montare il vetrino di prova fluorescente acrilico sul tavolino e illuminare il vetrino con il laser di eccitazione. Ancora una volta, guarda attraverso la parte posteriore di O3, regola sia l'altezza che la posizione assiale di O3 per trovare la luce di emissione a 30°, quindi regola O3 assialmente finché la luce di emissione non riempie l'apertura posteriore.
- Rimuovere il disco di allineamento in vetro smerigliato tra SL2 e TL2 per ottenere un segnale di emissione più forte.
- Avvitare due aste a gabbia da 8 pollici nella parte posteriore dello stadio di traslazione O3. Far scorrere una piastra a gabbia con un disco di vetro smerigliato montato sulle aste, quindi regolare con precisione O3 utilizzando il supporto xy per assicurarsi che la luce di emissione esca da O3 centrata. Quindi, rimuovere le aste della gabbia.
- Montare un disco di vetro smerigliato nella posizione approssimativa del sensore della fotocamera e allineare l'altezza e la posizione del disco alla luce di emissione.
- Montare TL3 immediatamente dietro O3. Centrare TL3 sulla luce di emissione in entrata, quindi regolare l'inclinazione di TL3 per allineare la luce in uscita al disco di vetro smerigliato.
- Per impostare in modo più accurato la distanza della telecamera TL3, svitare con cautela O3 e montare il laser di allineamento in modo che sia focalizzato da TL3 sulla telecamera. Se necessario, utilizzare filtri ND in modo che l'intensità del laser sia <1 mW. Avviare il live view della telecamera e regolare TL3 assialmente per ridurre al minimo il punto laser sulla telecamera.
- Rimontare il disco di allineamento in vetro smerigliato sul piano focale condiviso tra SL2 e TL2. Montare il campione di prova del colorante fluorescente e illuminare il campione con il fascio di eccitazione. Regolare le manopole di traslazione xy sull'attacco O3 fino a quando il piccolo foro nel disco di allineamento del vetro non si trova all'interno del FoV sulla fotocamera. Regolare lo stadio di traslazione della gabbia per spostare O3 assialmente fino a quando il foro non è a fuoco; Assicurarsi che il foro appaia simile a come appariva a 0°.
- Rimontare il target di prova della griglia positiva alla stessa altezza assiale e illuminare la griglia con la luce BF. Verificare che solo una sezione verticale sia a fuoco (a causa dell'inclinazione di 30°). Ancora una volta, usa l'immagine della griglia per confermare che il campo attraverso il FoV è piatto, anche quando non è a fuoco. Quando la diapositiva viene traslata assialmente, verificare che la parte a fuoco del FoV (destinazione della griglia) si estenda sullo schermo orizzontalmente, mentre i quadrati della griglia mantengano una dimensione coerente (Figura 10).
NOTA: A causa dell'inclinazione del piano di imaging sul campione, la griglia potrebbe apparire leggermente allungata nel piano x.
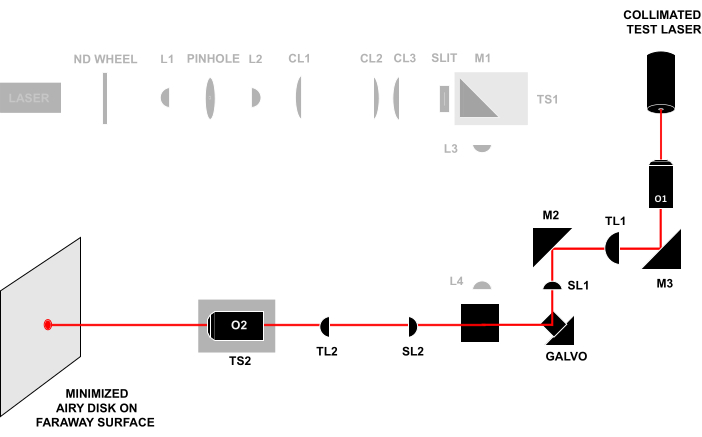
Figura 4: Tecnica Laser-in-laser-out. Invio di un fascio di prova collimato attraverso la parte anteriore di O1 e osservazione del fascio che esce da O2 su una superficie lontana. Se tutti i componenti sono allineati alla distanza corretta, il raggio formerà un piccolo disco di Airy sulla superficie lontana. Tutte le abbreviazioni sono identiche a quelle della Figura 3. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Utilizzo della luce di emissione per l'allineamento. (A) Luce di emissione da un vetrino fluorescente acrilico su un bersaglio avvitabile dietro il BFP di O2. (B) Trovare la luce di emissione a vista attraverso la parte posteriore di O3. Abbreviazioni: O2-O3 = obiettivi; BFP = piano focale posteriore. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Immagine sulla telecamera del disco di allineamento in vetro smerigliato correttamente messo a fuoco. Il disco è stato posizionato sul piano intermedio tra SL2 e TL2. Barra graduata = 50 μm. Abbreviazioni: SL2 = lente di scansione; TL2 = lente tubolare. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: Immagine della telecamera del campione di perline 3D. L'immagine mostra perline da 1 nm con il modulo di imaging impostato a 0° e illuminate da un fascio circolare prima dell'inserimento delle lenti cilindriche. Barra della scala = 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8: Target positivo del test della griglia correttamente focalizzato sul piano intermedio tra SL2 e TL2. Le griglie piatte in tutto il campo indicano un buon allineamento dei componenti SL2 e precedenti. Barra della scala = 30 μm. Abbreviazioni: SL2 = lente di scansione; TL2 = lente tubolare. Fare clic qui per visualizzare una versione più grande di questa figura.
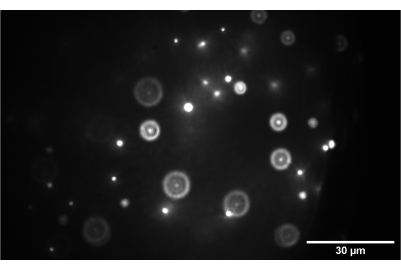
Figura 9: Immagine della telecamera del campione di perline 3D. L'immagine mostra perline da 1 nm correttamente focalizzate sul piano intermedio tra SL2 e TL2. Barra della scala = 30 μm. Abbreviazioni: SL2 = lente di scansione; TL2 = lente tubolare. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 10: Target di prova della griglia positivo con un quadrato giallo di dimensioni coerenti sovrapposto in modo che corrisponda ai quadrati della griglia. (A) Griglia a fuoco sul lato sinistro. (B) Griglia a fuoco sul lato destro. Il quadrato giallo corrisponde alle dimensioni dei riquadri della griglia su entrambi i lati del FoV. Barre della scala = 30 μm. Abbreviazione = FoV = campo visivo. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Allineamento del foglio luminoso obliquo
- Rimuovere O1 e reinserire al suo posto la doppia gabbia di allineamento in vetro smerigliato. Verificare che la trave sia collimata e centrata su entrambi i dischi di vetro smerigliato.
- Avvitare la lente cilindrica 1 (CL1) in un supporto per obiettivo rotante. Montare CL1 nel percorso ottico e ruotare il supporto in modo che il raggio venga espanso in direzione verticale rispetto al tavolo ottico. Regolare l'inclinazione e la posizione laterale di CL1 in modo che il fascio sia centrato sulla parte anteriore e mantenga una posizione centrata su entrambi i dischi di vetro smerigliato.
- Avvitare la lente cilindrica 2 (CL2) in un supporto per obiettivo rotante e montare CL2 nel percorso ottico alla distanza corretta per formare un sistema 4f con CL1. Ruotare CL2 con lo stesso orientamento di CL1 in modo che il fascio venga allungato in direzione verticale rispetto alla tavola ottica e collimato. Utilizzare una scheda di prova per misurare l'altezza del profilo della trave cilindrica in più punti per assicurarsi che la trave sia collimata. Regolare l'inclinazione e la posizione laterale di CL2, come eseguito al punto 4.2.
- Avvitare la lente cilindrica 3 (CL3) in un innesto rotante e montare CL3 nel percorso ottico alla distanza corretta per formare un sistema 4f con L3. Ruotare CL3 con lo stesso orientamento di CL1 e CL2 in modo che il raggio venga focalizzato su un profilo di foglio orizzontale sul piano focale. Regolare l'inclinazione e la posizione laterale di CL3, come eseguito al punto 4.2.
- Inserire la fessura: utilizzando quattro aste a gabbia da 4 pollici e il supporto a gabbia CL3, montare la fessura con orientamento verticale sul piano focale tra CL3 e L3, come misurato con un righello. Utilizzare il profilo della trave di eccitazione allungata per regolare l'altezza e la posizione laterale della fessura fino a quando non è centrata sulla trave.
- Reinserire O1, montare il campione di prova del colorante fluorescente e illuminare il campione con il foglio luminoso di eccitazione. Sul sensore della fotocamera, verificare che il foglio luminoso a 0° appaia come un sottile foglio verticale (Figura 11A).
- Rimuovere il campione di prova del colorante fluorescente e pulire l'O1. Lasciare che il foglio luminoso si espanda sopra O1 senza ostacoli. Utilizzando il controllo motorizzato dello stadio di traslazione, traslare M1 verso le lenti cilindriche per impostare l'angolo del foglio luminoso a circa 60° rispetto all'asse ottico di O1.
NOTA: È fondamentale che il foglio luminoso sia inclinato nella direzione corretta per allinearsi con il piano di imaging inclinato in modo simile (Figura 12); Se un sistema è strutturato in modo diverso da questo specifico design, la direzione corretta dell'inclinazione può essere individuata attraverso il ray tracing geometrico.
NOTA: Per riferimento, traslando M1 2.647 mm verso la fessura, impostare il foglio luminoso sull'inclinazione corretta in questa configurazione. - Reinserire il campione di prova del colorante fluorescente per visualizzare l'immagine del foglio inclinato. Assicuratevi che il foglio luminoso abbia mantenuto una forma del fascio verticale sulla fotocamera, ma che sia più largo e più debole (Figura 11B) .
- Traslare il campione assialmente con il tavolino in modo che il colorante fluorescente sia illuminato dal foglio luminoso a cinque diverse profondità tra il centro del FoV e il lato destro dello schermo. Salva ogni immagine.
- Apri le immagini in Figi. Per ogni immagine, selezionate lo strumento Linea e disegnate una linea orizzontale dal centro del campo visivo al centro del foglio luminoso. Per misurare lo spostamento, vai a Analizza | Misura per vedere la lunghezza delle linee. Quindi, tracciare lo spostamento del foglio luminoso in funzione della profondità del campione per calcolare l'angolo del foglio luminoso sopra O1.
- Traduci leggermente M1. Ripetere i passaggi 4.9 e 4.10 fino a quando l'angolo del foglio luminoso è di 60° rispetto all'asse ottico di O1, corrispondente all'angolo del piano di imaging.

Figura 11: Immagini della telecamera del campione di prova di colorante fluorescente illuminato da un foglio luminoso di forma corretta. (A) Il foglio a 90°, dritto verso l'alto lungo l'asse ottico di O1, e (B) inclinato di 30° (60° rispetto all'asse ottico di O1). Barre graduate = 50 μm. Abbreviazione: O1 = obiettivo. Fare clic qui per visualizzare una versione più grande di questa figura.
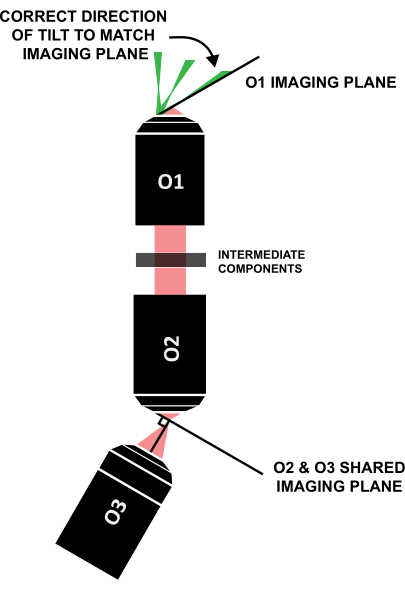
Figura 12: Direzione corretta dell'inclinazione del foglio luminoso per allinearla con il piano di imaging di O1. Abbreviazione: O1-O3 = obiettivi. Fare clic qui per visualizzare una versione più grande di questa figura.
5. Messa a punto del sistema per l'imaging e la raccolta dei dati
- Montate la diapositiva per perline 3D e traslate il campione assialmente con il tavolino fino a quando le perline non riempiono il campo visivo della telecamera.
- Regolare l'O3 utilizzando lo stadio xy e lo stadio di traslazione a gabbia, con l'obiettivo di ridurre al minimo le aberrazioni e ottimizzare il rapporto segnale/rumore nell'immagine (Figura 13).
- Regolare il collare di correzione di O1, con l'obiettivo di ridurre al minimo le aberrazioni e ottimizzare il rapporto segnale/rumore nell'immagine.
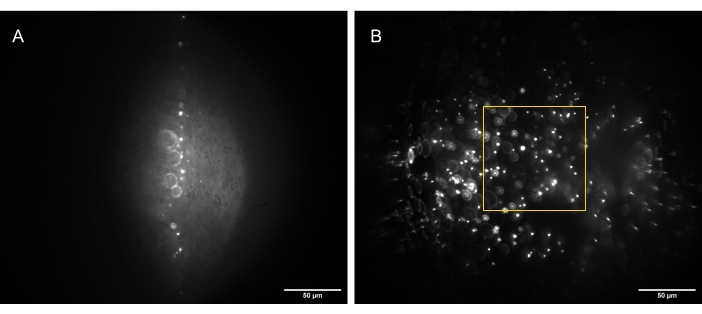
Figura 13: Immagini della telecamera del campione di microsfere 3D (perline da 1 μm) illuminate da un foglio luminoso di forma corretta. (A) Foglio a 90°, dritto verso l'alto lungo l'asse ottico di O1, e (B) inclinato di 30° rispetto all'asse ottico di O1. Il riquadro giallo indica la porzione del FoV che è piatta, coerente e utilizzabile (80 μm x 80 μm) e in cui è possibile acquisire dati affidabili. Barre della scala = 50 μm. Abbreviazioni: O1 = obiettivo; FoV = campo visivo. Fare clic qui per visualizzare una versione più grande di questa figura.
6. Calibrazione dell'ingrandimento del sistema
- Montare il target di prova della griglia positiva sul tavolino di campionamento e illuminarlo con la luce in campo chiaro.
- Traslate la diapositiva della griglia assialmente con lo stage per mettere a fuoco la diapositiva della griglia. Metti a fuoco il centro della griglia.
- Cattura e salva l'immagine, quindi aprila in Figi.
- Usa lo strumento Linea e la funzione Misura nelle Figi per misurare con precisione la distanza tra due linee della griglia in pixel. Dividere questo valore per la distanza nota (10 μm) per determinare la calibrazione pixel-micron.
- Calcolare l'ingrandimento (M) del sistema utilizzando la dimensione misurata del pixel e la dimensione nota di un pixel con l'equazione (1).
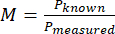 (1)
(1)
7. Acquisizione di scansioni volumetriche
- Posizionare il campione.
- Attivare l'anteprima della telecamera, il galvo, il generatore di funzioni, l'alimentatore, il tavolino e il laser di eccitazione.
- Montare il campione, quindi fare clic sul pulsante FSK sul generatore di funzioni per impostare un'onda triangolare. Per trovare il campione, utilizzare il generatore di funzioni per impostare quanto segue: ampiezza picco-picco di 400 mV (utilizzando il pulsante Ampl.), offset 0 (utilizzando il pulsante Offset ) e frequenza di 200 mHz. Utilizzare la finestra Micromanager per impostare un tempo di esposizione di 100 ms.
- Scorrere manualmente in z fino a raggiungere il piano di campionamento. Ottimizzare l'impostazione z in modo che l'area desiderata per la scansione volumetrica passi attraverso lo schermo durante un ciclo.
- Selezionare i parametri di scansione.
- Assicurarsi che l'ampiezza picco-picco sia impostata correttamente controllando visivamente che l'anteprima appaia a fuoco per tutta la durata della scansione. Se la qualità dell'immagine peggiora prima di avvicinarsi a un'estremità della scansione rispetto all'altra, modificare l'offset sul generatore di funzioni per spostare il centro della scansione verso l'area migliore.
- Nel programma Micromanager, selezionare un tempo di esposizione e fare clic su Multi-D Acq. per aprire la finestra Acquisizione multidimensionale. Utilizzare la casella Conteggio per scegliere il numero di fotogrammi, che imposterà il tempo totale di acquisizione. L'intervallo tra i fotogrammi (frame rate) verrà impostato in base al tempo di esposizione, a meno che non sia specificato un intervallo più lungo nella casella Intervallo. Sul generatore di funzioni, impostare la frequenza per creare una scansione a volume completo di metà del periodo della funzione d'onda triangolare (scansione lineare in una direzione).
NOTA: Se la frequenza e la frequenza dei fotogrammi sono troppo basse, verranno acquisiti troppo pochi fotogrammi per una scansione del volume e il numero di fotogrammi basso creerà artefatti visibili durante la post-elaborazione. Per riferimento, la Figura 13 era composta da ~100 fotogrammi nella scansione e la Figura 14 era composta da ~800. È inoltre fondamentale considerare il campione stesso quando si selezionano i parametri. Assicurarsi che il tempo di esposizione sia impostato in modo che il campione sia sufficientemente eccitato ma non saturo. A tal fine è possibile regolare anche l'intensità del laser di eccitazione. Se l'utente sta acquisendo una serie di scansioni volumetriche per caratterizzare un processo variabile nel tempo in 3D, assicurarsi che la scala temporale di scansione superi la dinamica della scala temporale del sistema.
- Raccolta di video: acquisisci un time-lapse che catturi almeno la durata di una rampa completa verso l'alto o verso il basso dell'onda triangolare, corrispondente a una scansione completa del volume.
8. Procedure di post-elaborazione
- Pile di immagini volumetriche per raddrizzamento
- Raddrizzare le scansioni del volume per convertire la pila di immagini in piani inclinati in una serie di immagini in coordinate xyz reali.
NOTA: Esistono molte guide eccellenti sulla post-elaborazione delle immagini light-sheet e sul software open-source per eseguire il raddrizzamento delle scansioni di volumi esistenti, nonché per eseguire il raddrizzamento e salvare le immagini raddrizzate durante l'acquisizione24. - Per raddrizzare le scansioni volumetriche, ottenere i seguenti due parametri: la distanza reale tra due fotogrammi in pixel (d) e l'angolo tra il piano del fotogramma e il piano x-y (θ è impostato dall'angolo del foglio di luce obliquo (in questo sistema, 30°). La distanza tra i fotogrammi dipenderà dall'ottica di imaging e dalle impostazioni di acquisizione.
- Raddrizzare le scansioni del volume per convertire la pila di immagini in piani inclinati in una serie di immagini in coordinate xyz reali.
- Trovare il parametro d
- Calibrare la distanza tra i telai per ogni volta che il sistema viene sostanzialmente riallineato. Eseguire questa calibrazione con una pila di immagini di perline fluorescenti, poiché sono le più facili da usare per diagnosticare i problemi.
- Acquisisci una pila di immagini ed esegui il codice di raddrizzamento usando qualsiasi ipotesi iniziale per il parametro d . Aprire la pila di immagini raddrizzate in ImageJ e scorrere la pila. Se d è stato impostato sostanzialmente lontano dal suo valore reale, si osservi che le perline appariranno allungate artificialmente in x o y, e le singole perline sembreranno muoversi nel piano xy mentre l'utente scorre i fotogrammi in z (piuttosto che mettere a fuoco e sfocare dallo stesso punto centrale). Eseguire l'iterazione sul parametro d più volte fino a quando questi problemi non sono più evidenti.
- Una volta che il parametro d sembra essere ragionevolmente vicino al valore reale, calcola le proiezioni di intensità massima della pila di immagini lungo le direzioni x e y. Si noti che le perline di un diametro vicino al limite di diffrazione possono apparire allungate in z, ma idealmente non dovrebbero apparire coniche o essere allungate in diagonale. Perfezionate i parametri di raddrizzamento fino a quando questi criteri non migliorano in modo sostanziale con le nuove iterazioni. Per riferimento, i dati mostrati nella Figura 13 sono stati raddrizzati a d = 2,50 pixel e i dati nella Figura 14 sono stati raddrizzati a d = 1,0 pixel.
NOTA: La distanza tra i fotogrammi dipenderà linearmente dall'ampiezza, dalla frequenza e dalla frequenza dei fotogrammi della scansione.
Risultati Rappresentativi
Sono state eseguite scansioni volumetriche di perle da 1 μm incorporate nella gomma di gellano. La Figura 14 mostra le proiezioni di intensità massima delle scansioni volumetriche raddrizzate lungo le direzioni x, y e z.

Figura 14: Imaging volumetrico di microsfere fluorescenti da 1 μm in gomma di gellano. Vengono mostrate le proiezioni di massima intensità delle scansioni volumetriche raddrizzate. Barre di scala = 30 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Abbiamo dimostrato l'uso del microscopio a foglio di luce monoobiettivo per caratterizzare reti di citoscheletri ricostituiti eseguendo scansioni volumetriche di campioni di astri microtubuli. In breve, i microtubuli marcati con rodamina e stabilizzati con taxolo sono stati polimerizzati da dimeri ricostituiti mediante GTP; quindi, dopo la polimerizzazione, i cluster motori della chinesina a base di streptavidina sono stati miscelati in campioni insieme all'ATP per concentrazioni finali di microtubuli da 6 μM, dimeri di chinesina da 0,5 μM e ATP da 10 mM. Protocolli e guide approfonditi per la preparazione di microtubuli stabilizzati con taxolo e cluster motori di chinesina sono disponibili sui siti web del Mitchson Lab e del Dogic Lab25,26. I campioni sono stati pipettati delicatamente in vetrini da microscopio, sigillati e lasciati riposare per 8 ore prima dell'imaging per consentire la cessazione dell'attività motoria in modo che i campioni raggiungessero uno stato strutturale stabile che assomigliava agli astri.
Gli studi sui sistemi di citoscheletro ricostituito impiegano più frequentemente la microscopia confocale o a epifluorescenza per l'immagine di filamenti marcati. Tuttavia, entrambe queste tecniche sono limitate nella loro capacità di visualizzare campioni 3D densi27. Mentre sono stati fatti molti progressi nella ricerca sulla materia attiva basata sul citoscheletro in vitro vincolando i campioni ad essere quasi 2D28,29, le reti di citoscheletro sono intrinsecamente 3D e molti sforzi attuali risiedono nella comprensione degli effetti che possono verificarsi solo nei campioni 3D29,30, creando così la necessità di imaging 3D ad alta risoluzione.
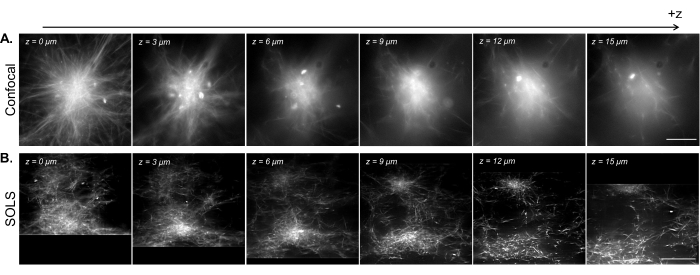
Figura 15: Facilitazione della visualizzazione 3D di campioni di citoscheletro ricostituiti mediante microscopia a foglio di luce a singolo obiettivo. (A) Immagini di astri di microtubuli fluorescenti acquisite su un microscopio confocale a scansione laser Leica DMi8. Le immagini mostrano piani diversi da uno z-scan. Barra della scala = 30 μm. (B) Immagini raddrizzate deconvolute da una scansione volumetrica eseguita sulla configurazione del foglio luminoso a obiettivo singolo dello stesso campione. Barra della scala = 30 μm. L'area dell'immagine raddrizzata qui corrisponde al FoV utilizzabile (riquadro giallo) mostrato nella Figura 13B. Mentre il confocale eccelle nell'imaging di singoli piani vicino al vetrino coprioggetto, la densità del campione fluorescente introduce complicazioni quando si esegue l'imaging su piani più alti a causa del segnale aggiuntivo proveniente da sotto il piano di imaging. Il foglio luminoso aggira questo problema illuminando solo il piano di imaging, consentendo così un'immagine uniformemente nitida su diversi piani in z. Abbreviazioni: SOLS = foglio luminoso monoobiettivo; FoV = campo visivo. Fare clic qui per visualizzare una versione più grande di questa figura.
Nella Figura 15, mostriamo l'imaging volumetrico di una rete di microtubuli ricostituita contratta in strutture simili ad aster da cluster motori di chinesina. Come mostrato in una precedente ricerca28,31, queste strutture 3D tendono a crescere dense verso il centro, risultando in regioni luminose di fluorescenza che sono predominanti nel segnale. Nei piani di imaging vicino al vetrino coprioggetto (basso livello z), la microscopia confocale (Figura 15A) può risolvere singoli filamenti intorno alla periferia dell'astro, con uno sfondo aggiuntivo verso il centro a causa dei segnali di fluorescenza fuori fuoco dall'alto. Tuttavia, spostandosi di alcuni micron in z si riduce rapidamente la qualità delle immagini a causa delle sezioni dense fuori fuoco dell'astro che sono predominanti nel segnale nel piano di imaging. L'illuminazione su un solo piano del foglio luminoso (Figura 15B) elimina i segnali sfocati dalle parti dense dell'astro sopra e sotto il piano di imaging, consentendo così una qualità dell'immagine comparabile tra i piani. La capacità del foglio luminoso di produrre dati di scansione volumetrica affidabili e di alta qualità apre la possibilità di visualizzare e caratterizzare fenomeni 3D in sistemi di citoscheletro ricostituiti.
Discussione
Due dettagli importanti relativi a questo protocollo sono il costo complessivo del sistema e il tempo previsto di costruzione e allineamento. Sebbene il costo esatto sia variabile, possiamo tranquillamente stimare che il costo in toto di questo SOLS o di un sistema fai-da-te simile si aggirerebbe intorno agli 85.000 dollari. Notiamo che questa stima considera il prezzo al dettaglio di tutti i componenti, quindi questo prezzo complessivo può essere notevolmente ridotto acquistando componenti usati. In termini di tempo di costruzione, sarebbe ragionevole aspettarsi che un utente con poca esperienza ottica costruisca e allinei l'intero sistema SOLS entro 1-2 mesi, a condizione che tutti i componenti siano disponibili e pronti. Nonostante la lunghezza e la complessità del protocollo, riteniamo che la quantità di dettagli nel manoscritto scritto, abbinata al protocollo video, dovrebbe rendere questo protocollo semplice e veloce da seguire.
Ci sono due passaggi critici in questo protocollo. Innanzitutto, il posizionamento del galvo determina il posizionamento di molti obiettivi in quanto fa parte di tre coppie di lenti 4f separate. È fondamentale che il galvo sia coniugato con i piani focali posteriori di O1 e O2 e centrato correttamente per garantire una scansione invariante dell'inclinazione. In secondo luogo, la qualità dell'immagine è estremamente sensibile all'allineamento di O2 e O3 l'uno rispetto all'altro. In questo caso, è necessario prestare attenzione per garantire che, in primo luogo, l'angolo di allineamento da O3 a O2 corrisponda all'inclinazione del foglio luminoso di eccitazione, fornendo così un'illuminazione il più possibile piatta attraverso il FoV inclinato in modo simile. In secondo luogo, l'O3 deve essere posizionato alla distanza assiale corretta per mantenere un FoV piatto con un'area il più ampia possibile. In terzo luogo, l'O3 deve essere posizionato alla corretta distanza laterale dall'O2 per massimizzare il segnale che passa attraverso l'interfaccia O2-O3.
In termini di FoV utilizzabile, questo sistema ha ottenuto un campo piatto e affidabile con un'illuminazione costante su un'area di 80 μm x 80 μm. Quest'area è più piccola del FoV massimo fornito dalla telecamera, quindi il FoV utilizzabile è indicato dal riquadro giallo nella Figura 13. In termini di potere risolutivo, questo sistema ha raggiunto una distanza minima risolvibile di 432 nm lungo l'asse x e 421 nm lungo l'asse y, che è stata misurata trovando la media sigma x e y delle funzioni di diffusione gaussiane (PSF) nel FoV buono e moltiplicando per due. Notiamo che questo sistema non è stato ottimizzato in termini di NA totale, il che significa che c'è spazio per miglioramenti significativi se gli utenti desiderano un potere risolutivo superiore a quello che questo sistema ha raggiunto. Ci sono una moltitudine di opzioni di obiettivi compatibili per questo tipo di build SOLS, molte delle quali contribuirebbero a una maggiore risoluzione del sistema ma con gli svantaggi di un costo più elevato, un FoV più piccolo o tecniche di allineamento più complicate all'interfaccia del relè 8,11,13,20. Separatamente, se gli utenti desiderano un FoV più ampio, l'incorporazione di un secondo galvo per consentire la scansione 2D raggiungerebbe questo obiettivo, ma richiederebbe l'integrazione di ottiche e meccanismi di controllo aggiuntivi nel progetto32. Abbiamo fornito maggiori dettagli sulle modifiche al sistema sulla pagina del nostro sito Web, insieme a collegamenti ad altre risorse utili relative al processo di progettazione23.
Oltre a migliorare i componenti specifici per questo particolare progetto, sarebbe molto fattibile aggiungere altre tecniche o modalità di microscopia ad alta risoluzione a questa build. Uno di questi miglioramenti sarebbe quello di incorporare l'illuminazione a più lunghezze d'onda, che comporterebbe l'allineamento di laser di eccitazione aggiuntivi al percorso di eccitazione originale8. Inoltre, poiché questo tipo di design SOLS lascia il campione accessibile, l'aggiunta di ulteriori funzioni al microscopio, tra cui, ma limitatamente, pinzette ottiche, microfluidica e reometria, è relativamente semplice 2,33.
Rispetto alla miriade di guide light-sheet che sono state pubblicate, questo protocollo fornisce istruzioni a un livello di comprensione che un utente senza una significativa esperienza ottica può trovare utile. Rendendo accessibile a un pubblico più ampio una build SOLS di facile utilizzo con le tradizionali capacità di montaggio dei vetrini campione, speriamo di consentire un'ulteriore espansione delle applicazioni della ricerca basata su SOLS in tutti i campi in cui lo strumento è stato o potrebbe essere utilizzato. Anche con le applicazioni degli strumenti SOLS in rapida crescita nel numero 2,34,35, crediamo che molti vantaggi e utilizzi degli strumenti di tipo SOLS rimangano ancora inesplorati ed esprimiamo entusiasmo per le possibilità di questo tipo di strumento in futuro.
Divulgazioni
Gli autori non hanno nulla da rivelare. Tutte le ricerche sono state condotte in assenza di relazioni commerciali o finanziarie che potessero essere interpretate come un conflitto di interessi.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Science Foundation (NSF) RUI Award (DMR-2203791) a J.S. Siamo grati per la guida fornita dal Dr. Bin Yang e dal Dr. Manish Kumar durante il processo di allineamento. Ringraziamo la Dott.ssa Jenny Ross e la K. Alice Lindsay per le istruzioni di preparazione dei motori della chinesina.
Materiali
| Name | Company | Catalog Number | Comments |
| 1" Plano-Concave Lens f = -50 mm | Thorlabs | LC1715-A-ML | For alignment laser Estimated Cost: $49.5 |
| 1" Achromatic Doublet f = 100 mm (x3) | Thorlabs | AC254-100-A-ML | L2, L4 and alignment laser Estimated Cost: $342.42 |
| 1" Achromatic Doublet f = 125 mm | Thorlabs | AC254-125-A-ML | SL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | L3 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | TL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 45 mm | Thorlabs | AC254-045-A-ML | L1 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 75 mm | Thorlabs | AC254-075-A-ML | SL1 Estimated Cost: $114.14 |
| 1" Cylindrical Lens f = 100 mm | Thorlabs | LJ1567RM | CL3 Estimated Cost: $117.62 |
| 1" Cylindrical Lens f = 200 mm | Thorlabs | LJ1653RM | CL2 Estimated Cost: $111.22 |
| 1" Cylindrical Lens f = 50 mm | Thorlabs | LJ1695RM | CL1 Estimated Cost: $117.62 |
| 1" Mounted Pinhole, 30 µm Pinhole Diameter | Thorlabs | P30K | Estimated Cost: $77.08 |
| 1" Silver Mirror (x3) | Thorlabs | PF10-03-P01 | M1, M2, one for alignment Estimated Cost: $168.78 |
| 2" Elliptical Mirror | Thorlabs | PFE20-P01 | M3 Estimated Cost: $179.98 |
| 2" Post Holder (x11) | Thorlabs | PH2 | For custom laser mount, ND wheel, safety screens Estimated Cost: $98.45 |
| 2" Posts (x47) | Thorlabs | TR2 | For custom laser mount and optical components Estimated Cost: $277.3 |
| 3" Posts (x4) | Thorlabs | TR3 | For M3 supports and other mounts Estimated Cost: $24.6 |
| 3" Post Holder (x4) | Thorlabs | PH3 | Estimated Cost: $38.48 |
| 30 to 60 mm Cage Adapter | Thorlabs | LCP33 | To mount O1 Estimated Cost: $45.42 |
| 30mm Cage Filter Wheel | Thorlabs | CFW6 | To mount ND filters Estimated Cost: $172.36 |
| 30mm Cage Plate (x6) | Thorlabs | CP33 | To build alignment cage and alignment laser Estimated Cost: $114.54 |
| 30mm Right-Angle Kinematic Mirror Mount (x3) | Thorlabs | KCB1 | To mount M1 and M2 and for alignment laser Estimated Cost: $463.95 |
| 4" Post Holder (x30) | Thorlabs | PH4 | Estimated Cost: $320.1 |
| 561 nm Laser and Power Supply | Opto Engine LLC | MGL-FN-561-100mW | Excitation laser Estimated Cost: $6000 |
| 60mm Cage Plate (x2) | Thorlabs | LCP01 | To mount TL1 and M3 mount Estimated Cost: $88.52 |
| 60mm Right-Angle Kinematic Mirror Mount | Thorlabs | KCB2 | To mount M3 Estimated Cost: $187.26 |
| 90° Flip Mount | Thorlabs | TRF90 | For alignment laser Estimated Cost: $95.5 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | Thorlabs | SM1A9 | To connect lens tube to camera Estimated Cost: $20.96 |
| Adapter with External SM1 Threads and Internal C-Mount Threads | Thorlabs | SM1A10 | To connect tube lens to lens mount Estimated Cost: $21.82 |
| Adapter with External SM1 Threads and Internal M25 Threads (x2) | Thorlabs | SM1A12 | To mount O1 and O2 Estimated Cost: $47.06 |
| Adapter with External SM1 Threads and Internal M26 Threads | Thorlabs | SM1A27 | To mount O3 Estimated Cost: $22.38 |
| Alignment Disk | Thorlabs | SM1A7 | Estimated Cost: $20.45 |
| Alignment Laser | BISKEE | https://www.amazon.com/Tactical-Presentation-Teaching-Interactive-Adjustable/dp/B09B1VXPNM Estimated Cost: $16.98 | |
| Autoluorescent Plastic Slide, Red | Chroma | 92001 | Estimated Cost: $20 |
| Beam Shutter | Thorlabs | SM1SH1 | To block laser light Estimated Cost: $65.8 |
| Cage Rotation Mount (x3) | Thorlabs | CRM1T | To mount CL1-3 Estimated Cost: $282.15 |
| Cage System Rods 1" (x8) | Thorlabs | ER1 | To mount M3 and O1 Estimated Cost: $44.8 |
| Cage System Rods 3" (x2) | Thorlabs | ER3 | To mount O3 Estimated Cost: $14.28 |
| Cage System Rods 4" (x4) | Thorlabs | ER4 | To mount slit Estimated Cost: $30.76 |
| Cage System Rods 8" (x2) | Thorlabs | ER8 | For tube lens alignment Estimated Cost: $25.3 |
| Cage System Rods 12" (x8) | Thorlabs | ER12 | For alignment cage Estimated Cost: $145.36 |
| Camera | Andor | Zyla 4.2 sCMOS | Estimated Cost: ~$14,000 |
| Clamping Fork (x35) | Thorlabs | CF125 | To clamp down post mounts Estimated Cost: $338.8 |
| Cover Glass, 22 x 22 mm | Corning | 2850-22 | For slide samples Estimated Cost: $265 |
| Dichroic | AVR | DI01-R405/488/561/635-25x36 | To split exciation/emission paths Estimated Cost: $965 |
| Dovetail Translation Stage | Thorlabs | DT12 | To translate pinhole Estimated Cost: $90.55 |
| Emission Filter | Thorlabs | FELHO600 | Estimated Cost: $140.99 |
| Frosted Glass Alignment Disk (x2) | Thorlabs | DG10-1500-H1 | For alignment cage and intermediate plane Estimated Cost: $75.14 |
| Function Generator | Hewlett-Packard | HP 33120A 15 MHz | To control galvo Estimated Cost: $900 |
| Galvanometer - 1D Large Beam Diameter System | Thorlabs | GVS011 | Estimated Cost: $1715.78 |
| Galvanometer Power Supply | Siglent | SPD3303C | Estimated Cost: $300 |
| Gelrite | Research Products International | G35020-100.0 | Gellan gum for 3D bead sample Estimated Cost: $68.25 |
| FIJI Software | Open-source | Download from https://imagej.net/software/fiji/downloads Estimated Cost: Free | |
| Hot Plate/ Stirrer | Corning | 6795-220 | For preparing sample solutions Estimated Cost: $550 |
| K-Cube Brushed Motor Controller | Thorlabs | KDC101 | Drives Z825B Estimated Cost: $757.51 |
| Kinematic Mount | Thorlabs | KM100S | To mount dichroic Estimated Cost: $92.01 |
| Kinesis Software | Thorlabs | Download from https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=10285 Estimated Cost: Free | |
| Laser Light Blocker | Thorlabs | LB1 | For ND filter reflections Estimated Cost: $57.65 |
| Laser Mount | custom made | 3D printed Estimated Cost: N/A | |
| Laser Safety Screen (x2) | Thorlabs | TPS4 | For blocking stray laser light Estimated Cost: $92.02 |
| Laser Scanning Tube Lens | Thorlabs | TTL200MP | TL1 Estimated Cost: $1491 |
| Lens Mount (x10) | Thorlabs | LMR1 | To mount all lens and extra alignment mirror. Estimated Cost: $164.7 |
| Magnetic Ruler | Thorlabs | BHM4 | To check alignment Estimated Cost: $52.74 |
| Micro-Manager Software | Open-source | Download from https://micro-manager.org/Download_Micro-Manager_Latest_Release Estimated Cost: Free | |
| Microscope Slides | Thermo Fisher Scientific | 12550400 | For slide samples Estimated Cost: $123.9 |
| Microscope Stage | ASI | FTP-2000 with custom parts | To fine-translate samples Estimated Cost: ~$16,000 |
| Mini Vortex Mixer | VWR | 10153-688 | For sample preparation Estimated Cost: $152.64 |
| Motorized Actuator | Thorlabs | Z825B | To fine-translate M1 Estimated Cost: $729.07 |
| Mounted Standard Iris (x2) | Thorlabs | ID20 | At least 2 for alignment Estimated Cost: $118.02 |
| ND Filter Set | Thorlabs | NDK01 | To reduce excitation intensity Estimated Cost: $726.73 |
| Objective Lens 1 | Nikon | Plan Apo 60X/ 1.20 WI | O1 Estimated Cost: ~$15,000 |
| Objective Lens 2 | Nikon | TU Plan Fluor 100X/0.90 | O2 Estimated Cost: ~$6,000 |
| Objective Lens 3 | Mitutoyo | Plan Apo HR 50X/0.75 | O3 Estimated Cost: ~$6,800 |
| OPM Deskewing Software | Open-source | For image processing. Download from https://github.com/QI2lab/OPM Estimated Cost: Free | |
| Photodiode Power Sensor | Thorlabs | S121C | For measuring laser intensity Estimated Cost: $379.68 |
| Positive Grid Distortion Target | Thorlabs | R1L3S3P | Brightfield alignment Estimated Cost: $267.87 |
| Power Meter Digital Console | Thorlabs | PM100D | For measuring laser intensity Estimated Cost: $1245.48 |
| Rhodamine 6G | Thermo Scientific | J62315.14 | For fluorescent coated slide sample Estimated Cost: $27.7 |
| Right-Angle Clamp for Posts | Thorlabs | RA90 | For M3 support and flip down mirror Estimated Cost: $32.46 |
| RMS-Threaded Cage Plate (x2) | Thorlabs | CP42 | For alignment laser Estimated Cost: $70.56 |
| Shear Plate 2.5-5.0 mm | Thorlabs | SI050P | Estimated Cost: $182.85 |
| Shear Plate 5.0-10.0 mm | Thorlabs | SI100P | Estimated Cost: $201.47 |
| Shear Plate 10.0-25.4 mm | Thorlabs | SI254P | Estimated Cost: $236.42 |
| Shear Plate Viewing Screen | Thorlabs | SIVS | Estimated Cost: $337.74 |
| Shearing Interferometer with 1-3 mm Plate | Thorlabs | SI035 | For checking collimation Estimated Cost: $465.85 |
| Slip-On Post Collar (x35) | Thorlabs | R2 | To maintain post height Estimated Cost: $208.25 |
| Slit | Thorlabs | VA100 | Estimated Cost: $294.64 |
| Slotted Lens Tube, 3" | Thorlabs | SM1L30C | For alignment laser Estimated Cost: $77.45 |
| Square Mirror, 1 x 1" | https://www.amazon.com/Small-Square-Mirror-Pieces-Mosaic/dp/B07FBNMDC1/ref=asc_df_B07FBNMDC1/?tag=hyprod-20&linkCode=df0&hva did=642191768069&hvpos=&hvne tw=g&hvrand=1336734911900437 4691&hvpone=&hvptwo=&hvqmt= &hvdev=c&hvdvcmdl=&hvlocint=& hvlocphy=9031212&hvtargid=pla-1 943952718742&gclid=Cj0KCQiA6L yfBhC3ARIsAG4gkF_AYBpn5EdGL q3mc-RU-nanT5vM4ac9r3-obbzqJoWKPkIPIJU6e1caAjWmEA Lw_wcB&th=1 Estimated Cost: $14.76 | ||
| Stackable Lens Tube 1/2" (x3) | Thorlabs | SM1L05 | To mount CL1-3 Estimated Cost: $40.86 |
| Stackable Lens Tube 1" | Thorlabs | SM1L10 | To mount O3 Estimated Cost: $15.41 |
| Stackable Lens Tube 2" (x2) | Thorlabs | SM1L20 | For camera path Estimated Cost: $35.7 |
| Studded Pedestal Base Adapter (x37) | Thorlabs | BE1 | To attach post mounts to table Estimated Cost: $400.71 |
| Translating Lens Mount (x3) | Thorlabs | LM1XY | To fine-translate pinhole, O2 and O3 Estimated Cost: $441 |
| Translation Stage with Standard Micrometer (x2) | Thorlabs | PT1/M | TS1-2 Estimated Cost: $647.54 |
| Travel Manual Translation Stage | Thorlabs | CT1A | O3 cage translation mount Estimated Cost: $497.3 |
| Tube Lens | Nikon | MXA20696 | TL3 Estimated Cost: $359 |
| White Mounted LED | Thorlabs | MNWHL4 | Brightfield light source Estimated Cost: $171.28 |
| TOTAL ESTIMATED COST: $84,858.98 | |||
| The authors note that many parts were bought used. Here, we have attempted to reflect the retail price of all items, so the total cost can be greatly reduced by buying particular items used, especially the more expensive ones. | |||
| OPTIONAL COMPONENTS | |||
| Grasshopper3 USB3 | FLIR | GS3-U3-23S6C-C | For diagnostic checks during alignment. Acquisiton camera can be used instead, but requires realignment afterwards. Estimated Cost: $1089 |
Riferimenti
- Girkin, J. M., Carvalho, M. T. The light-sheet microscopy revolution. Journal Optics. 20 (5), 053002 (2018).
- You, R., McGorty, R. Light sheet fluorescence microscopy illuminating soft matter. Frontiers in Physics. 9, 760834 (2021).
- Fuchs, E., Jaffe, J. S., Long, R. A., Azam, F. Thin laser light sheet microscope for microbial oceanography. Optics Express. 10 (2), 145-154 (2002).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Dunsby, C. Optically sectioned imaging by oblique plane microscopy. Optics Express. 16 (25), 20306-20316 (2008).
- Bouchard, M. B., et al. Swept confocally-aligned planar excitation (SCAPE) microscopy for high-speed volumetric imaging of behaving organisms. Nature Photonics. 9 (2), 113-119 (2015).
- Smith, C. W., Botcherby, E. J., Wilson, T. Resolution of oblique-plane images in sectioning microscopy. Optics Express. 19 (3), 2662-2669 (2011).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Wu, Y., et al. Simultaneous multiview capture and fusion improves spatial resolution in wide-field and light-sheet microscopy. Optica. 3 (8), 897-910 (2016).
- Sahasrabudhe, A., Vittal, V., Ghose, A. Peeping in on the cytoskeleton: Light microscopy approaches to actin and microtubule organization. Current Science. 105 (11), 1562-1570 (2013).
- Kumar, M., Kishore, S., Nasenbeny, J., McLean, D. L., Kozorovitskiy, Y. Integrated one- and two-photon scanned oblique plane illumination (SOPi) microscopy for rapid volumetric imaging. Optics Express. 26 (10), 13027-13041 (2018).
- Kim, J., et al. Oblique-plane single-molecule localization microscopy for tissues and small intact animals. Nature Methods. 16 (9), 853-857 (2019).
- Sapoznik, E., et al. A versatile oblique plane microscope for large-scale and high-resolution imaging of subcellular dynamics. eLife. 9, e57681 (2020).
- Bernardello, M., Marsal, M., Gualda, E. J., Loza-Alvarez, P. Light-sheet fluorescence microscopy for the in vivo study of microtubule dynamics in the zebrafish embryo. Biomedical Optics Express. 12 (10), 6237-6254 (2021).
- Shelden, E. A., Colburn, Z. T., Jones, J. C. R. Focusing super resolution on the cytoskeleton. F1000Res. 5, (2016).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), (2019).
- Sheung, J. Y., Garamella, J., Kahl, S. K., Lee, B. Y., McGorty, R. J., Robertson-Anderson, R. M. Motor-driven advection competes with crowding to drive spatiotemporally heterogeneous transport in cytoskeleton composites. Frontiers in Physics. 10, 1055441 (2022).
- Zeiss Lightsheet 7. Light-Sheet Multiview Imaging of Living and Cleared Specimens. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lightsheet-7.html (2023)
- Zeiss Lattice Lightsheet 7. Long-Term Volumetric Imaging of Living Cells. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lattice-lightsheet-7.html (2023)
- Kumar, M., Kishore, S., McLean, D. L., Kozorovitskiy, Y. Crossbill: An open access single objective light-sheet microscopy platform. bioRxiv. , (2021).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: A tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Pitrone, P. G., et al. OpenSPIM: An open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Single Objective Light Sheet Microscope (SOLS) Guide. Sheung Lab Available from: https://sites.google.com/view/sheunglab/microscopy/single-objective-light-microscope-sols (2023)
- Lamb, J. R., Ward, E. N., Kaminski, C. F. Open-source software package for on-the-fly deskewing and live viewing of volumetric lightsheet microscopy data. Biomedical Optics Express. 14 (2), 834-845 (2023).
- . Harvard University. Mitchison Lab Available from: https://mitchison.hms.harvard.edu/home (2023)
- Watkins, S. C., St. Croix, C. M. Light sheet imaging comes of age. Journal of Cell Biology. 217 (5), 1567-1569 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Berezney, J., Goode, B. L., Fraden, S., Dogic, Z. Extensile to contractile transition in active microtubule-actin composites generates layered asters with programmable lifetimes. Proceedings of the National Academy of Sciences of the United States of America. 119 (5), e2115895119 (2022).
- Kim, K., et al. Isomorphic coalescence of aster cores formed in vitro from microtubules and kinesin motors. Physical Biology. 13 (5), 056002 (2016).
- Millett-Sikking, A., et al. . High NA single-objective lightsheet. , (2019).
- Bourgenot, C., Saunter, C. D., Taylor, J. M., Girkin, J. M., Love, G. D. 3D adaptive optics in a light sheet microscope. Optics Express. 20 (12), 13252-13261 (2012).
- Bernardello, M., Gualda, E. J., Loza-Alvarez, P. Modular multimodal platform for classical and high throughput light sheet microscopy. Scientific Reports. 12 (1), 1969 (2022).
- Crombez, S., Leclerc, P., Ray, C., Ducros, N. Computational hyperspectral light-sheet microscopy. Optics Express. 30 (4), 4856-4866 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon