Esame istologico della morfologia mitocondriale in un modello di malattia di Parkinson
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo studio presenta un metodo per analizzare la morfologia dei mitocondri basato sull'immunocolorazione e l'analisi delle immagini nel tessuto cerebrale di topo in situ. Descrive anche come questo consenta di rilevare i cambiamenti nella morfologia mitocondriale indotti dall'aggregazione proteica nei modelli di malattia di Parkinson.
Abstract
I mitocondri svolgono un ruolo centrale nel metabolismo energetico delle cellule e la loro funzione è particolarmente importante per i neuroni a causa della loro elevata richiesta di energia. Pertanto, la disfunzione mitocondriale è un segno distintivo patologico di vari disturbi neurologici, tra cui il morbo di Parkinson. La forma e l'organizzazione della rete mitocondriale sono altamente plastiche, il che consente alla cellula di rispondere a segnali e bisogni ambientali, e anche la struttura dei mitocondri è strettamente legata alla loro salute. Qui, presentiamo un protocollo per studiare la morfologia mitocondriale in situ basato sull'immunocolorazione della proteina mitocondriale VDAC1 e successiva analisi delle immagini. Questo strumento potrebbe essere particolarmente utile per lo studio delle malattie neurodegenerative perché è in grado di rilevare sottili differenze nella conta mitocondriale e nella forma indotte da aggregati di α-sinucleina, una proteina soggetta ad aggregazione fortemente coinvolta nella patologia della malattia di Parkinson. Questo metodo permette di riferire che i neuroni dopaminergici che ospitano lesioni pS129 mostrano una frammentazione mitocondriale (come suggerito dal loro rapporto d'aspetto ridotto, AR) rispetto ai loro neuroni vicini sani in un modello di Parkinson con iniezione intracranica di fibrille preformate.
Introduzione
Il sistema nervoso centrale ha un'intensa richiesta di ATP: i neuroni utilizzano l'ATP per supportare i gradienti ionici, la sintesi dei neurotrasmettitori, la mobilizzazione, il rilascio e il riciclaggio delle vescicole sinaptiche e per consentire la traduzione e la degradazione locale delle proteine. Più del 95% dell'ATP utilizzato dal cervello è prodotto dai mitocondri1. Pertanto, non sorprende che la disfunzione mitocondriale sia particolarmente dannosa per i neuroni. Infatti, le compromissioni della funzione mitocondriale svolgono un ruolo importante in diverse malattie neurologiche, comprese le condizioni neurodegenerative, come il morbo di Parkinson (PD) e il morbo di Alzheimer (AD)2,3.
Diversi geni sono inequivocabilmente legati a proteine codificanti per PD che sono rilevanti per la funzione mitocondriale e l'omeostasi, come Parkin 4,5,6, la chinasi 1 indotta da PTEN (PINK1)7,8 e DJ-19. Un'ulteriore evidenza di un ruolo della disfunzione mitocondriale nella malattia di Parkinson è che i trattamenti con inibitori del Complesso I della catena di trasporto degli elettroni mitocondriali (come il Rotenone e l'MPTP) ricapitolano diversi aspetti della malattia di Parkinson in vitro e in vivo10. Tuttavia, è importante affermare che molti processi patologici possono guidare la perdita neuronale nella malattia di Parkinson, insieme ai deficit mitocondriali: lo stress ossidativo, l'alterata omeostasi del calcio, il fallimento dell'ubiquitina-proteasoma e dei sistemi autofagia-lisosomiale e l'aggregazione proteica sono tra i più studiati (esaminati in 11,12,13 e).
I mitocondri hanno una forma eterogenea: oltre alle singole unità, si trovano comunemente come reti reticolari e tubulari estese. La struttura e la posizione cellulare dei mitocondri sono fondamentali per la loro funzione14; Infatti, le reti mitocondriali sono estremamente dinamiche, subendo frequenti processi di fissione, fusione e mitofagia al fine di soddisfare le esigenze delle cellule e di rispondere a segnali ambientali15,16. Inoltre, la morfologia dei mitocondri è intimamente legata al loro stato di salute. Ad esempio, nell'atrofia ottica umana, le mutazioni genetiche che riducono l'attività mitocondriale portano a mitocondri anormali, sottili e iperfusi17. D'altra parte, una varietà di malattie umane presenta una morfologia mitocondriale aberrante, tra cui la frammentazione mitocondriale o l'eccessiva fusione mitocondriale, che hanno effetti dannosi sulla funzione mitocondriale (esaminata in18). Nel contesto della malattia di Parkinson, noi e altri abbiamo precedentemente dimostrato che la forma mitocondriale anomala è correlata con la disfunzione in risposta agli aggregati di α-sinucleina19. Mentre la morfologia mitocondriale è stata ampiamente studiata in vitro sia nel contesto della malattia di Parkinson che di altre malattie 20,21,22, mancano protocolli per la valutazione della morfologia mitocondriale da sezioni in vivo. Ciò rende lo studio in vivo dei mitocondri nel contesto di malattie come la malattia di Parkinson altamente dipendente da animali transgenici23 o la valutazione di estratti del mesencefalo che non possono fornire la risoluzione cellulare.
Qui, viene presentato un protocollo per studiare la morfologia mitocondriale in situ come indicatore del loro stato funzionale e di salute, basato sull'immunocolorazione della proteina mitocondriale VDAC124 seguita dall'analisi delle immagini in sezioni di tessuto incluse in paraffina. Mostriamo anche i risultati di questo protocollo in modelli di PD in vitro e in vivo : cellule di neuroblastoma che sovraesprimono SNCA (sinucleina alfa) e tessuto cerebrale di topi sottoposti a iniezione intracranica di fibrille preformate di α-sinucleina (PFF). La co-immunocolorazione con un anticorpo contro la α-sinucleina (nelle cellule) o la fosfoSer129- α-sinucleina pS129 (nel cervello di topo) ci ha permesso di identificare le cellule con patologia proteica aggregata (fibrille di α-sinucleina e α-sinucleina sovraespresse, rispettivamente) nei campioni, mentre le cellule negative sono servite come controllo non patologico all'interno degli stessi campioni. Attraverso questa analisi e i dati qui descritti, è stato osservato un rapporto d'aspetto ridotto, indicando la frammentazione dei mitocondri nelle cellule che sovraesprimono SNCA o che presentano lesioni pS129.
Protocollo
Tutte le procedure descritte in questa sezione sono state eseguite secondo il quadro etico fornito dall'Università dei Paesi Baschi Riferimento M20/2022/212, dal Governo dei Paesi Baschi, dal Governo spagnolo e dall'Unione Europea.
1. Analisi della morfologia mitocondriale in cellule SH-SY5Y sovraesprimenti SNCA
NOTA: Qui viene fornita una breve descrizione della generazione del materiale in vitro per lo studio, che servirà come confronto per i risultati ottenuti in situ . Si raccomanda di eseguire questo tipo di analisi prima di avviare un esperimento in vivo per la morfologia mitocondriale, in quanto garantirà che siano in atto tutte le impostazioni di imaging e analisi appropriate.
- Per aumentare l'adesione cellulare e facilitare l'adesione cellulare su piastre a 96 pozzetti con fondo ottico piatto, aggiungere 25 μL/pozzetto di matrice di rivestimento 1:1000 in DMEM F12 mediante pipettaggio (vedere Tabella dei materiali). Incubare le piastre per 1 ora a 37 °C e 5% di CO2 .
- Contare SH-SY5Y utilizzando la camera Neubauer. Rimuovere la matrice di rivestimento mediante pipettaggio e seminare 10.000 cellule/pozzetto sulla piastra rivestita a 96 pozzetti in 50 μL/pozzetto di DMEM F-12 integrato con il 10% di FBS, 2 mM di glutammina e penicillina/streptomicina (vedere la tabella dei materiali).
- Incubare le cellule a 37 °C e 5% di CO2per 24 ore.
- Preparare una miscela di 250 ng di pcDNA3.1 contenente SNCA wild-type umano, 0,250 μL del reagente di trasfezione, 0,250 L di adiuvante di trasfezione e mezzo di trasfezione fino a 50 μL per ciascun pozzetto (vedere Tabella dei materiali). Preparare una soluzione principale considerando il numero totale di pozzetti nell'esperimento.
- Rimuovere il terreno di coltura mediante pipettaggio manuale e aggiungere 50 μL/pozzetto della soluzione preparata nella fase 1.4 mediante pipettaggio. Incubare a 37 °C, 5% CO2.
- h dopo la trasfezione, rimuovere il mezzo di trasfezione mediante pipettaggio e aggiungere 25 μL/pozzetto di paraformaldeide (PFA) al 4% in PBS.
ATTENZIONE: La paraformaldeide è un fissativo tossico; utilizzare DPI adeguati. - Incubare per 5 minuti a temperatura ambiente (R.T). Rimuovere la soluzione di fissaggio mediante pipettaggio e lavare una volta aggiungendo 50 μL/pozzetto di PBS. Rimuovere il PBS mediante pipettaggio.
- Pipettare 25 μL/pozzetto di TBS con siero d'asina normale allo 0,05% (TBS-T) e al 10% di siero d'asina normale (NDS, vedere la tabella dei materiali). Incubare per 1 ora a R.T. per bloccare qualsiasi segnale aspecifico.
- Preparare una soluzione di anticorpo anti-α-sinucleina di coniglio MJFR1 1:1000 insieme all'anticorpo anti-TOMM20 di topo 1:100 in TBS-T (vedi Tabella dei materiali) in base al numero di pozzetti da analizzare.
- Rimuovere la soluzione bloccante dalla fase 1.8 mediante pipettaggio e aggiungere 25 μL/pozzetto della miscela di anticorpi primari preparata nella fase 1.9. Incubare una notte a 4 °C.
- Rimuovere la soluzione anticorpale primaria e lavare tre volte aggiungendo e rimuovendo 50 μL/pozzetto di TBS-T mediante pipettaggio.
- Preparare una soluzione di anticorpo secondario verde anti-Topo 1:1000 insieme all'anticorpo secondario rosso anti-Coniglio 1:1000 in TBS-T (vedi Tabella dei Materiali) in base al numero di pozzetti da analizzare.
- Dopo aver aspirato il PBS dall'ultimo lavaggio descritto al punto 1.11, aggiungere 25 μL/pozzetto della miscela di anticorpi secondari utilizzando una pipetta e incubare la piastra per 1 ora a R.T.
- Rimuovere la soluzione anticorpale secondaria mediante pipettaggio e aggiungere 25 μL/pozzetto di DAPI da 2 g/mL in TBS-T. Incubare la piastra per 5 minuti a R.T.
- Rimuovere la soluzione DAPI utilizzando una pipetta e lavare tre volte aggiungendo e rimuovendo 50 μL/pozzetto di TBS-T con una pipetta.
- Pipettare 80 μL/pozzetto di PBS con sodio azide allo 0,02% e conservare la piastra a 4 °C.
ATTENZIONE: L'azoturo di sodio è tossico; utilizzare DPI adeguati. - Acquisire immagini utilizzando un microscopio a fluorescenza automatizzato ad alto contenuto o un sistema di imaging confocale equivalente dotato di un obiettivo 60x (vedere la tabella dei materiali).
- Eseguire l'analisi del segnale TOMM20 di singole celle utilizzando Fiji seguendo i passaggi 3.15-3.21. Evitare qualsiasi cellula soggetta ad apoptosi, necrosi o mitosi.
NOTA: Per fare ciò, escludiamo dall'analisi le cellule che mostrano quelle caratteristiche morfologiche di apoptosi, necrosi o mitosi che sono visibili al microscopio, come il restringimento cellulare, il blebbing della membrana, il distacco cellulare, la condensazione nucleare, la frammentazione del DNA e la cromatina nucleare condensata organizzata in filamenti spessi allineati su un unico piano.
2. La generazione di PFF e le iniezioni intracraniche di PFF nei topi
NOTA: La generazione del materiale di iniezione e il processo di iniezione intracranica sono presentati qui. Questo protocollo è adattato da Luk et al.25.
- Per ottenere PFF, posizionare una provetta/matraccio contenente 0,5 mL di α-Syn (5 mg/mL; Peptide, vedi Tabella dei Materiali) su un agitatore a 37 °C e 250 giri/min per 7 giorni per indurre l'aggregazione della α-sinucleina.
- Sonicare la α-sinucleina aggregata con un'ampiezza del 20% e un ciclo di 0,25 cicli fino a raggiungere una frammentazione ottimale e osservarla mediante colorazione negativa dei campioni con microscopia elettronica a trasmissione.
- Per preparare topi maschi e femmine di tipo selvatico C57Bl/6 (3 mesi) per le iniezioni di PFF striatale, somministrare Meloxicam/Metacam (5 mg/kg) in soluzione salina per via sottocutanea. Somministrare anche 1 mL di soluzione salina sterile tramite due iniezioni sottocutanee da 0,5 mL per animale. Questi trattamenti prevengono la disidratazione, l'infiammazione e il dolore.
- Indurre l'anestesia con isoflurano al 4% e 0,7 L/min O2 in una camera di induzione. Controllare la profondità dell'anestesia in base alla mancanza di risposta del pedale.
- Radere la parte superiore della testa del topo e inserire delicatamente l'animale nel telaio dell'apparecchio stereotassico su un tappetino termico.
- Mantenere il piano anestetico somministrando l'anestesia per inalazione animale (1%-2% di isoflurano in 0,7 L/min O2 ) attraverso una maschera facciale durante l'intero processo di iniezione.
- Posiziona l'animale sulla cornice stereotassica. Disinfettare l'area operatoria con tre cicli di scrub alternato a base di clorexidina ed etanolo al 70%. Applicare localmente Marcaina/Bupivacaina (circa 100 μL) come infiltrazione sottocutanea dello 0,25%.
- Eseguire un'incisione di 0,5 cm della pelle per esporre il cranio e praticare un foro di 1 mm di diametro nel cranio per esporre la superficie cerebrale, nelle seguenti coordinate da Bregma: - 0,5 mm anteroposteriore, +/- 2,5 mm mediolaterale.
- Iniettare 1,5 L di PFF ottenuti nella fase 2.2 mediante somministrazione stereotassica alle coordinate indicate nella fase 2.8 da Bregma e -2,7 mm dorso-ventrale (dalla parte superiore dell'encefalo) ad una velocità di flusso di 100 nl/min con una siringa Hamilton da 32 G. Estrarre la siringa 5 minuti dopo l'iniezione.
- Suturare (misura: 4-0, 45 cm, vedi Tabella dei materiali) la ferita con tre o cinque punti di sutura secondo necessità, e legare ciascuno di essi con 2 nodi doppi e poi un nodo singolo. Interrompere l'inalazione di anestetico e rimuovere il mouse dal telaio.
- Lasciare che il topo si riprenda in una gabbia di recupero appropriata prima di riportarlo nella sua gabbia di origine.
- Durante la settimana successiva, eseguire controlli postoperatori giornalieri. Il dolore, l'angoscia o il disagio di qualsiasi animale devono essere dosati con Meloxicam/Metacam come indicato al punto 2.3 ogni 24 ore.
- Tre mesi dopo, iniettare 300 μL di pentobarbital di sodio da 200 mg/mL in soluzione salina tramite un'iniezione intraperitoneale. Una volta perso il riflesso del dolore, praticare un'incisione (2-3 cm) sul torace e sollevare le costole per esporre il cuore.
- Perfondere per via transcardiaca con 10 mL di PBS e 35 mL di paraformaldeide al 4% in PBS uno dopo l'altro a 5 mL/min utilizzando una siringa da 50 mL collegata a un ago a farfalla da 23 G.
- Rimuovere il cervello e il suffisso in PFA al 4% per altre 24 ore a 4 °C. Conservare in etanolo al 70% a 4 °C dopo il trattamento con PFA.
- Mettere il cervello in apposite scatole di plastica (vedi Tabella dei materiali) e incubare in etanolo al 95% per 1 ora a R.T. Ripetere il passaggio in etanolo fresco al 95% e incubare di nuovo per 1 ora.
- Trasferire il cervello in etanolo al 100% per 1 ora a R.T. Ripetere il passaggio in etanolo fresco al 100% e incubare di nuovo per 1 ora.
- Trasferire il cervello nello xilene o nel sostituto dello xilene per 1 ora a R.T. Ripetere in soluzione fresca e incubare di nuovo per 1 ora.
- Rimuovere lo xilene o il sostituto dello xilene e incubare il campione in paraffina calda per 1 ora. Sostituisci la paraffina e incuba per un'altra ora.
- Montare il cervello sulle scatole di inclusione con paraffina calda e lasciarlo asciugare per una notte. Preparare sezioni da 5 μm utilizzando un microtomo (vedi Tabella dei materiali) e montarle su vetrini.
3. Analisi della morfologia mitocondriale mediante immunoistochimica su fette di cervello incluse in paraffina da topi iniettati con PFF
- Decerare i vetrini immergendoli dieci volte nel sostituto dello xilene. Incubare i vetrini per 2 minuti in sostituto dello xilene. Immergere di nuovo dieci volte nel sostituto dello xilene.
NOTA: Questo passaggio è necessario per rimuovere la paraffina e consentire la reidratazione dei campioni. - Reidratazione: ripetere la procedura descritta al punto 3.1 con le seguenti soluzioni: 100% EtOH, 95% EtOH, 70% EtOH e due volte con ddH2O nell'ordine.
- Eseguire il recupero dell'antigene e l'immunocolorazione seguendo i passaggi seguenti.
- Iniziare trasferendo i campioni in un contenitore per microonde con ddH2O.
- Riscaldare 100 tamponi citrati pH 6 (vedi Tabella dei materiali) conservati a 4 °C (i detergenti potrebbero essere precipitati) e preparare 350 ml di tampone citrato 1x fresco. Quindi versare il tampone citrato in un comodo contenitore di plastica con coperchio.
- Mettere i vetrini nel contenitore del tampone citrato (CRITICO: verificare che i vetrini siano al di sotto del livello del tampone) e mettere il coperchio.
ATTENZIONE: Assicurarsi che il coperchio NON sia completamente chiuso, altrimenti il contenitore potrebbe scoppiare nel microonde. - Microonde a 700 W: 4 min + 5 min di riposo, 1,5 min + 5 min di riposo. Rabboccare il tampone citrato e cuocere nuovamente a microonde 1,5 min + 5 min di riposo, 1,5 min + 5 min di riposo, 1,5 min + 5 min di riposo.
- Raffreddare i campioni in tampone citrato su ghiaccio per 20 minuti. Lavare il campione con ddH2O.
NOTA: Il recupero dell'antigene può variare in base alle specifiche esigenze anticorpali.
- Asciugare i vetrini del campione con un tovagliolo di carta senza toccare il fazzoletto. Disegna dei rettangoli con un pennarello (vedi Tabella dei materiali) attorno ai pezzi di tessuto.
- Trasferire tutti i vetrini in una scatola per la colorazione immunitaria dei vetrini e lavare un paio di volte delicatamente con TBS + 0,05 % TWEEN (TBS-T). Controlla che le gocce TBS-T rimangano all'interno dei rettangoli della penna.
- Rimuovere TBS-T dai campioni picchiettando su un tovagliolo di carta. Aggiungere 50 μL di una soluzione bloccante (10% NDS in TBS-T) in ciascun rettangolo (senza toccare il tessuto) e incubare per 1 ora a RT.
NOTA: I volumi possono variare in base alle dimensioni del tessuto; Cercare di assicurarsi che: (1) l'area di Pap-Penned sia simile tra i campioni e (2) l'area sia completamente coperta dal volume tampone scelto. - Rimuovere la soluzione bloccante dai campioni picchiettando un tovagliolo di carta. Pipettare delicatamente 50 μL/rettangolo della seguente miscela di anticorpi primari in TBS-T: anti-tirosina idrossilasi 1:250 insieme a anti-VDAC1 1:100 e anti-pSer129 α-sinucleina EP1536Y 1:2000 (vedere Tabella dei materiali).
- Incubare una notte a 4 °C.
- Lavare pipettando TBS-T sui vetrini e rimuoverlo picchiettando su carta assorbente. Ripeti tre volte.
- Aggiungere pipettando 50 μL/rettangolo di miscela di anticorpi secondari: anti-pollo secondario verde, anti-topo secondario rosso e anti-coniglio secondario rosso lontano 1:1000 in TBS-T (vedere Tabella dei materiali). Incubare a 37 °C per 1 h al buio.
- Lavare tre volte con TBS-T come descritto al punto 3.13.
- Incubare con DAPI 2 μg/mL in TBS-T per 1 min. Rimuovere la soluzione DAPI picchiettando sul tovagliolo di carta. Lavare tre volte con TBS-T come descritto al punto 3.13.
- Montare un vetrino coprioggetti sui campioni utilizzando 2 gocce/vetrino di reagente di montaggio (vedere Tabella dei materiali). Premere delicatamente il vetrino coprioggetto per eliminare le bolle e lasciare asciugare i campioni per 1 ora a R.T. Successivamente, conservare a 4 °C al buio.
- Immagini di almeno 50 cellule in diversi campi utilizzando un sistema di imaging a fluorescenza a illuminazione strutturata dotato di obiettivo a olio 60x o tecnologia confocale.
- Eseguire l'analisi del segnale VDAC1 di singole celle utilizzando Fiji come indicato nei passaggi seguenti.
- Innanzitutto, selezionare e isolare la regione di interesse (ROI) disegnando un contorno attorno alla cella positiva o negativa (a seconda dei casi) e utilizzando la funzione "Ritaglia". Al fine di evitare distorsioni nella selezione del ROI, sceglierlo considerando il segnale di fluorescenza di un marcatore non correlato all'analisi (cioè non un marcatore mitocondriale).
- Opzionale: se l'immagine è eccessivamente pixelata, utilizzare la funzione "smussata" per ottenere una maggiore definizione dei bordi.
NOTA: Se la funzione di arrotondamento viene applicata a un'immagine, applicarla a tutte le immagini successive. - Opzionale: utilizzare la funzione "Convolve" (modalità Kernel, in Process > Filters) per ridurre lo sfondo.
NOTA: Questo è facoltativo e di solito non è necessario quando si utilizzano sezioni da 5 m a causa della natura più sottile delle sezioni. - Attivare i descrittori di forma e limitare le opzioni di soglia nella funzione "Imposta misurazione" (assicurarsi che siano attivati durante l'analisi).
- Nel menu "Regolazione", selezionare la funzione di soglia e regolare il livello di soglia. Le impostazioni di soglia devono essere mantenute per tutte le cellule dello stesso campione.
- Cerca di garantire un'adeguata visualizzazione della rete mitocondriale, come mostrato nelle immagini rappresentative di questo articolo, scartando i pixel di sfondo.
- Utilizzare lo strumento Analizza particelle nella scheda Analizza. Imposta una dimensione appropriata per catturare i mitocondri. In questo esempio, per visualizzare il risultato sono stati utilizzati i comandi size: 25-Infinity, activate: Pixel units e select: Show: Masks . Fiji calcolerà e visualizzerà i conteggi, le proporzioni (AR) e altri parametri di forma in un nuovo pannello.
- Eseguire un'analisi statistica dei dati, se del caso. In questo esperimento, il t-test è stato utilizzato per analizzare la differenza tra l'Aspect Ratio (AR) e i conteggi medi calcolati dalle Fiji tra i gruppi sperimentali dopo il test di normalità con i test di normalità di D'Agostino e Pearson.
Risultati Rappresentativi
Al fine di garantire che siano in atto le condizioni appropriate per l'imaging e l'analisi per la valutazione in situ della morfologia mitocondriale nei tessuti, si raccomanda un'esplorazione in vitro della morfologia mitocondriale in risposta a un modulatore noto della morfologia mitocondriale (Sezione 1). Ad esempio, SNCA è stato geneticamente sovraespresso nelle cellule SH-SY5Y per indurre cambiamenti nella morfologia mitocondriale come descrittoin precedenza 26. Altri insulti che potrebbero essere usati come controllo per peggiorare la morfologia mitocondriale sarebbero la fame o l'uso di inibitori dell'attività mitocondriale come MPP+. Le cellule sono state trasfettate e colorate per la α-sinucleina (AS) per separare le cellule SNCA+ (AS+) e SNCA- (AS-). Sono stati anche colorati con TOMM2027 per visualizzare la rete mitocondriale di cellule. Per rendere questa analisi il più simile possibile a quella di una sezione di tessuto di 5 μm, è stato analizzato un piano confocale invece di una proiezione massima di più piani. L'analisi morfologica di un piano confocale di TOMM20 ha rivelato che sia il numero totale di mitocondri che il loro rapporto d'aspetto o AR (che è correlato all'allungamento dell'organello) sono stati ridotti in risposta alla sovraespressione di SNCA (Figura 1).
L'immunocolorazione è stata eseguita per la proteina mitocondriale VDAC1 in sezioni cerebrali di topo incluse in paraffina da 5 μm di animali iniettati con PFF, come descritto nella sezione del protocollo sopra. I neuroni dopaminergici della substantia nigra pars compacta (SNc), che subiscono una degenerazione nella malattia di Parkinson, sono stati rivelati attraverso la co-immunocolorazione con l'anti-tirosina idrossilasi (TH) e sono stati separati a livello regionale dall'area tegmentale ventrale e dalla substantia nigra pars lateralis. D'altra parte, la colorazione anti-fosfoSer129-α-sinucleina (pS129) ci ha permesso di discriminare le cellule che ospitavano lesioni pS129 dalle cellule sane (pS129+ rispetto a pS129-). Sono state acquisite immagini SNc di tre diversi animali e la successiva analisi delle immagini della colorazione VDAC1 dei neuroni TH-positivi ha rivelato una riduzione sia del numero mitocondriale che del rapporto d'aspetto tra i neuroni portatori di lesioni pS129 e i neuroni privi di queste (Figura 2). Questi risultati indicano che la morfologia mitocondriale dei neuroni che ospitano lesioni pS129 è compromessa rispetto a quella delle cellule prive di lesioni pS129.
Mentre questo particolare esperimento mostra una riduzione dell'AR, evidenziando così una riduzione dell'allungamento dei mitocondri insieme a una riduzione della conta globale, che indica un peggioramento della morfologia mitocondriale, l'interpretazione dei dati dovrebbe dipendere dall'esperimento. Ad esempio, una riduzione dell'AR e della conta può indicare una riduzione globale del contenuto mitocondriale e della frammentazione, mentre una riduzione dell'AR ma un aumento della conta globale indicherebbe un fenotipo di frammentazione mitocondriale. Pertanto, è importante interpretare i dati nel contesto di entrambe le misure.
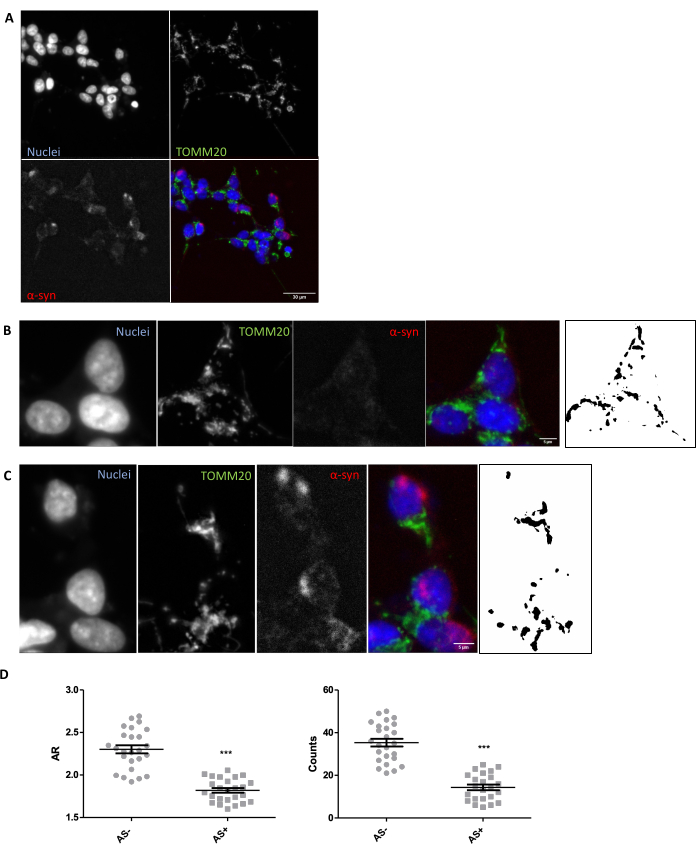
Figura 1: Morfologia mitocondriale in un modello in vitro con sovraespressione di SNCA. Co-immunocolorazione per TOMM20 (verde), α-sinucleina (AS, rosso) e DAPI (blu) su cellule sovraesprimenti e non sovraesprimenti SNCA (AS+ e AS-, rispettivamente) (A). Dettaglio di una cella AS- (B) e di una cella AS+ (C). Le immagini in bianco e nero nei pannelli (B) e (C) rappresentano le maschere del segnale TOMM20 dopo l'applicazione della funzione Fiji descritta nella sezione Protocollo. Questa maschera consente di quantificare la forma delle strutture risultanti. La conta mitocondriale e i valori di Aspect Ratio (AR) delle cellule AS- e AS+ (N = 25 cellule per condizione) sono stati quantificati e rappresentati come valori individuali e ± SEM medi; **Valore p < 0,05 t-test (D). La normalità è stata valutata attraverso i test di normalità di D'Agostino e Pearson. Barre graduate: A, 30 μm; B,C, 5 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
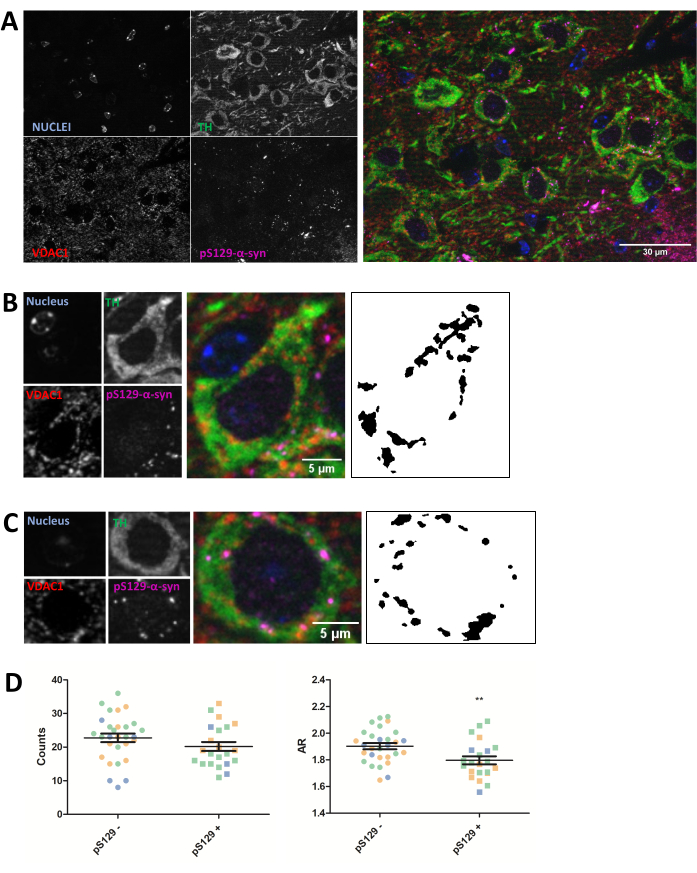
Figura 2: La morfologia mitocondriale è influenzata dai neuroni che ospitano lesioni pS129. Co-immunocolorazione per TH (verde), VDAC1 (rosso), fosfoS129-α-sinucleina (magenta) e DAPI (blu) del SNc di topi iniettati con PFF (A). Il dettaglio di un neurone dopaminergico fosfoS129-α-sinucleina-negativo (pS129-) e di un neurone dopaminergico (C) fosfoS129-α-sinucleina-positivo (pS129+). Le immagini in bianco e nero nei pannelli (B) e (C) rappresentano le maschere del segnale TOMM20 dopo l'applicazione della funzione Fiji descritta nella sezione Protocollo. Questa maschera consente di quantificare la forma delle strutture risultanti. Le cellule negative e positive sono state contate in campioni di tre diversi animali, come illustrato dai diversi colori dei singoli valori grafici (blu, verde e arancione). La conta mitocondriale e la quantificazione AR di pS129- (N = 29) rispetto a pS129+ (N = 22) nei neuroni dopaminergici sono stati rappresentati come valori medi ± SEM e delle singole cellule; **Valore p < 0,05 t-test (D). La normalità è stata valutata attraverso i test di normalità di D'Agostino e Pearson. Barre graduate: A, 30 μm; B,C, 5 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Nel complesso, questo studio dimostra che l'immunocolorazione combinata con l'analisi delle immagini è un metodo affidabile per analizzare la morfologia mitocondriale. Permette infatti di quantificare il numero di mitocondri e alcuni parametri morfologici come l'aspect ratio sia in coltura cellulare che in tessuto. Il numero di mitocondri è direttamente collegato allo stato funzionale dei meccanismi di fissione e fusione dei campioni, mentre il valore AR si basa sull'allungamento dell'organello. Questo metodo può essere particolarmente utile per la valutazione rapida delle anomalie mitocondriali in modelli di PD in cui l'alterazione della morfologia, della dinamica e delle funzioni mitocondriali sono meccanismi patologici ben noti28,29. Anche la α-sinucleina svolge un ruolo rilevante nella malattia di Parkinson: la α-sinucleina è infatti uno dei componenti dei Corpi di Lewy, gli aggregati fibrillari citoplasmatici che vengono utilizzati per la diagnosi post-mortem dei pazienti affetti da malattia di Parkinson30. Inoltre, mutazioni nel gene SNCA sono state trovate in pazienti con PD sia familiare che sporadica (esaminata in31). È stato ampiamente dimostrato che la fosforilazione della α-sinucleina a Ser129 etichetta la patologia simile al corpo di Lewy, che emerge dopo l'insulto PFF e suscita vari effetti tossici32,26.
Utilizzando lo strumento qui presentato, siamo stati in grado di rilevare una riduzione del numero mitocondriale e dei valori di AR in presenza di α-sinucleina sia sovraespressa che aggregata (cellule con colorazione α-sinucleina e neuroni portatori rispettivamente di lesioni positive alla fosfoSer129α-sinucleina) rispetto alle cellule prive di tali lesioni (cellule negative alla α-sinucleina e fosfoS129α-sinucleina). Questi risultati concordano con i precedenti rapporti che mostrano come le interazioni dirette α-sinucleina-mitocondri producano effetti tossici sulla funzione mitocondriale e sull'omeostasi nel PD26,33, 34. In effetti, è stato riportato che i topi con mutazioni di α-sinucleina mostrano un aumento del danno al DNA mitocondriale35 e alla mitofagia 36,37. Inoltre, è stato descritto che l'aumento dei livelli di α-sinucleina promuove la fissione/frammentazione mitocondriale, induce specie reattive dell'ossigeno all'interno dei mitocondri e disregola l'espressione proteica mitocondriale in linee cellulari e modelli murini che sovraesprimono α-sinucleina 26,38,39.
È importante sottolineare che questo strumento dipende molto dagli anticorpi utilizzati per lo studio; Un'attenta valutazione morfologica del colorante anticorpale utilizzato è indispensabile per individuare il compartimento subcellulare appropriato. Poiché questa tecnica si basa su sezioni di 5 μm e quindi richiede singoli piani focali per l'analisi delle strutture mitocondriali, l'assenza di un fenotipo non escluderà l'esistenza di un fenotipo, in quanto è possibile che sottili differenze nella morfologia mitocondriale non possano essere rilevate con questo metodo.
Mentre questo lavoro e altri hanno precedentemente utilizzato approcci simili per valutare la morfologia mitocondriale in vivo40, è necessario rendere accessibile alla comunità di ricerca un protocollo dettagliato per questa valutazione. L'importanza di questo studio è che è possibile applicare questo metodo a vari modelli di malattia in vivo per valutare le anomalie morfologiche mitocondriali e identificare potenziali patologie, che possono eventualmente facilitare lo screening dei composti guida per il trattamento di tali disturbi. Sebbene questa analisi sia attualmente limitata al tessuto incluso in paraffina, il vantaggio del metodo è che può essere applicato a qualsiasi modello di malattia dopo la raccolta di tessuto terminale, rendendolo uno strumento molto versatile.
Divulgazioni
Desideriamo segnalare l'assenza di conflitti di interesse.
Riconoscimenti
Desideriamo ringraziare i finanziatori di questo studio, in particolare Ikerbasque, il Ministero spagnolo per la Scienza e l'Innovazione, la Michael J Fox Foundation, l'IBRO e l'Achucarro Basque Center for Neuroscience.
Materiali
| Name | Company | Catalog Number | Comments |
| 32 G Hamilton syringe | Hamilton | 7632-01 | |
| 4',6-diamidino-2-fenilindol, dihidrocloruro (DAPI) | Invitrogen | D1306 | |
| 4/0 USP 45 cm suture | SSa90 pga | 32345n-36u | |
| Alexa fluor 488/594-Donkey anti-Mouse | Invitrogen | A21202; A21203 | green/red dye-Donkey anti-Mouse |
| Alexa fluor 594/647-Donkey anti-Rabbit | Invitrogen | A21207 A31573 | red/far red dye-Donkey anti-Rabbit |
| AlexaFluor 488-Donkey anti-Chicken | Jackson ImmunoResearch | 703-545-155 | green dye-Donkey anti-Chicken |
| Anti-PSer129 α-synuclein EP1536Y (Rabbit) antibody | Abcam | ab51253 | |
| Anti-TOM 20 (Mouse) antibody | Santa Cruz | sc-17764 | |
| Anti-Tyrosine Hydroxylase (Chicken) antibody | Abcam | ab76442 | |
| Anti-VDAC1 (Mouse) antibody | Santa Cruz | sc-390996 | |
| Anti-α-synuclein antibody MJFR1 (Rabbit) | Abcam | ab138501 | |
| Citrate buffer 100X stock: 120mM citrate buffer, 5% Tween in water (pH 6) | Home-made | ||
| Disposable base mold for tissue embedding | Fisher | 22-363-553 | Plastic embedding boxes |
| D-MEM F12 | Gibco | A321331020 | |
| EVOS M7000 Imaging System | ThermoFisher Scientific | High-content automated fluorescence microscope | |
| Fetal Bovine Serum | Gibco | 10270106 | |
| Flat optical bottom 96 well plates | Greiner | 675090 | |
| FluorSave Reagent | Millipore | 345789-20ML | Mounting reagent |
| Glutamine 200 mM | Gibco | 25030-024 | |
| ImmEdge Hydrophobic Barrier Pen | Vector Laboratories | H-4000 | PAP-pen |
| Lipofectamine and Plus Reagent | Invitrogen | 11668-019; 11514-015 | Transfection reagent and transfection adjuvant |
| Matrigel | Corning | 354230 | Coating matrix |
| Microtome | ThermoFisher Scientific | ||
| Normal Donkey Serum | Gibco | PCN5000 | |
| Opti-MEM | Gibco | 31985070 | Transfection medium |
| PCDNA4 plasmid (backbone) | Addgene | 41036 | |
| Penicillin/Streptomycin solution | Gibco | 15140-122 | |
| SH-SY5Y cells/well | ATCC | HTB-11 | |
| Xylene substitute | Labbox | 22L36504 | |
| Zeiss Axio Imager Apotome 2 | Carl Zeiss | Structured illumination fluorescence imaging system | |
| α-synuclein peptide | rpeptide | S-1010-2 |
Riferimenti
- Yang, Y., Lu, B. Mitochondrial morphogenesis, distribution, and parkinson disease. Journal of Neuropathology and Experimental Neurology. 68 (9), 953-963 (2009).
- Schapira, A. H. Mitochondria in the aetiology and pathogenesis of Parkinson's disease. The Lancet Neurology. 7 (1), 97-109 (2008).
- Swerdlow, R. H. Mitochondria and mitochondrial cascades in alzheimer's disease. Journal of Alzheimer's Disease. 62 (3), 1403-1416 (2018).
- Hedrich, K., et al. type, and origin of Parkin mutations: Review and case studies. Movement Disorders. 19 (10), 1146-1157 (2004).
- Kahle, P. J., Haass, C. How does parkin ligate ubiquitin to Parkinson's disease. EMBO reports. 5 (7), 681-685 (2004).
- Dawson, T. M., Dawson, V. L. The role of parkin in familial and sporadic Parkinson's disease. Movement Disorders. 25, S32-S39 (2010).
- Pickrell, A. M., Youle, R. J. The Roles of PINK1, Parkin, and Mitochondrial Fidelity in Parkinson's Disease. Neuron. 85 (2), 257-273 (2015).
- Zhi, L., et al. Loss of PINK1 causes age-dependent decrease of dopamine release and mitochondrial dysfunction. Neurobiology of Aging. 75, 1-10 (2019).
- Bonifati, V., et al. DJ-1(PARK7), a novel gene for autosomal recessive, early onset parkinsonism. Neurological Sciences. 24 (3), 159-160 (2003).
- Chia, S. J., Tan, E. -. K., Chao, Y. -. X. Historical Perspective: Models of Parkinson's Disease. International Journal of Molecular Sciences. 21 (7), 2464 (2020).
- Wilson, D. M., Cookson, M. R., Den Bosch, L. V. a. n., Zetterberg, H., Holtzman, D. M., Dewachter, I. Hallmarks of neurodegenerative diseases. Cell. 186 (4), 693-714 (2023).
- Moore, D. J., West, A. B., Dawson, V. L., Dawson, T. M. Molecular pathophysiology of Parkinson's disease. Annual Review of Neuroscience. 28 (1), 57-87 (2005).
- Olanow, C. W., Tatton, W. G. Etiology and pathogenesis of Parkinson's disease. Annual Review of Neuroscience. 22 (1), 123-144 (1999).
- Nunnari, J., Suomalainen, A. Mitochondria: In sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Okamoto, K., Shaw, J. M. Mitochondrial Morphology and Dynamics in Yeast and Multicellular Eukaryotes. Annual Review of Genetics. 39 (1), 503-536 (2005).
- Malpartida, A. B., Williamson, M., Narendra, D. P., Wade-Martins, R., Ryan, B. J. Mitochondrial Dysfunction and Mitophagy in Parkinson's Disease: From Mechanism to Therapy. Trends in Biochemical Sciences. 46 (4), 329-343 (2021).
- Zou, W., et al. Nanoscopic quantification of sub-mitochondrial morphology, mitophagy and mitochondrial dynamics in living cells derived from patients with mitochondrial diseases. Journal of Nanobiotechnology. 19 (1), 136 (2021).
- Navaratnarajah, T., Anand, R., Reichert, A. S., Distelmaier, F. The relevance of mitochondrial morphology for human disease. The International Journal of Biochemistry & Cell Biology. 134, 105951 (2021).
- Zambon, F., et al. Cellular α-synuclein pathology is associated with bioenergetic dysfunction in Parkinson's iPSC-derived dopamine neurons. Human Molecular Genetics. 28 (12), 2001-2013 (2019).
- Cherubini, M., Lopez-Molina, L., Gines, S. Mitochondrial fission in Huntington's disease mouse striatum disrupts ER-mitochondria contacts leading to disturbances in Ca2+ efflux and Reactive Oxygen Species (ROS) homeostasis. Neurobiology of Disease. 136, 104741 (2020).
- Parihar, M. S., Parihar, A., Fujita, M., Hashimoto, M., Ghafourifar, P. Alpha-synuclein overexpression and aggregation exacerbates impairment of mitochondrial functions by augmenting oxidative stress in human neuroblastoma cells. The International Journal of Biochemistry & Cell Biology. 41 (10), 2015-2024 (2009).
- Wiemerslage, L., Lee, D. Quantification of mitochondrial morphology in neurites of dopaminergic neurons using multiple parameters. Journal of Neuroscience Methods. 262, 56-65 (2016).
- Liu, Y. -. T., et al. Mt-Keima detects PINK1-PRKN mitophagy in vivo with greater sensitivity than mito-QC. Autophagy. 17 (11), 3753-3762 (2021).
- Shoshan-Barmatz, V., Shteinfer-Kuzmine, A., Verma, A. VDAC1 at the intersection of cell metabolism, apoptosis, and diseases. Biomolecules. 10 (11), 1485 (2020).
- Luk, K. C., et al. Pathological α-Synuclein transmission initiates parkinson-like neurodegeneration in nontransgenic mice. Science. 338 (6109), 949-953 (2012).
- Ryan, B. J., et al. REST protects dopaminergic neurons from mitochondrial and α-synuclein oligomer pathology in an alpha synuclein overexpressing BAC-transgenic mouse model. The Journal of Neuroscience. 41 (16), 3731-3746 (2021).
- Yamamoto, H., et al. Dual role of the receptor Tom20 in specificity and efficiency of protein import into mitochondria. Proceedings of the National Academy of Sciences. 108 (1), 91-96 (2011).
- Exner, N., Lutz, A. K., Haass, C., Winklhofer, K. F. Mitochondrial dysfunction in Parkinson's disease: molecular mechanisms and pathophysiological consequences. The EMBO Journal. 31 (14), 3038-3062 (2012).
- Grünewald, A., Kumar, K. R., Sue, C. M. New insights into the complex role of mitochondria in Parkinson's disease. Progress in Neurobiology. 177, 73-93 (2019).
- Baba, M., et al. Aggregation of alpha-synuclein in Lewy bodies of sporadic Parkinson's disease and dementia with Lewy bodies. The American journal of pathology. 152 (4), 879-884 (1998).
- Vázquez-Vélez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44 (1), 87-108 (2021).
- Mahul-Mellier, A. -. L., et al. The process of Lewy body formation, rather than simply α-synuclein fibrillization, is one of the major drivers of neurodegeneration. Proceedings of the National Academy of Sciences. 117 (9), 4971-4982 (2020).
- Ganguly, U., et al. Interaction of α-synuclein and Parkin in iron toxicity on SH-SY5Y cells: implications in the pathogenesis of Parkinson's disease. Biochemical Journal. 477 (6), 1109-1122 (2020).
- Ganjam, G. K., et al. Mitochondrial damage by α-synuclein causes cell death in human dopaminergic neurons. Cell Death & Disease. 10 (11), 865 (2019).
- Martin, L. J., et al. Parkinson's Disease α-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. The Journal of Neuroscience. 26 (1), 41-50 (2006).
- Choubey, V., et al. Mutant A53T α-Synuclein induces neuronal death by increasing mitochondrial autophagy. Journal of Biological Chemistry. 286 (12), 10814-10824 (2011).
- Chen, L., Xie, Z., Turkson, S., Zhuang, X. A53T Human α-synuclein overexpression in transgenic mice induces pervasive mitochondria macroautophagy defects preceding dopamine neuron degeneration. The Journal of Neuroscience. 35 (3), 890-905 (2015).
- Kamp, F., et al. Inhibition of mitochondrial fusion by α-synuclein is rescued by PINK1, Parkin and DJ-1. The EMBO Journal. 29 (20), 3571-3589 (2010).
- Nakamura, K., et al. Direct membrane association drives mitochondrial fission by the parkinson disease-associated protein α-synuclein. Journal of Biological Chemistry. 286 (23), 20710-20726 (2011).
- Park, J., et al. Abnormal mitochondria in a non-human primate model of MPTP-induced Parkinson's disease: Drp1 and CDK5/p25 signaling. Experimental Neurobiology. 28 (3), 414-424 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon