Attivazione neuronale remota accoppiata con campionamento automatico del sangue per indurre e misurare l'ormone luteinizzante circolante nei topi
In questo articolo
Riepilogo
La pulsatilità dell'ormone luteinizzante (LH) è un segno distintivo della funzione riproduttiva. Descriviamo un protocollo per l'attivazione remota di specifiche popolazioni neuronali legate alla raccolta automatica seriale del sangue. Questa tecnica consente la modulazione ormonale temporizzata, il multiplexing e la riduzione al minimo degli effetti di manipolazione sui livelli di LH in animali coscienti, in movimento libero e indisturbati.
Abstract
I livelli circolanti dell'ormone luteinizzante (LH) sono un indice essenziale del funzionamento del controllo ipotalamo-ipofisario della riproduzione. Il ruolo di numerosi input e popolazioni neuronali nella modulazione del rilascio di LH è ancora sconosciuto. Misurare i cambiamenti nei livelli di LH nei topi è spesso una sfida poiché sono facilmente interrotti dallo stress ambientale. Le attuali tecniche per misurare il rilascio di LH e la pulsatilità richiedono un addestramento a lungo termine per i topi per adattarsi allo stress da manipolazione, a una certa moderazione, alla presenza del ricercatore e al lavoro su singoli animali, riducendone l'utilità per molte domande di ricerca.
Questo documento presenta una tecnica per attivare a distanza specifiche popolazioni neuronali utilizzando la tecnologia Designer Receptor Exclusive Activated by Designer Drugs (DREADDs) abbinata al campionamento sequenziale automatizzato del sangue in topi coscienti, in movimento libero e indisturbati. In primo luogo descriviamo il protocollo di chirurgia stereotassica per veicolare vettori di virus adeno-associati (AAV) che esprimono DREADDs a specifiche popolazioni neuronali. Successivamente, descriviamo il protocollo per l'incannulamento dell'arteria carotide e della vena giugulare e la connessione postchirurgica al sistema automatizzato di prelievo del sangue CULEX. Infine, descriviamo il protocollo per l'iniezione endovenosa di clozapina-N-ossido per l'attivazione neuronale remota e la raccolta automatizzata del sangue. Questa tecnica consente un campionamento automatizzato programmato ogni 5 minuti o più per un determinato periodo, abbinato all'iniezione di sostanze per via endovenosa in un momento o in una durata desiderati. Nel complesso, abbiamo scoperto che questa tecnica è un approccio potente per la ricerca sul controllo neuroendocrino.
Introduzione
L'asse ipotalamo-ipofisi-gonadi (HPG) è regolato centralmente dal rilascio pulsatile dell'ormone di rilascio delle gonadotropine (GnRH) nel sistema portale ipofisario. Nella ghiandola pituitaria, il GnRH controlla il rilascio pulsatile di gonadotropine, ormone luteinizzante (LH) e ormone follicolo-stimolante (FSH) al sistema circolatorio. Il rilascio pulsatile di LH funge da segno distintivo per il funzionamento dell'asse centrale HPG 1,2,3,4. Ad esempio, mostra gli effetti di alterazioni genetiche o cambiamenti in fattori ormonali o ambientali sulla parte neurale dell'asse 5,6,7. Fino a poco tempo fa, la misurazione del pattern pulsatile di LH era limitata ai grandi mammiferi8 e ai ratti9, data l'elevata frequenza di campionamento e i grandi volumi di sangue necessari per identificare gli impulsi.
Il rilevamento degli impulsi di LH nei topi è auspicabile poiché questa specie ha ampi modelli genetici disponibili e può essere facilmente manipolata utilizzando tecnologie di ingegneria genomica per studiare ulteriormente geni specifici e popolazioni cellulari. Nell'ultimo decennio, un grande progresso nell'analisi delle concentrazioni di LH nei topi utilizzando un test di immunoassorbimento enzimatico LH a sandwich (ELISA) ha permesso di rilevare l'LH in una piccola quantità di sangue10. Lo sviluppo della tecnica di prelievo frequente del sangue con punta di coda ha reso possibile il prelievo frequente necessario per rilevare la frequenza e l'ampiezza degli impulsi di LH nei topi10,11. Tuttavia, il prelievo di sangue dalla punta della coda è limitato al suo uso in animali svegli coscienti; Richiede un lungo periodo di addestramento affinché i topi si adattino alla manipolazione e alla presenza di uno sperimentatore designato durante il campionamento. Il suo successo è altamente suscettibile ai fattori di stress ambientale e potrebbe non essere adatto per l'uso in ceppi di topi che mostrano alti livelli di ansia. L'incannulamento intra-atriale è stato utilizzato anche per frequenti prelievi di sangue in topi coscienti che si muovevano liberamente12. Tuttavia, tale configurazione richiede ancora ripetuti prelievi di sangue manuali e limita lo spazio di movimento degli animali, mentre l'incannulamento atriale può portare a cambiamenti dinamici nella funzione cardiaca. È quindi auspicabile stabilire un metodo per la raccolta del sangue in condizioni prive di stress in topi coscienti, in movimento libero e indisturbati, senza la necessità di un addestramento preliminare o di manipolazione o presenza umana.
Il prelievo automatico di sangue o dialisato è stato utilizzato in precedenza per misurare diversi livelli ormonali (ad esempio, melatonina13,14) e la loro secrezione pulsatile (ad esempio, ormone della crescita)15 in roditori non controllati. Presentiamo qui un protocollo per il prelievo automatico di sangue frequente a lungo termine in animali coscienti e non vincolati, accoppiato con una tempestiva attivazione remota di specifiche popolazioni neuronali utilizzando tecnologie chemiogenetiche: i recettori designer attivati esclusivamente dai farmaci di progettazione (DREADDs). Descriveremo la somministrazione stereotassica di un vettore di virus adeno-associato (AAV) e l'attivazione remota da parte di una somministrazione endovenosa automatizzata (IV) di clozapina-N-ossido (CNO)16,17. Questo protocollo consente la rilevazione sequenziale dei livelli basali e dei cambiamenti indotti nella pulsatilità dell'LH in più animali contemporaneamente. Sia il prelievo di sangue che la somministrazione endovenosa del composto vengono condotti in modo controllato nel tempo tramite un programma informatico, eliminando la presenza fisica dello sperimentatore o la necessità di un precedente addestramento sui topi. Questo metodo supera i principali limiti del prelievo manuale di sangue. Consente il prelievo di sangue in una condizione di stress e la somministrazione simultanea di composti per via endovenosa abbinata al controllo remoto dell'attività neuronale. Mostriamo i risultati rappresentativi dell'uso del prelievo automatico del sangue da solo o in combinazione con l'attivazione neuronale remota e discutiamo i suoi vantaggi, limiti e usi aggiuntivi.
Protocollo
Tutte le procedure sugli animali vengono eseguite in accordo con la Guida del Consiglio Nazionale delle Ricerche per la Cura e l'Uso degli Animali da Laboratorio18 e con le leggi federali, statali e locali. Per questa dimostrazione del protocollo sono stati utilizzati topi femmine adulte (3-6 mesi), tra cui quattro femmine C57BL/6J e quattro Kiss1-Cre; ChR2-eYFP (Kiss1-eYFP) femmine. I topi sono stati tenuti sotto un ciclo luce:buio 12:12, a temperatura controllata a 22 °C e alimentati ad libitum con una dieta a basso contenuto di fitoestrogeni. Le procedure e i protocolli sono stati approvati dal Comitato istituzionale per la cura e l'uso degli animali dell'Università del Michigan (IACUC, Animal Protocols: PRO00010420 and PRO00010138).
1. Somministrazione stereotassica di AAV ad una specifica popolazione cellulare
- Preparazione all'intervento chirurgico
- Sterilizzare tutti gli strumenti. Preparare più confezioni di strumenti chirurgici per garantire che ogni confezione sia utilizzata in non più di cinque animali. Preparare guanti sterili, almeno un paio per ogni animale.
- Per micropipette lunghe e sottili, estrarre micropipette in vetro per preparazioni iniettabili utilizzando le seguenti impostazioni (vedere la Tabella dei materiali) che iniettano lentamente e costantemente e non si intasano facilmente: Calore 1: 915, Calore 2: 630, Tiro: 630. Ottimizza queste impostazioni per ogni estrattore.
- Eseguire interventi chirurgici in uno spazio chirurgico designato. Disinfettare le superfici chirurgiche con etanolo al 70%.
- Utilizzare teli sterili per mantenere la sterilità del campo operatorio. Indossare un camice da laboratorio pulito o un camice monouso e una maschera.
- Preparare il sistema di anestesia per inalazione. Aprire l'alimentazione dell'ossigeno e regolare la portata a 0,8 L/min.
- Chirurgia
- Metti il topo in una scatola per anestesia e apri l'isoflurano al 2,5%. Ridurre il flusso di isoflurano al 2% dopo l'induzione iniziale; mantenere il flusso durante tutta la procedura. Per metodi alternativi di anestesia, fare riferimento al protocollo sugli animali e alle linee guida del comitato etico locale.
- Iniettare analgesico preventivo (carprofene 5 mg/kg s.c.) seguendo le raccomandazioni del comitato per l'uso animale e le normative locali.
- Radere la testa del mouse usando le forbici.
- Installare l'animale su un tavolo stereotassico, posizionare le barre auricolari e assicurarsi che la testa sia correttamente fissata e stabile. Fissare la bocca del topo al boccaglio, assicurandosi di posizionare la lingua di lato all'esterno della bocca per evitare il soffocamento.
- Verificare che l'animale sia profondamente anestetizzato con un pizzico di dita dei piedi prima di iniziare l'intervento chirurgico e monitorare il respiro e il colore del topo durante la procedura.
- Posizionare il supporto di elevazione sotto il mouse per mantenere il corpo e la testa livellati in posizione orizzontale. Tieni l'animale al caldo con un tampone caldo ricoperto di carta. Applicare l'unguento per gli occhi su entrambi gli occhi per evitare che si secchino.
- Mantenere l'area chirurgica il più pulita possibile. Indossare guanti sterili. Disinfettare la testa del topo con iodio e alcol prima di aprire la pelle. Con un bisturi, tagliare la pelle della testa lungo la linea mediana, approssimativamente da dietro gli occhi fino a dietro la sutura lambda. Tenere il cranio esposto e pulirlo con un batuffolo di cotone incorporato in NaCl sterile allo 0,9%.
- Trova la vena rostrale del reno (RRV) e segnala con una matita sterile. Utilizzare lo stereoscopio per il resto della procedura.
NOTA: Otteniamo risultati migliori utilizzando l'RRV come riferimento anteroposteriore, ma è standard utilizzare il bregma come riferimento. - Utilizzando un ago sterile come riferimento, assicurarsi che l'orientamento del cervello sia corretto prima di procedere alle misurazioni stereotassiche. Assicurarsi inoltre che le altezze della superficie cranica in corrispondenza di RRV e lambda, nonché l'inclinazione laterale, siano le stesse (± 0,02 mm).
NOTA: L'inclinazione laterale diventa più rilevante per l'iniezione in strutture cerebrali più laterali. - Caricare una pipetta di vetro sterile con la soluzione virale da iniettare. Portarlo al riferimento RRV per il riferimento 0 anteroposteriore (AP). Avanzare lungo la sutura sagittale fino alla coordinata AP scelta. Segna questa posizione con una matita sterile, solleva l'ago e procedi alla craniotomia.
- Praticare con cautela un piccolo cerchio attorno alla posizione contrassegnata per evitare di rompere il seno sagittale superiore. Posizionare il trapano in posizione inclinata anziché perpendicolare per ridurre la pressione durante la perforazione. Rimuovere il pezzo di cranio con una piccola pinza.
- Una volta che la vascolarizzazione è esposta, utilizzare la parte centrale del seno sagittale superiore da utilizzare come riferimento mediolaterale (ML) (punto 0); Questo è più preciso rispetto all'uso della sutura sagittale. Passare alla posizione ML scelta. Abbassare la pipetta in modo che tocchi la dura madre come riferimento dorso-ventrale (DV) (punto 0). Rompere leggermente la dura-madre e far scendere la pipetta fino alla posizione DV scelta.
- Iniettare la quantità desiderata di AAV (50-200 nL) e lasciare la cannula in posizione per 3 minuti per consentire un'adeguata dispersione del liquido. Rimuovere con cautela la pipetta dal cervello.
- Rilasciare il mouse dalle barre auricolari. Chiudere la pelle utilizzando clip chirurgiche o qualsiasi metodo a scelta. Metti l'animale in una gabbia riscaldata separata per il recupero. Monitora il recupero, la reattività e l'attività dopo che il mouse è sveglio. Quando si è completamente ristabilito, riportare il mouse nella sua gabbia originale.
- Attendere un minimo di 3-4 settimane per l'espressione virale prima di procedere con la seconda parte della procedura.
2. Canulazione della vena giugulare e dell'arteria carotide
- Preparazione all'intervento chirurgico
- Eseguire interventi chirurgici in uno spazio chirurgico designato. Disinfettare le superfici chirurgiche con etanolo al 70% prima di iniziare le procedure. Preparare più confezioni di strumenti chirurgici per garantire che ogni confezione sia utilizzata in non più di cinque animali.
- Autoclavare tutti gli strumenti chirurgici. Quindi, pulire con acqua sterile o soluzione fisiologica e disinfettare gli strumenti con uno sterilizzatore a microsfere calde per almeno 15 secondi (secondo le istruzioni del produttore) tra un intervento chirurgico e l'altro.
- Utilizzare teli sterili per mantenere la sterilità del campo operatorio. Indossare un camice da laboratorio pulito o un camice monouso e una maschera.
- Preparare microcateteri per incannulazioni nell'arteria carotide e nella vena giugulare. Costruire il catetere arterioso unendo un piccolo segmento di tubo in microrenathane (allungato da 0,025 pollici di diametro esterno [OD] x 0,012 pollici di diametro interno [ID]) con un tubo silastico (0,025 pollici OD x 0,012 pollici ID). Costruire il catetere venoso solo utilizzando tubi silastici (0,025 pollici OD x 0,012 pollici ID). Immergere tutti i cateteri in etanolo al 70% durante la notte prima dell'intervento chirurgico.
- Smussare le punte tagliate di entrambi i cateteri a 45° a lunghezze prestimate in base al peso corporeo e alla lunghezza dell'animale.
- Procedure chirurgiche
- Anestetizzare gli animali con isoflurano al 2% con un sistema di isoflurano a basso flusso da tavolo per controllare con precisione la fase di anestesia e il piano durante l'intervento chirurgico.
- Iniettare la dose preventiva di analgesico (carprofene 5 mg/kg s.c.) e applicare unguento oftalmico per prevenire l'essiccazione e le lesioni corneali.
- Radere le zone ventrali e posteriori del collo e pulire la pelle con tre scrub allo iodio alternati con etanolo al 70%. Praticare un'incisione cutanea verticale (12 mm) tra le scapole e coprirla con una garza chirurgica per un uso successivo. Posizionare l'animale in posizione supina con la testa rivolta verso il chirurgo.
- Utilizzare un endoscopio da dissezione stereo per la maggior parte delle procedure descritte di seguito.
- Praticare una piccola incisione verticale (~10 mm) sul lato destro del collo, superiore alla clavicola per esporre l'arteria carotide destra e la vena giugulare. Tagliare la pelle con le forbici ed eseguire una dissezione smussata per separare i tessuti sottocutanei utilizzando micro pinze non dentate con punte sottili, esponendo la vena giugulare esterna destra e l'arteria carotide comune destra.
- Legare l'estremità distale della vena giugulare per fermare il flusso sanguigno e praticare un piccolo foro nella vena collassata utilizzando micro pinze e forbici. Inserire lo smusso del catetere venoso verso il basso e prossimalmente utilizzando un paio di micro pinze per farlo avanzare attraverso la vena cava superiore per raggiungere il livello dell'atrio destro. La lunghezza inserita è di ~10-12 mm per un mouse magro da 30 g. Legare il catetere per fissarlo al vaso utilizzando punti di sutura in seta 7-0.
NOTA: Con il catetere nel posto giusto, il sangue può essere facilmente prelevato; In caso contrario, il catetere potrebbe essere posizionato in modo errato nella vena toracica laterale e deve essere reinserito. - Sezionare con cura i tessuti connettivi per esporre l'arteria carotide comune destra situata in un'area triangolare circondata dal muscolo sternoioideo, dal muscolo sternomastoideo e dal muscolo digastrico. Se necessario, utilizzare un divaricatore a filo per separare questi muscoli. Legare l'arteria a livello della biforcazione delle arterie carotidi interne ed esterne utilizzando suture di seta 7-0. Preposizionare due anse di sutura slegate prossimalmente.
- Interrompere temporaneamente il flusso sanguigno tirando un'ansa di sutura preposizionata e praticare un piccolo foro sulla parete del vaso utilizzando microforbici o un ago da 27 G. Inserire il catetere arterioso con smusso verso il basso e prossimalmente a una lunghezza prestimata raggiungendo l'arcata aortica ma senza toccare la valvola aortica. La lunghezza inserita è di ~9-10 mm per un mouse magro da 30 g. Legare il catetere per fissarlo al vaso utilizzando le due suture preposizionate.
- Scavare un tunnel sottocutaneo in tutti i cateteri e esternarli nella parte posteriore del collo tramite l'incisione pretagliata e unirli alle porte venose o arteriose di un connettore per tubi rivestiti in silicone realizzati con un tubo ad ago da 25 G: MASA19 modificato utilizzando due tubi ad ago da 25 G e due tubi da 4,0 cm di PE-20, rivestiti con 2,0 cm di tubo silastico ID da 0,062 pollici attaccato con un piccolo anello in filo metallico. Il volume totale del flusso luminoso di ciascun catetere, compreso il connettore, è di 6-8 μL (Figura 1A).
- Chiudere l'incisione ventrale e fissare il connettore per via sottocutanea sulla chiusura della pelle posteriore con punti di sutura. Riempire entrambi i cateteri con soluzione fisiologica eparinizzata (200 U/mL) e collegarli saldamente all'estremità con fili chirurgici in acciaio inossidabile.
- I topi si riprendono dall'anestesia con isoflurano in pochi minuti e si riprendono completamente dall'intervento chirurgico entro 5 giorni. Posizionare gli animali nella camera di alloggiamento per la raccolta del sangue automatizzata 24 ore dopo l'intervento chirurgico e collegarli al sistema unendo il gancio di ancoraggio del sistema all'anello metallico fissato al connettore del tubo impiantato sulla parte posteriore del collo. Collegare i cateteri arteriosi e venosi rispettivamente alle linee di iniezione e di campionamento 24 ore prima dell'inizio del campionamento (Figura 1B). La lunghezza totale della linea di campionamento è di 55 cm di lunghezza o 40 μL per volume di lumen.
NOTA: Le impostazioni delle linee di iniezione e di campionamento, la programmazione del metodo di raccolta e i meccanismi di bilanciamento della gabbia del sistema automatico di campionamento del sangue sono stati descritti in dettaglio20,21. Il sistema mantiene il catetere aperto erogando automaticamente 10 μL di soluzione fisiologica eparinizzata ogni 20 minuti. - Impostare il tempo e la frequenza di campionamento pre-iniezione, iniezione e post-iniezione tramite il programma informatico del sistema. Vedere il passaggio 3.1 di seguito per le impostazioni correnti.
- Il sistema consente all'animale di muoversi liberamente senza aggrovigliare le linee di campionamento e/o infusione, rilevando il movimento del mouse mentre ruota la camera di alloggiamento in direzione opposta al movimento del mouse21 (Figura 1).
- Riempire la linea di infusione o iniezione con il composto e ricollegarlo al catetere venoso almeno 2 ore prima dell'inizio dell'infusione o dell'iniezione.
NOTA: Potrebbero verificarsi complicazioni chirurgiche e gli animali devono essere monitorati attentamente per il recupero e nei giorni successivi all'intervento. Fare riferimento al protocollo sugli animali per il corretto monitoraggio, i requisiti di terminazione e le procedure.
3. Raccolta di sangue automatizzata e iniezione endovenosa
- Prelievo di sangue automatizzato
- Per seguire questo protocollo, utilizzare un volume di campionamento di 20,0 μL e impostare un intervallo (ad esempio, 7,0 minuti) tra ciascun campionamento per avere una frequenza di campionamento di ogni 10,0 minuti per campione. La velocità massima è quella di campionare in continuo a 3,0 min/campione; il volume di campionamento minimo possibile è di 5,0 μL. Una quantità uguale di soluzione fisiologica viene restituita automaticamente dal sistema per sostituire il sangue prelevato e mantenere l'equilibrio dei liquidi corporei.
- Impostare il tempo totale di campionamento su 30 (t = -30 - 0) min prima e 30 (t = 0 - 30) min dopo l'iniezione endovenosa di CNO (0,5 mg/kg, Figura 2).
- Ogni campione di sangue raccolto (20,0 μL) viene automaticamente diluito in 50 μL di soluzione fisiologica (contenente eparina a 10 U/mL) e conservato singolarmente in una microprovetta conservata in un carosello di campioni refrigerato dal sistema.
- Iniezione endovenosa automatizzata
- Scollegare la linea venosa dal catetere venoso per riempire il CNO (dose calcolata individualmente in volume di ~50-60 μL a 0,5 mg/kg) almeno 2 ore prima dell'inizio del prelievo di sangue.
- Prelevare manualmente la soluzione (leggermente superiore al volume calcolato) dalla linea retrograda con la siringa per iniezione, lasciando una piccola bolla d'aria tra la soluzione e la soluzione fisiologica esistente nella linea.
- Ricollegare la linea di iniezione al catetere venoso e impostare la velocità di iniezione a 500 μL/min e il tempo di inizio dell'iniezione a 2 min al termine del campionamento t = 0. Il tempo totale di iniezione per ogni animale è di 5-6 s.
NOTA: Se necessario, il composto può anche essere somministrato mediante un'iniezione intraperitoneale manuale (IP), ma ciò richiederà di disturbare l'animale durante o prima del protocollo di raccolta del sangue. Mostriamo anche questa alternativa nei risultati.
4. Perfusione animale e raccolta del cervello (OPZIONALE)
NOTA: Questa procedura deve essere seguita solo se il cervello è tenuto ad analizzare il sito cerebrale dell'attivazione neuronale o delle risposte a valle.
- Scollegare il mouse dal sistema di raccolta del sangue al termine del protocollo di raccolta. Due ore dopo l'iniezione endovenosa, procedere alla perfusione dell'animale con formalina tamponata neutra (NBF) al 10%, utilizzando il metodo preferito o come descritto altrove22.
- Sezionare il cervello e conservarlo in saccarosio al 20% in NBF al 10% per 3 ore per continuare la fissazione.
- Dopo 3 ore, trasferire il cervello fissato al 20% di saccarosio in PBS e conservare a 4 °C fino al momento del sezionamento.
NOTA: Evitare l'eccessiva fissazione in quanto ciò maschererà gli antigeni cFOS. Nella soluzione di saccarosio al 20%, il cervello dovrebbe affondare sul fondo del contenitore. - Realizzare sezioni utilizzando un microtomo congelante o un criostato e utilizzare il metodo preferito per esaminare l'attivazione neuronale (ad esempio, viene mostrata l'immunoistochimica cFOS).
NOTA: Gli anticorpi utilizzati per i risultati attuali sono descritti nella Tabella dei materiali.
5. Elaborazione e analisi dei campioni
- Rimuovere i campioni di sangue dal campionatore automatico subito dopo la fine dell'esperimento e metterli sul ghiaccio.
- Centrifugare i campioni a 14.000 × g per 30 s.
- Raccogli il plasma. Conservare a -80 °C fino all'analisi.
- Analizzare i campioni di sangue mediante LH ELISA come descritto prima di 10,23.
Risultati Rappresentativi
I neuroni che esprimono kisspeptina (gene Kiss1) situati nel nucleo arcuato dell'ipotalamo sono un potente stimolatore del GnRH e, quindi, del rilascio di LH dalla ghiandola pituitaria24,25. In questa dimostrazione del protocollo, abbiamo utilizzato la secrezione di LH indotta dalla kisspeptina per illustrare il funzionamento della tecnica di prelievo automatico del sangue. La Figura 2 mostra i pattern rappresentativi di LH nelle femmine adulte di Kiss1-eYFP che hanno precedentemente ricevuto un'iniezione stereotassica unilaterale di AAV-hM3Dq-mCherry nel nucleo arcuato (AP: -4,95, ML: -0,35, DV: -5,7). Il ChR2-eYFP è stato utilizzato come reporter fluorescente per le cellule Kiss1. Un mese dopo l'intervento chirurgico stereotassico, i topi sono stati sottoposti a incannulamento dell'arteria carotide e della vena giugulare e sono stati collegati al campionatore di sangue automatico 4 giorni dopo l'intervento. Le raccolte di sangue per la determinazione dei livelli basali di LH sono state avviate il giorno successivo con una frequenza di campionamento di 10 minuti (intervallo di 7 minuti tra i campioni e 3 minuti per campionamento), seguite da un'iniezione automatizzata di CNO per via endovenosa e da un campionamento di sangue continuato ogni 10 minuti per 30 minuti. I livelli diestrosi di LH sono generalmente bassi (Figura 2A), ma di solito si osservano variazioni a causa del suo rilascio pulsatile (Figura 2B). Dopo l'iniezione di CNO (e l'attivazione dei neuroni della kisspeptina), l'aumento dell'LH è stato netto (entro 10 minuti). Il livello di aumento e la durata del picco dipendono da numerosi fattori, tra cui il sito di iniezione, il numero di neuroni attivati o la popolazione target.
La Figura 3 mostra il sito cerebrale di iniezione nel nucleo arcuato della femmina di topo rappresentata nella Figura 2A. I neuroni Kiss1-eYFP sono marcati in verde, mentre l'immunoreattività di mCherry mostra il sito dell'iniezione e dell'attivazione dell'AAV dopo il CNO. I neuroni attivati sono stati rilevati utilizzando l'immunoreattività cFOS, marcata con DAB. La maggior parte dei neuroni mCherry è colocalizzata con Kiss1-eYFP e molti hanno mostrato immunoreattività cFOS, dimostrando che l'attivazione virale e neuronale era specifica per la popolazione bersaglio.
Nella Figura 4 è mostrato un pattern rappresentativo di rilascio pulsatile di LH in topi diestrosi wildtype (C57BL/6J) seguito dalla risposta a un'iniezione IP di kisspeptina-10. Il topo è stato sottoposto a incannulamento dell'arteria carotide ed è stato collegato al sistema automatico di prelievo del sangue 4 giorni dopo l'intervento. La mattina successiva, i cicli estrali sono stati controllati e la raccolta del sangue e l'iniezione di kisspeptina-10 sono state eseguite il giorno26 del diestro. I campioni di sangue sono stati raccolti ogni 7 minuti per 2 ore (intervallo di 4 minuti, più 3 minuti/campionamento per 120 minuti prima dell'iniezione) per determinare i livelli basali e la pulsatilità dell'LH, seguiti da un'iniezione IP di kisspeptin-10 (65 μg/kg) e da una raccolta di sangue continuata ogni 7 minuti per altri 30 minuti. Sono stati osservati chiari impulsi di LH tipici di una femmina in diestro, che mostrano bassi livelli basali di LH, frequenza degli impulsi di ~2 impulsi/h e ampiezza dell'impulso ~1 ng/mL27. È stato rilevato un aumento immediato e robusto dell'LH in risposta alla somministrazione di kisspeptina28. I modelli di secrezione di LH e i cambiamenti dopo la stimolazione sono in accordo con altri studi che utilizzano la raccolta manuale del sangue 10,27,29,30. Questi risultati dimostrano che il metodo automatizzato di prelievo di sangue cattura la secrezione di LH tipica e stimolata in condizioni prive di stress.
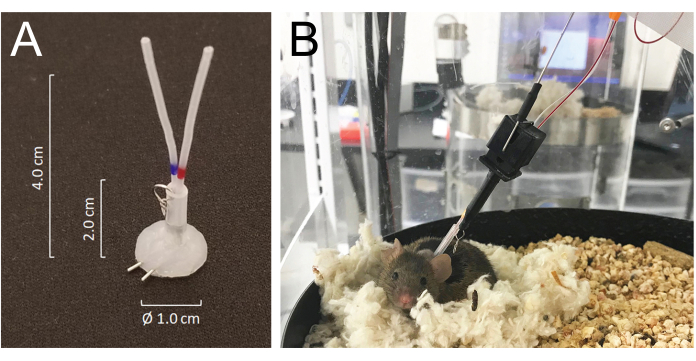
Figura 1: Dettagli del sistema di connettori e dei collegamenti del mouse al tubo del sistema di infusione e campionamento. (A) Un connettore per tubi rivestito in silicone (MASA) costruito utilizzando due tubi ad ago 25G e due tubi in PE-20, rivestiti in un tubo silastico attaccato con un piccolo anello metallico. (B) Un topo collegato al tubo di infusione e campionamento nella gabbia di campionamento, che riposa nel suo nido durante il prelievo di sangue. Fare clic qui per visualizzare una versione più grande di questa figura.
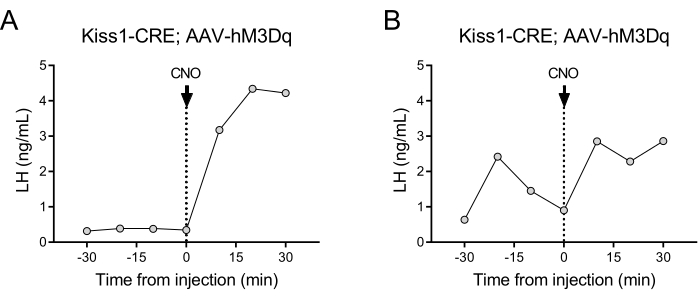
Figura 2: Risultati rappresentativi per gli impulsi di LH in topi femmina Kiss1-Cre iniettati con AAV-hM3Dq nel nucleo arcuato e attivati a distanza con CNO. I livelli basali di LH sono stati misurati ogni 10 minuti per mezz'ora. Al tempo 0 dopo la raccolta di sangue, la femmina ha ricevuto un'iniezione endovenosa di clozapina-N-ossido (0,5 mg/kg) e il sangue ha continuato ad essere raccolto dall'arteria carotide ogni 10 minuti per un'ulteriore mezz'ora. (A) Mostra una femmina con bassi livelli basali di LH. (B) Mostra una femmina che mostra una pre-iniezione di impulsi di LH. Abbreviazioni: Kiss1 = Kisspeptin; AAV = virus adeno-associato; CNO = clozapina-N-ossido; LH = ormone luteinizzante. Fare clic qui per visualizzare una versione più grande di questa figura.
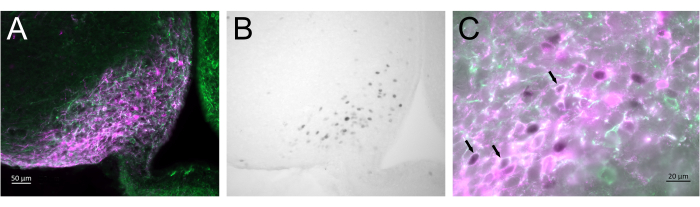
Figura 3: Attivazione cerebrale nel nucleo arcuato del Kiss1-Cre; Chr2-eYFP (Kiss1-eYFP) femmina rappresentata nella Figura 2A. ChR2-eYFP è stato utilizzato solo come gene reporter per marcare i neuroni kiss1. (A) Immagine a fluorescenza a basso ingrandimento che mostra il sito dell'iniezione di AAV nel nucleo arcuato. Verde: immunoreattività eYFP, Magenta: immunoreattività mCherry. (B) Immagine in campo chiaro a basso ingrandimento dell'area corrispondente alla Figura 3A, che mostra l'immunoreattività cFOS (nero) nel sito dell'iniezione di AAV nel nucleo arcuato . (C) Fluorescenza ad alto ingrandimento e immagine in campo chiaro combinate che mostrano uno sguardo più ravvicinato dei neuroni nella Figura 3A,B. I neuroni Kiss1-eYFP che coesprimono AAV-mCherry che sono stati attivati sono quelli con citoplasma bianco e nucleo nero (frecce). Barre di scala = 50 μm (A,B), 20 μm (C). Abbreviazioni: Kiss1 = Kisspeptin; AAV = virus adeno-associato; eYFP = proteina fluorescente gialla potenziata. Fare clic qui per visualizzare una versione più grande di questa figura.
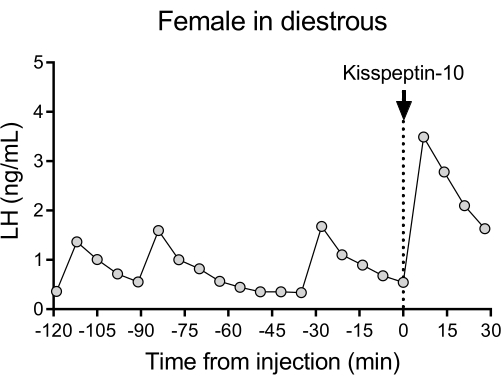
Figura 4: Pulsatilità basale dell'LH in una femmina di wildtype diestrosa misurata ogni 7 minuti per 2 ore. La femmina ha quindi ricevuto un'iniezione intraperitoneale di kisspeptina-10 (65 μg/kg) al tempo 0 e i campioni di sangue sono stati raccolti continuamente ogni 7 minuti per mezz'ora. Abbreviazione: LH = ormone luteinizzante. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Utilizzando questo protocollo, siamo stati in grado di mostrare la pulsatilità basale di LH e la secrezione di LH dopo la stimolazione di una popolazione neuronale. I grandi vantaggi del sistema sono l'ambiente privo di stress in cui avviene il prelievo, senza presenza umana o manipolazione durante il prelievo di sangue. Inoltre, durante l'esperimento non è stato richiesto alcun laborioso addestramento e adattamento all'uomo o alla manipolazione umana. Gli esperimenti precedenti che utilizzavano il prelievo manuale di sangue richiedevano una grande quantità di tempo e sforzi per ridurre al minimo i fattori di stress 7,31,32. Tuttavia, tagliare la coda da solo è un fattore di stress33. Anche l'implementazione di un ambiente non stressante e di un paradigma di addestramento in strutture animali condivise, dove le interruzioni sono imprevedibili, può essere un vincolo. In alcuni laboratori, gli animali devono spesso essere trasportati in sale procedurali alternative per il prelievo di sangue. Queste limitazioni possono rendere il metodo manuale inappropriato per il rilevamento di sottili cambiamenti nei livelli di LH e, pertanto, un approccio hands-off può essere utile in queste situazioni. Il campionamento automatizzato viene effettuato in una stanza silenziosa dove i topi vengono posizionati con diversi giorni di anticipo per acclimatarsi al nuovo ambiente. La nostra precedente esperienza con questo protocollo ha fornito un rilevamento preciso dei modelli di secrezione di corticosterone e ormone della crescita pulsatile nei topi, non mostrando livelli elevati di corticosterone durante il campionamento automatizzato15. Negli esperimenti attuali, tutti gli animali si sono adattati bene al sistema di campionamento, mostrando la costruzione del nido nella camera di campionamento dopo ~24 ore e un colore del pelo brillante, indicando una mancanza di stress e un buono stato di salute generale (Figura 1).
La principale difficoltà che porta a risultati negativi è probabilmente il targeting inappropriato dell'AAV sulla popolazione neuronale richiesta. La precisione nelle iniezioni stereotassiche è essenziale e l'addestramento deve essere fatto in anticipo per verificare le coordinate e i volumi di iniezione. L'allenamento può essere fatto iniettando una piccola quantità di Evans Blue allo 0,5-1% nella posizione desiderata in un intervento chirurgico di non recupero e quindi prelevando una fetta del cervello appena sezionato utilizzando una matrice cerebrale di topo (ad esempio, Ted Pella) per controllare il sito e le dimensioni dell'iniezione utilizzando uno stereoscopio.
È inoltre importante tenere conto del fatto che il sangue e il plasma raccolti dal sistema automatizzato di prelievo del sangue saranno diluiti in soluzione fisiologica eparinizzata (ad esempio, 20 μL di sangue in 50 μL di soluzione fisiologica nei nostri risultati)20 e potrebbe essere necessario regolare il rapporto di diluizione per la sensibilità del metodo analitico selezionato. Sono stati testati i livelli di LH nel sangue intero diluito in BSA-PBS (come raccomandato per l'ELISA LH ultra-sensibile)10 o soluzione salina e non sono state riscontrate differenze nei valori di LH. Tween non può essere utilizzato nel diluente poiché questo circolerà nel sistema sanguigno per estrarre i campioni sostituendo i fluidi del campione20. Nella nostra esperienza, diluizioni inferiori a 1:10 hanno dato buoni risultati di LH ma hanno leggermente sottostimato i livelli di LH rispetto a 1:3,5. Ciò indica che la diluizione può essere ulteriormente regolata per ridurre la quantità di sangue raccolto, se necessario.
Un'alternativa alla somministrazione automatizzata del composto consiste nell'eseguire iniezioni manuali tramite il catetere venoso. In questo caso, lo sperimentatore è brevemente presente nella stanza per somministrare l'iniezione. Tuttavia, non c'è contatto diretto con gli animali o con il loro alloggio e l'ambiente circostante e, a differenza delle iniezioni intraperitoneali o sottocutanee, l'intera procedura è spesso inosservata dall'animale. I vantaggi di un'iniezione manuale sono che la diluizione del composto non deve essere impostata in anticipo, il che può essere fondamentale per i composti che sono troppo costosi da utilizzare in volumi maggiori o sono sensibili alla degradazione nel tempo; poiché il volume operatorio è inferiore rispetto alla somministrazione automatica, in cui la linea di infusione e il catetere devono essere preriempiti con più soluzione composta.
Il prelievo automatico del sangue offre un'opportunità unica per studiare le variazioni di LH durante il sonno, ad esempio. Abbiamo osservato regolarmente animali che dormivano nei loro nidi durante il periodo di campionamento. È possibile collegare questo campionamento con le registrazioni EEG per generare un'analisi più dettagliata della relazione tra l'attività neurale e il pattern LH34. Come mostrato qui, le possibilità di utilizzare il prelievo automatico del sangue sono molteplici: dal campionamento basale dell'LH al test della risposta dell'LH a composti endogeni o esogeni, o all'attivazione o soppressione di popolazioni neuronali. Le manipolazioni neuronali possono essere implementate in modo acuto con la chemiogenetica o l'optogenetica, o in modo permanente utilizzando modelli murini transgenici e strumenti di silenziamento apoptotico o neuronale. Il prelievo automatico del sangue consente anche la misurazione di altri ormoni con pattern secretori altamente pulsatili (ad esempio, l'ormonedella crescita 15). Nei topi femmine, se è necessaria una fase specifica del ciclo estrale, gli strisci vaginali possono essere raccolti con cura ore prima dell'inizio del protocollo26 senza interrompere le linee di infusione e campionamento. Gli animali possono essere collegati al sistema di campionamento per 7-10 giorni con il rischio di coagulazione della linea arteriosa che aumenta con il tempo.
Questa tecnica, tuttavia, è limitata all'uso in animali a stabulazione singola e, pertanto, potrebbe non essere adatta per lo studio delle interazioni sociali. È anche invasivo e richiede un intervento chirurgico tecnicamente impegnativo, quindi potrebbe non essere possibile implementarlo con animali giovani o alcuni modelli di malattia. Infine, poiché il costo per l'acquisto del sistema potrebbe essere troppo elevato per un singolo laboratorio di ricerca, sarebbe consigliabile installarlo in un laboratorio di base che fornisca come servizi il protocollo sperimentale menzionato.
In conclusione, questo protocollo mostra come eseguire la somministrazione stereotassica di AAV combinata con il prelievo di sangue automatizzato. Il preciso controllo spaziale e temporale ottenuto con questa tecnica, insieme alla sua flessibilità di applicazione a diversi modelli, protocolli di misurazione e ormoni, la rende un metodo potente per lo studio della regolazione ormonale nei roditori. Ancora più importante, il metodo fornisce un ambiente privo di stress eliminando la presenza umana e la manipolazione durante l'iniezione e/o il campionamento e il precedente addestramento degli animali. Questi vantaggi, insieme alla possibilità di multiplexing, rendono questo metodo uno strumento unico per studiare il controllo neurale dei cambiamenti ormonali in topi coscienti, che si muovono liberamente e indisturbati.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Ringraziamo il Dr. Daniel Haisenleder per il suo aiuto nel testare diversi metodi di diluizione del sangue. I saggi ormonali sierici sono stati eseguiti presso il Center for Research in Reproduction Ligand Assay and Analysis Core dell'Università della Virginia, supportato dall'Eunice Kennedy Shriver NICHD Grant R24 HD102061. Il Michigan Mouse Metabolic Phenotyping Center-Live è supportato dal NIH Center Grant U2C DK135066. JF e NQ sono supportati da sovvenzioni DK020572 (MDRC) e DK089503 (MNORC). CFE e CSM sono supportati dalla sovvenzione NICHD R21 HD109485 e R01 HD096324.
Materiali
| Name | Company | Catalog Number | Comments |
| AAV8-hSyn-hM3D(Gq)-mCherry | Addgene | 44361 | Not necessarily this virus but this was the one used for representative results |
| Alcohol | Disinfection | ||
| Anesthesia Induction box | Vetequip | ||
| Anesthesia induction machine | Kent Scientific Equipment | SomnoSuite | |
| Anesthesia masks for mice | Kent Scientific Equipment | SOMNO-0801 | |
| Autoclip applier 9 mm | Clay Adams | 427630 | |
| Autoclip remover 9 mm | Clay Adams | 427637 | |
| Autoclips 9 mm | Clay Adams | 427631 | |
| BASi Culex Controller | Culex | SN: 2151, 2152, 2156, 2158 | 4 stations |
| BASi Honey Comb Fraction Collector | Honey Comb | SN: 2105, 2106, 2107, 2108 | 4 stations |
| BASi Ratrun Rotation Control | RATURN 2 | SN: 5680, 5681, 5682, 5683 | 4 stations |
| C57BL/6J mice | JAX # 000664 | ||
| Carprofen | Zoetis | Rimadyl | Analgesic |
| Clippers | Braun | ||
| Clozapine-N-oxide | ENZO | BLM-NS105-0005 | |
| Cotton tipped applicators | |||
| CULEX Automated In Vivo Sampling System | BASi | DS000627 | with CX-4000S Replacement Tubing Sets |
| Curved forceps serrated | FST | 11151-10 | |
| Drill | Dremel | 61100 | |
| Empis control Module | EMPIS CM | SN: 174 | |
| Empis Programmable Infusion System | EMPIS | SN: 2125 , 2126, 2127, 2128 | With CX-7010S 4 BAS-2 Infusion Sets; 4 stations |
| Envigo 2016 diet | low-phytoestrogen diet | ||
| Eye ointment | Dechra | Puralube Vet Ointment | Petrolatum Ophtalmic oinment |
| Glass pipettes | World Precision Instruments | MIB100-6 | |
| Hemostats | Roboz Surgical | RS-7101 | |
| Iodine | Betadine Surgical scrub | ||
| Isoflurane | VetOne | Fluriso | Anesthetic |
| Isoflurane Vaporizer or SomnoSuite Low-Flow Anesthesia System | Surgivet or Kent Scientific Corp | SS-01 | Anesthesia Machine |
| Kiss1-Cre;ChR2-eYFP (Kiss1-eYFP) mice | JAX # 023436 and #024109 | ||
| Kisspeptin-10 | Phoenix Pharmaceuticals | 048-56 | |
| Micro-renathane tubing | Braintree Scientific | MRE025 | Surgical catheterization |
| Micro-Scissors | Roboz Surgical | RS-5606 | |
| Needle Holder | Roboz Surgical | RS-7842 | |
| Picoliter injector | Warner Instruments | PLI-100A | |
| Pipette puller | Sutter Instruments | P30 | |
| Rodent Warmer X2 | Stoelting | 53850 | |
| Scalpel | FST | 10003-12 | |
| Scissors | Roboz Surgical | RS-6808 | |
| Silicon tubing | Liveo Laboratory Tubing | NO.508-001 | 0.012 in I.D x 0.025 in O.D. |
| Stereotaxic table | RWD | E06208 | |
| Sterile 0.9% saline | Baxter | 2F7124 | |
| Sterile towel drapes | Dynarex | 4410 | |
| Surgical blades | SKLAR | 06-3011 | |
| Surgical stereoscope | Zeiss | f-160 | |
| Tweezers | Roboz Surgical | RS-4960 | |
| Tweezers | Roboz Surgical | RS-4972 | |
| Tweezers | Roboz Surgical | RS-5058 | |
| Antibodies | |||
| Anti-cFos | Millipore | ABE457 | Antigen target: N-terminus cFos; Host organism: Rabbit; Dilution used: 1:5,000; RRID: AB_2631318 |
| Anti-GFP | Aves Labs | GFP-1010 | Antigen target: recombinant GFP null; Host organism: Chicken; Dilution used: 1:10,000; RRID: AB_2307313 |
| Biotin-SP-conjugated AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch Labs | 711-065-152 | Antigen target: Rabbit IgG (H+L); Host organism: Donkey; Dilution used: 1:1,000; RRID: AB_2340593 |
| Donkey anti-Rat IgG, AlexaFluor 594 | Thermo Fisher Scientific | A-21209 | Antigen target: Rat IgG (H+L); Host organism: Donkey; Dilution used: 1:500; RRID: AB_2535795 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A-11039 | Antigen target: Chicken, IgY (H+L); Host organism: Goat; Dilution used: 1:500; RRID: AB_2534096 |
| mCherry monoclonal (16D7) | Thermo Fisher Scientific | M11217 | Antigen target: mCherry tag; Host organism: Rat; Dilution used: 1:5,000; RRID: AB_2536611 |
Riferimenti
- Kokoris, G. J., Lam, N. Y., Ferin, M., Silverman, A. J., Gibson, M. J. Transplanted gonadotropin-releasing hormone neurons promote pulsatile luteinizing hormone secretion in congenitally hypogonadal (hpg) male mice. Neuroendocrinology. 48 (1), 45-52 (1988).
- Coquelin, A., Desjardins, C. Luteinizing hormone and testosterone in young and old male mice. American Journal of Physiology - Endocrinology and Metabolism. 243 (3), E257-E263 (1982).
- Carmel, P. W., Araki, S., Ferin, M. Pituitary stalk portal blood collection in rhesus monkeys: Evidence for pulsatile release of gonadotropin-releasing hormone (GnRH). Endocrinology. 99 (1), 243-248 (1976).
- Schuiling, G., Gnodde, H. Site of origin of the pulsatile secretion of luteinizing hormone in long-term ovariectomized rats. Journal of Endocrinology. 70 (1), 97-104 (1976).
- Hackwell, E. C. R., Ladyman, S. R., Brown, R. S. E., Grattan, D. R. Mechanisms of lactation-induced infertility in female mice. Endocrinology. 164 (5), 1-12 (2023).
- Bahougne, T., Kretz, M., Angelopoulou, E., Jeandidier, N., Simonneaux, V. Impact of circadian disruption on female mice reproductive function. Endocrinology. 161 (4), (2020).
- Kreisman, M. J., McCosh, R. B., Tian, K., Song, C. I., Breen, K. M. Estradiol Enables Chronic Corticosterone to Inhibit Pulsatile Luteinizing Hormone Secretion and Suppress Kiss1 Neuronal Activation in Female Mice. Neuroendocrinology. 110 (6), 501-516 (2020).
- Moenter, S. M., Evans, N. P. Gonadotropin-releasing hormone GnRH measurements in pituitary portal blood. Journal of Neuroendocrinology. 34 (5), 13065 (2022).
- Maeda, K. I., et al. The LHRH pulse generator: A mediobasal hypothalamic location. Neuroscience and Biobehavioral Reviews. 19 (3), 427-437 (1995).
- Steyn, F. J., et al. Development of a methodology for and assessment of pulsatile luteinizing hormone secretion in juvenile and adult male mice. Endocrinology. 154 (12), 4939-4945 (2013).
- Steyn, F. J., et al. Development of a method for the determination of pulsatile growth hormone secretion in mice. Endocrinology. 152 (8), 3165-3171 (2011).
- Minabe, S., Uenoyama, Y., Tsukamura, H., Maeda, K. Analysis of pulsatile and surge-like luteinizing hormone secretion with frequent blood sampling in female mice. Journal of Reproduction and Development. 57 (5), 660-664 (2011).
- Perreau-Lenz, S., Kalsbeek, A., Pévet, P., Buijs, R. M. Glutamatergic clock output stimulates melatonin synthesis at night. European Journal of Neuroscience. 19 (2), 318-324 (2004).
- Herwig, A., Pévet, P., Bothorel, B., Steinlechner, S., Saboureau, M. Trans-pineal microdialysis in the Djungarian hamster (Phodopus sungorus): A tool to study seasonal changes of circadian clock activities. Journal of Pineal Research. 40 (2), 177-183 (2006).
- Adams, J. M., Otero-Corchon, V., Hammond, G. L., Veldhuis, J. D., Qi, N., Low, M. J. Somatostatin is essential for the sexual dimorphism of GH secretion, corticosteroid-binding globulin production, and corticosterone levels in mice. Endocrinology. 156 (3), 1052-1065 (2015).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63 (1), 27-39 (2009).
- Krashes, M. J., et al. reversible activation of AgRP neurons drives feeding behavior in mice. Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- National Research Council. Guide for the Care and Use of Laboratory Animals. Eighth edition. National Research Council. , (2011).
- Ayala, J. E., et al. Hyperinsulinemic-euglycemic clamps in conscious, unrestrained mice. Journal of Visualized Experiments. (57), e3188 (2011).
- Peters, S., et al. Culex ABS Part I: Introduction to automated blood sampling. Current Separations. 18 (4), 139-145 (2000).
- Bohs, C., Cregor, M., Gunaratna, G., Kissinger, C. Culex Automated blood sampler part II Managing freely-moving animals and monitoring their activity. Current Separations. 18 (4), 147-151 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kreisman, M. J., Mccosh, R. B., Breen, K. M. A Modified ultra-sensitive ELISA for measurement of LH in mice. Endocrinology. 163 (9), (2022).
- Pielecka-Fortuna, J., Chu, Z., Moenter, S. M. Kisspeptin acts directly and indirectly to increase gonadotropin-releasing hormone neuron activity and its effects are modulated by estradiol. Endocrinology. 149 (4), 1979-1986 (2008).
- Kumar, D., et al. Specialized subpopulations of kisspeptin neurons communicate with GnRH neurons in female mice. Endocrinology. 156 (1), 32-38 (2015).
- Caligioni, C. S. Assessing reproductive status/stages in mice. Current Protocols in Neuroscience. , 1-8 (2009).
- Czieselsky, K., et al. Pulse and surge profiles of luteinizing hormone secretion in the mouse. Endocrinology. 157 (12), 4794-4802 (2016).
- Wang, L., et al. Genetic dissection of the different roles of hypothalamic kisspeptin neurons in regulating female reproduction. eLife. 8, 43999 (2019).
- McCosh, R. B., Kreisman, M. J., Breen, K. M. Frequent tail-tip blood sampling in mice for the assessment of pulsatile luteinizing hormone secretion. Journal of Visualized Experiments. (137), e57894 (2018).
- Vanacker, C., Defazio, R. A., Sykes, C. M., Moenter, S. M. A role for glial fibrillary acidic protein (Gfap)-expressing cells in the regulation of gonadotropin-releasing hormone (GnRH) but not arcuate kisspeptin neuron output in male mice. eLife. 10, e68205 (2021).
- Dulka, E. A., Defazio, R. A., Moenter, S. M. Chemogenetic suppression of GnRH neurons during pubertal development can alter adult GnRH neuron firing rate and reproductive parameters in female mice. eNeuro. 7 (3), 0223 (2020).
- Talbi, R., et al. Characterization of the Action of Tachykinin Signaling on Pulsatile LH Secretion in Male Mice. Endocrinology. 162 (8), 1-9 (2021).
- Tuli, J., Smith, J., Morton, D. Corticosterone, adrenal and spleen weight in mice after tail bleeding, and its effect on nearby animals. Laboratory Animals. 29 (1), 90-95 (1995).
- Lucien, J. N., Ortega, M. T., Shaw, N. D. Sleep and puberty. Current Opinion in Endocrine and Metabolic Research. 17, 1-7 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon