Somministrazione costante di virus adeno-associato tramite iniezione laterale della vena di coda in topi adulti
In questo articolo
Riepilogo
Qui descriviamo in dettaglio un protocollo ottimizzato per l'iniezione laterale della vena di coda nel topo per somministrare sistemicamente il virus adeno-associato (AAV) nei topi adulti. Inoltre, descriviamo i protocolli dei saggi comunemente usati per valutare la trasduzione di AAV.
Abstract
Molti disturbi colpiscono più organi o coinvolgono diverse regioni del corpo, quindi è fondamentale somministrare terapie a livello sistemico per colpire le cellule colpite situate in siti diversi. L'iniezione endovenosa è una via di somministrazione sistemica ampiamente utilizzata negli studi preclinici che valutano i trattamenti destinati alla somministrazione in tutto il corpo. Nei topi adulti, comporta la somministrazione endovenosa dell'agente terapeutico nelle vene laterali della coda del topo. Una volta padroneggiate, le iniezioni della vena caudale sono sicure e veloci e richiedono solo strumenti semplici e comunemente disponibili. Tuttavia, le iniezioni della vena caudale sono tecnicamente impegnative e richiedono una formazione approfondita e una pratica continua per garantire l'erogazione accurata della dose prevista.
Qui descriviamo un protocollo di iniezione della vena di coda laterale dettagliato e ottimizzato che abbiamo sviluppato sulla base della nostra esperienza e delle raccomandazioni precedentemente riportate da altri gruppi. Oltre ai sistemi di contenzione per topi e alle siringhe per insulina, questo protocollo richiede solo reagenti e attrezzature prontamente disponibili nella maggior parte dei laboratori. Abbiamo scoperto che seguendo questo protocollo si ottiene una somministrazione endovenosa costantemente efficace di virus adeno-associato (AAV) nelle vene caudali di topi non sedati di 7-9 settimane. Inoltre, descriviamo i protocolli ottimizzati per la rilevazione istologica delle proteine reporter fluorescenti e la quantificazione del genoma del vettore per genoma diploide (vg/dg) utilizzati per valutare la trasduzione e la biodistribuzione dell'AAV. L'obiettivo di questo protocollo è aiutare gli sperimentatori a eseguire facilmente iniezioni di vena caudale con successo e costanza, il che può ridurre il tempo di pratica necessario per padroneggiare la tecnica.
Introduzione
Le malattie monogeniche costituiscono l'80% delle malattie rare, che colpiscono complessivamente 300 milioni di individui in tutto il mondo 1,2. Attualmente non esistono terapie curative approvate per la maggior parte di queste malattie rare altamente debilitanti 1,2,3. Tuttavia, i disturbi monogenici sono candidati ideali per le terapie geniche che possono sostituire, integrare, correggere o silenziare i geni disfunzionali 4,5. Attualmente, più vettori sono in fase di sviluppo e utilizzati per fornire terapie geniche a specifici tipi di cellule 4,6. Uno di questi vettori è il virus adeno-associato (AAV). L'AAV è un parvovirus non patogeno che viene sempre più utilizzato come vettore di terapia genica7. Rispetto ad altri vettori virali, l'AAV ha una minore immunogenicità, un minore potenziale di integrazione nel genoma dell'ospite e la capacità di trasdurre in modo efficiente le cellule in divisione e non in divisione in vari tessuti 7,8. Inoltre, sono stati sviluppati diversi approcci per ingegnerizzare e identificare AAV con caratteristiche desiderabili come il tropismo tissutale specifico o l'immunogenicità ulteriormente ridotta, il che migliora notevolmente la versatilità dell'AAV come vettore virale per diverse indicazioni9. Questi fattori hanno reso l'AAV un vettore di terapia genica ampiamente studiato e hanno portato allo sviluppo di molteplici terapie geniche basate su AAV approvate dalla FDA10.
I modelli murini sono comunemente usati per testare potenziali terapie geniche in vivo e comprendere meglio i meccanismi patologici delle malattie monogeniche. Ciò è dovuto alla ricapitolazione dei modelli murini delle patologie di diverse condizioni, alla somiglianza del loro genoma con il genoma umano e alla relativa facilità di manipolazione, manutenzione e generazione dei topi 11,12,13. I test in vivo sono particolarmente importanti quando si studiano disturbi che colpiscono più sistemi o regioni del corpo, come le distrofie muscolari. Per questi disturbi, i test in vitro potrebbero non essere sufficienti per valutare in modo completo la sicurezza, l'efficacia, la farmacocinetica e la farmacodinamica delle terapie destinate a raggiungere diverse regioni del corpo dopo la somministrazione sistemica14.
Varie vie di somministrazione sistemica possono essere utilizzate per somministrare farmaci. Ogni percorso ha i suoi vantaggi, svantaggi e grado di compatibilità con il modello animale e il farmaco oggetto di studio15. L'iniezione endovenosa (IV) della vena di coda laterale è una via comunemente usata per la somministrazione sistemica di AAV nei topi16. Le iniezioni laterali della vena caudale consentono la somministrazione rapida e diretta dell'iniettato nel flusso sanguigno del topo, garantendo un'elevata biodisponibilità del farmaco nella circolazione sistemica17. Richiedono anche strumenti relativamente semplici e comunemente disponibili per essere eseguiti. Tuttavia, principalmente a causa del piccolo diametro della vena caudale e della difficoltà di localizzare la vena, le iniezioni laterali della vena caudale sono tecnicamente impegnative e richiedono un alto grado di abilità e pratica costante per evitare tentativi di iniezione falliti o l'erogazione incompleta della dose 16,17,18,19. Questi possono comportare la perdita di reagenti costosi o risultati imprecisi, soprattutto se l'iniezione incompleta non viene riconosciuta durante l'esecuzione dell'iniezione. La nostra esperienza qui riassunta si basa su protocolli riportati in articoli ben documentati che abbiamo adattato per il nostro utilizzo, ottimizzando vari passaggi della procedura di iniezione laterale della vena di coda per garantire iniezioni costantemente di successo 20,21,22,23,24,25,26,27.
Qui, descriviamo questo protocollo dettagliato e ottimizzato di iniezione della vena di coda laterale per somministrare AAV in topi di 7-9 settimane non sedati utilizzando strumenti semplici e comunemente disponibili. Inoltre, forniamo i protocolli per i metodi utilizzati per valutare la somministrazione e la biodistribuzione di AAV. Questi protocolli coprono la raccolta dei tessuti dopo l'iniezione, la fissazione dei tessuti, l'estrazione del DNA e la quantificazione del genoma del vettore della reazione a catena della polimerasi digitale (dPCR) per genoma diploide (vg/dg). Il protocollo di iniezione endovenosa e i suggerimenti forniti qui mirano a migliorare la facilità di esecuzione con successo delle iniezioni laterali della vena di coda. Ciò contribuirà potenzialmente a ridurre il tempo necessario per padroneggiare le abilità di iniezione, migliorando contemporaneamente l'accuratezza e la coerenza delle iniezioni.
Protocollo
Tutte le procedure di manipolazione e iniezione degli animali sono state approvate dal Comitato per la cura degli animali del NINDS. Tutte le procedure sugli animali sono state condotte in conformità con le linee guida NINDS per la cura e l'uso degli animali.
1. Preparazione pre-iniezione
- Preparazione della dose di AAV
- Determinare il peso medio dei topi che verranno iniettati.
- Calcolare il volume massimo consentito di iniezione secondo le linee guida per la cura degli animali dell'istituto, come mostrato nell'equazione (1). Il volume massimo iniettato è tipicamente un valore di volume (μL)/peso del topo (g) (ad esempio, 10 μL/g.).
Volume massimo iniettato (μL)/topo= [volume massimo iniettato (μL/g)) × [peso medio del topo (g)] (1)
NOTA: Esempio di calcolo: Volume massimo iniettato/topo = 10 μL/g × 20 g/topo = 200 μL/topo - Impostare la dose del genoma del vettore AAV (vg) da erogare per topo.
NOTA: Questo potrebbe essere lo stesso valore assoluto in diversi mouse (ad esempio, tutti i mouse ricevono 1,5 × 1012 vg indipendentemente dal peso di ciascun topo). Oppure la dose potrebbe essere in vg/kg, quindi il vg totale da iniettare per topo deve essere calcolato per ciascun topo in base al peso di quel topo il giorno dell'iniezione.- Se la dose è in vg/kg, pesare ciascun topo il giorno dell'iniezione prima della preparazione della dose.
- Calcolare i genomi vettori da consegnare per ciascun topo in base al suo peso utilizzando l'equazione (2):
Genomi vettori da somministrare in un topo specifico (vg) = valore vg/kg prespecificato (vg/kg) ×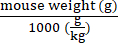 (2)
(2)
NOTA: L'uso di vg/kg come unità di dose invece di vg/topo potrebbe essere più appropriato in alcuni studi preclinici per garantire confronti validi tra le dosi iniettate. Ciò è dovuto alle differenze di peso tra topi maschi e femmine della stessa età o eventualmente tra topi dello stesso sesso. - Utilizzare il volume massimo iniettato e la dose di AAV (vg) per calcolare i volumi di AAV madre e soluzione salina sterile tamponata con fosfato (PBS) necessari per preparare la dose richiesta (vedere equazioni (3-6)). Assicurarsi che il volume da iniettare sia uguale o inferiore al volume massimo di iniezione consentito. Preparare sempre un volume di iniezione che sia almeno 15 μl maggiore del volume che verrà iniettato per tenere conto degli errori di pipettaggio e dello spazio morto della siringa.
Concentrazione di iniettato (vg/μL) =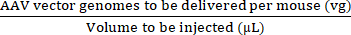 (3)
(3)
Genomi totali del vettore AAV da aggiungere per preparare l'iniettato (vg) = concentrazione di iniettato (vg/μL) × volume da preparare (μL) (4)
Volume di AAV da aggiungere per preparare l'iniettato) (μL) =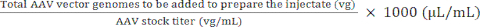 (5)
(5)
Volume di PBS da aggiungere per preparare l'iniettato (μL) = Volume da preparare (μL) - Volume di stock AAV da aggiungere per preparare l'iniettato (μL) (6)
NOTA: Esempio di calcolo:
6 × 1013 vg/kg (la dose) saranno somministrati in 200 μL/topo (il volume da iniettare) in un topo che pesa 25 g. Il titolo AAV è 3,0 × 1013 (vg/mL)
Genomi vettori da consegnare in questo specifico topo (vg) = 6 × 1013 (vg/kg) ×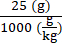 = 1,5 × 1012 vg per questo topo
= 1,5 × 1012 vg per questo topo
Concentrazione di iniettato =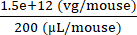 = 7,5 × 109 (vg/μL)
= 7,5 × 109 (vg/μL)
Totale genomi del vettore AAV da aggiungere per preparare l'iniettato = 7,5 × 109 (vg/μL) × (200 (μL) + 15 (μL)) = 1,6125 × 1012 (vg)
Volume di stock AAV da aggiungere per preparare l'iniettato =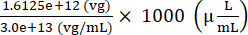 = 53,75 (μL)
= 53,75 (μL)
Volume di PBS da aggiungere per preparare l'iniettato = 215 (μL) - 53,75 (μL) = 161,25 (μL)
- Procedura di preparazione della dose di AAV
NOTA: Seguendo le linee guida sulla biosicurezza e sui DPI dell'istituto per la manipolazione dell'AAV, in una provetta per microcentrifuga da 1,7 ml sterile sterilizzata autoclavata senza RNasi e DNasi, preparare l'iniettato di AAV utilizzando il brodo AAV e il PBS sterile secondo i calcoli al punto 1.1.3.3. Tenere sempre l'AAV di serie e l'AAV iniettato sul ghiaccio. Utilizzare micropipette pulite e nuove scatole di puntali per micropipette per garantire la sterilità. Smaltire i puntali per micropipette contaminati da AAV secondo le linee guida per la gestione dei rifiuti dell'istituto.- Scongelare l'AAV di serie sul ghiaccio.
NOTA: Evitare di scongelare e ricongelare il calcio AAV. Ordinare o preparare l'AAV in aliquote da 100-200 μl per evitare di avere un eccesso di AAV dopo la preparazione della dose che dovrà essere ricongelata.
- Scongelare l'AAV di serie sul ghiaccio.
- Preparazione della stazione di iniezione
- Pulitura
- Pulire l'area di lavoro con etanolo al 70% (EtOH).
- Disinfettare l'area di lavoro utilizzando uno o più reagenti battericidi, fungicidi e virucidi.
- Pulire il sistema di ritenuta del tubo del mouse con acqua e sapone.
- Impostazione degli strumenti della stazione
- Posizionare una provetta conica vuota da 15 mL in un portaprovette/rack.
- Installare una piattaforma rialzata su cui verrà posizionato il sistema di ritenuta del tubo del mouse (Figura 1A, B).
- Posizionare il sistema di ritenuta del tubo del mouse pulito nell'area di lavoro.
- Se si iniettano topi molto più piccoli del sistema di ritenuta per topi disponibile, utilizzare un cono di plastica per roditori per creare un manicotto di contenimento. Vedere i passaggi 2.1.3-4.
- Posizionare le siringhe che verranno utilizzate per le iniezioni nell'area di lavoro. Utilizzare siringhe da insulina da 0,3 ml con aghi da 29 G.
- Posizionare il contenitore dei rifiuti il più vicino possibile alla stazione di iniezione per consentire lo smaltimento immediato degli strumenti contaminati da AAV.
- Tirare e spingere più volte lo stantuffo di ciascuna siringa per assicurarsi che lo stantuffo si muova senza intoppi in modo che non vi sia resistenza causata dalla siringa durante l'iniezione. Se lo stantuffo non si muove agevolmente, gettare questa siringa e sostituirla con una nuova.
- Tieni a disposizione una bilancia per topi e una mini centrifuga accanto all'area di iniezione.
- Tenere a portata di mano l'AAV preparato sul ghiaccio nell'area di iniezione.
- Preparare acqua tiepida (38-40 °C). Fare attenzione che la temperatura dell'acqua non superi i 40 °C per evitare di provocare ustioni alla coda del topo.
- Pulitura
2. Procedura di iniezione
- Contenimento del mouse
- Pesare ogni topo per calcolare la dose in vg/kg, se necessario.
- Assicurarsi che il mouse sia completamente trattenuto e non sia in grado di muoversi.
NOTA: Se il topo non è completamente trattenuto, potrebbe muoversi durante la somministrazione endovenosa con conseguente spostamento dell'ago. Ciò potrebbe causare la fuoriuscita dell'ago dalla vena e/o ferire il topo. - Per il sistema di ritenuta del tubo:
- Lavare il sistema di ritenuta con acqua tiepida e sapone tra i topi per pulire e riscaldare il supporto.
- Tieni il mouse per la coda. Inserire la coda del mouse nell'apertura superiore del tubo; Quindi, tirare lentamente il mouse nel fermatubi. Se le dimensioni del fermatubo sono adatte alle dimensioni del mouse, posizionare il tappo davanti al mouse per evitare che il mouse fuoriesca.
NOTA: La spina deve essere abbastanza vicina al mouse per evitare che il mouse si muova o ruoti all'interno del tubo, ma la spina non deve ostruire il naso del mouse per consentire al mouse di respirare liberamente. Se il mouse è più piccolo delle dimensioni del sistema di ritenuta del tubo, utilizzare un cono flessibile monouso oltre al sistema di ritenuta del tubo, come descritto di seguito al punto 2.1.4.
- Per i coni di contenimento flessibili e monouso, se necessario (per realizzare un manicotto di contenimento per i topi più piccoli):
- Fai un taglio all'estremità del naso del cono per assicurarti che il naso del topo non sia ostruito e che il topo abbia abbastanza spazio per respirare.
- Tagliare la parte posteriore del cono in modo che il cono sia quasi della stessa lunghezza del mouse (in modo che il cono si adatti all'interno del tubo) (Figura 1A, B).
- Posizionare il mouse nel fermatubo come descritto sopra nei passaggi 2.1.3. Tenendo la coda del mouse, inserire il cono di ritenuta con il lato di apertura più largo prima nel tubo.
- Tenendo la coda del topo, lascia che il topo entri nel cono; Quindi, fai scorrere il resto del cono nel tubo. Assicurati che la coda del mouse sia completamente fuori dalla parte posteriore del tubo e che il mouse abbia spazio per respirare all'interno del cono.
- Fissare il tappo del tubo immediatamente davanti all'apertura del naso del cono, assicurandosi che il mouse sia completamente trattenuto e abbia spazio sufficiente per respirare.
- Iniezione del mouse
- Riempire la provetta conica da 15 ml con acqua tiepida.
- Posizionare il fermatubo con il mouse al suo interno sulla piattaforma rialzata (Figura 1B).
- Immergere il più possibile la coda del topo trattenuto nell'acqua tiepida per almeno 1 minuto fino a quando le vene laterali sono chiaramente dilatate e visibili (Figura 1B).
- Durante la fase di riscaldamento della coda, caricare la dose di AAV nella siringa.
- Collocare la provetta per microcentrifuga da 1,7 mL contenente AAV senza tappo in un rack per provette. Inserire l'ago verticalmente nel tubo con la mano dominante. Una volta che l'ago è all'interno del tubo, tenere il tubo con la mano non dominante.
NOTA: L'inserimento verticale dell'ago previene danni all'ago che potrebbero essere causati dal contatto con la parete del tubo. Possono essere utilizzati altri metodi alternativi di caricamento della siringa, ma la sicurezza dello sperimentatore e del topo iniettato dovrebbe essere garantita. Tenere il tubo con la mano non dominante protegge da lesioni accidentali da puntura dell'ago se l'ago viene inserito tenendo il tubo. - Con l'ago all'interno del tubo, sollevare contemporaneamente il tubo e la siringa all'altezza degli occhi, assicurandosi che l'ago non tocchi la parete del tubo. Appoggia entrambe le braccia sul tavolo per stabilizzarle. Aspirare lentamente la dose nella siringa.
NOTA: L'aspirazione lenta impedisce alle bolle d'aria sottili di attaccarsi ai lati del cilindro della siringa. - Espellere le bolle d'aria dalla siringa. Se si inietta AAV, assicurarsi che le bolle d'aria vengano espulse dalla siringa su un tampone assorbente monouso che verrà smaltito in una scatola a rischio biologico.
- Tenere premuto l'iniettato per almeno 40 secondi per riscaldarlo.
NOTA: Assicurarsi sempre che l'iniettato sia caldo prima dell'iniezione. Se viene somministrato l'iniettato a freddo, l'iniezione potrebbe non fluire attraverso la vena, ad eccezione dei primi μL. - Controlla le vene della coda ogni minuto.
NOTA: Le vene devono essere MOLTO visibili fino al sito di iniezione (aggiungere il tempo di riscaldamento della coda e sostituire con acqua calda fresca secondo necessità fino a quando la vena è chiaramente visibile, ma non superare il tempo di contenimento del topo consentito dal protocollo di manipolazione degli animali dell'istituto). - Dopo essersi assicurati che le vene siano chiaramente visibili, rimuovere il sistema di ritenuta del tubo dalla parte superiore della piattaforma rialzata e posizionare il sistema di ritenuta del tubo direttamente sul tavolo. Posizionare il mouse nel sistema di ritenuta con i piedi rivolti verso il basso e non di lato per maneggiare facilmente la coda.
NOTA: Il mouse non deve essere su un lato o all'interno del fermatore. Il mouse deve essere completamente trattenuto e non essere in grado di muoversi o ruotare all'interno del sistema di ritenuta o di muovere/tirare la coda. - Pulisci rapidamente la coda con una garza per asciugare la coda; Pulisci la coda con un batuffolo imbevuto di alcol e poi asciugala con una garza asciutta.
NOTA: Utilizzare una garza asciutta per rendere la coda sufficientemente asciutta da consentire una presa sicura della coda, ma non completamente asciutta. Può essere più difficile vedere la vena quando la coda è completamente asciutta. - Ruota la coda di circa 90° a sinistra o a destra in modo che una delle due vene laterali sia rivolta verso l'alto. Individuare un sito di iniezione adatto all'interno del terzo medio della coda. Iniziare l'iniezione iniziale distalmente (più vicino alla punta della coda) e spostarsi prossimalmente se sono necessarie ulteriori iniezioni a causa di tentativi falliti o rese necessarie dal disegno sperimentale.
NOTA: Non tentare di iniettare distalmente in un sito di iniezione precedente poiché l'iniettato potrebbe fuoriuscire da quel sito di iniezione precedente. Facoltativo: utilizzare il pollice e l'indice della mano non dominante per applicare una pressione prossimale (a monte/più vicino al corpo del topo) sul sito di iniezione per 10 s. Le dita fungono da lacci emostatici per dilatare ulteriormente la vena nel sito di iniezione. Subito dopo il laccio emostatico 10 s, rilasciare le dita del laccio emostatico e assicurarsi che una delle due vene laterali sia rivolta verso l'alto e sia chiaramente visibile. - Tenere la coda con la mano non dominante usando il pollice e l'indice immediatamente distalmente al sito di iniezione. Pieghi la coda sopra il dito indice in modo che il sito di iniezione sia piatto sul dito indice. Tirare indietro la coda in modo che la coda sia allungata e il sito di iniezione sia completamente orizzontale (a 0°) (parallelo alla tavola orizzontale) (Figura 1C).
- Tenere la siringa utilizzando l'indice e il medio della mano dominante su entrambi i lati della flangia del cilindro della siringa, tenendo il pollice pronto allo stantuffo.
NOTA: In questo modo sarà più facile non muovere il pollice o l'ago una volta che l'ago è all'interno della vena (Figura 1C). - Appoggiare entrambe le mani sul tavolo per stabilizzarle e posizionare l'ago direttamente sopra e parallelamente alla coda e alla vena con lo smusso rivolto verso l'alto. Tenere il sito di iniezione vicino al dito indice che tiene la coda per migliorare il controllo e la stabilità del sito di iniezione.
NOTA: Il sistema di ritenuta del tubo deve essere sufficientemente profondo nel tavolo in modo che entrambe le mani siano appoggiate sul tavolo. - Mantenendo l'ago parallelo alla vena caudale e applicando una pressione verso il basso sull'ago, far scorrere l'ago in avanti nella vena.
NOTA: La pressione verso il basso dovrebbe essere sufficiente per inserire l'ago con l'angolazione corretta nella vena. La vena è estremamente superficiale, quindi l'ago dovrebbe essere il più piatto possibile quando si cerca di entrare nella vena. - Iniettare lentamente la soluzione nella vena. Dopo aver somministrato la dose, ritirare lentamente l'ago e applicare immediatamente una pressione con una garza nel sito di iniezione per almeno 10 s per fermare l'emorragia.
NOTA: Applicare la pressione per tutto il tempo necessario fino a quando l'emorragia non si è completamente fermata per evitare la potenziale perdita del reagente iniettato. Una goccia di sangue di solito appare dopo aver ritirato l'ago, indicando che l'ago è penetrato nella vena. Occasionalmente, la goccia di sangue non appare nemmeno con un'iniezione riuscita. La goccia di sangue non indica l'avvenuta iniezione; Indica solo che l'ago è penetrato nella vena. L'indicatore affidabile di successo dell'iniezione è la completa assenza di resistenza dello stantuffo durante l'iniezione. Se l'ago si trova all'interno della vena, non dovrebbe esserci resistenza allo stantuffo dell'ago durante l'iniezione dell'iniettato e la vena prossimale al sito di iniezione apparirà momentaneamente di colore leggermente più chiaro (sbianca) (lo sbiancamento della vena potrebbe non essere molto chiaro in alcuni ceppi di topo). Se c'è resistenza e/o inizia a comparire un rigonfiamento nel sito di iniezione, l'ago non è posizionato correttamente all'interno della vena. In tal caso, rimuovere completamente l'ago dalla coda e tentare di iniettare la vena in un nuovo sito di iniezione prossimale al sito di iniezione fallito (più vicino al corpo del topo). - Smaltire le siringhe e i tubi contaminati da AAV secondo le linee guida per la gestione dei rifiuti dell'istituto.
- Libera il topo dai sistemi di ritenuta e rimettilo in una nuova gabbia separata dai topi non iniettati. Monitorare i topi per 10 minuti per garantire livelli di attività normali dopo l'iniezione.
NOTA: Ciò evita la potenziale trasmissione di agenti iniettati a topi non iniettati se vengono somministrati agenti trasmissibili. - Disinfettare l'area di lavoro utilizzando reagenti battericidi, fungicidi e virucidi e EtOH al 70%. Pulire il sistema di ritenuta del tubo del mouse con acqua e sapone.
- Collocare la provetta per microcentrifuga da 1,7 mL contenente AAV senza tappo in un rack per provette. Inserire l'ago verticalmente nel tubo con la mano dominante. Una volta che l'ago è all'interno del tubo, tenere il tubo con la mano non dominante.
3. Dissezione e raccolta e fissazione dei tessuti27
- Preparazione della stazione di prelievo dei tessuti
- Pulire la stazione di lavoro con un reagente per la degradazione del DNA secondo le istruzioni del produttore per degradare il DNA contaminante che potrebbe essere presente nell'area di lavoro.
- Mettere il metilbutano in un contenitore di metallo. Posizionare il contenitore metallico di metilbutano all'interno di una scatola di polistirolo; Quindi, circondare il contenitore di metallo con ghiaccio secco in modo che il livello del ghiaccio secco che circonda il contenitore sia superiore al livello di metilbutano all'interno del contenitore.
- Etichettare e posizionare le provette vuote per la conservazione dei tessuti per microcentrifuga da 2 ml sul ghiaccio secco. Lasciare raffreddare le provette di metilbutano e di tessuto su ghiaccio secco per almeno 20 minuti prima di iniziare a congelare i tessuti. Posizionare le pinze per il trasferimento dei tessuti sul ghiaccio secco.
- Etichettare e riempire un altro set di provette per microcentrifuga da 2 ml con paraformaldeide (PFA) fresca al 4% e conservarle a temperatura ambiente. Aggiungere abbastanza 4% di PFA a ciascun tubo per immergere completamente i tessuti che verranno inseriti nel tubo.
- Raccolta e fissazione dei tessuti
- Sopprimere il topo secondo le linee guida per la cura degli animali dell'istituto.
NOTA: Qui, i topi sono stati soppressi utilizzando la lussazione cervicale. - Spruzzare completamente il mouse con il 70% di EtOH.
- Raccogli i tessuti necessari.
NOTA: Il protocollo di raccolta e fissazione qui descritto è stato testato sui muscoli scheletrici e sul fegato. - Per i tessuti che verranno utilizzati per l'estrazione del DNA:
- Immergere il fazzoletto in metilbutano preraffreddato su ghiaccio secco e lasciare il fazzoletto in metilbutano per almeno 1 minuto. Utilizzare le pinze di trasferimento preraffreddate per trasferire i tessuti congelati dal metilbutano alle provette vuote prerefrigerate da 2 mL per la conservazione dei tessuti per microcentrifuga. Conservare il fazzoletto a -80 °C.
NOTA: Opzionale: il fazzoletto può essere tagliato in pezzi da 20 mg prima di immergerlo in metilbutano per essere pronto per essere utilizzato al punto 4.1.4.
- Immergere il fazzoletto in metilbutano preraffreddato su ghiaccio secco e lasciare il fazzoletto in metilbutano per almeno 1 minuto. Utilizzare le pinze di trasferimento preraffreddate per trasferire i tessuti congelati dal metilbutano alle provette vuote prerefrigerate da 2 mL per la conservazione dei tessuti per microcentrifuga. Conservare il fazzoletto a -80 °C.
- Per i tessuti che verranno utilizzati per l'analisi istologica e per la conservazione della fluorescenza delle proteine reporter:
- Utilizzando una pinza designata con PFA mantenuta a temperatura ambiente, far cadere i tessuti nella rispettiva provetta da microcentrifuga che contiene il 4% di PFA (mantenuto a temperatura ambiente) assicurandosi che il tessuto sia completamente immerso nella soluzione di PFA al 4%.
NOTA: La contaminazione da PFA può influenzare negativamente diversi saggi molecolari a valle. Utilizzare solo pinze designate per PFA quando si maneggia il PFA per prevenire la contaminazione da PFA di altri tessuti o strumenti. - Posizionare le provette per microcentrifuga su una griglia e coprire la griglia con carta stagnola per mantenere le provette al buio. Incubare il rack coperto a 4 °C su uno shaker agitando delicatamente per una notte.
- Dopo l'incubazione notturna, preparare il 5% di saccarosio (% p/v) in 1x PBS sciogliendo 5,0 g. di saccarosio in 70 mL di 1x PBS agitando energicamente. Aggiungere una quantità sufficiente di 1x PBS a un volume totale finale di 100 mL per ottenere una soluzione di saccarosio al 5% (% p/v).
- Sterilizzare la soluzione di saccarosio al 5% utilizzando il filtro per siringa da 0,22 μm. Etichettare e riempire le provette per microcentrifuga da 2,0 ml con saccarosio al 5% appena preparato.
- Trasferire i tessuti dal 4% di PFA alla rispettiva provetta da microcentrifuga che contiene il 5% di saccarosio (conservato a temperatura ambiente) assicurandosi che il tessuto sia completamente immerso nella soluzione di saccarosio al 5%.
- Posizionare le provette per microcentrifuga su una griglia e coprire la griglia con carta stagnola per mantenere le provette al buio. Incubare il rack coperto a 4 °C su uno shaker agitando delicatamente per una notte.
- Dopo l'incubazione notturna, preparare il 20% di saccarosio (% p/v) in 1x PBS sciogliendo 20,0 g. di saccarosio in 70 mL di 1x PBS agitando energicamente. Aggiungere una quantità sufficiente di 1x PBS a un volume totale finale di 100 mL per ottenere una soluzione di saccarosio al 20% (% p/v).
- Sterilizzare la soluzione di saccarosio al 20% utilizzando un filtro per siringa da 0,22 μm. Etichettare e riempire le provette per microcentrifuga da 2,0 ml con saccarosio al 20% appena preparato.
- Trasferire i tessuti dal 5% di saccarosio alla rispettiva provetta da microcentrifuga che contiene il 20% di saccarosio (conservato a temperatura ambiente) assicurandosi che il tessuto sia completamente immerso nella soluzione di saccarosio al 20%.
- Posizionare le provette per microcentrifuga su una griglia e coprire la griglia con carta stagnola per mantenere le provette al buio. Incubare il rack coperto a 4 °C su uno shaker agitando delicatamente per una notte.
- Dopo l'incubazione notturna, mettere il metilbutano in un contenitore di metallo e posizionare il contenitore di metallo di metilbutano all'interno di una scatola di polistirolo. Circondare il contenitore di metallo con ghiaccio secco in modo che il livello del ghiaccio secco che circonda il contenitore sia superiore al livello di metilbutano all'interno del contenitore.
- Etichettare e posizionare le provette vuote da 2 ml per la conservazione dei tessuti per microcentrifuga sul ghiaccio secco. Lasciare raffreddare le provette di metilbutano e di tessuto su ghiaccio secco per almeno 20 minuti prima di iniziare a congelare i tessuti. Posizionare la pinza di trasferimento sul ghiaccio secco.
- Tamponare rapidamente i fazzoletti con salviette di precisione per rimuovere l'eccesso di saccarosio al 20%. Immergere il fazzoletto in metilbutano preraffreddato su ghiaccio secco. Lasciare il fazzoletto in metilbutano per almeno 1 minuto.
- Utilizzare le pinze di trasferimento preraffreddate per trasferire i tessuti congelati dal metilbutano alle provette vuote prerefrigerate da 2 mL per la conservazione dei tessuti per microcentrifuga. Conservare il fazzoletto a -80 °C.
- Utilizzando una pinza designata con PFA mantenuta a temperatura ambiente, far cadere i tessuti nella rispettiva provetta da microcentrifuga che contiene il 4% di PFA (mantenuto a temperatura ambiente) assicurandosi che il tessuto sia completamente immerso nella soluzione di PFA al 4%.
- Sopprimere il topo secondo le linee guida per la cura degli animali dell'istituto.
4. dPCR per la quantificazione vg/dg
- Estrazione del DNA dai tessuti e digestione iniziale dell'RNA
NOTA: Il manuale del kit di estrazione del DNA elencato nella Tabella dei materiali è stato utilizzato per derivare questo protocollo di estrazione del DNA. Conservare sempre i tubi contenenti i pezzi di tessuto congelati su ghiaccio secco.- Prepara un secchio di ghiaccio.
- Per ogni campione di DNA, etichettare una provetta per microsfere di lisi da 1,5 mL e due provette per microcentrifuga da 1,7 mL vuote prive di RNasi e DNasi.
- Aggiungere 180 μl del primo tampone del kit di estrazione del DNA a ciascuna provetta del microsfera. Tarare il primo tubo di perline contenente il tampone.
NOTA: Se i fazzoletti non sono stati pretagliati al punto 3.2.4.1, utilizzare una lama di rasoio preraffreddata su ghiaccio secco per tagliare il fazzoletto in pezzi da 20 mg. Questo passaggio deve essere eseguito all'interno di un criostato pulito mantenuto a -20 °C o più freddo. - Aggiungere un pezzo di tessuto nel tubo; pesare e registrare il peso del tessuto (essere ~20 mg.).
- Posizionare immediatamente la provetta del cordone di lisi con il fazzoletto al suo interno sul ghiaccio. Il buffer potrebbe cristallizzarsi.
- Ripetere i passaggi precedenti per ogni campione di tessuto.
- Trasferire le provette nel miscelatore a provette di lisi e farle funzionare per 1 minuto alla massima velocità (velocità 10) a 4 °C.
- Posizionare i campioni sul ghiaccio per trasferirli nella centrifuga. Centrifugare per 1 minuto a 20.000 × g a 4 °C.
- Durante la fase di centrifugazione, aggiungere 20 μL di proteinasi K alla prima serie di provette per microcentrifuga da 1,7 mL. Dopo la fase di centrifugazione, trasferire il surnatante degli omogeneizzati nelle provette da 1,7 mL contenenti la proteinasi K e mescolare bene. Incubare a 56 °C per 15 minuti, con miscelazione a 500 giri/min.
- Raccogliere le gocce dalle pareti e dal coperchio della provetta centrifugando la provetta per 1-2 s utilizzando una mini centrifuga. Incubare a temperatura ambiente per 2 min.
- Aggiungere 4 μL di RNasi A e mescolare con un breve vortice di impulsi. Incubare a temperatura ambiente per 2 min. Vortice di impulsi per 15 s.
- Raccogliere le gocce dalle pareti e dal coperchio della provetta centrifugando la provetta per 1-2 s utilizzando una mini centrifuga. Aggiungere 200 μl del secondo tampone del kit di estrazione del DNA. Vortice di impulsi per 15 s.
- Raccogliere le gocce dalle pareti e dal coperchio della provetta centrifugando la provetta per 1-2 s utilizzando una mini centrifuga. Aggiungere 200 μl di 100% EtOH. Vortice di impulsi per 15 s.
- Raccogliere le gocce dalle pareti e dal coperchio della provetta centrifugando la provetta per 1-2 s utilizzando una mini centrifuga. Trasferire i lisati nella colonna di centrifuga per l'estrazione del DNA. Centrifugare a 6.000 × g per 1 min.
- Posizionare la colonna di centrifuga in una nuova provetta di raccolta. Aggiungere 500 μl del terzo tampone del kit di estrazione del DNA alla colonna di rotazione. Centrifugare a 6.000 × g per 1 min.
- Posizionare la colonna di centrifuga in una nuova provetta di raccolta. Aggiungere 500 μl del quarto tampone del kit di estrazione del DNA alla colonna di rotazione. Centrifugare a 20.000 × g per 3 min.
- Posizionare la colonna di centrifuga in una nuova provetta da microcentrifuga da 1,7 mL. Aggiungere 100 μL di acqua di grado molecolare alla colonna di centrifuga. Incubare a temperatura ambiente per 1 min. Centrifugare a 6.000 × g per 1 minuto a temperatura ambiente.
- Misurare la concentrazione di DNA, se necessario. Conservare a 4 °C per la conservazione a breve termine o a -20 °C per la conservazione a lungo termine.
- Estrazione del DNA da cellule selezionate FACS
NOTA: Il manuale del kit di estrazione del DNA elencato nella Tabella dei materiali è stato utilizzato per derivare questo protocollo di estrazione del DNA.- Dopo aver selezionato le celle, centrifugare i campioni a 300 × g per 5 s per raccogliere tutte le gocce sui lati e sul coperchio. Assicurati che tutte le gocce siano raccolte.
NOTA: Se il volume del campione è inferiore a 1,5 mL, procedere direttamente al passaggio successivo. Se il volume del campione è superiore a 1,5 mL, rimuovere con cautela ed eliminare la parte superiore del surnatante utilizzando una micropipetta lasciando 1-1,5 mL di campione. - Miscelare il campione pipettandolo più volte e trasferirlo in una provetta da microcentrifuga da 1,7 ml. Centrifugare a 515 × g per 1 min a temperatura ambiente.
- Scartare il surnatante ad eccezione degli ultimi 50 μL. Risospendere il pellet in 50 μL del primo tampone del kit di estrazione del DNA per un volume finale di 100 μL.
- Seguire il protocollo del produttore per l'isolamento del DNA genomico da piccoli volumi di sangue (vedere la Tabella dei materiali).
- Aggiungere 10 μL di proteinasi K e 100 μL di secondo tampone del kit di estrazione del DNA; Miscelare a impulsi per 15 s. Incubare i campioni a 56 °C per 10 minuti con miscelazione a 300 giri/min. Mescolare i campioni due volte mediante una leggera inversione durante questo periodo di incubazione.
- Raccogliere le gocce dalle pareti e dal coperchio della provetta centrifugando la provetta per 1-2 s utilizzando una mini centrifuga. Aggiungere 50 μl di EtOH al 100% e miscelare a vortice di impulsi per 15 s. Incubare i campioni a temperatura ambiente per 5 minuti.
- Raccogliere le gocce dalle pareti e dal coperchio della provetta centrifugando la provetta per 1-2 s utilizzando una mini centrifuga. Trasferire i campioni nella colonna di estrazione del DNA (la colonna si trova in una provetta di raccolta da 2 mL) senza bagnare il bordo. Centrifugare a 6.000 × g per 1 min.
- Dopo aver posizionato la colonna in una provetta di raccolta da 2 mL pulita, gettare la provetta di raccolta contenente il flusso. Aggiungere 500 μl del terzo tampone del kit di estrazione del DNA alla colonna senza bagnare il bordo e centrifugare a 6.000 × g per 1 minuto.
- Anche in questo caso, dopo aver posizionato la colonna in una provetta di raccolta da 2 mL pulita, gettare la provetta di raccolta contenente il flusso. Aggiungere 500 μl del quarto tampone del kit di estrazione del DNA alla colonna senza bagnare il bordo e centrifugare a 6.000 × g per 1 minuto.
- Collocare la colonna in una provetta di raccolta pulita da 2 mL ed eliminare la provetta di raccolta contenente il flusso continuo. Centrifugare a 20.000 × g per 3 min.
- Posizionare la colonna in una provetta da microcentrifuga pulita da 1,7 mL ed eliminare la provetta di raccolta contenente il flusso continuo. Aggiungere 20 μl di acqua di grado molecolare al centro della membrana della colonna per l'eluizione; Chiudere il coperchio e incubare i campioni con l'acqua di grado molecolare a temperatura ambiente per 5 minuti.
- Centrifugare a 20.000 × g per 1 min. Conservare il DNA eluito a 4 °C per la conservazione a breve termine o a -20 °C per la conservazione a lungo termine.
- Dopo aver selezionato le celle, centrifugare i campioni a 300 × g per 5 s per raccogliere tutte le gocce sui lati e sul coperchio. Assicurati che tutte le gocce siano raccolte.
- Digestione e purificazione dell'RNA
NOTA: Il manuale del kit di estrazione del DNA elencato nella Tabella dei materiali è stato utilizzato per derivare questo protocollo di pulizia del DNA. A seconda delle condizioni della dPCR, dei reagenti e dei disegni dei primer e delle sonde, potrebbe essere necessario garantire la completa assenza di RNA nel campione di DNA prima di procedere alla quantificazione vg/dg della dPCR. La contaminazione da RNA potrebbe portare a vari gradi di valori vg/dg imprecisi in determinate condizioni di dPCR.- In una provetta per PCR da 0,2 mL o in una provetta per microcentrifuga da 1,7 mL, aggiungere al massimo 20 μl del campione di DNA estratto e 1,5 μl di RNasi priva di DNasi a ciascun campione di DNA. Se il volume della miscela DNA/RNasi è inferiore a 21,5 μl, aggiungere una quantità sufficiente di acqua di grado molecolare fino a un volume finale di 21,5 μl e miscelare 25x capovolgendo le provette. Incubare a 37 °C per 30 minuti mescolando periodicamente ogni 10 minuti capovolgendo le provette.
NOTA: La quantità totale di acidi nucleici aggiunti alla provetta deve essere compresa tra 175 ng e 700 ng. Potrebbero essere necessarie modifiche se i campioni di DNA contengono volumi o quantità di acido nucleico al di fuori di questo intervallo o se i campioni di DNA sono stati isolati in modo diverso. - Mettere sul ghiaccio per 2 min. Aggiungere una quantità sufficiente di acqua di grado molecolare a ciascuna miscela di DNA/RNasi fino a un volume finale di 100 μl.
NOTA: La RNasi qui elencata è consigliata poiché digerisce l'RNA contaminante senza influire negativamente sul DNA bersaglio o sui saggi PCR a valle. - Seguire il protocollo del produttore per la pulizia del DNA genomico (vedere la tabella dei materiali).
- Aggiungere 10 μl del primo tampone del kit di estrazione del DNA e 250 μl del secondo tampone del kit di estrazione del DNA. Miscelare a impulsi per 10 s.
- Trasferire i campioni nella colonna di estrazione del DNA in una provetta di raccolta da 2 mL senza bagnare il bordo. Centrifugare a 6.000 × g per 1 min.
- Dopo aver posizionato la colonna in una provetta di raccolta da 2 mL pulita, gettare la provetta di raccolta contenente il flusso. Aggiungere 500 μl del secondo tampone del kit di estrazione del DNA alla colonna senza bagnare il bordo. Centrifugare a 6.000 × g per 1 min.
- Collocare la colonna in una provetta di raccolta pulita da 2 mL ed eliminare la provetta di raccolta contenente il flusso continuo. Centrifugare a 20.000 × g per 6 min.
- Posizionare la colonna in una provetta da microcentrifuga pulita da 1,7 mL ed eliminare la provetta di raccolta contenente il flusso. Aggiungere 20 μl di acqua di grado molecolare al centro della membrana della colonna per l'eluizione, chiudere il coperchio e incubare i campioni con acqua di grado molecolare a temperatura ambiente per 5 minuti.
- Centrifugare a 20.000 × g per 1 min. Conservare a 4 °C per la conservazione a breve termine o a -20 °C per la conservazione a lungo termine.
- Confermare l'assenza di contaminazione da RNA nel campione digerito con RNasi con PCR o dPCR o PCR quantitativa (qPCR) utilizzando una coppia di primer PCR che amplificherebbe una regione di mRNA che si estende su più esoni e non solo su un singolo esone.
NOTA: Il bersaglio dell'mRNA deve essere di un gene altamente espresso nel tipo di tessuto/cellula bersaglio per garantire che la contaminazione da mRNA venga identificata correttamente, se presente. Gli ampliconi che si estendono su più esoni differenziano tra bande derivanti dalla contaminazione dell'mRNA rispetto al DNA genomico. Avere sempre un campione di DNA digerito non RNasi come controllo positivo per la reazione PCR per garantire che la contaminazione da mRNA venga rilevata se presente.
- In una provetta per PCR da 0,2 mL o in una provetta per microcentrifuga da 1,7 mL, aggiungere al massimo 20 μl del campione di DNA estratto e 1,5 μl di RNasi priva di DNasi a ciascun campione di DNA. Se il volume della miscela DNA/RNasi è inferiore a 21,5 μl, aggiungere una quantità sufficiente di acqua di grado molecolare fino a un volume finale di 21,5 μl e miscelare 25x capovolgendo le provette. Incubare a 37 °C per 30 minuti mescolando periodicamente ogni 10 minuti capovolgendo le provette.
- PCR digitale (dPCR)
- End-point PCR per verificare la specificità dei primer e le condizioni ottimali della PCR (opzionale)
- Progettare coppie di primer e sonde dPCR per il genoma del vettore e coppie di primer e sonde dPCR per il gene di riferimento del topo che verranno utilizzate per quantificare i genomi diploidi nel campione.
NOTA: Puntare a una dimensione dell'amplicone compresa tra 60 bp e 150 bp. Il gene di riferimento del topo dovrebbe essere un gene che ha un numero costante di copie geniche per genoma diploide. Per i calcoli qui elencati, il gene di riferimento (Polr2a) ha due copie per genoma diploide. - Per la reazione PCR con endpoint da 10 μl, preparare la miscela PCR utilizzando i reagenti e le concentrazioni finali da utilizzare successivamente per la reazione dPCR. Aggiungere il campione di DNA stampo digerito con RNasi (la quantità di acidi nucleici varia da 56 a 223 ng) a una concentrazione finale di 1x master mix dPCR che contiene la DNA polimerasi e i dNTP, 0,8 μM di ciascun primer diretto, 0,8 μM di ciascun primer inverso, 0,4 μM di ciascuna sonda e 0,025 U/μL di enzima di restrizione (la concentrazione finale dell'enzima di restrizione dipende dall'enzima di restrizione e dalla marca utilizzata). Aggiungere acqua di grado molecolare per raggiungere un volume finale di 10 μl.
NOTA: Dovrebbero esserci almeno due coppie di primer e due sonde nella miscela PCR: una coppia di primer e una sonda per rilevare il genoma del vettore e una coppia di primer e una sonda per rilevare il genoma del topo. - Condizioni dei cicli termici della PCR: Fase iniziale di attivazione del calore a 95 °C per 2 minuti, seguita da 35-45 cicli di una fase di denaturazione a 95 °C per 25 s e una fase combinata di ricottura/estensione a 58-62 °C per 1 minuto.
NOTA: La temperatura di ricottura ottimale deve essere determinata per ogni coppia di amplicone e innesco. Il numero di cicli può essere regolato in base alla quantità di DNA stampo nel campione. - Visualizzare il prodotto della PCR su un gel di agarosio utilizzando l'elettroforesi su gel per determinare la presenza delle bande di ampliconi target e di eventuali bande di amplificazione non specifiche.
- Procedere alla fase successiva della dPCR dopo aver confermato che le coppie di primer e le condizioni cicliche determinano un'amplificazione specifica delle sequenze target.
- Progettare coppie di primer e sonde dPCR per il genoma del vettore e coppie di primer e sonde dPCR per il gene di riferimento del topo che verranno utilizzate per quantificare i genomi diploidi nel campione.
- Reazione dPCR
- Per una reazione di dPCR da 40 μl, aggiungere fino a 4 μl del campione di DNA stampo digerito con RNasi (la quantità di acidi nucleici varia da 50 a 330 ng) a una concentrazione finale di 1x miscela master per dPCR che contiene la DNA polimerasi e i dNTP, 0,8 μM di ciascun primer diretto, 0,8 μM di ciascun primer inverso, 0,4 μM di ciascuna sonda, e 0,025 U/μL di enzima di restrizione (la concentrazione finale dell'enzima di restrizione dipende dall'enzima di restrizione e dalla marca utilizzata). Aggiungere acqua di grado molecolare per raggiungere un volume finale di 40 μl.
- Condizioni dei cicli termici dPCR: Fase iniziale di attivazione del calore a 95 °C per 2 minuti, seguita da 40-50 cicli di una fase di denaturazione a 95 °C per 25 s e una fase combinata di ricottura/estensione a 58-62 °C per 1 minuto.
NOTA: La temperatura di ricottura ottimale deve essere determinata per ogni coppia di amplicone e innesco. Il numero di cicli può essere regolato in base alla quantità di DNA stampo nel campione. I volumi, le concentrazioni e le condizioni qui elencate sono ottimizzati per le piastre per dPCR, i reagenti e i dispositivi elencati nella Tabella dei materiali. Queste condizioni riducono l'effetto di eventuali potenziali inibitori della dPCR che possono ridurre l'accuratezza della reazione. - Dopo aver eseguito la reazione di dPCR e ottenuto i valori assoluti per i genomi vettori e il gene di riferimento del topo, calcolare vg/dg nel campione utilizzando le equazioni (7-8).
Per i geni di riferimento con due copie del gene/genoma diploide:
Valore assoluto dei genomi diploidi (dg) =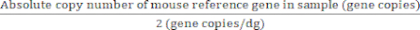 (7)
(7)
vg/dg =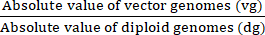 (8)
(8) - Controllare il grafico a dispersione 1D della reazione dPCR per confermare la validità del test e della quantificazione (Figura 3A, C). Affinché il test sia valido, verificare che il grafico a dispersione 1D soddisfi tutti i seguenti criteri: la presenza di partizioni positive e negative; una chiara separazione tra le partizioni positive e negative per consentire un'accurata determinazione della soglia; e la presenza di poche goccioline tra le partizioni positive e negative (nota anche come pioggia), che può ridurre l'accuratezza della quantificazione della dPCR.
- End-point PCR per verificare la specificità dei primer e le condizioni ottimali della PCR (opzionale)
Risultati Rappresentativi
Topi maschi di età compresa tra sette e nove settimane sono stati iniettati con AAV tramite iniezione laterale della vena di coda a 1,5 × 1012 vg/topo erogati in 150-200 μL di volume iniettato. L'ssDNA AAV utilizzato qui ha fornito il transgene Cre ricombinasi guidato dal promotore del CMV. I topi iniettati erano omozigoti per l'allele Cre reporter Ai14. Quando esposte alla Cre ricombinasi, le cellule contenenti l'allele Ai14 esprimono la proteina fluorescente tdTomato. Poiché l'espressione di tdTomato è causata dalla ricombinazione genomica indotta da Cre, le cellule che esprimono tdTomato indicano cellule che sono state trasdotte direttamente dall'AAV o erano cellule progenie di cellule trasdotte. I dati qui riportati sono di topi iniettati con AAV9-CMV-Cre a 1,5 × 1012 vg/topo somministrati in 160 μl (5,8-5,9 × 1013 vg/kg). I topi sono stati sacrificati 28 giorni dopo l'iniezione e i tessuti sono stati raccolti come descritto sopra. Alcuni muscoli scheletrici e lobi del fegato sono stati digeriti e le loro cellule sono state raccolte utilizzando FACS. Alcuni lobi del fegato sono stati congelati immediatamente utilizzando metilbutano prerefrigerato per l'estrazione dell'acido nucleico. Alcuni muscoli scheletrici e lobi epatici sono stati fissati e congelati per l'imaging istologico del tdTomato fluorescente. tdTomato è stato espresso diffusamente in tutto il fegato (Figura 2A) e nel quadricipite (Figura 2C), indicando che AAV9 ha ampiamente raggiunto e trasdotto diverse regioni di entrambi i tessuti.
Il DNA estratto da fegato fresco congelato e cellule selezionate con FACS è stato utilizzato per quantificare vg/dg utilizzando la dPCR. La quantificazione Vg/dg può essere utilizzata per valutare la consistenza dell'iniezione e l'efficienza di trasduzione di AAV nel campione analizzato. Per garantire la validità del test sono stati utilizzati i grafici a dispersione di gocce 1D dal campione di tessuto epatico fresco congelato e le cellule selezionate da FACS (Figura 3A, C). Il grafico a dispersione ha mostrato la presenza di partizioni positive e negative, una chiara separazione tra le partizioni positive e negative che consente una determinazione accurata della soglia di rilevamento e la presenza di poche goccioline tra le partizioni positive e negative, che possono ridurre l'accuratezza del test dPCR. Il soddisfacimento di tutti questi criteri ha indicato che i risultati del test dPCR erano validi. Il numero di copie del gene Polr2a in ciascun campione è stato quantificato per determinare il numero di genomi diploidi di topo (2 copie del gene Polr2a /genoma diploide di topo) e sono stati utilizzati primer/sonda contro la sequenza del transgene Cre ricombinasi per quantificare il genoma virale (1 copia del transgene/genoma virale, Tabella 1). Il valore vg/dg è stato quantificato per il campione di tessuto epatico fresco congelato e per le cellule selezionate con FACS e ha mostrato la presenza di 187,7 vg/dg e 4,7 vg/dg in ciascun campione, rispettivamente (Figura 3B, D). Come controlli negativi sono stati utilizzati campioni di topi iniettati con PBS e controlli non modello privi di acidi nucleici.

Figura 1: Panoramica della stazione di iniezione endovenosa. (A) Strumenti necessari per eseguire l'iniezione endovenosa. Qui sono mostrati (1) il timer, (2) il sistema di ritenuta del tubo del topo, (3) i coni di contenimento in plastica non tagliati e (4) tagliati, (5) il tampone imbevuto di alcol, (6) la scatola vuota dei puntali delle pipette utilizzata come piattaforma per sollevare il sistema di contenimento del tubo del topo, (7) i tamponi assorbenti monouso, (8) la provetta conica da 15 ml con acqua calda, (9) il supporto della provetta da 15 ml, (10) la garza e (11) la siringa da insulina. (B) Il topo viene prima posizionato all'interno del fermatubi. Quindi, il cono di contenimento tagliato viene inserito per creare un manicotto di contenimento attorno al mouse, se il mouse è troppo piccolo per essere trattenuto solo dal fermatore del tubo. Assicurarsi che la respirazione del mouse non sia ostruita dai sistemi di ritenuta. Il sistema di ritenuta del tubo è posizionato sulla parte superiore della piattaforma rialzata per consentire il posizionamento della coda del topo in acqua calda. (C) Posizionamento della coda del mouse e angolo di tenuta dell'ago immediatamente prima di eseguire l'iniezione. Tira indietro la coda in modo che la coda sia tesa e il sito di iniezione sia completamente orizzontale. L'ago è parallelo alla coda e alla vena e lo smusso è rivolto verso l'alto. Clicca qui per visualizzare una versione più grande di questa figura.
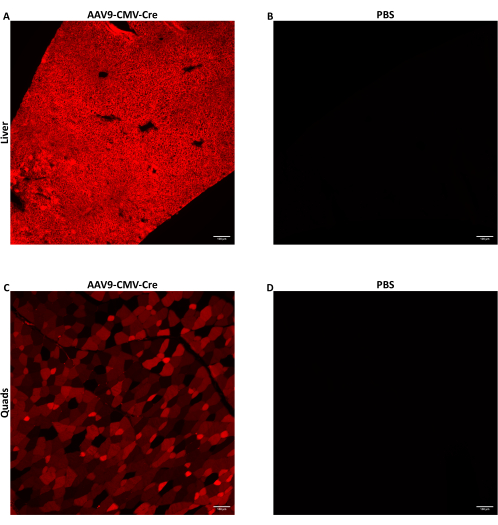
Figura 2: Rilevamento della proteina reporter fluorescente dopo l'iniezione IV. Topi maschi di età compresa tra sette e nove settimane che ospitavano l'allele Cre reporter Ai14 sono stati iniettati per via endovenosa con AAV9-CMV-Cre a 1,5 × 1012 vg/topo somministrati in 160 μl (5,8-5,9 × 10,13 vg/kg) o PBS. Immagini di fluorescenza rappresentative di sezioni di fegato o quadricipite (C) di topo dopo AAV9 che eroga l'iniezione di Cre IV. (B) Le sezioni del fegato o (D) del quadricipite di topi iniettati con PBS sono state sottoposte a imaging per fungere da controlli negativi. I tessuti sono stati raccolti e fissati congelati 28 giorni dopo l'iniezione endovenosa. Dopo l'esposizione a Cre, la proteina fluorescente tdTomato è espressa nelle cellule trasdotte e nelle cellule progenie delle cellule trasdotte. Le sezioni spesse 10 μm sono state riprodotte con un ingrandimento 10x. Barre di scala = 100 μm. Clicca qui per visualizzare una versione più grande di questa figura.
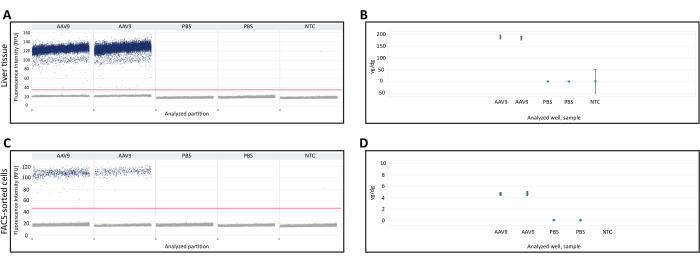
Figura 3: Quantificazione del genoma vettoriale per genoma diploide (vg/dg). Grafico a dispersione 1D della quantificazione dei genomi dei vettori dPCR in (A) tessuto epatico o (C) cellule selezionate FACS raccolte da topi iniettati con AAV9-CMV-Cre o PBS. I grafici a dispersione mostrano le partizioni dPCR positive e negative, nonché la soglia di rilevamento indicata dalla linea orizzontale che attraversa i campioni. Quantificazione (B,D) vg/dg dopo aver quantificato i genomi diploidi di topo e i genomi vettori in (B) tessuto epatico o (D) campioni di cellule selezionate FACS. I risultati mostrati qui provengono da un singolo topo iniettato con AAV9 e da un singolo topo iniettato con PBS con un duplicato tecnico di dPCR per ciascun topo. Le barre di errore indicano l'intervallo di confidenza del 95% per ogni campione. Abbreviazioni: NTC= Controllo non modello; dPCR = PCR digitale; FACS = smistamento cellulare attivato dalla fluorescenza. Clicca qui per visualizzare una versione più grande di questa figura.
| Abbecedario | Sequenza |
| Primer Cre forward | CTGACGGTGGGAATGTTAAT |
| Primer inverso Cre | CATCGCTCGACCAGTTTAGTT |
| Sonda Cre | /56-FAM/CGCAGGTGT/ZEN/AGAGAAGGCACTTAGC/3IABkFQ/ |
| Primer in avanti Polr2a | GACTCCTTCACTCACTGTCTTC |
| Primer inverso Polr2a | TCTTGCTAGGCAGTCCATTATC |
| Sonda Polr2a | /5HEX/ACGAGATGC/ZEN/TGAAAGAGCCAAGGT/3IABkFQ/ |
Tabella 1: Sequenze di primer e sonde utilizzate per la quantificazione vg/dg. I primer e la sonda Cre sono stati utilizzati per quantificare il genoma del vettore. I primer e la sonda Polr2a sono stati utilizzati per quantificare il genoma diploide del topo.
Discussione
Le terapie a base di AAV hanno un grande potenziale per le malattie monogeniche grazie alla versatilità dell'AAV come vettore di terapia genica, che consente di personalizzare gli AAV per soddisfare le varie esigenze di somministrazione di diverse malattie 4,5,7,9. Gli AAV sono comunemente somministrati tramite iniezione endovenosa in modelli murini preclinici per testare la sicurezza e l'efficacia di potenziali terapie16. Poiché diverse dosi iniettate di AAV possono comportare marcate differenze nei risultati sperimentali, è fondamentale che gli sperimentatori siano in grado di iniettare costantemente la dose di AAV prevista per garantire la validità e la robustezza dei dati in vivo generati 28. Le iniezioni endovenose sono ampiamente utilizzate, ma sono tecnicamente impegnative e richiedono una formazione approfondita e una pratica continua per sviluppare e mantenere un livello di abilità che garantisca iniezioni costantemente efficaci 16,17,18,19. Oltre a iniettare correttamente l'AAV, di solito si desidera utilizzare saggi per valutare la biodistribuzione dell'AAV iniettato e l'efficienza di consegna ai tessuti o alle cellule bersaglio29,30.
Questo protocollo mira ad aiutare gli sperimentatori a eseguire facilmente iniezioni endovenose con successo e in modo coerente, descrivendo accuratamente i dettagli di un protocollo di iniezione endovenosa ottimizzato per somministrare AAV in topi di 7-9 settimane non sedati. È importante notare che i topi che sono marcatamente più piccoli o più grandi dei topi di tipo selvatico nella fascia di età qui utilizzata possono presentare una sfida maggiore a causa di una ridotta visibilità delle vene o dell'incompatibilità con i sistemi di contenzione utilizzati in questo metodo. È stato precedentemente riportato che le iniezioni endovenose della coda non sono appropriate per la somministrazione di reagenti per via endovenosa in topi di età inferiore alle 6 settimane a causa delle piccole dimensioni del vaso31. Sebbene possibile, potrebbe essere difficile iniettare costantemente topi di peso inferiore a 22,0 g. con successo. Gli investigatori che utilizzano topi di dimensioni atipiche potrebbero dover apportare adattamenti alla procedura. Questo protocollo delinea anche diversi saggi che possono essere utilizzati per valutare la biodistribuzione e l'efficienza di trasduzione dell'AAV.
Alcuni punti critici devono essere tenuti a mente mentre si segue questo protocollo. Durante l'iniezione, gli aghi da 29 G forniscono una maggiore resistenza se l'ago non si trova all'interno della vena. Ciò riduce il volume perso dall'iniezione perivascolare accidentale della soluzione durante i tentativi di iniezione falliti. Le siringhe da insulina hanno volumi morti inferiori rispetto alle siringhe normali. Se si utilizza una siringa e/o un ago diversi da quelli elencati qui, potrebbe essere necessario preparare un volume di iniezione aggiuntivo nelle fasi del protocollo 1.1.3.3 per tenere conto di un volume di spazio morto maggiore (ad esempio, aggiungere 30 μl alla dose prevista invece di 15 μl).
Se durante l'aspirazione della dose di AAV nella siringa si formano bolle d'aria fini causate dall'aspirazione, tirare lentamente l'iniettato più in alto nella siringa. Questo rimuoverà la maggior parte delle piccole bolle d'aria. Caricare almeno altri 10-15 μl di AAV al volume previsto per l'iniezione. Questo volume aggiuntivo serve a tenere conto di qualsiasi volume che potrebbe essere perso durante l'espulsione di bolle d'aria o potenziali tentativi di iniezione falliti. (ad esempio, se il volume target da iniettare è 150 μL, caricare 165 μL nella siringa (a metà strada tra i segni 160 μL e 170 μL sulla scala graduatoria). Se l'ago è posizionato correttamente all'interno della vena e il volume nella siringa è di 165 μL immediatamente prima del tentativo di iniezione riuscito, erogare il reagente fino a quando non rimangono 15 μL nella siringa (a metà strada tra i segni di 10 μL e 20 μL), erogando così 150 μL (165 μL - 150 μL= 15 μL)). L'allineamento del lume smussato (smusso rivolto verso l'alto) con la scala della siringa consente di tracciare il volume erogato durante l'iniezione.
Alcuni sperimentatori potrebbero preferire posizionare il topo su un fianco in modo che una delle sue vene sia dritta e facilmente accessibile rispetto a un topo in piedi. Tuttavia, la coda di un topo su un lato sarà inclinata ad angoli diversi a seconda delle dimensioni del mouse che richiedono una regolazione dell'angolo di iniezione quando si iniettano topi di dimensioni diverse. Ciò potrebbe influire negativamente sulla coerenza del successo della procedura. Durante i tentativi di pratica iniziali, gli sperimentatori possono provare entrambi gli orientamenti di restrizione del mouse per determinare il loro approccio preferito. Avere il mouse sui piedi consente un accesso rapido e facile a entrambe le vene laterali della coda. Ciò riduce il tempo di trattenuta quando è necessario l'accesso a entrambe le vene in caso di più tentativi di iniezione falliti.
Se si inietta la vena laterale vicino alla base della coda (più vicino al corpo del topo) (soprattutto per i topi di peso >30 g), regolare l'angolo di iniezione da parallelo alla vena a 5°-10° rispetto alla vena poiché la vena alla base della coda è leggermente più profonda di quanto non lo sia distalmente.
I protocolli di digestione dell'RNasi e di controllo della contaminazione da RNA qui elencati sono stati verificati su campioni di DNA isolati da tessuti epatici freschi congelati contenenti un totale di 175-700 ng di acidi nucleici in 20 μL. Il protocollo di digestione della RNasi è stato testato anche su campioni di DNA isolati da tessuti epatici freschi congelati e cellule selezionate con FACS per confermare la presenza del genoma del vettore e del genoma del topo dopo la digestione della RNasi. I risultati sono stati visualizzati utilizzando l'elettroforesi su gel di agarosio dell'amplificazione PCR dell'endpoint degli ampliconi bersaglio.
Seguire la metodologia descritta può ridurre il tempo di formazione e pratica necessario per padroneggiare le iniezioni endovenose e portare a una maggiore velocità di iniezione di successo, che farebbe risparmiare reagenti. Questo protocollo utilizza strumenti semplici e di uso comune senza la necessità di attrezzature o configurazioni avanzate che potrebbero non essere prontamente disponibili. Inoltre, le fasi di iniezione endovenosa qui elencate possono essere applicate a un'ampia gamma di iniettati che devono essere somministrati per via endovenosa, come gli oligonucleotidi antisenso (ASO), con le opportune modifiche apportate alle fasi di preparazione dell'iniettato a seconda dell'iniettato.
Divulgazioni
Gli autori non hanno alcuna divulgazione rilevante per il lavoro pubblicato in questo articolo.
Riconoscimenti
Gli autori desiderano ringraziare il personale della struttura per la cura degli animali NINDS per il loro supporto. Questo lavoro è stato supportato dalla Divisione di Ricerca Intramurale del NIH, NINDS (Rapporto Annuale Numero 1ZIANS003129). Il contenuto è di esclusiva responsabilità degli autori e non rappresenta necessariamente le opinioni ufficiali del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Millipore | SLGVM33RS | |
| 0.3 mL insulin syringes with 29G needle | BD Biosciences | 324702 | |
| 1.7 mL microcentrifuge tube | Crystalgen | 23-2051 | |
| 10 mL syringe | BD Biosciences | 302995 | |
| 100% EtOH | The Warner Graham Company | 201096 | |
| 10x phosphate-buffered saline (PBS) | Corning | 46-013-CM | Used to prepare 1x PBS for tissue fixation |
| 15 mL conical tube | Corning | 430766 | |
| 15 mL conical tube holder | Multiple sources | N/A | |
| 190 proof ethyl alcohol | The Warner Graham Company | 6810-01-113-7320 | Used to prepare 70% ethanol |
| 1x sterile PBS | Gibco | 10010023 | |
| 2 mL microcentrifuge tissue storage tubes | Eppendorf | 022363344 | |
| 4% paraformaldehyde (PFA) | Electron Microscopy Sciences | 157-4 | |
| Adeno-associated virus (AAV) | Charles River | N/A | Single-stranded DNA (ssDNA) AAV was packaged to deliver Cre recombinase as the transgene driven by CMV promoter |
| Alcohol swab | BD Biosciences | 326895 | |
| Bead lysis tube | Next Advance | GREENE5 | |
| BsuRI (HaeIII) restriction enzyme | Thermo Fisher Scientific | ER0151 | |
| Bullet blender | Next Advance | BBX24B | |
| Ai14-derived mice from JAX 007914 strain (genetic background: C57BL/6J) | N/A | N/A | Mice containing Ai14 Cre-reporter allele were purchased from JAX (catalog number: 007914) |
| Disposable absorbent pads | Fisherbrand | 1420662 | |
| Dissection forceps | Fine Science Tools (F.S.T) | 11251-35 | |
| Dissection scissors | Fine Science Tools (F.S.T) | 14085-08 | |
| DNA degradation reagent (DNAZap) | Invitrogen | AM9890 | |
| DNA-Extraction RNase A | Qiagen | 19101 | For RNA digestion during nucleic acid extraction |
| DNase-free RNase for DNA cleanup | F. Hoffmann-La Roche | 11119915001 | For RNA digestion after nucleic acid extraction |
| dPCR Probe PCR Kit | Qiagen | 250102 | |
| dPCR software | Qiagen | N/A | QIAcuity Software Suite |
| Elevated platform | Multiple sources | N/A | An empty pipette tips box was used to elevate the mouse restrainer during tail warming up |
| Fluorescence microscope | Multiple sources | N/A | Model used here: Nikon Eclipse Ti |
| Fluorescence microscope software | Multiple sources | N/A | Software used here: NIS-Elements |
| Gauze | Covidien | 9022 | |
| Heat block | Eppendorf | Thermomixer 5350 | |
| High-speed centrifuge | Eppendorf | 22620689 | |
| Metal container | Vollrath | 80125 | |
| Methylbutane | J.T. Baker | Q223-08 | |
| Molecular grade water | Quality Biological | 351-029-131 | |
| Mouse tube restrainer | Braintree Scientific | TV-RED-150-STD | |
| Myfuge mini centrifuge | Benchmark Scientific | C1012 | |
| Polymerase chain reaction thermal cycler | Bio-Rad Laboratories | 1851148 | Model: C1000 Touch |
| Precision wipes | Kimberly-Clark Professional | 7552 | |
| Proteinase K | Qiagen | 19131 | |
| QIAcuity dPCR Nanoplate 26k 24-well | Qiagen | 250001 | |
| QIAcuity One dPCR system | Qiagen | 911020 | |
| Qiagen DNeasy Blood & Tissue Kit | Qiagen | 69504 | Used for DNA extraction from tissues |
| Qiagen QIAamp DNA Micro Kit | Qiagen | 56304 | Used for cleanup of genomic DNA, and the isolation of DNA from small volumes of blood prtocotol was used for DNA extraction from FACS-sorted cells |
| Rodent restrainer cone | Braintree Scientific | MDC-200 | |
| Scale | Ohaus | 72212663 | |
| Styrofoam box | Multiple sources | N/A | |
| Sucrose | Sigma-Aldrich | S9378-1kg | |
| Surface cleaner and disinfectant | Peroxigard | 29101 | |
| Timer | Multiple sources | N/A | |
| Transfer forceps | Fine Science Tools (F.S.T) | 91113-10 | |
| Vortex | Daigger & Company | 22220A | Model: Daigger Vortex Genie 2 |
Riferimenti
- Tisdale, A., et al. The ideas initiative: Pilot study to assess the impact of rare diseases on patients and healthcare systems. Orphanet J Rare Dis. 16 (1), 429 (2021).
- Condo, I. Rare monogenic diseases: Molecular pathophysiology and novel therapies. Int J Mol Sci. 23 (12), 6525 (2022).
- Vaisitti, T., et al. The frequency of rare and monogenic diseases in pediatric organ transplant recipients in italy. Orphanet J Rare Dis. 16 (1), 374 (2021).
- Bulcha, J. T., Wang, Y., Ma, H., Tai, P. W. L., Gao, G. Viral vector platforms within the gene therapy landscape. Signal Transduct Target Ther. 6 (1), 53 (2021).
- Lundstrom, K. Viral vectors in gene therapy: Where do we stand in 2023. Viruses. 15 (3), 698 (2023).
- Wang, C., et al. Emerging non-viral vectors for gene delivery. J Nanobiotechnology. 21 (1), 272 (2023).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (aav) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ghosh, S., Brown, A. M., Jenkins, C., Campbell, K. Viral vector systems for gene therapy: A comprehensive literature review of progress and biosafety challenges. Appl Biosaf. 25 (1), 7-18 (2020).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 18 (5), 358-378 (2019).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized aav vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Jucker, M. The benefits and limitations of animal models for translational research in neurodegenerative diseases. Nat Med. 16 (11), 1210-1214 (2010).
- Vandamme, T. F. Use of rodents as models of human diseases. J Pharm Bioallied Sci. 6 (1), 2-9 (2014).
- Anders, H. J., Vielhauer, V. Identifying and validating novel targets with in vivo disease models: Guidelines for study design. Drug Discov Today. 12 (11-12), 446-451 (2007).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Prabhakar, S., Lule, S., Da Hora, C. C., Breakefield, X. O., Cheah, P. S. Aav9 transduction mediated by systemic delivery of vector via retro-orbital injection in newborn, neonatal and juvenile mice. Exp Anim. 70 (4), 450-458 (2021).
- Hauff, P., Nebendahl, K., Kiessling, F., Pichler, B. J., Hauff, P. Drug administration. Small Animal Imaging: Basics and Practical. , 127-152 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. J Vis Exp. (146), (2019).
- Resch, M., Neels, T., Tichy, A., Palme, R., Rulicke, T. Impact assessment of tail-vein injection in mice using a modified anaesthesia induction chamber versus a common restrainer without anaesthesia. Lab Anim. 53 (2), 190-201 (2019).
- Glascock, J. J., et al. Delivery of therapeutic agents through intracerebroventricular (icv) and intravenous (iv) injection in mice. J Vis Exp. (56), 2968 (2011).
- Grames, M. S., Jackson, K. L., Dayton, R. D., Stanford, J. A., Klein, R. L. Methods and tips for intravenous administration of adeno-associated virus to rats and evaluation of central nervous system transduction. J Vis Exp. (126), 55994 (2017).
- Yano, J., Lilly, E. A., Noverr, M. C., Fidel, P. L. A contemporary warming/restraining device for efficient tail vein injections in a murine fungal sepsis model. J Vis Exp. (165), 61961 (2020).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined use of tail vein metastasis assays and real-time in vivo imaging to quantify breast cancer metastatic colonization and burden in the lungs. J Vis Exp. (154), 60687 (2019).
- JoVE Science Education Database. . Lab Animal Research. Compound administration I. , (2023).
- UCSF Office of Research, Institutional Animal Care and Use Program. Lateral tail vein injection in mice and rats (preferred technique for vascular access in mice Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/STD%20PROCEDURE%20-%20Misc%20Rodent%20Procedures%20-%20Lateral%20Tail%20Vein%20Injection%20in%20Mice%20and%20Rats.pdf (2023)
- Jones, K. Tail vein injections in the mouse and rat sop. UBC Animal Care Guidelines SOP: ACC-2012-Tech03. , (2012).
- Liadaki, K., Luth, E. S., Kunkell, L. M. Co-detection of gfp and dystrophin in skeletal muscle tissue sections. Biotechniques. 42 (6), 699-700 (2007).
- Burr, A., et al. Allometric-like scaling of aav gene therapy for systemic protein delivery. Mol Ther Methods Clin Dev. 27, 368-379 (2022).
- Lang, J. F., Toulmin, S. A., Brida, K. L., Eisenlohr, L. C., Davidson, B. L. Standard screening methods underreport aav-mediated transduction and gene editing. Nat Commun. 10 (1), 3415 (2019).
- Rodriguez-Estevez, L., Asokan, P., Borras, T. Transduction optimization of aav vectors for human gene therapy of glaucoma and their reversed cell entry characteristics. Gene Ther. 27 (3-4), 127-142 (2020).
- Hatakeyama, S., Yamamoto, H., Ohyama, C. Tumor formation assays. Methods Enzymol. 479, 397-411 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon