È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Fabbricazione e caratterizzazione di cerotti con microaghi per il caricamento e la somministrazione di esosomi
In questo articolo
Riepilogo
Gli esosomi possiedono un potenziale clinico significativo, ma la loro applicazione pratica è limitata a causa della facile clearance in vivo e della scarsa stabilità. I microaghi presentano una soluzione che consente la somministrazione localizzata perforando le barriere fisiologiche e la conservazione dello stato secco, affrontando così i limiti della somministrazione di esosomi e ampliando la loro utilità clinica.
Abstract
Gli esosomi, in quanto vettori emergenti di bioterapia e somministrazione di farmaci di "nuova generazione", hanno un immenso potenziale in diversi campi biomedici, che vanno dalla somministrazione di farmaci e dalla medicina rigenerativa alla diagnosi delle malattie e all'immunoterapia tumorale. Tuttavia, la rapida eliminazione mediante iniezione in bolo tradizionale e la scarsa stabilità degli esosomi ne limitano l'applicazione clinica. I microaghi fungono da soluzione che prolunga il tempo di permanenza degli esosomi nel sito di somministrazione, mantenendo così la concentrazione del farmaco e facilitando gli effetti terapeutici sostenuti. Inoltre, i microaghi possiedono anche la capacità di mantenere la stabilità delle sostanze bioattive. Pertanto, introduciamo un cerotto con microaghi per il caricamento e la somministrazione di esosomi e condividiamo i metodi, tra cui l'isolamento degli esosomi, la fabbricazione e la caratterizzazione di cerotti con microaghi caricati con esosomi. I cerotti con microaghi sono stati fabbricati utilizzando trealosio e acido ialuronico come materiali della punta e polivinilpirrolidone come materiale di supporto attraverso un metodo di fusione in due fasi. I microaghi hanno dimostrato una robusta resistenza meccanica, con punte in grado di resistere a 2 N. La pelle di maiale è stata utilizzata per simulare la pelle umana e le punte dei microaghi si sono completamente sciolte entro 60 secondi dopo la puntura della pelle. Gli esosomi rilasciati dai microaghi mostravano morfologia, dimensione delle particelle, proteine marcatrici e funzioni biologiche paragonabili a quelle degli esosomi freschi, consentendo l'assorbimento delle cellule dendritiche e promuovendone la maturazione.
Introduzione
Gli esosomi, che sono piccole vescicole rilasciate dalle cellule nella matrice extracellulare, sono stati proposti come potenziali vettori bioterapici e di somministrazione di farmaci per il trattamento di diverse malattie e tumori1. Durante il loro processo di biogenesi, gli esosomi incapsulano varie molecole biologicamente attive dall'interno delle cellule, comprese le proteine funzionali e gli acidi nucleici2. Di conseguenza, quando vengono assorbiti dalle cellule riceventi durante il processo di trasporto, gli esosomi hanno la capacità di modulare l'espressione genica e le funzioni cellulari nelle cellule bersaglio3. Come una sorta di messaggero naturale di informazioni, gli esosomi sono stati pienamente sfruttati nella rigenerazione dei tessuti, nella regolazione immunitaria e come vettore di consegna4. Attraverso tecniche ingegneristiche, ligandi specifici possono essere arricchiti sulla superficie degli esosomi, consentendo l'induzione o l'inibizione di eventi di segnalazione nelle cellule riceventi o mirando a specifici tipi di cellule5. Gli agenti chemioterapici possono anche essere caricati negli esosomi per il trattamento del cancro6. Inoltre, gli esosomi hanno la capacità di attraversare la barriera emato-encefalica per la consegna terapeutica del carico, il che li rende molto promettenti per il trattamento dei disturbi cerebrali7. Rispetto ai liposomi, gli esosomi mostrano un maggiore assorbimento cellulare e una migliore biocompatibilità8. Sono in grado di entrare in modo efficiente in altre cellule, dimostrando una migliore tolleranza e una minore tossicità9. Tuttavia, l'iniezione tradizionale in bolo di esosomi è soggetta a sequestro e rapida eliminazione da parte del fegato, dei reni e della milza nel flusso sanguigno10. Inoltre, gli esosomi hanno una scarsa stabilità in vitro e sono suscettibili alle condizioni di conservazione, che limitano le loro applicazioni cliniche11.
I microaghi, una serie di punte di aghi di dimensioni micrometriche, hanno la capacità di penetrare le barriere fisiologiche per la somministrazione di farmaci a piccole molecole12, proteine13, acidi nucleici14 e nanofarmaci15. I microaghi sono progettati con precisione per colpire le lesioni sulla superficie della pelle e le loro punte disperse garantiscono una distribuzione uniforme del farmaco nel sito bersaglio, amplificando così il loro impatto terapeutico16. Il design e la composizione dei materiali dei microaghi facilitano la conservazione a secco di sostanze bioattive come proteine e acidi nucleici, migliorandone la stabilità17. I metodi di iniezione tradizionali hanno una durata d'azione relativamente breve e possono causare dolore, inducendo paura nei pazienti18. La lunghezza micrometrica del microago riduce al minimo il trauma tissutale e previene la stimolazione nervosa, eliminando così il dolore e migliorando la compliance del paziente19. Inoltre, la facilità d'uso dei microaghi consente ai pazienti di autosomministrare il trattamento senza la necessità di personale specializzato16. Oltre che nella pelle, i microaghi possono essere utilizzati anche in tessuti come gli occhi20, la mucosa orale21, il cuore22 e i vasi sanguigni23. L'applicazione di microaghi per la somministrazione clinica di esosomi fornisce una strategia promettente e prospettica.
Pertanto, introduciamo un cerotto con microaghi (exo@MN) caricati con esosomi e ne riveliamo il metodo di fabbricazione. I cerotti con microaghi sono stati fabbricati utilizzando un metodo di fusione in due fasi, insieme alla centrifugazione e all'essiccazione sotto vuoto, che promuove l'aggregazione degli esosomi sulle punte dei microaghi, migliorando così l'efficienza della consegna. Sia le punte dell'ago che il supporto sono stati costruiti utilizzando materiali che presentano un'eccellente biocompatibilità e solubilità in acqua. Il trealosio e l'acido ialuronico (HA) sono stati incorporati come materiali di punta per fornire protezione agli esosomi e il polivinilpirrolidone (PVP) disciolto in etanolo assoluto è stato scelto come materiale di supporto. La morfologia del cerotto con microaghi è stata caratterizzata utilizzando la microscopia e il microscopio elettronico a scansione (SEM). Il test meccanico del microago è stato valutato utilizzando un misuratore di trazione per confermare la loro capacità di penetrare nella pelle e il tasso di rilascio sulla pelle di maiale è stato studiato per essere di 60 s. Inoltre, la morfologia, le dimensioni e il contenuto proteico sia degli esosomi freschi che degli esosomi in exo@MN sono stati caratterizzati utilizzando il microscopio elettronico a trasmissione (TEM), l'analisi del tracciamento delle nanoparticelle (NTA) e il western blotting (WB). L'internalizzazione degli esosomi da parte delle cellule dendritiche (DC) è stata caratterizzata utilizzando il microscopio confocale a scansione laser (CLSM) e la maturazione delle DC è stata valutata attraverso la citometria a flusso. La caratterizzazione morfologica e le funzioni biologiche dei due tipi di esosomi sono sostanzialmente coerenti.
Protocollo
Questo studio non richiede l'autorizzazione etica in quanto la pelle di maiale utilizzata per gli esperimenti descritti nella sezione 3 è stata acquistata come orecchie di maiale commestibili dal mercato e non proviene da animali da esperimento.
1. Isolamento degli esosomi
- Coltura cellulare
- Coltivare cellule di cancro epiteliale ovarico di topo ID8 nel terreno di coltura DMEM (Modified Eagle Medium) di Dulbecco contenente il 10% di siero fetale bovino e l'1% di soluzione di penicillina-streptomicina (100×) (vedi Tabella dei materiali) in piastre di Petri con un diametro di 15 cm.
- Incubare le cellule ID8 in un incubatore di CO2 (vedi Tabella dei materiali) a 37 °C e 5% di CO2 fino a quando la densità cellulare raggiunge il 90%.
- Isolamento degli esosomi
- Rimuovere il terreno di coltura dalle piastre di Petri e lavare due volte con soluzione salina tamponata con fosfato di Dulbecco (DPBS). Aggiungere 20 mL di DMEM senza siero fetale bovino (vedere Tabella dei materiali) e soluzione di penicillina-streptomicina (vedere Tabella dei materiali). Continuare l'incubazione a 37 °C e 5% CO2 per 48 ore.
- Raccogliere il surnatante di coltura cellulare da 20 piastre di Petri di 15 cm di diametro. Centrifugare a 300 x g per 10 minuti a 4 °C e raccogliere il surnatante per la rimozione delle cellule libere.
- Centrifugare a 2000 x g per 10 min 4 °C e raccogliere il surnatante per la rimozione dei detriti cellulari.
- Collegare il sistema di filtrazione sottovuoto monouso da 0,22 μm (vedere la tabella dei materiali) alla pompa del vuoto di circolazione dell'acqua (vedere la tabella dei materiali). Creare un vuoto per consentire al surnatante di passare attraverso la membrana di polietere solfone da 0,22 μm ed entrare nella camera inferiore del sistema di filtrazione, rimuovendo efficacemente vescicole o impurità di dimensioni superiori a 0,22 μm dal surnatante.
- Per collegare la pompa del vuoto, accendere l'interruttore della pompa e quindi collegarlo alla presa d'aria del sistema di filtrazione del vuoto. Alla chiusura, scollegare prima il collegamento con la pompa e poi spegnere la pompa del vuoto. Questa procedura aiuta a prevenire il riflusso della pompa a vuoto e la contaminazione del fluido di coltura.
- Aggiungere 15 mL di surnatante alla provetta della provetta per ultrafiltrazione da 100 kDa (vedere la Tabella dei materiali). Centrifugare a 3500 x g per 10 min a 4 °C e rimuovere il liquido dalla provetta esterna.
NOTA: Trattenere le particelle più grandi di 100 kDa sulla membrana del tubo interno, mentre le proteine più piccole di 100 kDa verranno centrifugate nel tubo esterno insieme alla soluzione. Gli esosomi erano più grandi di 100 kDa e sono stati aggregati sulla membrana del tubo interno. - Ripetere i passaggi precedenti fino a quando il volume totale del liquido non è entro 5 ml. Raccogliere il liquido dalla camera d'aria e aggiungere 1 mL di DPBS. Utilizzare una pipetta per pipettare ripetutamente nella camera d'aria, assicurando la risospensione degli esosomi attaccati in DPBS, quindi raccoglierli.
- Centrifugare a 10000 x g per 60 minuti a 4 °C e trasferire il surnatante in una provetta da centrifuga a scatto rapido da 6 mL (vedere la Tabella dei materiali). Sigillare il tubo con una termosigillatrice.
- Centrifugare a 100.000 x g per 2 h 4 °C utilizzando un'ultracentrifuga (vedi Tabella dei materiali). Aprire la provetta da centrifuga a scatto rapido, rimuovere il surnatante e risospendere il pellet in 100 μl di DPBS. Questa è la soluzione dell'esosoma.
NOTA: Durante il processo di risospensione del pellet, è necessario pipettare e agitare la parete del tubo almeno 200 volte utilizzando una pipetta.
2. Fabbricazione di exo@MN
- Preparazione dello stampo master
- Costruisci un modello di microaghi con un array 10 x 10 utilizzando un software CAD, con punte di forma conica con i seguenti parametri: un'altezza di 1200 μm, un diametro di base di 400 μm e un passo (distanza tra microaghi adiacenti) di 900 μm.
- Utilizzare la resina HTL come materiale e stampare lo stampo master del microago utilizzando una stampante 3D (vedi Tabella dei materiali).
- Immergere lo stampo master in etanolo assoluto per 1 ora per rimuovere l'eventuale resina aderente alla superficie.
- Esporre lo stampo alla luce ultravioletta per 5 minuti per indurirlo.
- Immergere nuovamente lo stampo in etanolo assoluto per 1 ora, quindi asciugarlo a 60 °C in un forno di essiccazione per 1 ora. Lo stampo master è pronto.
- Preparazione dello stampo di produzione
- Miscelare i componenti A e B del polidimetilsilossano (PDMS, vedi Tabella dei materiali) in un rapporto di 10:1. Mescolate bene e versate il composto in uno stampo master.
- Posizionare lo stampo PDMS sotto una pressione di 1 psi per 15 minuti per rimuovere le bolle d'aria dalla miscela PDMS.
- Polimerizzare lo stampo PDMS a 60 °C per 2 ore e poi sformare per ottenere lo stampo di produzione del microago.
- Pulire lo stampo di produzione con acqua ultrapura prima dell'uso.
- Preparazione della soluzione
- Quantificare il contenuto proteico della soluzione di esosoma utilizzando un kit per il dosaggio dei BCA (vedere la Tabella dei materiali). Aggiungere una quantità appropriata di DPBS per ottenere una concentrazione di 10 μg/μL per la soluzione di esosoma.
- Preparare una soluzione di 200 mg/mL di trealosio (vedere la Tabella dei materiali) utilizzando il DPBS come solvente. Mescolare per 20 minuti per garantire la completa dissoluzione.
- Preparare una soluzione di 200 mg/mL di acido ialuronico (HA, vedi Tabella dei materiali) utilizzando DPBS come solvente. Mescolare per una notte per garantire la completa dissoluzione.
- Preparare una soluzione di 150 mg/mL di polivinilpirrolidone (PVP, vedere la Tabella dei materiali) utilizzando etanolo assoluto come solvente. Mescolare per una notte per garantire la completa dissoluzione.
- Miscelare la soluzione di esosoma (10 μg/μL) e la soluzione di trealosio (200 mg/mL) in un rapporto di volume 1:1. Quindi, aggiungere un volume uguale di soluzione di HA (200 mg/mL). Mescolare accuratamente per ottenere la soluzione della punta.
- Fabbricazione di exo@MN
- Elaborare la superficie dello stampo PDMS utilizzando un pulitore al plasma (vedi Tabella dei materiali) per 30 s a un grado basso per migliorarne l'idrofilia.
- Aggiungere 40 μl della soluzione del puntale allo stampo PDMS. Centrifugare a temperatura ambiente (RT) e 3000 x g per 3 minuti per assicurarsi che il liquido riempia lo strato dell'ago dello stampo.
- Rimuovere il liquido in eccesso nello stampo e asciugare a RT in un forno di essiccazione sottovuoto (vedi Tabella dei materiali) per 1 giorno.
- Aggiungere 200 μl di soluzione PVP allo stampo PDMS. Centrifugare 3000 x g per 3 minuti a RT per assicurarsi che il liquido riempia lo strato di supporto dello stampo.
- Asciugare lo stampo a RT in un forno di essiccazione per 1 giorno, quindi sformare per ottenere il cerotto exo@MN.
NOTA: Conservare il cerotto exo@MN conservato in un forno di essiccazione fino al momento dell'uso.
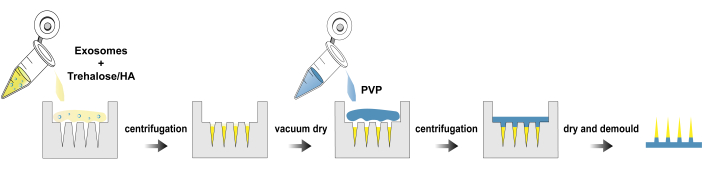
Figura 1: Processo di fabbricazione di exo@MN patch. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Caratterizzazione delle patch exo@MN
- Osservazione della morfologia
- Incollare il supporto del cerotto su una superficie inclinata di 45° e posizionarlo sotto uno stereomicroscopio (vedi Tabella dei materiali).
- Accendi l'illuminatore e cattura la morfologia del cerotto usando un obiettivo 4x.
- Microscopia elettronica a scansione (SEM)
- Fissare il cerotto al tavolino del campione utilizzando un adesivo conduttivo e trattarlo con un rivestimento fine automatico (vedere la tabella dei materiali) per 30 s.
- Acquisire immagini del cerotto exo@MN utilizzando il SEM (vedi Tabella dei materiali) con una tensione di accelerazione di 1 kV.
- Prove meccaniche
- Ritaglia una matrice 3 x 3 dal cerotto e posizionala con le punte rivolte verso l'alto sulla piattaforma rigida di un misuratore di trazione (vedi Tabella dei materiali). Regolare l'altezza della sonda per avvicinarla alle punte dell'ago senza toccarle.
- Impostare i parametri in modo che si fermino automaticamente quando la pressione raggiunge i 20 N. Comprimere verticalmente le punte dell'ago a una velocità di 0,5 mm/min e registrare il profilo di carico rispetto allo spostamento.
- Dissoluzione
- Acquista orecchie di maiale fresche dal mercato e tagliale a pezzi (5 cm x 5 cm x 0,3 cm). Stendere la pelle di maiale su un tavolo e utilizzare della carta per asciugare l'umidità superficiale.
- Preparare quattro cerotti a secco con microaghi con le punte dell'ago rivolte verso il basso sulla pelle del maiale, distanziando leggermente ogni cerotto. Usando il pollice e l'indice, premere verticalmente su ciascun cerotto con microaghi. Rimuovi una toppa ogni 15 s.
- Mettere immediatamente il cerotto rimosso in un forno di essiccazione e asciugare per 5 minuti. Tagliare una colonna di punte di microaghi, posizionarle orizzontalmente al microscopio (vedi Tabella dei materiali) e utilizzare un obiettivo 4x per osservare la dissoluzione delle punte.
4. Caratterizzazione degli esosomi in exo@MN patch
NOTA: Le punte dei microaghi di exo@MN vengono disciolte in 100 μL di soluzione DPBS per eseguire la seguente caratterizzazione sugli esosomi rilasciati.
- Microscopia elettronica a trasmissione (TEM)
- Trattare la rete di rame (vedi Tabella dei materiali) con un trattamento idrofilo utilizzando un pulitore ionico (vedi Tabella dei materiali) per 5 minuti.
- Erogare 10 μl di campione sul lato in carbonio della rete di rame. Lasciate riposare per 1 minuto, quindi rimuovete il liquido tamponandolo con carta da filtro dai bordi.
- Aggiungere 10 μl di acetato di uranile al 3% (vedere la tabella dei materiali) al campione. Lasciare riposare per 10 s, quindi rimuovere il liquido tamponando con carta da filtro dai bordi.
- Aggiungere 10 μl di acetato di uranile al 3% al campione. Lasciare riposare per 1 minuto, quindi rimuovere il liquido tamponandolo con carta da filtro dai bordi e asciugare all'aria a RT.
- Acquisire immagini degli esosomi utilizzando TEM (vedi Tabella dei materiali) con una tensione di accelerazione di 80 kV.
- Analisi del tracciamento delle nanoparticelle (NTA)
- Diluire la soluzione di esosoma con DPBS per ottenere una concentrazione di particelle di 1 x 107 particelle/mL. Iniettare lentamente 1 mL della soluzione di esosoma nella camera del campione dell'NTA utilizzando una siringa da 1 mL (vedere la Tabella dei Materiali).
- Impostare il tipo di procedura operativa standard (SOP) dello strumento su EV-488 per rilevare la distribuzione dimensionale degli esosomi.
- Western blotting (WB)
- Preparare il tampone di lisi miscelando il tampone di lisi del saggio di radioimmunoprecipitazione (RIPA): fenilmetanthansulfonilfluoruro (vedere la tabella dei materiali) in un rapporto di 100:1. Lizzare gli esosomi su ghiaccio per 20 minuti, vorticando ogni 10 minuti.
- Centrifugare la soluzione a 12.000 x g per 10 minuti a 4 °C. Raccogliere il surnatante per misurare la concentrazione proteica.
- Aggiungere 5 tamponi di caricamento SDS-PAGE (vedere la tabella dei materiali) al surnatante in un rapporto di volume di 1 : 4 e mescolare bene. Scaldare a 100 °C per 10 minuti per denaturare le proteine.
- Aggiungere 5 μl di un marcatore proteico precolorato da 180 kDa (vedere la Tabella dei materiali) e 10 μg di campione denaturato a un gel prefabbricato al 4%-20% (vedere la Tabella dei materiali). Far funzionare il sistema di elettroforesi (vedi Tabella dei materiali) a 60 V per 10 minuti e poi a 140 V per 50 minuti.
- Trasferire le proteine dal gel a una membrana in PVDF (vedi Tabella dei materiali) preattivata con metanolo. Eseguire il sistema di elettroforesi a 290 mA per 90 minuti su ghiaccio.
- Incubare la membrana in PVDF in una soluzione di latte scremato al 5% per 1 ora. Lavare tre volte con soluzione fisiologica tamponata tris con interpolazione (TBST, vedere Tabella dei materiali) per 5 minuti ciascuna.
- Ritaglia le bande bersaglio in base alla posizione della proteina. Incubare le bande con l'anticorpo anti-topo CD63 e l'anticorpo anti-topo Alix (vedere la Tabella dei materiali) diluiti alla concentrazione appropriata secondo le istruzioni del produttore e incubare per una notte a 4 °C.
- Lavare le bande tre volte con TBST. Incubare con IgG anti-coniglio coniugate con HRP (vedi Tabella dei materiali) a RT per 1 ora. Quindi, lavare nuovamente tre volte con TBST.
- Applicare un reagente di rilevamento super ECL (vedere la Tabella dei materiali) per coprire la superficie delle bande, quindi esporre e catturare immediatamente le bande utilizzando un gel imager (vedere la Tabella dei materiali).
- Microscopia confocale a scansione laser (CLSM)
- Coltivare 5 x 105 DC in un piatto confocale utilizzando 2 ml di terreno del Roswell Park Memorial Institute 1640 (RPMI 1640) (vedi Tabella dei materiali). Aggiungere esosomi o exo@MN e incubare a 37 °C per 24 ore.
- Aggiungere una goccia di Hoechst 33342 a ciascuna capsula confocale e incubare al buio a 37 °C per 20 minuti.
- Eseguire l'imaging con un CLSM (vedere la tabella dei materiali) utilizzando un obiettivo 60x. Applicare una goccia di olio da immersione (vedi Tabella dei materiali) sulla lente e posizionare il piatto confocale sul tavolino. Regolare gli assi x/y/z per individuare il piano focale appropriato delle celle.
- Avvia l'imaging con i canali DAPI/TRITC/TD, seleziona una risoluzione di 1024 px e imposta la modalità veloce su 1/8 s.
- Citometria a flusso
- Coltivare le DC in una piastra a 6 pozzetti, ogni pozzetto contenente 5 x 105 cellule e 2 mL di terreno 1640. Aggiungere volumi uguali di soluzione di DPBS, esosomi, microaghi senza esosomi e exo@MN, rispettivamente, e incubare a 37 °C per 24 ore.
- Trasferire il terreno da ciascun pozzetto in provette da centrifuga. Centrifugare a 300 x g per 3 minuti a 4 °C e rimuovere il surnatante.
- Aggiungere 0,5 μl di anticorpo FITC-CD11c, 2,5 μl di anticorpo APC-CD80 e 0,5 μl di anticorpo Pacific Blue I-A/I-E (vedere la Tabella dei materiali) a 100 μl di soluzione di BSA al 5% (vedere la Tabella dei materiali). Mescolare bene, risospendere le cellule e incubare su uno shaker in ghiaccio e al buio per 20 minuti.
- Aggiungere 1 mL di DPBS e centrifugare a 300 x g per 3 minuti a 4 °C, quindi rimuovere il surnatante. Ripetere il lavaggio due volte per rimuovere gli anticorpi non legati, quindi procedere all'analisi dei canali fluorescenti corrispondenti tramite citometria a flusso (vedere la Tabella dei materiali).
- Innanzitutto, nel grafico a dispersione FSC-A/SSC-A, porta la popolazione cellulare principale come P1. Nel grafico a dispersione SSC-A/SSC-H della popolazione di cellule P1, eseguire il gate di una regione P2 quadrata lungo la diagonale per rimuovere le cellule aggregate.
- Eseguire l'analisi della fluorescenza sulla popolazione di cellule P2 utilizzando i canali FITC, APC e Pacific Blue. Impostare la condizione di arresto per raccogliere 10.000 celle nel cancello P2.
5. Analisi statistica
- Esprimere i dati quantitativi come medie ± deviazioni standard (SD). Valutare la significatività statistica utilizzando l'analisi t-test utilizzando un'applicazione software di analisi dei dati appropriata. Considera i valori p inferiori a 0,05 per indicare la significatività statistica. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001.
Risultati
Qui, presentiamo un protocollo per l'isolamento degli esosomi, la fabbricazione e la caratterizzazione di exo@MN patch. La Figura 1 illustra il diagramma di flusso del processo per la fabbricazione di exo@MN patch. Gli esosomi sono stati miscelati con trealosio e HA, quindi la miscela è stata aggiunta allo stampo con microaghi e centrifugata. Questo processo ha facilitato l'aggregazione degli esosomi sulla punta dell'ago, favorendo un rapido rilascio. Dopo l'essiccazione, è stata aggiunta ...
Discussione
Attualmente, i principali metodi per isolare gli esosomi includono l'ultracentrifugazione, la centrifugazione a gradiente di densità, l'ultrafiltrazione, la precipitazione, le microsfere magnetiche di immunoaffinità e la microfluidica24. A causa della limitata capacità di carico dei microaghi causata dal loro piccolo spazio sulla punta dell'ago, è necessario aumentare la concentrazione di esosomi per caricarne di più. Pertanto, abbiamo scelto l'ultrafiltrazione per concentrare il surnatante d...
Divulgazioni
H. C., F.L.Q e S.J.M sono gli inventori di una domanda di brevetto che è stata depositata sulla base dei dati di questo manoscritto. H.C. è il fondatore scientifico di Medcraft Biotech. Inc.
Riconoscimenti
F.L.Q. apprezza il sostegno sostenuto dal Pioneer R&D Program di Zhejiang (2022C03031), dal National Key Research and Development Program of China (2021YFA0910103), dalla National Natural Science Foundation of China (22274141, 22074080), dalla Natural Science Foundation della Provincia di Shandong (ZR2022ZD28) e dal Taishan Scholar Program della Provincia di Shandong (tsqn201909106). H.C. riconosce il sostegno finanziario della National Natural Science Foundation of China (82202329). Gli autori riconoscono l'uso di strumenti presso la Shared Instrumentation Core Facility presso l'Istituto di Medicina di Hangzhou (HIM), Accademia Cinese delle Scienze.
Materiali
| Name | Company | Catalog Number | Comments |
| 100x penicillin-streptomycin solutions | Jrunbio Scientific | MA0110 | Cell culture |
| 180 kDa pre-stained protein marker | Thermo | 26616 | Western blotting |
| 3% Uranyl acetate | Henan Ruixin Experimental Supplies | GZ02625 | Morphological characterization of exosomes |
| 3D printer | BMF technology | nanoArch S130 | Mold preparation |
| 4%–20% precast gel | Genscript | ExpressPlus PAGE GEL | Western blotting |
| 5× SDS-PAGE loading buffer | Titan | 04048254 | Western blotting |
| Anti-mouse Alix antibody | Biolegend | 12422-1-AP | Western blotting |
| Anti-mouse CD63 antibody | Biolegend | ab217345 | Western blotting |
| APC anti-mouse CD80 antibody | Biolegend | 104713 | Antibody |
| Auto fine coater | ZIZHU | JBA5-100 | Morphological characterization of microneedle |
| BCA assay kit | Beyotime | P0012 | Protein concentration assay |
| Centrifuge | Thermo Fisher | Muitifuge X1R pro | Cell centrifuge |
| Circulating water vacuum pump | Yuhua Instrument | SHZ-D(III) | Filtration |
| CO2 incubator | Eppendorf | CellXpert C170 | Cell culture |
| Confocal laser scanning microscope | Nikon | A1HD25 | Fluorescence imaging |
| Copper mesh | Beijing Zhongjingkeyi Technology | JF-ZJKY/300 | Morphological characterization of exosomes |
| D- (+) -Trehalose dihydrate | Aladdin | 5138-23-4 | Fabrication of microneedle |
| Dulbecco’s modified Eagle’s medium | Meilunbio | MA0212 | Cell culture |
| Dulbecco’s phosphate-buffered saline | Meilunbio | MA0010 | Cell culture |
| Electrophoresis system | Bio-rad | PowerPac-basic | Western blotting |
| Fetal bovine serum | Jrunbio Scientific | JR100 | Cell culture |
| FITC anti-mouse CD11c antibody | Biolegend | 117305 | Antibody |
| Flow cytometry | BD | LSR Fortessa | Fluorescence detection |
| Gel imager | Cytiva | Amersham ImageQuant 800 | Western blotting |
| HRP-conjugated anti-rabbit IgG | CST | 7074S | Western blotting |
| HTL resin | BMF technology | Mold preparation | |
| Hyaluronic acid (MW = 300 kDa) | Bloomage Biotechnology | 9004-61-9 | Fabrication of microneedle |
| Immersion oil | Nikon | MXA22168 | Fluorescence imaging |
| Ion cleaner | JEOL | EC-52000IC | Morphological characterization of exosomes |
| Microscope | Olympus | CKX53 | Observe the microneedle tip dissolving process |
| Mouse ovarian epithelial cancer cell ID8 | MeisenCTCC | CC90105 | Cell culture |
| Nanoparticle tracking analysis | Particle Metrix | ZetaView | Size analysis of exosomes |
| Pacific Blue anti-mouse I-A/I-E antibody | Biolegend | 107619 | Antibody |
| Phenylmethanesulfonyl fluoride | Beyotime | ST507 | Protease inhibitors |
| Plasma cleaner | Hefei Kejing Material Technology | PDC-36G | Fabrication of microneedle |
| Polydimethylsiloxane | Dow Corning | 9016-00-6 | Mold preparation |
| Polyvinylpyrrolidone (MW = 40 kDa) | Aladdin | 9003-39-8 | Fabrication of microneedle |
| Prism | GraphPad | Version 9 | Statistical analysis |
| PVDF membrane | Millipore | IPVH00010 | Western blotting |
| Quick-snap centrifuge | Beckman | 344619 | Exosomes extraction |
| RIPA lysis buffer | Applygen | C1053 | Lysis membrane |
| Roswell park memorial institute 1640 | Meilunbio | MA0548 | Cell culture |
| Scanning electron microscope | JEOL | JSM-IT800 | Morphological characterization of microneedle |
| Stereo microscope | Olympus | SZX16 | Characterization of morphology |
| Super ECL detection reagent | Applygen | P1030 | Western blotting |
| Tensile meter | Instron | 68SC-05 | Mechanical testing |
| Transmission electron microscope | JEOL | JEM-2100plus | Morphological characterization of exosomes |
| Tris buffered saline | Sangon Biotech | JF-A500027-0004 | Western blotting |
| Tween-20 | Beyotime | ST825 | Western blotting |
| Ultracentrifuge | Beckman | Optima XPN-100 | Exosomes extraction |
| Ultrafiltration tube | Millipore | UFC910096 | Exosomes concentration |
| Vacuum drying oven | Shanghai Yiheng Technology | DZF-6024 | Fabrication of microneedle |
| Vacuum filtration system | Biosharp | BS-500-XT | Filtration |
Riferimenti
- Barile, L., Vassalli, G. Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacol Ther. 174, 63-78 (2017).
- Kalluri, R., Lebleu, V. S. The biology, function, and biomedical applications of exosomes. Science. 367 (640), 6977 (2020).
- Mathieu, M., Martin-Jaular, L., Lavieu, G., Thery, C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nat Cell Biol. 21 (1), 9-17 (2019).
- Nair, A., et al. Hybrid nanoparticle system integrating tumor-derived exosomes and poly(amidoamine) dendrimers: Implications for an effective gene delivery platform. Chem Mater. 35 (8), 3138-3150 (2023).
- Lu, Z., et al. Dendritic cell-derived exosomes elicit tumor regression in autochthonous hepatocellular carcinoma mouse models. J Hepatol. 67 (4), 739-748 (2017).
- Oskouie, M. N., Aghili Moghaddam, N. S., Butler, A. E., Zamani, P., Sahebkar, A. Therapeutic use of curcumin-encapsulated and curcumin-primed exosomes. J Cell Physiol. 234 (6), 8182-8191 (2019).
- Yuan, D., et al. Macrophage exosomes as natural nanocarriers for protein delivery to inflamed brain. Biomaterials. 142, 1-12 (2017).
- Liao, W., et al. Exosomes: The next generation of endogenous nanomaterials for advanced drug delivery and therapy. Acta Biomater. 86, 1-14 (2019).
- Zhu, X., et al. Comprehensive toxicity and immunogenicity studies reveal minimal effects in mice following sustained dosing of extracellular vesicles derived from hek293t cells. J Extracell Vesicles. 6 (1), 1324730 (2017).
- Wen, S., et al. Biodistribution of mesenchymal stem cell-derived extracellular vesicles in a radiation injury bone marrow murine model. Int J Mol Sci. 20 (21), 5468-5482 (2019).
- Cheng, Y., Zeng, Q., Han, Q., Xia, W. Effect of pH, temperature and freezing-thawing on quantity changes and cellular uptake of exosomes. Protein Cell. 10 (4), 295-299 (2019).
- Jana, B. A., Shivhare, P., Srivastava, R. Gelatin-PVP dissolving microneedle-mediated therapy for controlled delivery of nifedipine for rapid antihypertension treatment. Hypertens Res. 47 (2), 427-434 (2024).
- Zheng, Y., et al. A rapidly dissolvable microneedle patch with tip-accumulated antigens for efficient transdermal vaccination. Macromol Biosci. 23 (12), e2300253 (2023).
- Huang, D., et al. Efficient delivery of nucleic acid molecules into skin by combined use of microneedle roller and flexible interdigitated electroporation array. Theranostics. 8 (9), 2361-2376 (2018).
- Zhou, Z., et al. Reverse immune suppressive microenvironment in tumor draining lymph nodes to enhance anti-pd1 immunotherapy via nanovaccine complexed microneedle. Nano Res. 13 (6), 1509-1518 (2020).
- Kim, Y. C., Park, J. H., Prausnitz, M. R. Microneedles for drug and vaccine delivery. Adv Drug Deliv Rev. 64 (14), 1547-1568 (2012).
- Bui, V. D., et al. Dissolving microneedles for long-term storage and transdermal delivery of extracellular vesicles. Biomaterials. 287, 121644 (2022).
- Nir, Y., Potasman, I., Sabo, E., Paz, A. Fear of injections in young adults: Prevalence and associations. Am J Trop Med Hyg. 68 (3), 341-344 (2003).
- Zhang, Y., Jiang, G., Yu, W., Liu, D., Xu, B. Microneedles fabricated from alginate and maltose for transdermal delivery of insulin on diabetic rats. Mater Sci Eng C Mater Biol Appl. 85, 18-26 (2018).
- Roy, G., Garg, P., Venuganti, V. V. K. Microneedle scleral patch for minimally invasive delivery of triamcinolone to the posterior segment of eye. Int J Pharm. 612, 121305 (2022).
- Creighton, R. L., Woodrow, K. A. Microneedle-mediated vaccine delivery to the oral mucosa. Adv Healthc Mater. 8 (4), 1801180 (2019).
- Hu, S., Zhu, D., Li, Z., Cheng, K. Detachable microneedle patches deliver mesenchymal stromal cell factor-loaded nanoparticles for cardiac repair. ACS Nano. 16 (10), 15935-15945 (2022).
- Yang, W., Zheng, H., Lv, W., Zhu, Y. Current status and prospect of immunotherapy for colorectal cancer. Int J Colorectal Dis. 38 (1), 266-276 (2023).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2 (9), 1800021 (2018).
- Bosch, S., et al. Trehalose prevents aggregation of exosomes and cryodamage. Sci Rep. 6, 36162 (2016).
- Bhattacharyya, M., Jariyal, H., Srivastava, A. Hyaluronic acid: More than a carrier, having an overpowering extracellular and intracellular impact on cancer. Carbohydr Polym. 317, 121081 (2023).
- Chang, H., et al. Cryomicroneedles for transdermal cell delivery. Nat Biomed Eng. 5 (9), 1008-1018 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon