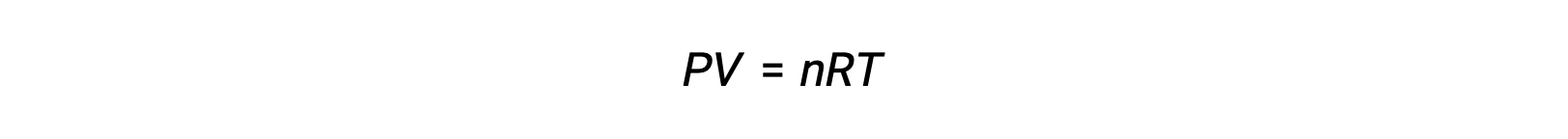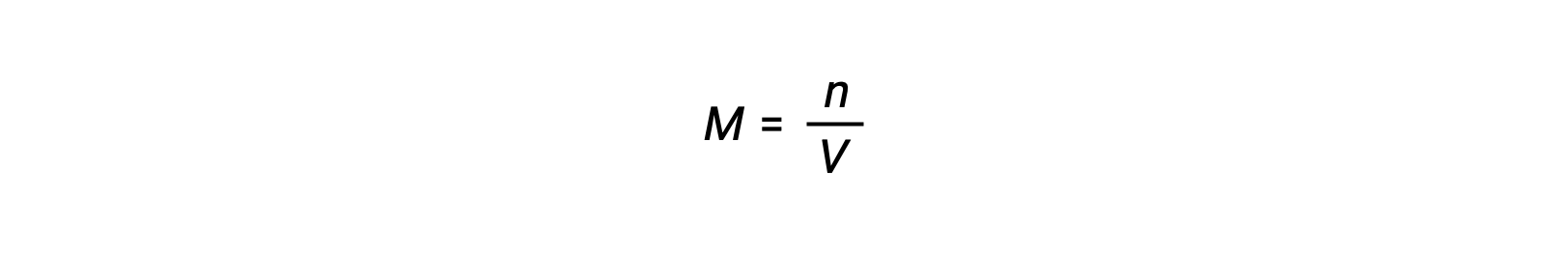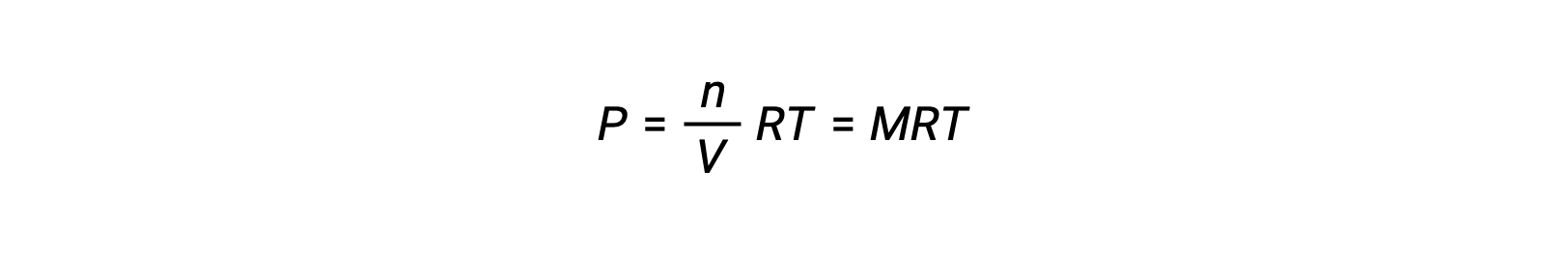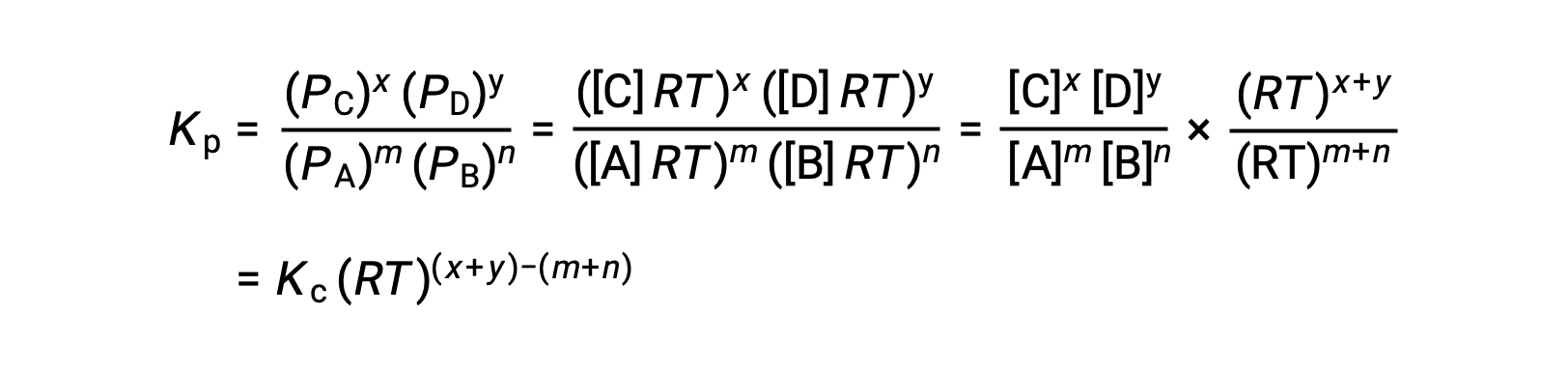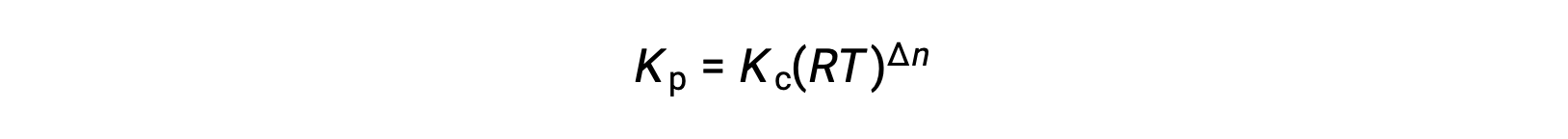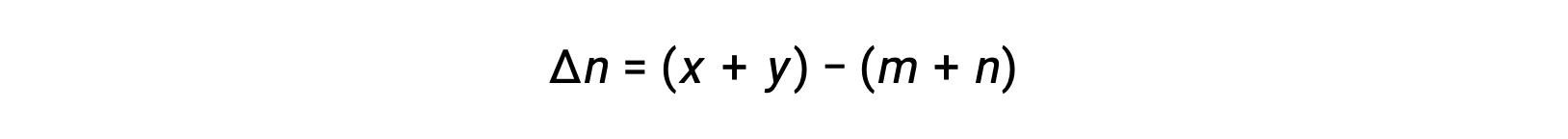For chemical reactions, where the reactants and products are all gases, the equilibrium constant can also be calculated using the individual partial pressures rather than their molar concentrations.
Thus, when gases A and B convert to gases C and D in a reversible reaction, the equilibrium expression can be written instead as the partial pressure of each gas, raised to their stoichiometric coefficients. The equilibrium constant is designated as Kp, where the subscript p indicates pressure.
For a given gaseous reaction, Kp is not necessarily equal to Kc, because the partial pressure of a gas and its molar concentration are separate values. However, a relationship can be derived between the two constants using the ideal gas equation and the definition of molarity.
To derive this relationship, consider the equilibrium expressions for Kc and Kp for the given chemical reaction.
The ideal gas equation relates the pressure of a gas to its number of moles and its volume at a given temperature. Substituting the ratio of moles to volume for molarity in the ideal gas equation allows the pressure of an ideal gas to be expressed in terms of its molar concentration.
In this way, the individual partial pressures in the expression for Kp can be substituted for the concentration equivalent of each gas. The stoichiometric coefficients remain unchanged.
In the modified expression of Kp, the ratio of the concentration of the products to the concentration of reactants can be substituted for Kc. This equation gives the relationship between the two constants — Kp equals Kc times RT raised to the sum of the coefficients of the products minus the sum of the coefficients of the reactants.
The difference between the coefficients of gaseous reactants and products can be represented as Δn.