14.4 : 平衡定数の計算
ある反応の平衡定数は、その反応物と生成物の平衡濃度(または圧力)から計算できます。これらの濃度がわかっている場合、Kcの式に代入すると値が得られます。
例えば、気体の二酸化窒素は、次式によって四酸化二窒素を形成します。
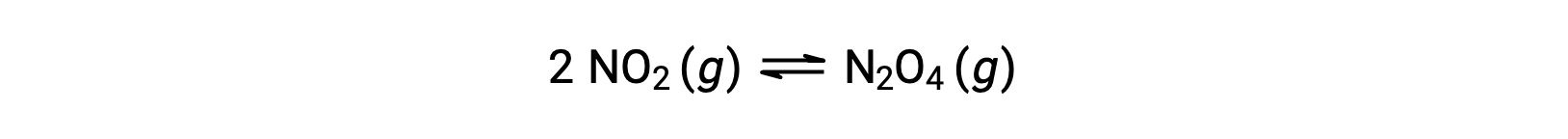
25°Cの1.0 Lのフラスコに0.10 molのNO2を加えると、その濃度が変化します。平衡状態では[NO2] = 0.016 M、[N2O4] = 0.042 Mとなり、この反応の平衡定数の値は次のように計算できます。
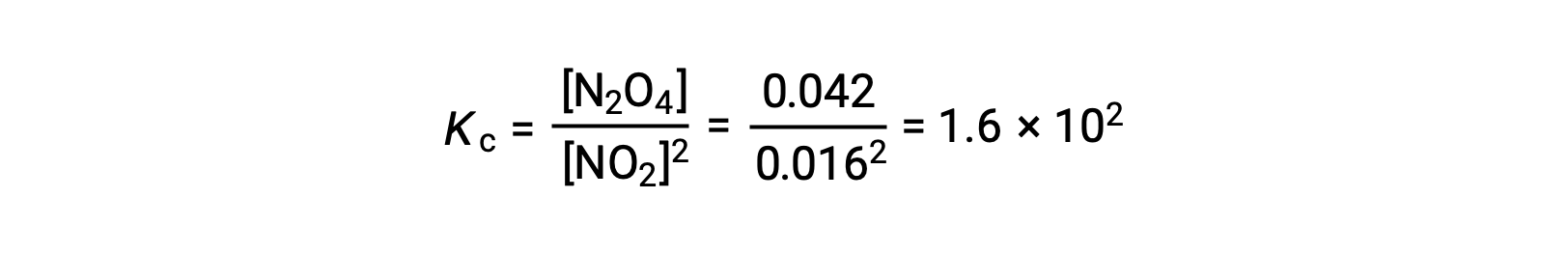
次に、少し難しい例を示します。この例では、反応の化学量論を用いて、与えられた情報から平衡濃度を計算します。この計算の基本的なやり方は、多くの種類の平衡計算に役立ちます。最初に存在する反応物と生成物の濃度、反応の進行に伴って変化する濃度、そして系が平衡に達したときの濃度をそれぞれ考えます。これらの頭文字をとってICEと呼ばれるこのやり方は、ICE表と呼ばれる表形式で濃度に関する項をまとめると便利です。
平衡定数の算出
ヨウ素分子はヨウ化物イオンと可逆的に反応し、三ヨウ化物イオンを生成します。
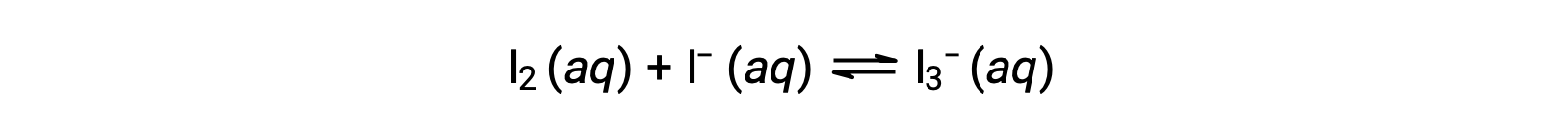
反応前のI2とI−の濃度がともに1.000 × 10−3 Mの溶液で、I2の平衡濃度が6.61 × 10−4 Mになる場合、その反応の平衡定数はいくらでしょうか?
平衡定数を計算するには、すべての反応物と生成物の平衡濃度が必要です。
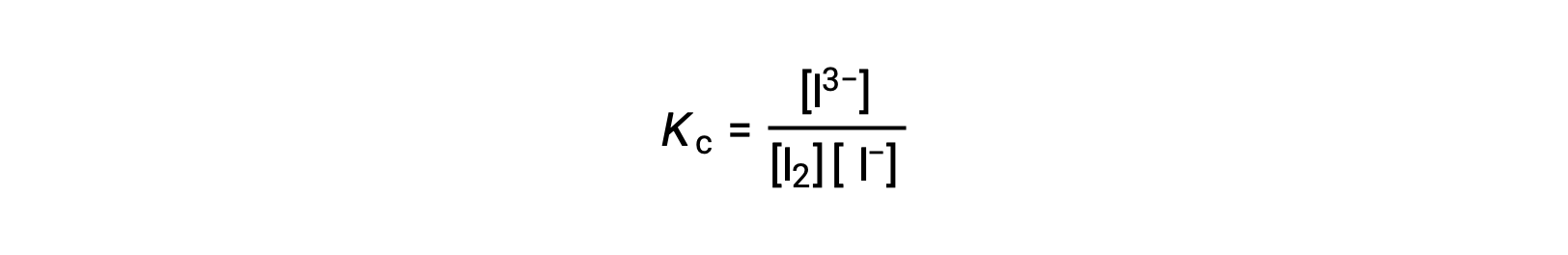
いま、反応物の初期濃度と生成物の平衡濃度が既知です。この情報は、反応物の平衡濃度を算出するために使用することができ、ICE表にすべての情報をまとめます。
| I2 (aq) | I− (aq) | I3− (aq) | |
| 初期濃度 (M) | 1.000 × 10−3 | 1.000 × 10−3 | 0 |
| 濃度変化 (M) | −x | −x | +x |
| 平衡濃度 (M) | 1.000 × 10−3 − x | 1.000 × 10-3 − x | x |
平衡状態では、I2の濃度は6.61 × 10−4 Mなので、
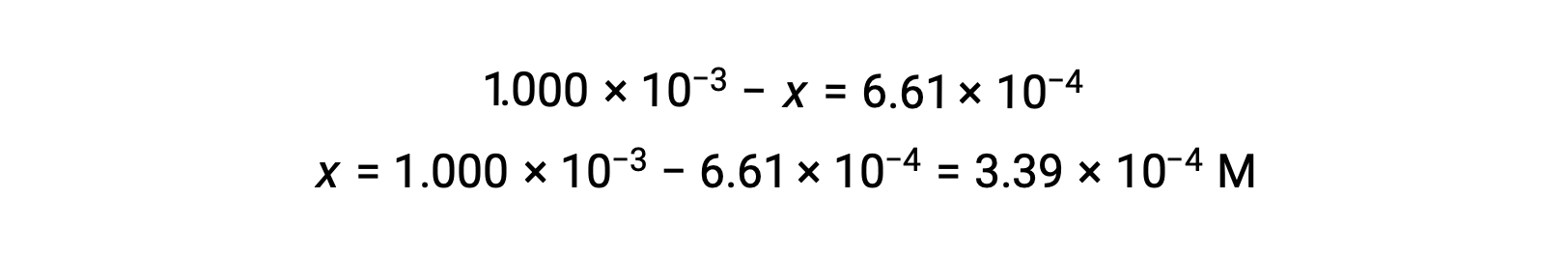
ICE表を用いて、すべての濃度で新しい値を計算します。
| I2 (aq) | I− (aq) | I3− (aq) | |
| 初期濃度 (M) | 1.000 × 10−3 | 1.000 × 10−3 | 0 |
| 濃度変化 (M) | −3.39 × 10−4 | −3.39 × 10−4 | +3.39 × 10-4 |
| 平衡濃度 (M) | 6.61 × 10−4 | 6.61 × 10−4 | 3.39 × 10−4 |
最後に、平衡濃度をKcの式に代入します。
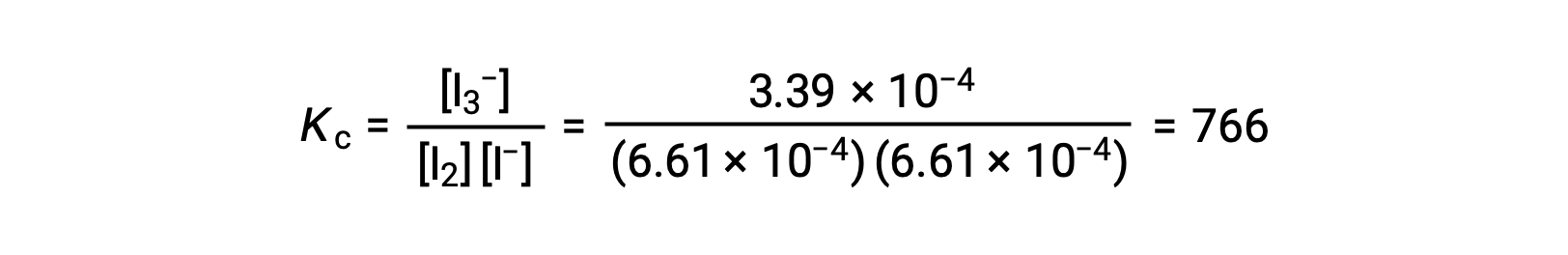
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 13.4 Equilibrium Calculations.
章から 14:

Now Playing
14.4 : 平衡定数の計算
化学平衡
30.8K 閲覧数

14.1 : 動的平衡
化学平衡
50.2K 閲覧数

14.2 : 平衡定数
化学平衡
46.5K 閲覧数

14.3 : 気相反応及び不均一系反応の平衡
化学平衡
24.6K 閲覧数

14.5 : 反応商
化学平衡
48.0K 閲覧数

14.6 : 平衡濃度の計算
化学平衡
47.4K 閲覧数

14.7 : ルシャトリエの原理:濃度の変更
化学平衡
57.4K 閲覧数

14.8 : ルシャトリエの原理:体積(圧力)の変更
化学平衡
34.1K 閲覧数

14.9 : ルシャトリエの原理:温度の変更
化学平衡
29.0K 閲覧数

14.10 : 小さい x の仮定
化学平衡
45.9K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved