14.7 : ルシャトリエの原理:濃度の変更
動的平衡状態にある系は、順方向と逆方向の反応が等しい速度で起こっています。平衡状態にある系が、これらの反応速度に異なる影響を与えるような条件の変化(外乱)を受けた場合、速度はもはや等しくなく、系は平衡状態ではありません。反応系は再び進行し(平衡シフト)、再び平衡状態になります。この現象は、ルシャトリエの原理として知られます。平衡状態にある系に外乱が起こると、その系は乱れに反応して平衡シフトし、再び平衡状態に達します。
反応速度は、主に濃度(反応速度則)と温度(アレニウス式)の影響を受けます。したがって、濃度と温度の変化は、平衡を変化させる2つの外乱です。
濃度変化の影響
平衡系において、反応物または生成物の濃度が変化すると、順方向または逆方向の反応の速度が変化します。例として、次の平衡反応を考えます。

この系が平衡状態にあるとき、順方向の反応速度と逆方向の反応速度は等しくなります。
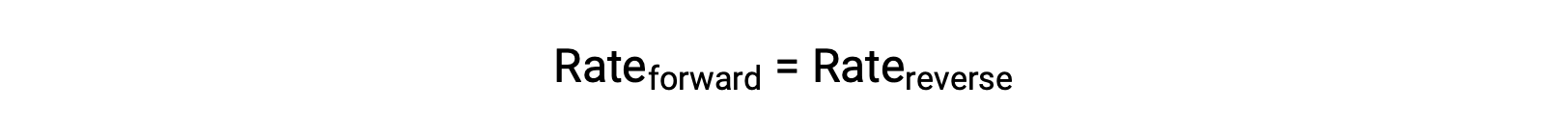
N2やO2などの反応物を加えて系に乱れを与えると、濃度の上昇によって順方向の反応の速度が逆方向の反応の速度を上回ります。

系は再び平衡に向かおうとして、一時的に順方向の反応が優位に起こる(平衡が右にシフトする)。生成物であるNOが系から取り除かれて逆反応の速度が低下すると、これと同じようなシフトが起こり、再び速度の不均衡が生じます。
同じ理屈で、平衡系から反応物を取り除いたり、生成物を加えたりしたときに生じる左側のシフトも説明できます。これらの外乱は、どちらも逆反応の速度を増加させます。

そして、一時的に逆方向が優位に起こって平衡を回復させます。
この動力学的な解釈に代わるものとして、濃度の変化が平衡に及ぼす影響を、反応速度の観点から説明することができます。系が平衡状態にあるときは、次が成立します。
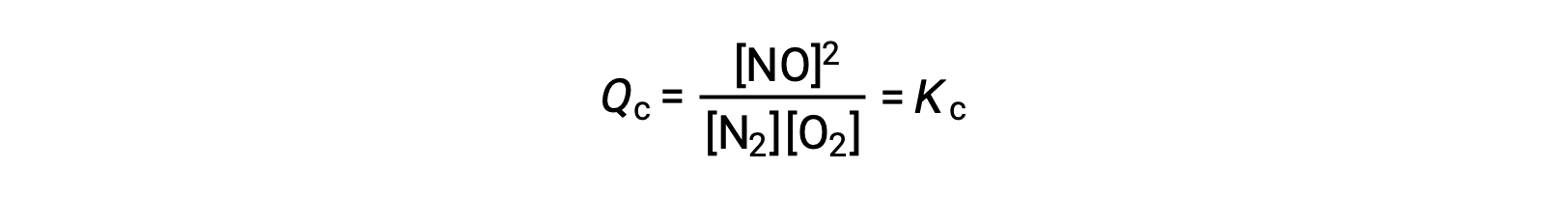
反応物が加えられたり(反応商の分母が大きくなる)、生成物が取り除かれたり(分子が小さくなる)すると、Qc < Kcとなり、平衡は右にシフトします。この外乱を誘発する3つの異なる方法は、平衡混合物の組成に3つの異なる変化をもたらします。N2を加えた場合、平衡が右にシフトすることで、平衡が再構築される際にO2が消費されてNOが生成されます。そのため、以前よりもN2とNOの濃度が高くなり、O2の濃度が低くなるような混合物が得られます。もしO2が加えられれば、新しい平衡混合物はO2とNOの濃度がより高く、N2の濃度がより低くなります。最後に、NOが除去された場合、新しい平衡混合物はN2とO2の濃度が高くなり、NOの濃度は低くなります。このような組成の違いにもかかわらず、平衡定数の値は、外乱の後でも以前と同じになる(質量作用の法則)。同じ理屈が、反応物の除去や生成物の追加を伴う外乱にも適用でき、その場合、Qc > Kcとなることから、平衡は左にシフトします。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 13.3 Shifting Equilibria: LeChatelier’s Principle.
タグ
章から 14:

Now Playing
14.7 : ルシャトリエの原理:濃度の変更
化学平衡
56.8K 閲覧数

14.1 : 動的平衡
化学平衡
49.3K 閲覧数

14.2 : 平衡定数
化学平衡
45.8K 閲覧数

14.3 : 気相反応及び不均一系反応の平衡
化学平衡
23.9K 閲覧数

14.4 : 平衡定数の計算
化学平衡
30.3K 閲覧数

14.5 : 反応商
化学平衡
47.5K 閲覧数

14.6 : 平衡濃度の計算
化学平衡
46.8K 閲覧数

14.8 : ルシャトリエの原理:体積(圧力)の変更
化学平衡
33.5K 閲覧数

14.9 : ルシャトリエの原理:温度の変更
化学平衡
28.6K 閲覧数

14.10 : 小さい x の仮定
化学平衡
45.5K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved