BrøNsted-Lowryの酸-塩基化学はプロトンの移動であり、したがって、共役の酸-塩基ペアの相対的な強さの間には関係があると考えられます。酸や塩基の強さは、酸や塩基の電離反応の程度を表す解離定数KaまたはKbで定量化されます。共役の酸塩基対HA / A−の場合、解離平衡式と解離定数式は次のようになります。
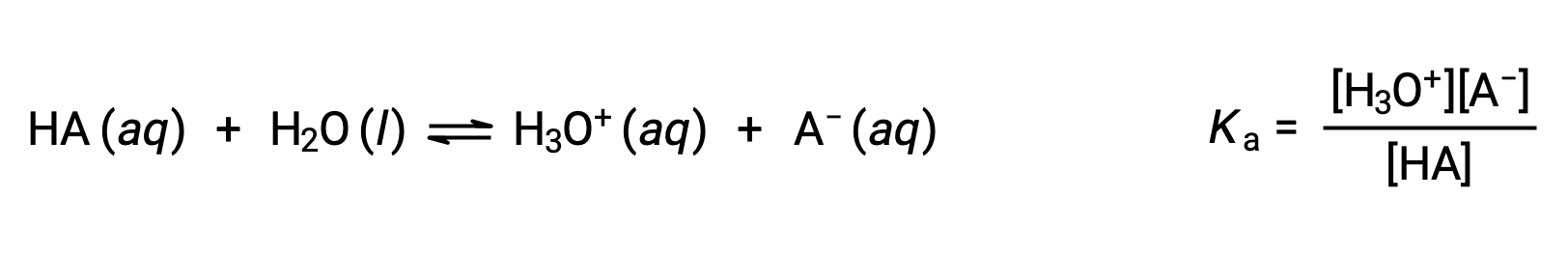
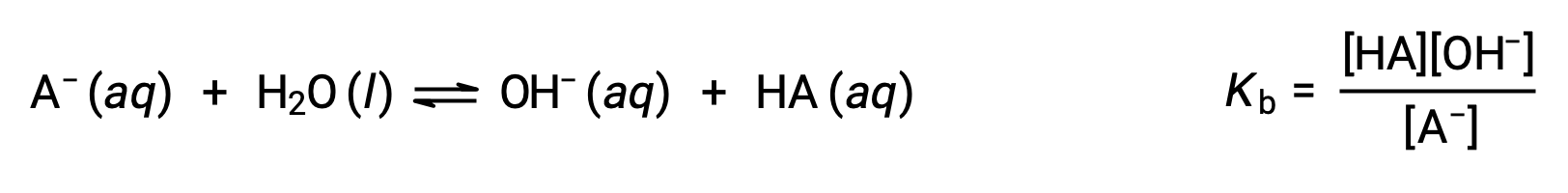
この2つの化学式を足すと、水の自己解離を表す式となります。
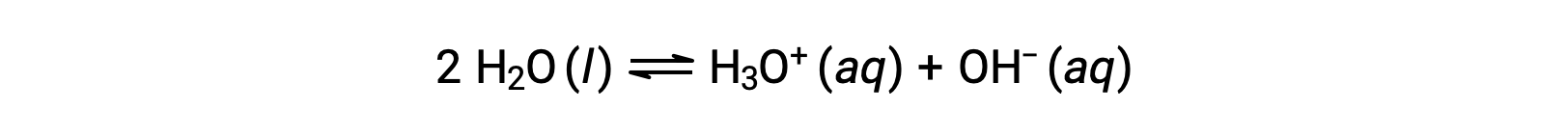
先に述べたように、足し合わされた反応の平衡定数は、加えられた反応の平衡定数の積に等しいので、
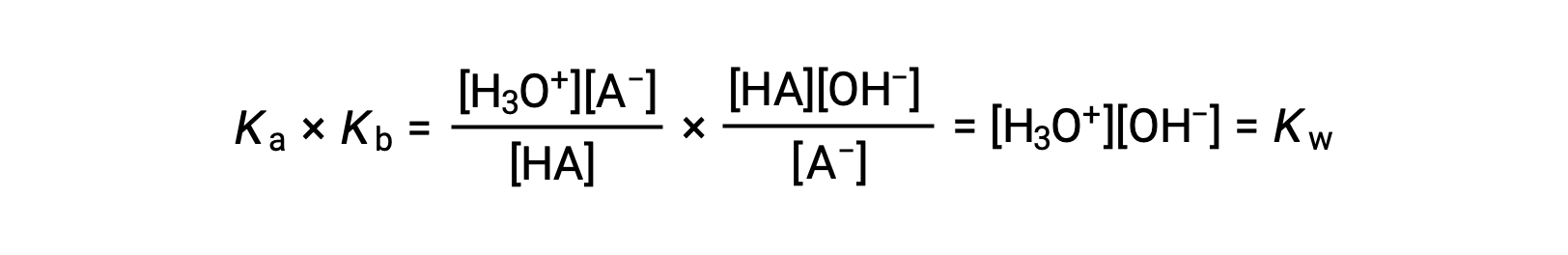
この式は、任意の共役酸塩基対のイオン化定数の関係、すなわち、その積が水のイオン積KWと等しいことを示しています。この式を並べ替えると、共役の酸と塩基対の強さの相互関係が明らかになります。
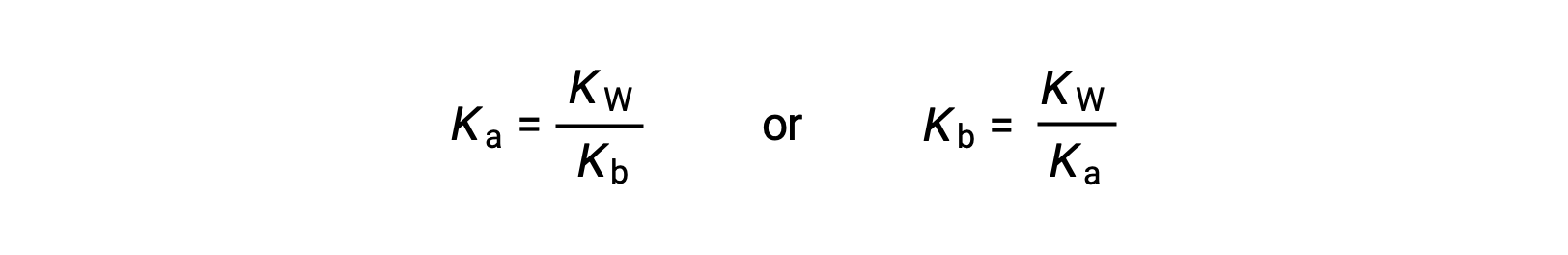
KaとKbの反比例の関係は、酸や塩基が強ければ、その共役の相手は弱くなるということを示しています。
式の両辺の負対数をとると、Ka × Kb= KWとなります。
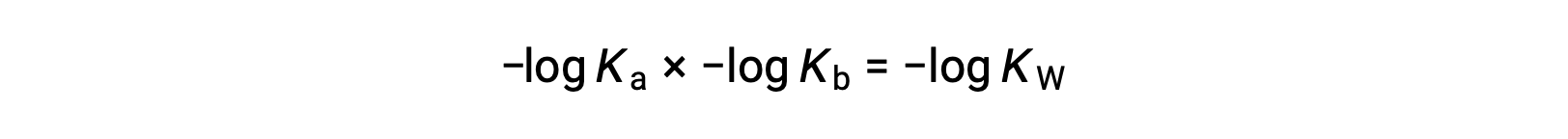
then
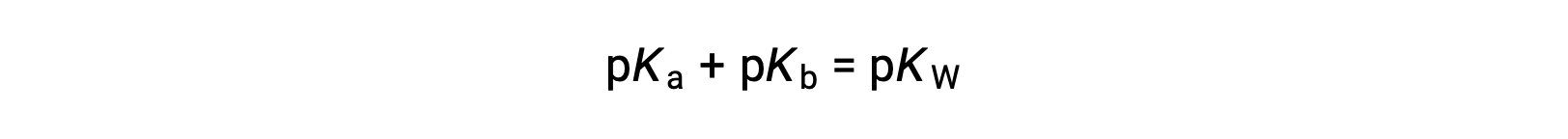
As pKW is 14 at 25 °C, this equation can also be written as
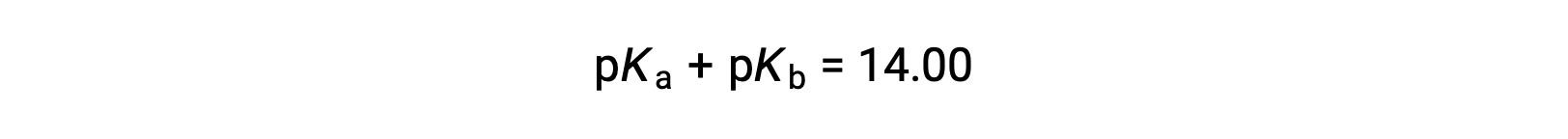
また、pKaとpKbは、それぞれ酸と塩基の強さを表しています。pHやpOHと同様に、pKaやpKbの値が大きいほど、それぞれ酸や塩基が弱くなります。
| 酸 | 塩基 |
| 過塩素酸 (HClO4)* | 過塩素酸イオン (ClO4−)** |
| 硫酸 (H2SO4)* | 硫酸水素イオン (HSO4−)** |
| ヨウ化水素 (HI)* | ヨウ化物イオン (I−)** |
| 臭化水素 (HBr)* | 臭化物イオン (Br−)** |
| 塩化水素 (HCl)* | 塩化物イオン (Cl−)** |
| 硝酸 (HNO3)* | 硝酸イオン (NO3−)** |
| ヒドロニウムイオン (H3O+) | 水 (H2O) |
| 硫酸水素イオン (HSO4−) | 硫酸イオン (SO42−) |
| リン酸 (H3PO4) | リン酸二水素イオン (H2PO4−) |
| フッ化水素 (HF) | フッ化物イオン (F−) |
| 亜硝酸 (HNO2) | 亜硝酸イオン (NO2−) |
| 酢酸 (CH3CO2H) | 酢酸イオン (CH3CO2−) |
| 炭酸 (H2CO3) | 炭酸水素イオン (HCO3−) |
| 硫化水素 (H2S) | 硫化水素イオン (HS−) |
| アンモニウムイオン (NH4+) | アンモニア (NH3) |
| シアン化水素 (HCN) | シアン化物イオン (CN−) |
| 炭酸水素イオン (HCO3−) | 炭酸イオン (CO32−) |
| 水 (H2O) | 水酸化物イオン (OH−) |
| 硫化水素イオン (HS−)† | 硫化物イオン(S2−)‡ |
| エタノール(C2H5OH)† | エトキシドイオン(C2H5O−)‡ |
| アンモニア (NH3)† | アミドイオン(NH2−)‡ |
| 水素 (H2)† | ヒドリドイオン (H−)‡ |
| メタン (CH4)† | メチドイオン (CH3−)‡ |
| *水の中で完全に酸性イオン化する | |
| † 水の中で酸性イオン化しない | |
| **水の中で塩基性イオン化しない | |
| ‡水の中で完全に塩基性イオン化される | |
示された共役酸–塩基対のリストは、水と比較した場合の各種の相対的な強さを示すように配置されています。酸の列では、水の下に記載されている種は、水よりも弱い酸です。これらの種は、水中で酸が電離せず、BrøNsted-Lowry酸ではありません。水より上に記載されている種はすべて強酸であり、水溶液に溶解するとプロトンがある程度水に移動してヒドロニウムイオンを生成する。水より上でヒドロニウムイオンより下の種は、部分的に酸がイオン化した弱酸で、ヒドロニウムイオンより上の種は水溶液中で完全にイオン化した強酸です。
上記の文章は以下から引用した。 Openstax, Chemistry 2e, Section 14.3: Relative Strengths of Acids and Bases.
タグ
Copyright © 2023 MyJoVE Corporation. All rights reserved