強酸として作用する化合物はほとんどません。それよりもはるかに多くの化合物が弱酸性であり、水と部分的にしか反応しません。溶解した分子の大部分は元のままであり、比較的少量のヒドロニウムイオンが生成されるだけです。柑橘類のピリッとした味、虫に刺されたときのチクチク感、体臭などの原因の一つが弱酸であり、自然界に多く存在しています。身近なところでは、お酢の主成分である酢酸が弱酸性です。
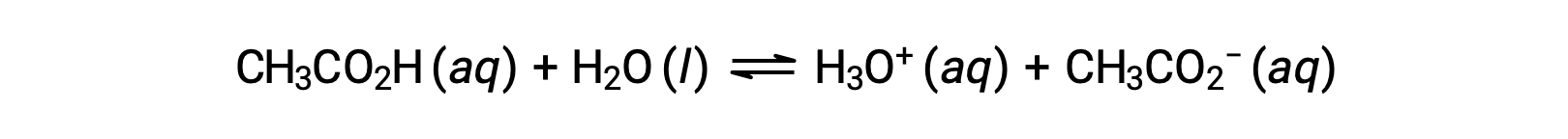
上の式で二重矢印が使われているのは、このプロセスが部分的な反応であるという側面を表しています。一般的な条件で水に溶解した場合、酢酸分子の約1%だけがイオン化した形であるCH3COO−で存在します。
弱酸性水溶液のヒドロニウムイオン濃度とpHの計算
ギ酸(HCO2H)は、一部のアリに噛まれたり、刺されたりしたときに体の反応を引き起こす刺激物の一つです。0.534 Mのギ酸水溶液のヒドロニウムイオンの濃度とpHはいくらでしょうか?
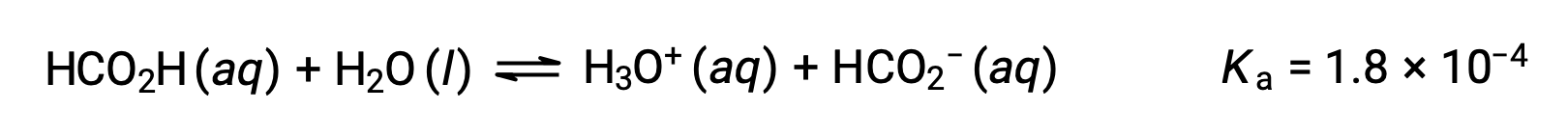
The ICE table for this system is
| HCO2H (aq) | H3O+ (aq) | HCO2− (aq) | |
| 初期濃度 (M) | 0.534 | ~0 | 0 |
| 濃度変化 (M) | −x | +x | +x |
| 平衡濃度 (M) | 0.534 − x | x | x |
平衡濃度の項をKaの式に代入すると、
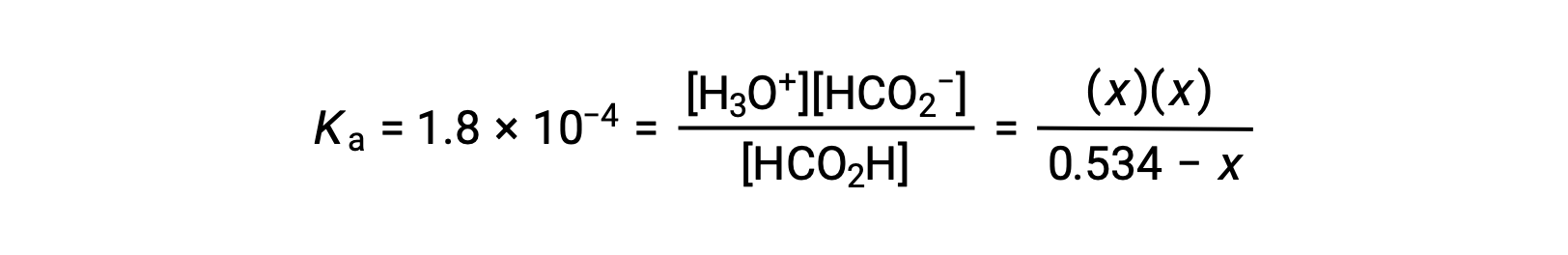
初期濃度が比較的大きく、平衡定数が小さいことから、xが0.534よりもはるかに小さいという単純化された仮定が成り立つため、式は次のようになります。
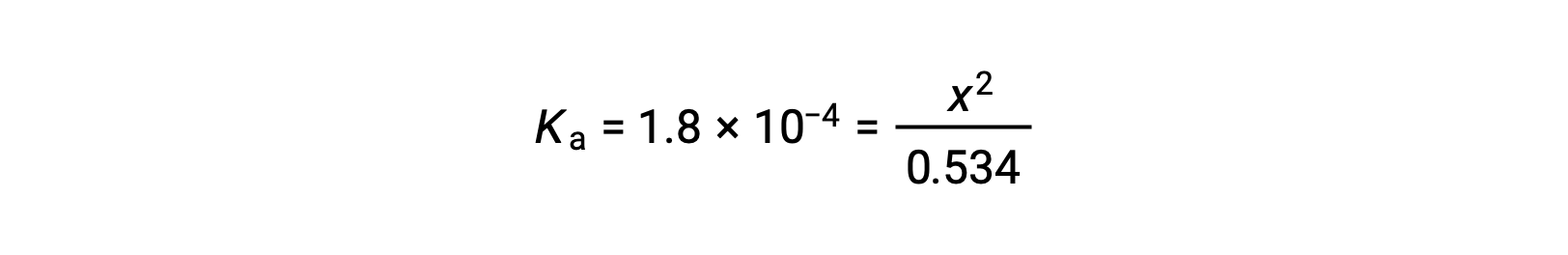
式をxについて解くと、次のようになります。
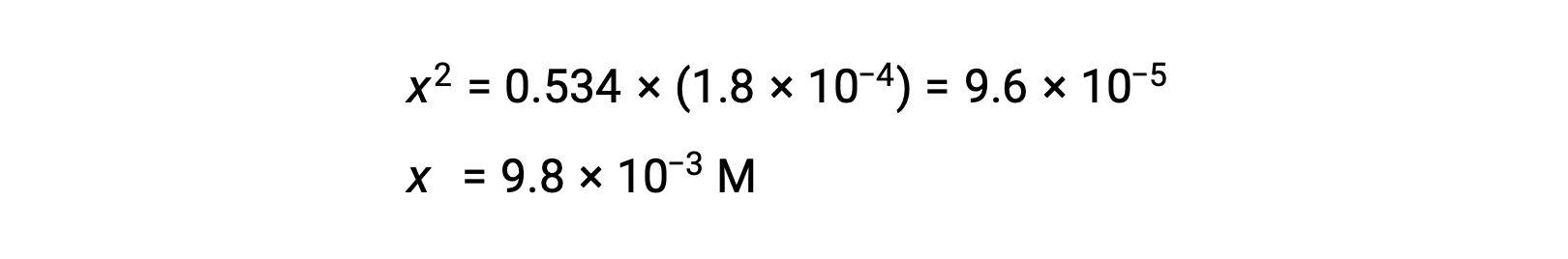
xが0.534に比べて小さいという仮定を確認するために、その相対的な大きさを推定することができます。
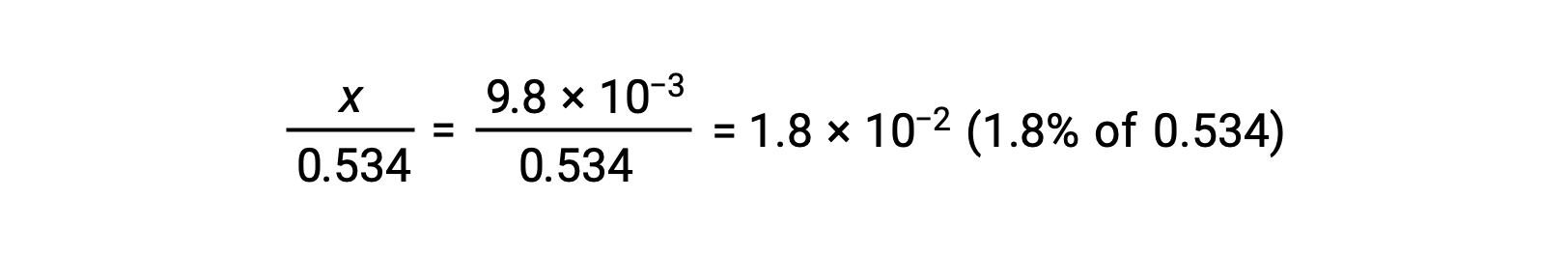
xが初期濃度の5%以下であるため、この仮定は成立しています。ICE表で定義されているように、xはヒドロニウムイオンの平衡濃度に等しいです。
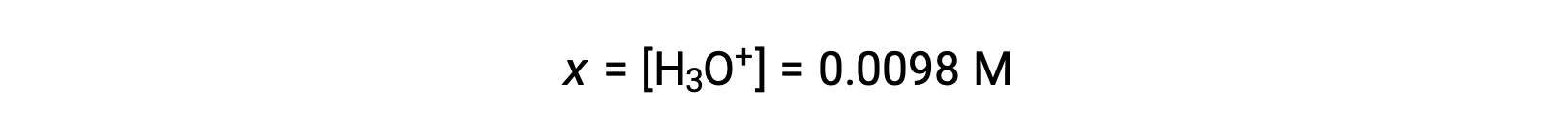
最終的に、pHは次のように計算されます。
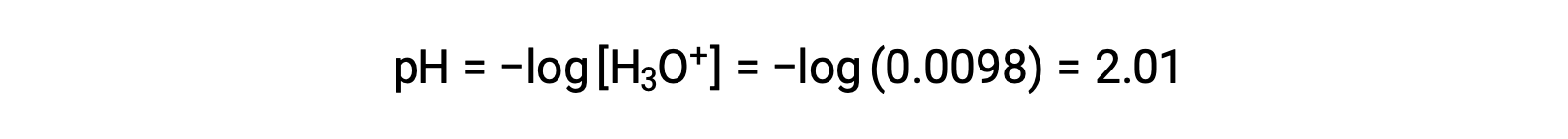
pHからのKaの決定
亜硝酸(HNO2)の0.0516 M溶液のpHは2.34です。そのKaはいくらでしょうか?
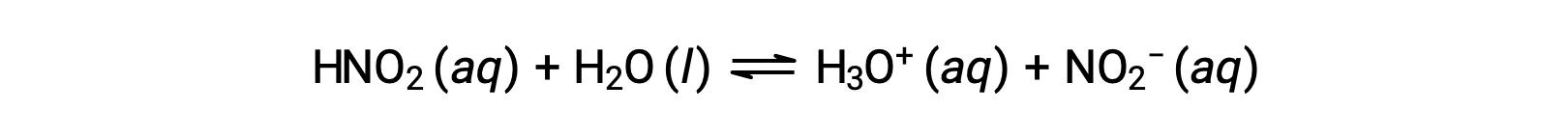
記載されている亜硝酸濃度は形式的な濃度であり、溶液中で成立する可能性のある化学平衡を考慮していないものです。このような濃度は、ICE表を用いた平衡計算では、 “初期”値として扱われます。ヒドロニウムイオンの初期値がほとんど 0と記載されていることに注意する必要があります。これは、水の自己解離により、わずかな濃度のH3O+が存在するからである(1 × 10−7 M)。多くの場合、この濃度は問題の酸(または塩基)のイオン化によって発生する濃度よりもはるかに小さく、無視してよいです。
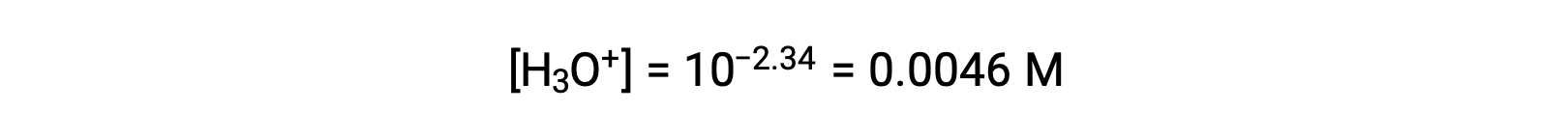
この系におけるICE表は次のとおりです。
| HNO2 (aq) | H3O+ (aq) | NO2− (aq) | |
| 初期濃度 (M) | 0.0516 | ~0 | 0 |
| 濃度変化 (M) | −0.0046 | +0.0046 | +0.0046 |
| 平衡濃度 (M) | 0.0470 | 0.0046 | 0.0046 |
最後に、表の値を使って平衡定数を計算します。
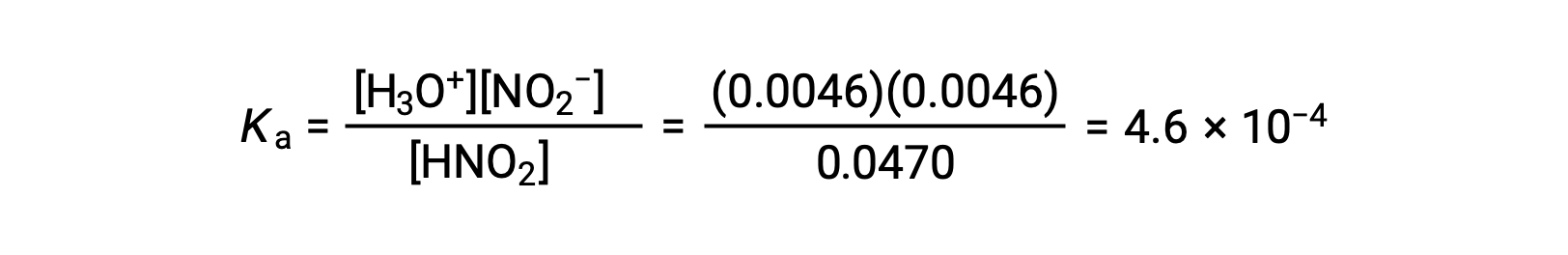
上記の文章は下記から引用しました。 Openstax, Chemistry 2e, Section 4.2: Classifying Chemical Reactions and Openstax, Chemistry 2e,14.3 Relative Strengths of Acids and Bases.
章から 15:

Now Playing
15.7 : 弱酸性溶液
酸・塩基
36.9K 閲覧数

15.1 : ブレンステッド・ローリーの酸塩基理論
酸・塩基
88.2K 閲覧数

15.2 : 酸/塩基強度及び解離定数
酸・塩基
59.1K 閲覧数

15.3 : 水:ブレンステッド・ローリーの酸塩基理論
酸・塩基
48.6K 閲覧数

15.4 : pHスケール
酸・塩基
66.8K 閲覧数

15.5 : 共役酸塩基対の相対強度
酸・塩基
44.4K 閲覧数

15.6 : 強酸、強塩基性溶液
酸・塩基
30.7K 閲覧数

15.8 : 弱塩基性溶液
酸・塩基
22.0K 閲覧数

15.9 : 酸の混合物
酸・塩基
19.3K 閲覧数

15.10 : 酸・塩基性イオン
酸・塩基
22.8K 閲覧数

15.11 : 塩水溶液のpHの決定
酸・塩基
42.7K 閲覧数

15.12 : 多価酸
酸・塩基
28.3K 閲覧数

15.13 : 酸性強度と分子構造
酸・塩基
30.2K 閲覧数

15.14 : ルイス酸及びルイス塩基
酸・塩基
42.4K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved