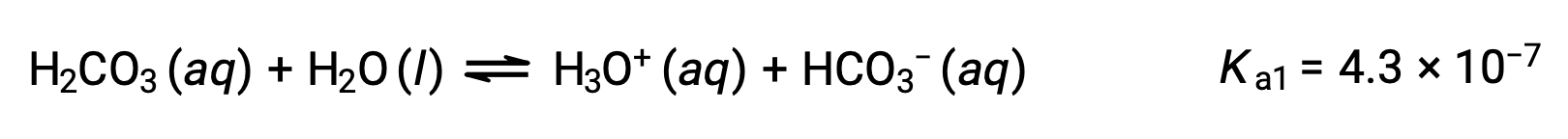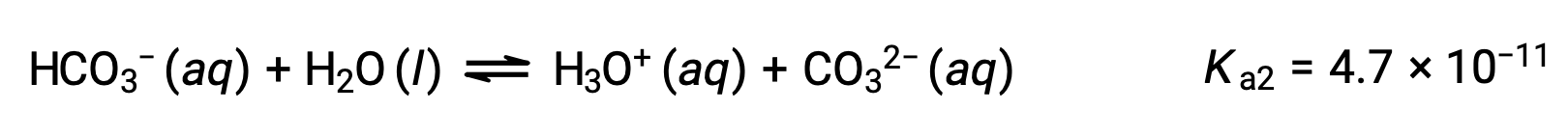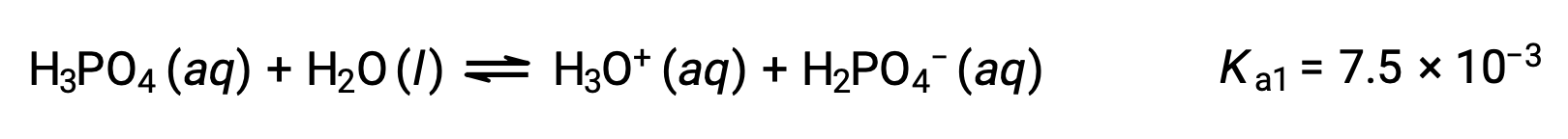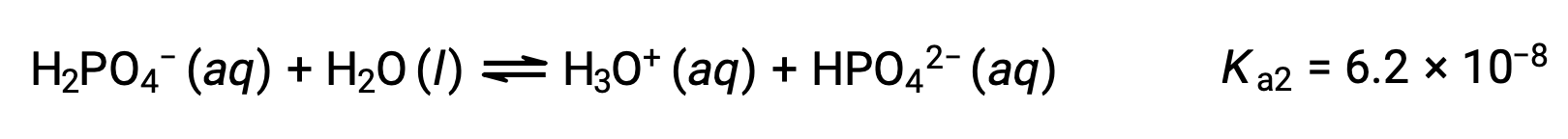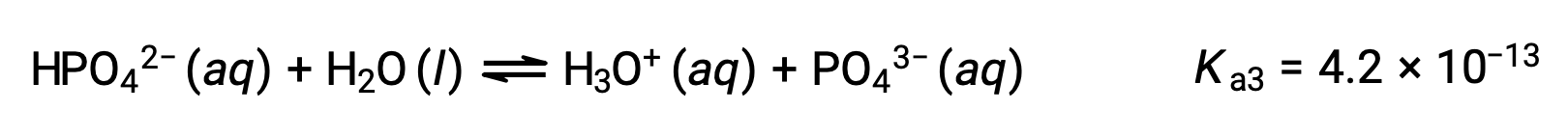A polyprotic acid contains multiple ionizable protons, and each dissociates in a distinct step. The loss of each proton has a different Ka, and each subsequent acid dissociation constant is weaker than the previous one.
For example, sulfurous acid has two ionizable protons. Ka1 for the dissociation of the first proton is 1.6 × 10−2, whereas Ka2 for the dissociation of the second proton is 6.4 × 10−8.
If sulfurous acid is titrated with a strong base, such as sodium hydroxide, the first ionizable proton is removed initially, generating hydrogen sulfite ions. This part of the titration curve is similar to that of a weak monoprotic acid and a strong base. It has an equivalence point, and the pH of the solution at the half-equivalence point is equal to pKa1.
As more base is added, it neutralizes the second ionizable proton. As the concentration of hydrogen sulfite ion is equal to the initial sulfurous acid, the same amount of base is needed to neutralize it. Therefore, two moles of a base is necessary to neutralize one mole of a diprotic acid completely.
The titration curve for the second neutralization step also has a second half-equivalence point, where the pH of the solution equals pKa2, and a second equivalence point, which lies in the basic region.
Similarly, the curve for the titration of triprotic phosphoric acid with a strong base has three equivalence points.
Therefore, during the titration of a weak polyprotic acid, the number of equivalence points generated in the titration curve is equal to the number of ionizable protons present as long as the difference between the Ka values of the ionizable protons is more than ten thousand fold.