16.13 : イオンの沈殿
沈殿生成の予測
固体の炭酸カルシウムとその溶解したイオンの間の平衡を表す式は次の通りです。
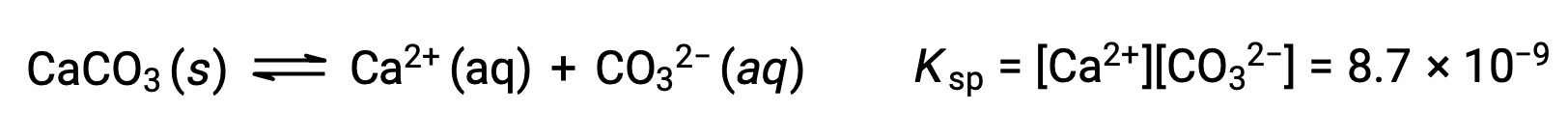
この平衡は、水に炭酸カルシウムを飽和させてできた溶液だけでなく、Ca2+とCO32–イオンを含むあらゆる水溶液で成立する点が重要です。例えば、可溶性化合物である炭酸ナトリウムと硝酸カルシウムの水溶液を混合することを考えます。混合物中のカルシウムイオンと炭酸イオンの濃度が、溶解度積Kspを超える反応商Qをもたらさない場合、沈殿は発生しません。もし、イオン濃度が溶解度積よりも大きい反応商をもたらすならば、沈殿が発生し、平衡が成立するまでそれらの濃度を下げる(Q=Ksp)。沈殿を予測するためにQとKspを比較することは、反応の方向性を予測するための一般的な手法です。溶解平衡の具体的なケースとしては次の通りです。
Q < Ksp:順方向に反応が進む(溶液が飽和しておらず、沈殿を生成しない)
Q > Ksp:逆方向に反応が進む(溶液が過飽和状態であり、沈殿が生成)
同じ対イオンを含んだ2種類以上の難溶性化合物からなる溶液では、溶液から個々のイオンを除去するために、選択的沈殿と呼ばれる実験方法が用いられます。化合物の溶解度が十分に異なる場合、対イオンの濃度を徐々に増加させることで、溶液中のイオンを個別に沈殿させることができます。 対象となる共通イオンの濃度が等しい溶液では、最も溶解度の低い化合物を形成するイオンが最初に沈殿します。他のイオンは、それぞれの化合物の溶解度に達するに従って析出します。
ハロゲン化銀の析出
1 Lあたり0.00010 molのKBrと0.10 molのKClを含む溶液があります。この溶液にAgNO3を徐々に加えていく。このとき、固体のAgBrと固体のAgClのどちらが先に生成するでしょうか?
2つの化学平衡が成立します。
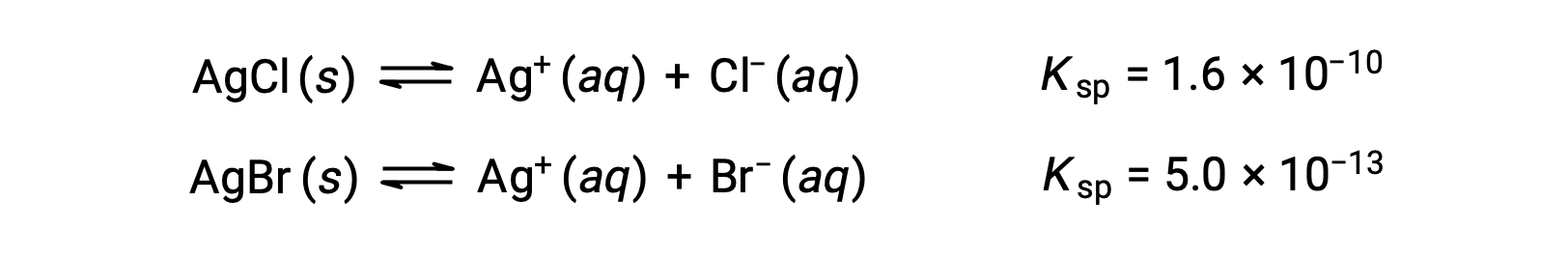
仮に溶液中にCl–とBr–がほぼ同じ濃度で含まれている場合、Kspの小さい銀塩(AgBr)が先に析出します。しかし、実際には濃度は同じではないので、AgClが析出し始める[Ag+]とAgBrが析出し始める[Ag+]を計算する必要があります。そして、低い[Ag+]でからなる塩が先に析出します。
AgBrについて、Q=Kspとなる場合にAgBrが析出します。
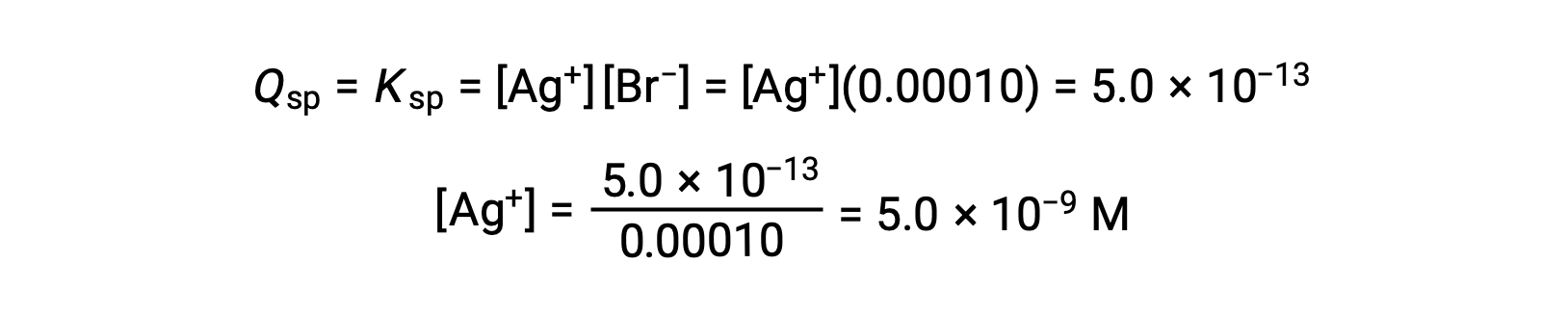
AgBrは[Ag+]が5.0 × 10−9 Mのときに析出し始めます。
AgClについては、
QがAgClのKsp(1.6 × 10-10)と等しいとき、AgClが析出します。[Cl–] = 0.10 Mのとき、
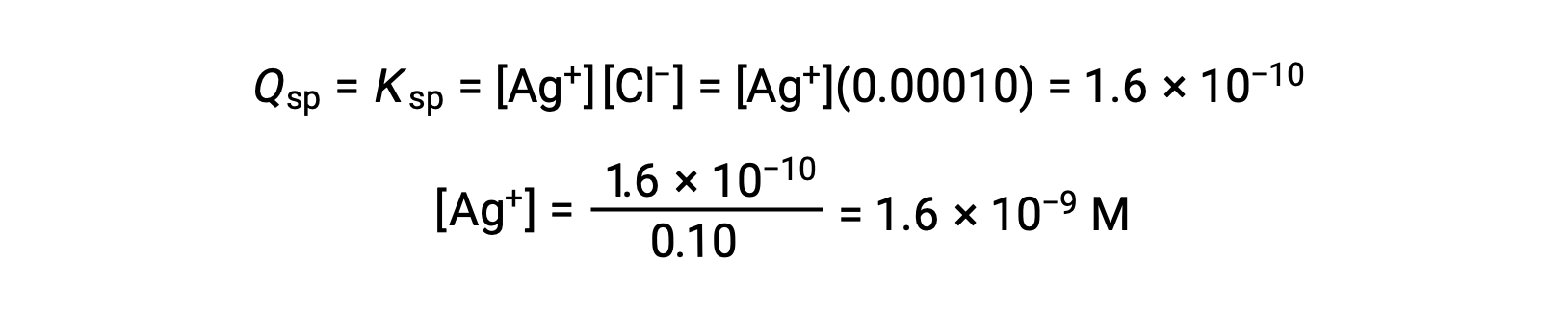
AgClは、[Ag+]が1.6 × 10-9 Mのときに析出し始めます。
AgClはAgBrよりも低い[Ag+]で析出し始めるため、AgClが先に析出します。なお、初期の混合物の塩化物イオン濃度は臭化物イオン濃度よりもかなり大きいため、臭化銀よりもKspが大きいにもかかわらず、塩化銀が先に析出したことに注意しましょう。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Chapter 15.1: Precipitation and Dissolution.
タグ
Copyright © 2023 MyJoVE Corporation. All rights reserved