Method Article
最終分化を研究するための準備とラットの水晶体上皮外植片の培養
要約
FGF - 2の存在下で培養するとラットレンズ上皮の中心領域の外植片は、同期的に分化する。そのような文化の免疫蛍光顕微鏡は、遺伝子発現と分化に関連付けられているシグナリングイベントに関する新たな情報を提供することができます。
要約
接眼レンズの前面は、毛様体の根底にある環状のゾーンで増殖する上皮細胞の単層によって覆われている。網膜からの拡散FGFは、それらがレンズの大部分を構成する細長い水晶体繊維細胞、の後の配列への分化を誘導する場所分裂に続いて、これらの細胞は、後方に移動する。水晶体線維に水晶体上皮細胞の分化はFGF - 2の存在下で前方上皮の中心領域の培養片でin vitroで誘導することができる。外植片は、目からレンズを取り外すと解剖ピンセットで後部側のレンズカプセルを把握し、新生児ラットのレンズから調製されています。後嚢をそっと開いて引き裂かれ、組織培養皿のプラスチック製の底に押されている。外植片の周辺領域は、メスで除去され、中央のエリアは、検討すべきパラメータに応じて、限り2〜3週間などのため100ng/mlのFGF - 2の存在下で培養される。培養片の上皮細胞は数日から数週間の期間にわたって近似同期して区別するので、シグナル伝達および遺伝子発現のタイムコースは、分子生化学、薬理学的手法を用いて決定することができる。それは興味の蛋白質の細胞内局在を証明し、シグナル伝達経路の実験操作の生理的影響を明らかにすることができるように免疫蛍光顕微鏡観察は、これらのメソッドへの強力な補助です。
プロトコル
パート1:レンズの取り外し
材料と試薬:
- ミクロ解剖ハサミ、湾曲した、鈍のヒント、(そのようなas.RS - 5983、Roboz手術器械株式会社、株式会社、ゲイサーズバーグ、MD)、ミクロ解剖ピンセット、湾曲した先端(などRoboz#RS5137など)。
- 懸濁培地:培地199を含む0.1%ウシ血清アルブミン、100単位/ mlペニシリン、100μg/mlのストレプトマイシンは、2.5μg/ mlのアムホテリシンBの試薬は、Invitrogen、カールスバッド、カリフォルニア州から入手できます。
手順:
- 国立衛生研究所、ベセスダ、MDから提供されたガイドラインに準拠した新生児ラットを(2-4日齢)安楽死させる。
- 手術用ハサミでまぶたを削除します。外側に膨らみに目を強制的に目のソケットの反対側に湾曲したピンセットで軽く押してください。はさみと眼の後部側に小さな切開を加えます。切開反対眼の側面にピンセットで押すことによって、レンズと付属の硝子体の少量は、レンズが曲がったピンセットで拾い上げできるように、破裂を通って強制することができます。ケアは、水晶体嚢を破壊しないように注意してください。
- 5ミリリットル暖かい、無菌懸濁培地を含む60ミリメートルプラスチック組織培養皿にレンズを転送するために湾曲したピンセットを使用してください。
第2部:片のマイクロダイセクション
材料と試薬:
- ミクロ解剖ピンセット、0.1mmのヒント、(そのようなRoboz RS - 4976など)。我々は、理由の先端の柔軟性Dumostar合金を使用しますが、他の合金鋼で指定することもできます。彼らはこの手順の実行中に折ったり、曲げたりする傾向があるとして、0.1ミリメートルよりも薄いのヒントとピンセットは、推奨されていません。
- 懸濁培地(パート1を参照)
- ハムのF12培地または培地199(Invitrogen社、Carlsburg、CA)はUnsupplemented
手順:
- 次の手順は、滅菌解剖ツールと滅菌培地を使用してクリーンな、ドラフトのない環境で実施されるべきである。
- ステレオ解剖顕微鏡を用いて、0.1mmの先端のピンセットで任意の付着組織のレンズをきれいにし、5ミリリットル滅菌懸濁培地を(このステップは、汚染を減らすために役立ちます)含む第二の60ミリメートル培養皿に移す。ピンセットで、5ミリリットル滅菌、unsupplemented培地を含む35ミリメートル培養皿にレンズの希望数を転送する。 (下の染料の濃度が解離容易にするため私たちはしばしば、このステップのためにハムのF12(Invitrogen)を使用しますが、培地199にも受け入れられるない抗生物質または他の追加がこのステップで必要とされていない。。)12植を行うことができる限り多くの料理この大きさの中心部に位置します。少ない外植片は解剖用のツールが小さい皿の中で簡単に操作することができないため、行われる場合であってもしかし、35mmの皿を使用する必要があります。それらが必要になるまで37℃で組織培養インキュベーターに残っているレンズ° Cを含む料理を転送する。
- レンズの後側を識別する。これを認識する多くの方法があります:1)後部は若干フラット化されている前方、より丸みである、2)新生児ラットのレンズは、解剖時の室温に彼らは涼しいと寒い白内障を形成する。コールド白内障が完全にレンズをいっぱいにしていない場合、後側は不透明領域から最も遠い側です。不透明度が37に皿を温めて、レンズをいっぱいにしている場合° C数分間、それが逆になります。後側は、冷却時に白内障の改革として識別することができます。 3) 水晶体血管膜の痕跡は、後方側に見える場合があります。 4)後部縫合糸は、後方側に見える場合があります。これはカプセルが開かれる場所なので、正しく後側を特定することは、不可欠です。前方側にレンズを開くと、上皮を引き裂くだろう。
- 後方側が識別されたら、上方向に回し、左ピンセット(右利きの労働者用)でレンズを把握する。その後、小さな倍を生成するために右ピンセットで後嚢をつまんで。
- 右ピンセットで後嚢を押しながら、左ピンセットでカプセルの倍を把握し、カプセルに小さな裂傷を作るために反対方向にピンセットの2つのペアを引き出します。
- ピンセットで後退カプセルの端をつかんで、ピンセットで皿のプラスチックにそれを押すと、他のにして、片側で最初に、下方に引っ張る。カプセルがしっかりと多くの点でプレートに接続されるまで、すべてのレンズの赤道の周りに移動し、これを数回繰り返します。左ピンセットで固定カプセルを保持する、静かにレンズの赤道での繊維細胞と上皮細胞間の接続を中断する権利ピンセットで繊維の塊を揺らし。その後の底部に取り付けられたままカプセル/上皮を、それをロールオフ、離れて繊維の塊を押してください皿。ディッシュ内のすべてのレンズで、このプロセスを続けます。繊維の質量を(またはそれらが他の研究のためのレンズ蛋白質の源として凍結保存)を取り外して廃棄します。
パート3:中央の外植片のマイクロダイセクションと文化
材料と試薬:
- 滅菌使い捨てメス、#15ブレード、(シンシナティ外科株式会社シンシナティ、オハイオ州)
- 滅菌リン酸塩はカルシウムとマグネシウム(Invitrogen社、カールスバッド、カリフォルニア州)と緩衝生理食塩水
- 培地:100ng/mlのFGF - 2(シグマ - アルドリッチ社セントルイス、MO)を含む懸濁培地。
手順:
- 滅菌メスを使用して、のみ(CE)(図の中央の上皮細胞で構成され、側に中央広場では約2.0ミリメートル残して、差別化(図1A)の初期段階で細胞を含む末梢上皮(PE)を、切り落とす1B)。
- バイオセーフティキャビネットに中央の植片を含んでいる皿を転送する。新鮮な、平衡化(37℃、5%CO 2)懸濁培地を1mlで一度滅菌PBSを含むカルシウムとマグネシウムで3回洗浄し。これらは、汚染の可能性を大幅に削減洗う。
- 分化1を誘導し、37℃加湿、組織培養インキュベーターで外植片を配置するために培養液の2mLの追加° C、5%CO 2を 。文化の期間は数時間な限り短くしたり、研究されているパラメータに応じて、限り2〜3週間として延長することができる。培地は2〜3日ごとに変更する必要があります。
パート4:分化に関連するイベントの分析のための植の収穫
1。タンパク質やRNAの解析のための収穫植
材料:
- Microdissectingピンセット
- SDS溶解バッファーまたはRNA -後
手順:
- 潜伏期間の終わりに、培養液を取り除く。
- ステレオ解剖顕微鏡を使って、静かにそれぞれ植の端を緩める。
- ピンセットで各植片を持ち上げて、100μlのSDS溶解緩衝液(タンパク質分析用)またはRNA -以降(RNA分析用)についての入ったチューブに移す。外植片はピンセットに固執しないことを保証するために溶液中でピンセットの先端に撹拌。
2。免疫蛍光のための収穫植
材料と試薬:
- リン酸塩はカルシウムとマグネシウム(Invitrogen社、カールスバッド、カリフォルニア州)と緩衝生理食塩水
- リン酸(Invitrogen社、カールスバッド、カリフォルニア州)(カルシウムおよびマグネシウムを含まない)緩衝生理食塩水
- 4%パラホルムアルデヒド(ボストンのバイオ製品、ウスター、MA)
- Microdissectingピンセット
- 疎水性マーキングペン
- 顕微鏡用スライドガラス
- 0.25パーセントリン酸塩のトリトンX - 100は、緩衝生理食塩水。
手順:
- PBSは、カルシウムとマグネシウムを含むで簡単に外植片を洗い流す。
- 室温で30分間、4%パラホルムアルデヒドを添加することにより組織を固定してください。
- 固定液を取り出して、リン酸緩衝生理食塩水と交換してください。固定片は、それらが免疫染色のために持ち上げてスライドガラスに転送できるように、多少堅くなる。
- ポジション組織を支援し、カーリングを防止するために、スライド上でPBSの小滴を(カルシウムおよびマグネシウムを含まない)に置きます。 microdissectingピンセットを使用して、外植片を持ち上げ、スライド上のドロップに挿入します。外植片に触れることなく、慎重にガラス上に外植片を平らにし、3〜5分間、室温で空気中の組織を乾燥させるために紙の芯に液体を取り除く。
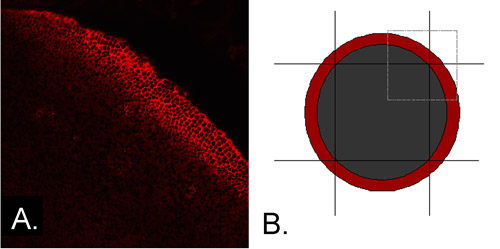
図1 A.、末梢上皮には分化特異的タンパク質を発現する。示すように、外植片はすぐに顕微解剖の後、N -カドヘリンのために免疫染色した。式がこの地域で細胞が分化し始めていることを示し、末梢上皮の細胞のバンドに見られる。B.は末梢上皮が発現するN -カドヘリンと他の分化特異的タンパク質その細胞を除去するために離れてトリミングすることができます。小さな四角が灰色に記載されている間、赤い円環は、急行N -カドヘリンそのセルの位置を表しますパネル1Aに示すように上皮の象限を表しています。末梢上皮はまだ区別するために開始されていないセルだけが含まれている中央広場を残して、4つのメスをカットして除去することができます。
ディスカッション
ラットのレンズの外植片のシステムが正常水晶体線維21,3,4,5に水晶体上皮細胞の分化を研究する研究室の数によって使用されています。 100ng/mlの時にFGF - 2にさらされると外植片は、形態と遺伝子発現の変化は数日間にわたって順次3,4,5を表示されると、分6内シグナル伝達に変更を表示するために開始されます。注意が汚染を防止するために取られれば文化は2-3週間生き抜く。
FGF - 2の前に分化マーカーを発現あらゆる細胞は1,5を追加された場合、彼らはいくつか含まれているので、このプロトコルで説明されている中央の外植片は、分化に関連するイベントのシーケンスを研究するために特に便利です。細胞は、それが可能な分化に関連するシグナル伝達および転写イベントの時間的経過を追跡すること、コホートとして、同期的に分化する。時間の長さが異なるため、培養の外植片は、このようにシーケンスのイベントについての正確な時間情報を提供します。特異的阻害剤は、関連するシグナル伝達経路を特定するために、培養培地に添加してもよい。外植片をSDSゲル電気泳動とイムノブロッティングによるタンパク質の発現を分析したり、RT - PCRによる特定のmRNAの発現を分析するために使用されることがあります。培養期間の長さに応じて、600 ngの/植 - 20から50μgの/植とRNAの収量からのタンパク質収量の範囲は約200です。我々は一般的に皿あたり5から6の外植片は、いくつかのアッセイに十分なタンパク質やRNAを提供することを見つける。外植片からのRNAは、分化に重要である可能性新規遺伝子を識別することができるマイクロアレイ解析により遺伝子発現を評価するためのcDNAを調製するために使用することができます。外植片は、トランスフェクトすることができる。トランスフェクション効率は一般的に低いですが、それは、レポーター遺伝子4をアッセイするための十分です、7、8。外植片の免疫蛍光顕微鏡は、目的のタンパク質の細胞内局在を決定することにより、生化学的方法に有用な補助を提供します。従って、ラットのレンズの外植片の準備と文化は、このようなトランスジェニックやノックアウトマウスの作製など、生体のテクニックで補完することができる哺乳類で、端末のレンズの分化を研究するための強力なシステムを、提供します。
謝辞
水晶体上皮片の調製は、ドクタージョンマカヴォイ9の実験室で生まれたの方法から適合されています。この作品は、国立眼研究所、学内研究プログラムZ01 - EY000238 - 22によって資金を供給される
参考文献
- McAvoy, J. W., Chamberlain, C. G. Fibroblast growth factor (FGF) induces different responses in lens epithelial cells depending on its concentration. Development. 107 (2), 221-228 (1989).
- Campbell, M. T., McAvoy, J. W. Onset of fibre differentiation in cultured rat lens epithelium under the influence of neural retina-conditioned medium. Exp Eye Res. 39 (1), 83-94 (1984).
- Lovicu, F. J., McAvoy, J. W. Structural analysis of lens epithelial explants induced to differentiate into fibres by fibroblast growth factor (FGF). Exp Eye Res. 49 (3), 479-494 (1989).
- Golestaneh, N., Fan, J., Fariss, R. N. Lens major intrinsic protein (MIP)/aquaporin 0 expression in rat lens epithelia explants requires fibroblast growth factor-induced ERK and JNK signaling. J Biol Chem. 279 (30), 31813-31822 (2004).
- Saravanamuthu, S. S., Gao, C. Y., Zelenka, P. S. Notch signaling is required for lateral induction of Jagged1 during FGF-induced lens fiber differentiation. Dev Biol. 332 (1), 166-176 (2009).
- Lovicu, F. J., McAvoy, J. W. FGF-induced lens cell proliferation and differentiation is dependent on MAPK (ERK1/2) signalling. Development. 128 (24), 5075-5084 (2001).
- Dirks, R. P., Kraft, H. J., Van Genesen, S. T. The cooperation between two silencers creates an enhancer element that controls both the lens-preferred and the differentiation stage-specific expression of the rat beta B2-crystallin gene. Eur J Biochem. 239 (1), 23-32 (1996).
- Yang, Y., Stopka, T., Golestaneh, N. Regulation of alphaA-crystallin via Pax6, c-Maf, CREB and a broad domain of lens-specific chromatin. The EMBO journal. 25 (10), 2107-2118 (2006).
- McAvoy, J. W., T, V. Neural retinas promote cell division and fibre differentiation in lens epithelial explants. Curr Eye Res. 3 (6), 827-834 (1984).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved