このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
のライブイメージングキイロショウジョウバエ胚性血球移行
要約
ショウジョウバエの血球は胚の全体にわたって分散させる。このプロトコルは、蛍光標識した血球で胚を使用してこれらの移行をマウントし、イメージする方法を示します。
要約
使用して多くの研究のアドレスの細胞遊走
プロトコル
準備
- 血球特異Gal4のドライバ(例:SRP - Gal4の 2)とUAS制御(例えば、UAS - GFP)の下で遺伝的に符号化された蛍光レポーターを含む適切なショウジョウバエの行を取得します。 SRP - GAL4、UAS - GMA 3またはCRQ - GAL4、UAS - GFP 4、5のホモ接合体ハエは、イメージングのために(NB GMAはモエシンのアクチン結合ドメインに融合したGFPです)特に有効です。については下記を参照してくださいGal4のドライバーとUASの範囲は(ブルーミントン証券センターでは様々なを含む)利用可能な構築。
- 一般的に遺伝的交雑は、その突 然変異対立遺伝子をGal4のドライバと代替相同染色体上に運ばUAS構築物で、蛍光バランサCTGまたはTTG 6を使用してバランスしている行われている。これはCTG / TTG関連GFP蛍光(このはステージ2.11で行われる)の有無に基づいてホモ接合変異体を選択することが可能になります。
- リンゴジュース寒天プレート7と産卵ケージに株式や場所のハエを増幅する。ハエは、十分な胚が敷設され始める前に敷設ケージに慣れるために最低2日必要です。一般的に雌雄各二十ハエは、イメージングのための十分な胚を生成するために十分なはずですが、それは別の線が生殖能力の度合いが異なることに留意すべきである。私たちは、空気の流れを可能にするために、その基部に穴を開け、プラスチックビーカーの底部に収まる55ミリメートルペトリ皿を、使用してください。胚のコレクションの正確な意味は重要ではありませんが、タイミングは胚の段階を正しく収集するために不可欠です。
- 25℃を維持して一晩リンゴジュース寒天プレートからまたはタイムアウトしたプレートから胚を収集する。後者について我々は一般的にハエがプレートを取り外すと前胚の取り付けに15〜16時間18 ° Cでそれを配置する前に、4時間予め温めておいた皿にレイアウトすることができますが、これは後半ステージ12からを通じて胚を提供します。開発の15段階まで。一晩プレートはステージの多様化が含まれているが25時間の長い期間に起因する血球細胞における蛍光レポーターの発現の高いレベルの利点を提供° CはGAL4 - UASシステムとして、温度に敏感です。
手順
- 少量の水と柔らかい先端絵筆を使ってリンゴジュース寒天プレートから胚を押しのける。外れた胚は、肉眼で容易に見ることができます。
- セルストレーナー(フィッシャー)に胚を移したり、排水を収集するためにビーカーに開催されたバスケットにリンゴジュース寒天プレートから水を注ぐことによってバスケット7のホームメイド。
- あなたがリンゴジュース寒天プレートから転送された十分な胚を持って満足するまで、手順2.2を繰り返します。
- 水を使用してセルストレーナー/バスケットで胚を洗浄してください。
- リンゴジュース寒天プレートのペトリ皿の蓋の場所のセルストレーナー/バスケットと十分なセルストレーナー/バスケットに胚を中断するためにきちんとした漂白剤を追加。
- 明視野の下に解剖顕微鏡で胚のdechorionationに従ってください:dechorionationは2分以内に発生する必要のある、背の付属物が溶解したときに完了です。
- 漂白剤から胚を含むセルストレーナー/バスケットを取り外し、水を使用して残留漂白剤を洗い流す。漂白剤のすべてのトレースは2.8段階に進む前に削除する必要があります。すべての漂白剤が除去されたかどうかを評価する1つのトリックは、青い色の実験室組織に残留水をオフブロットになります - 残留漂白剤が存在する場合、青色がピンク/白漂白されます。
- セルストレーナー/バスケットの下側に適用される研究室組織/ mediwipesを使用して残りの水をオフに汚点。
- ペトリ皿の蓋で水の液滴を配置。細かい絵筆で、胚のバスケットからすべてdechorionated胚を収集し、液滴に再懸濁します。次のマイクロピペットを用いて水を吸引したり、慎重に実験室での組織/ mediwipesでそれを吸収することにより胚を乾燥させる。
- 胚が乾燥したら、すべての胚をカバーするためにvoltalef油の滴を追加します。胚を含む液滴に隣接する油の第二の小さなドロップを置く。 NBは、我々はvoltalef油の英国ベースのサプライヤーを見つけることができませんでした;ハロカーボンのオイル700(Sigma)を代わりに使用することができます。
- 蛍光解剖顕微鏡下で適切に油滴から時計ピンセット(5番)のペアを使用して、目的の遺伝子型の胚を上演選択。これらの鉗子は、卵黄膜に穴を開けることなく、胚をすくい上げるために、曲げ内側(図1)でなければなりません。第二次オイル滴に選択された胚を移す。それはあなたが共焦点顕微鏡(図2)で良好な画像を収集できるようにするために解剖顕微鏡で蛍光血球を見ることができることが重要です。我々は通常、腹側正中またはステージ15胚の血球の画像横移行する段階14分の13の胚をマウントします。画像胚上に分散、以下の血球の運動をする。
- それらの(図3)の間に約1cm残し、voltalef油の2つの小さな滴を使用して、Petriperm / Lumoxディッシュ(ザルスタット)の下側に2つのカバーグラス(18x18mm、厚さ1)を守っています。これらは、上に配置カバースリップをサポートするために使用されます。胚は、これはそれらを押しつぶすためではない。 Petripermの皿(直径50mm)は疎水性、ガス透過性膜が含まれています。我々は、料理は、彼らが(料理は70%エタノールで拭くと再利用できる)を複数回使用された後、より使いやすくなることがわかります。
- 解剖顕微鏡で明視野の下に、カバースリップの端(図3)までと平行に曲がったピンセットとライン、それら腹側で選択された胚を一つずつピックアップ。あなたの器用さと忍耐によっては、この方法では15胚まで揃えることが可能です。胚とPetriperm皿膜の両方が壊れていると簡単に破裂することができるとして、それは穏やかに胚を操作することが重要です。
- 一度胚は油の小滴を追加し、これに2つのカバーガラスの間に均一な層を形成するために広がっせ整列されます。油が広がっている後に(これは数分かかる場合があります)胚がまだ腹側であることを確認してください。胚はわずかにロールバックしている場合は、鉗子で再びそれらを再配置。
- 最後に、ピンセット(3番)場所いた2つの付着したカバースリップ上休んで胚オーバーカバー(18x18mm、厚さ1)を、使用して。カバースリップに接着剤このカバーはマニキュアを(図3)を使用してサポートしています。
- 共焦点または広視野顕微鏡にマウントされている胚でPetriperm皿を取り、適切なアダプタを使ってステージ上でPetriperm皿をマウント。正立または倒立顕微鏡は、カバースリップを介して焦点対物レンズ(のような膜を介してではなく)で、いずれも使用可能である。
代表的な結果:
このプロトコルは、胚の腹側にある血球のライブイメージングのために、ショウジョウバエの胚をマウントする方法について説明します。正しく行えば、それは、血球の静止画または動画のどちらかを生成することが容易になります。主要な決定要因は、画像血球を(特に対物レンズの)ために使用する顕微鏡ですが、取得した画像の性質にも開発の段階に依存する、温度は胚がで育ち、Gal4のとUASラインを使用した。
蛍光タンパク質の発現の高いレベルは、血球がより簡単に撮像されるようになります、したがって、それは(図2は胚内で明確な血球の例が含まれている、で撮影した胚はプロトコルの段階2.11にいるときは血球を見ることができることが重要です解剖顕微鏡に取り付けたカメラ)。 Gal4のとUASの構造のそのための増加の数値が高い信号対雑音比を有効にします。さらに、これは順番に血球挙動を可能にするイメージングは、より長い期間にわたって続くことに高いレーザー強度の増加または露光時間の必要性が軽減されます。
GFP発現の非常に高いレベルは、円形の細胞体(図4A - B)を囲む、特に血球形態の細部、薄いシート状のラメラが表示されます。 GFPを除く円形の領域は、ファゴソーム(図4A - C)を表しています。指状の糸状仮足もラメラ(図4B)から出て見ることができます。二つのGal4のドライバが1つ以上のがSRP - Gal4の (議論を参照)である場合は特に、(図4C)これらのプロセスを参照するのに十分残っている、しかし遅いスキャン速度や共焦点顕微鏡に大きなレーザーパワーが必要になることがあります。発現レベルが低下するとして、それは画像血球の突起をすることはより困難になり、それにもかかわらず、それは、突起が(図4D)あまり明確な場合であっても細胞体が明らかに残っているとして、これらの条件の下で血球の移行を追跡することも可能です。
開発の初期段階(ステージアップ13〜)血球が互いに密接に連絡を移行し、それは個々の細胞を区別することは困難です。ステージの終わりで13血球は、腹側正中(図5A)ダウン単一の行を形成して、その後、より多くの運動になって、腹側神経索(図5B)の端に横方向に移行する。血球の動的な突起内のアクチン細胞骨格は直接GMA(図5C)や桜モエシンの発現を通して観察することができます。
このように胚をマウントすると、ガス交換を可能にし、脱水を防ぎ、胚は、実行可能な以下の画像のまま。胚は、それをマウント中に破損している場合、胚のコンテンツは、その卵黄膜を介して漏洩するとして、一般的に明白です。胚はその後、脱水を開始しない場合、これは多くの場合、卵黄膜の変形が見られたこともできます。時折胚のタイムラプスムービーの途中でロールバックされます、しかしこれだけ長いタイムスケールの映画の問題となる傾向があります。 Lastlyは、一度に複数の胚をマウントすると、実験家に彼らの実験に最適な向きで胚を得る絶好のチャンスを与えます。

図1。 dechorionated胚の操作のための鉗子 。
時計職人鉗子(サイズ番号5)のヒントがここに示されているように胚をすくい上げるためのツールのファッションへ順番に曲げ内側にする必要があります。彼らはパンク胚をアップできる鋭いエッジを持っていないとしてPetriperm膜上に配置するときに曲がって地域の外表面には、胚を操作すると便利です。
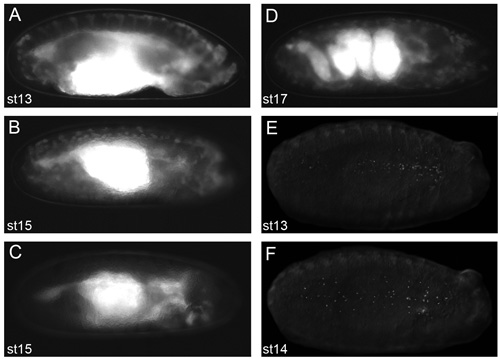
図2。良いライブイメージングの結果が得られる胚の代表的な画像 。
voltalef油でdechorionated胚(プロトコルの段階2.11時)の画像は、蛍光実体顕微鏡で撮影。 CRQ - GAL4、UAS - GFPの胚、ステージ13(A)とステージ15(B)SRP - GAL4、UAS - GFPの側面図。ステージ15 SRP - GAL4、UAS - GFP / +の側面図、CRQ - GAL4、uas-GFP/uas-N17Racの胚は(C)これで血球は時血球どのようなものかを胚実演、ヘッドからの移行に失敗しているそれらの渡り鳥の経路に沿って明らかではありません。開発(D)のこの段階で腸内の複雑な構造を示すCRQ - GAL4、UAS - GFPの胚;ステージ17 SRP - GAL4、UAS - GFPの側面図筋収縮の発症は、これ以上の胚のライブイメージングを防止開発の段階。ステージ13(E)とステージ14の腹側のビュー(F)SRP - Gal4の、蛍光標識した核と血球の分散を示すUAS -赤スティンガーの胚。プロトコルの段階で2.11での蛍光による血球の観察は、優れた画像を得るための前提条件であり、前方には、すべての画像の右側にあります。

図3。 Petriperm / Lumox皿に胚の取付け 。
二つ18x18mmカバースリップ(厚さ1)に示すように約1cmで区切られた油の小滴を、使用してPetriperm皿の底面に貼り付けています。胚はその後、カバースリップの端に彼らの長い(前後)方向の平行と腹側を上に並べられ、油の小滴で覆われている。一度油はサードカバースリップ(18x18mmの厚さ1)を静かに押しつぶされてから胚を防ぐために、ブリッジとして2つの以前に付着したカバーグラスを使用して油で覆われた胚の上に配置されている2つのカバーグラスの間のギャップを埋めるために広がっている。このカバーは、マニキュアの二つの小さな滴を使用して、2つのカバースリップのブリッジに糊付けされています。一度設定すれば、胚は、カバースリップを下に焦点対物レンズ(のようなPetripermの膜を介してではなく)と正立または倒立顕微鏡上に結像することができます。
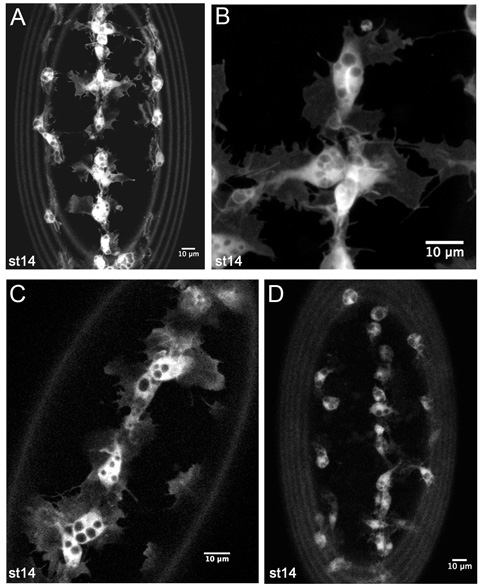
図4。 GFP標識した血球のライブイメージングから代表的な結果 。
CRQ - GAL4、UAS - GFPの胚(AB)、ステージ14 SRP - GAL4、UAS - GFPの腹側にある血球のZ -予測。 (A)タイムラプスムービーで血球発達移行を監視するために使用されるような低倍率の画像です。 (B)、その形態の細かい詳細を示す、腹側正中線上の血球のさらに高い倍率です。 Gal4のドライバーとUASのそれより低いコピー数を明らかに、CRQ - GAL4、UAS - GFP / +胚、(C)ステージ14 SRP - GAL4、UAS - GFP / +の腹側正中線上血球の単一の1 mのスライスです。構文はまた、良好な画像を生成するのに十分です。 (D)ステージ14 CRQ - GAL4、UAS - GFPの胚における血球のz -射影を表示します。ここで血球突起が原因でGFPの低い発現にはあまり明白ですが、それは映画を作るとGal4のドライバとUAS構築のこの組み合わせで血球移行を追跡することも可能です。画像は、ライカLSM510共焦点顕微鏡で撮影した、前方には、すべての画像で、最大であり、画像の周辺部でのリングは卵黄膜の自家蛍光によって引き起こされます。

図5。 GMA表現する血球のライブイメージングから代表的な結果 。
Z -突起ステージ13()とステージ14(B)SRP - GAL4、UAS - GMAの胚、血球の発育への移行を表示するボックスに追加映画から取られたの腹側正中線上に血球の。アクチンダイナミクスの詳細情報は、GMA表現血球(C)の高倍率撮影することにより得ることができる。 GMAはモエシンとラベルアクチンフィラメントのアクチン結合ドメインに融合したGFPで構成されています。前方には、すべての画像で最高であり、画像は共焦点顕微鏡で撮影された。
ディスカッション
この手順の最も重要な要素は明記された血球との健全な胚の選択であり、それらを傷つけることなく慎重にそれらをマウントする。一度胚は、脱水に耐性があると一度にマウントされている数時間のためにイメージングすることができるハロカーボンのオイルになります。私たちの手では40倍の目標と私たちのツァイスLSM510共焦点顕微鏡で3分ごとに画像のz -スタックを取っ胚やフォトダメー?...
謝辞
このプロトコルは、ポールマーティンとアントニオサンジャシントの研究室とのコラボレーションの中でとの我々の仕事を通じて開発されています。我々は、フライラインを共有し続けるための素晴らしいサービスとショウジョウバエコミュニティのためのブルーミントンストックセンターに感謝します。 BSは現在BBSRCプロジェクトの助成金によって賄われています。 WWは、ウェルカムトラストのキャリア開発奨学金によって運営されている。
資料
| Name | Company | Catalog Number | Comments |
| Cell strainer | BD Biosciences | 352350 | 70μm pores |
| Halcarbon oil 700 | Sigma-Aldrich | H8898 | |
| Lumox/Petriperm dish | Sarstedt Ltd | 96077305 |
参考文献
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Bruckner, K. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Dev Cell. 7, 73-84 (2004).
- Dutta, D., Bloor, J. W., Ruiz-Gomez, M., VijayRaghavan, K., Kiehart, D. P. Real-time imaging of morphogenetic movements in Drosophila using Gal4-UAS-driven expression of GFP fused to the actin-binding domain of moesin. Genesis. 34, 146-151 (2002).
- Stramer, B. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Halfon, M. S. New fluorescent protein reporters for use with the Drosophila Gal4 expression system and for vital detection of balancer chromosomes. Genesis. 34, 135-138 (2002).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila protocols. , (2000).
- Tepass, U., Fessler, L. I., Aziz, A., Hartenstein, V. Embryonic origin of hemocytes and their relationship to cell death in Drosophila. Development. 120, 1829-1837 (1994).
- Millard, T. H., Martin, P. Dynamic analysis of filopodial interactions during the zippering phase of Drosophila dorsal closure. Development. 135, 621-626 (2008).
- Doerflinger, H., Benton, R., Shulman, J. M., St Johnston, D. The role of PAR-1 in regulating the polarised microtubule cytoskeleton in the Drosophila follicular epithelium. Development. 130, 3965-3975 (2003).
- Olofsson, B., Page, D. T. Condensation of the central nervous system in embryonic Drosophila is inhibited by blocking hemocyte migration or neural activity. Dev Biol. 279, 233-243 (2005).
- Paladi, M., Tepass, U. Function of Rho GTPases in embryonic blood cell migration in Drosophila. J Cell Sci. 117, 6313-6326 (2004).
- Vlisidou, I. Drosophila embryos as model systems for monitoring bacterial infection in real time. PLoS Pathog. 5, e1000518-e1000518 (2009).
- Jacinto, A. Dynamic actin-based epithelial adhesion and cell matching during Drosophila dorsal closure. Curr Biol. 10, 1420-1426 (2000).
- Wood, W., Jacinto, A. Imaging cell movement during dorsal closure in Drosophila embryos. Methods Mol Biol. 294, 203-210 (2005).
- Kunwar, P. S. Tre1 GPCR initiates germ cell transepithelial migration by regulating Drosophila melanogaster E-cadherin. J Cell Biol. 183, 157-168 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved