Method Article
植物細胞壁の包括的な組成分析(リグノセルロース系バイオマス)パートI:リグニン
要約
植物バイオマスは、バイオ燃料の生産に使用できる主要なカーボンニュートラルな再生可能な資源です。植物バイオマスは、主に細胞壁、リグノセルロースと呼ばれる構造的に複雑な複合材料で構成されています。ここでは、コンテンツとポリフェノールリグニンの組成の包括的な分析のためのプロトコルについて説明します。
要約
産業と社会のための再生可能エネルギー、カーボンニュートラル、そして持続可能な原材料の必要性は、21世紀の最重要課題の一つとなっている。これは輸送用液体燃料の生産のための工業用原料としての植物製品の使用に関心を再燃させたている
プロトコル
1。細胞壁の分離
- iWallを使用して2ミリリットルザルスタットスクリューキャップチューブ、研削及び調剤ロボット(30秒)で5.5 mm、ステンレス鋼ボールで空気または凍結乾燥植物の材料の約60 - 70mgを挽く。ボールミル(retschmill)を使用して代替の非ロボットの低スループットの手順は、第II部2に示す。
- 徹底的に分注された地盤材料を70%エタノール水溶液を1.5 ml加え、ボルテックス。
- ペレットアルコール不溶性残渣への10分間10,000 rpmで遠心する。
- 上清を吸引したり、デカントする。
- ペレットを再懸濁するために残渣にクロロホルム/メタノール(1:1 v / v)の溶液1.5mlを加え、よくチューブを振る。
- 10分と吸引または上清をデカントし、10,000 rpmで遠心。
- アセトン500μlのでペレットを再懸濁します。
- 乾燥するまで35℃の空気の流れ° Cで溶媒を蒸発させる。
必要に応じて乾燥試料は、さらに処理するまで室温で保存することができます。 - サンプルから澱粉の除去を開始するには0.1 Mの酢酸ナトリウム緩衝液pH 5.0を1.5 mlでペレットを再懸濁します。
- 20分間ザルスタット管と熱にフタを。 80℃の加熱ブロックインチ
- 氷の上に、懸濁液を冷却する。
- ペレットには、次のエージェントを追加:0.01%アジ化ナトリウム(NaN3)の35μlの、35μlのアミラーゼ(50μg/ mlのH 2 O、 バチルス属から、シグマ)、17μlのプルラナーゼ( 枯草acidopullulyticusから17.8単位;シグマ) 。チューブと徹底的にボルテックスにフタを。
- 懸濁液を37℃で一晩インキュベート°回転シェーカーでC。管を配向させる水平側近は改良混合。
- 100℃の熱サスペンション° C消化を終了するために加熱ブロックに10分間。
- 遠心(10,000 rpm、10分)とを含む上清を可溶化された澱粉を捨てる。
- 、1.5 mlの水を加えボルテックス、遠心分離、洗浄水からデカンテーションによって、残りのペレット3回洗浄する。
- アセトン500μlのでペレットを再懸濁します。
- 乾燥するまで35℃の空気の流れ° Cで溶媒を蒸発させる。それはよりよい乾燥用スパチュラでチューブの材料を分割することも必要になる場合があります。
乾燥した材料は、単離された細胞壁(リグノセルロース)を提示。必要に応じて乾燥試料は、さらに処理するまで室温で保存することができます。
2。リグニン含量
このメソッドは、福島とハットフィールド3で報告された方法に基づいています。
- 1量る - 調製した細胞壁の材料の1.5ミリグラム(1を参照)ブランクのための空のチューブを残し、2 mlのメスフラスコにする。
- チューブの底に細胞壁の材料を収集し、空気の流れの下で非常に優しいアセトンを蒸発させるためにアセトン250μlをチューブの壁を洗う。
- ゆっくりと水はねを防止するためにチューブの壁に沿ってたてのアセチルブロマイド溶液100μl(25%氷酢酸でV / Vアセチルブロマイド)を追加します。
- 50キャップのメスフラスコと熱° 2時間のためのC
- 15分毎にボルテックスで追加の時間のための熱。
- 室温に氷上で冷却してください。
- 2M水酸化ナトリウムと作りたての0.5 M塩酸ヒドロキシルアミン70μlの400μlを添加する。渦メスフラスコ。
- 氷酢酸を持っている2.0 mlのマーク、キャップに正確にメスフラスコをいっぱいにして混在させることを数回転倒。
- ピペットUV特定の96ウェルプレートへの溶液200μlと280nmでELISAリーダーで読み取る。
- (;草= 17.75;ポプラ= 18.21 シロイヌナズナ = 15.69)、適切な係数を用いて臭化アセチル水溶性リグニン(%ABSL)の割合を決定し、次の式で:
%ABSL Calcの: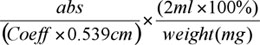
UG / mgの細胞壁のユニットで10件の検索結果で%のABSLの乗算
それは、少なくとも3プレートは微粒子の吸光度値のわずかな変動を引き起こす可能性があるので、吸光度(ABS)を平均化する読み取り行うことができます。注:0.539センチメートルは、光路長を表しますが、板によってはこれを決定する必要があります。
3。リグニン組成
このメソッドは、ロビンソンとマンスフィールド5で発表された最近の方法を採用したものになっています。
- thioacidolysis用スクリューキャップ付きガラス管に(1を参照。)細胞壁の材料の約2 mgを転送する。
- 慎重に2.5パーセント三フッ化ホウ素ジエチルエーテレート(BF 3)、10%エタンチオール(EtSH)溶液を調製。あなたは、窒素とジオキサンボトルで失われたボリュームを置換する窒素ガスを充填した気球を使用する必要があります。ジオキサンが非常に有害である、フードの中から試料や装置を取ることはありません。サンプルあたりの溶液の調製に必要なボリューム:ジオキサン175μL、20μLEtSH、5μlのBF 3。
- EtSH、BF 3、各サンプルのジオキサン溶液200μlを加え。
- すぐに窒素ガスとキャップ付きパージバイアルヘッドスペース。
- 100℃熱°だけ時間混合穏やかで4時間。
- 氷上で5分間冷却することにより、エンド反応。
- 0.4M重炭酸ナトリウム150μlの、渦を追加
- クリーンアップのために1mlの水と酢酸エチル0.5mlの、渦と相が分離することができます(上に酢酸エチル、底面の水)を追加します。
- 2ミリリットルザルスタットチューブに酢酸エチル層を150μlを移す。ない水が転送されていないことを確認します。
- 空気とコンセントレータで溶剤を蒸発させる。
- (2回の合計のために繰り返す余分な水分を除去)200μlのアセトンを追加し、蒸発させる。
- TMS誘導体化のために酢酸エチル500μlの、ピリジン20μlを、そしてN、各チューブにO -ビス(トリメチルシリル)アセトアミドの100μlを加える。
- 25℃で2時間インキュベート℃に
- GC / MSバイアルに反応液100μlを移し、アセトン100μlを加える。
- 四重極質量分光器または炎イオン化検出器付きGCによるサンプルを分析する。 AgilentのHP - 5MSカラムは、(X 0.25ミリメートル× 0.25μmの膜厚30mm)をインストールされています。以下の温度勾配を30分間溶剤遅延および1.1 ml / minの流速で使用されています:130イニシャルホールド℃で3分間、3℃〜250℃/分のランプ℃、1分間保持;を許可130℃の初期温度に平衡化
- ピークはそれぞれ、テトラコサン内部標準(オプション)を使用して相対保持時間によって、または299メートル/ zの、269のm / z、およびSの239メートル/ Z、G、およびHの単量体の特性マススペクトルのイオンによって識別されます(図を参照してください。 2)。リグニン成分の組成は、100%に、総ピーク面積を設定することによって定量化される
4。代表的な結果
壁の解析の例を図2に示す。この場合にはポプラの幹(木)は、プロトコルのセクションで概説、様々な手順で分析した。 thioacidolysisとTMS -誘導体化後のリグニン成分の分離の例のクロマトグラムが表示されます。明らかに、syringyl -(S)の相対量、guaiacyl -(G)、およびp - hydroxyphenol -(H)の単位を決定することができます。臭化アセチル水溶性リグニンの含有量は自明であり、一つは壁乾燥重量の20〜50%の間の値を期待することができます。一つは、臭化アセチルを壁にリグニンの存在のすべてを可溶化しない、と可溶化の程度は材料によって異なることに注意する必要があります。しかし、この方法は、比較的実施しやすいと急速であり、リグノセルロース材料のリグニン含量の優れた近似を与える。

図1:。リグノセルロースの分析の概要細胞壁(リグノセルロース)は、原油乾燥植物材料から分離されています。壁材は、アリコートに重み付けをし、様々なアッセイのために分割されます。壁材は、臭化アセチルとUV -分光法により定量化可溶化したリグニンと扱われます。リグニンの組成の決定については、壁材はthioacidolysisに供される。可溶化されたフェノール類は、TMS誘導体化を受け、その後分離し、GC - MS分析により定量することができる。マトリックス多糖類組成と結晶セルロースのコンテンツのプロトコルは、パートII 2で説明されています。
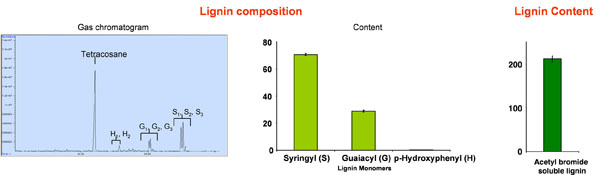
図2:ポプラ( ポプラtremoloides)からポプラ樹木木材チップの包括的なリグノセルロースの分析は、記載されているプロトコルに供した。
Ligin組成物; H のp -ヒドロキシフェニル、G guaiacyl、S syringylユニット。
ディスカッション
記載された方法は、リグニン含量とリグノセルロース植物バイオマスの組成の迅速な定量的評価を有効にしてください。 iWallのロボットを使用して約350試料を粉砕し、日ごとに分配することができます。お一人様、様々な分析手法のスループットが異なります。プロトコルを使用すると、30サンプルを一日あたりのリグニン組成物のためリグニン含量のために処理し、15することができる、ここで説明する。データに最適な原料作物の定量的な性質のために、様々なまたは遺伝子型は、バイオ燃料生産のためのその適合性の観点で評価することができる。
謝辞
私たちは、優れた技術サービスとジョンラルフ、貴重なアドバイス、ディスカッション、およびポプラの木のサンプルのウィスコンシン大学のマシューロバートウェザーに感謝しています。この作品は、科学局、米国エネルギー省(DOE)五大湖バイオエネルギー研究センター(科学DE - FC02 - 07ER64494のDOE BER局)によって、化学科学、地球科学およびバイオサイエンス部門、基礎エネルギー科学局によって資金を供給された、米国エネルギー省(賞なし。DE - FG02 - 91ER20021)。
資料
| Name | Company | Catalog Number | Comments |
| Hydroxylamine Hydrochloride | Sigma-Aldrich | 255580 | |
| Acetyl Bromide | Aldrich | 135968 | |
| Ethanethiol | Sigma-Aldrich | E3708 | |
| Borontrifluoride diethyl etherate | Fluka | 15719 | |
| N,O,-Bis(trimethylsilyl) acetimide | Fluka | 15241 | |
| Dioxane | Sigma-Aldrich | 296309 | |
| Spectromax Plus 384 | Molecular Devices | Plus384 | |
| GC-MS | Agilent Technologies | 6890 GC/5975B MSD | (lignin composition) |
| 5.5mm Stainless Steel Balls | Salem Ball Company | (N/A) | |
| 96 well plate heat spreader | Biocision | Coolsink 96F | |
| Heating block | Techne | Dri-block DB-3D | |
| Sample concentrator | Techne | FSC400D |
参考文献
- Carroll, A., Somerville, C. Cellulosic Biofuels. Annual Review of Plant Biology. 60, 165-165 (2009).
- Foster, C. E., Martin, T., Pauly, M. Comprehensive compositional analysis of Plant Cell Walls (Lignocellulosic biomass), Part II: Carbohydrates. J Vis Exp. , (2010).
- Fukushima, R. S., Hatfield, R. D. Extraction and isolation of lignin for utilization as a standard to determine lignin concentration using the acetyl bromide spectrophotometric method. J. Agric. Food Chem. 49 (7), 3133-3133 (2001).
- Pauly, M., Keegstra, K. Cell-wall carbohydrates and their modification as a resource for biofuels. Plant J. 54 (4), 559-559 (2008).
- Robinson, A. R., Mansfield, S. D. Rapid analysis of poplar lignin monomer composition by a streamlined thioacidolysis procedure and near-infrared reflectance-based prediction modeling. Plant J. 58 (4), 706-706 (2009).
- Somerville, C. Toward a systems approach to understanding plant-cell walls. Science. 306 (5705), 2206-2206 (2004).
- Teeri, T. T., Brumer, H. Discovery, characterization and applications of enzymes from the wood-forming tissues of poplar: Glycosyl transferases and xyloglucan endo-transglycosylases. Biocatalysis and Biotransformation. 21, 173-173 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved