このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
生細胞で蛍光タンパク質とのデュアルプローブ光の強調表示を精製の光変換
要約
このプロトコルは、共焦点レーザー走査型顕微鏡に蛍光タンパク質の光変換を実行するための一般的なアプローチを説明します。我々はpuriedタンパク質試料の光変換用だけでなく、mOrange2とドロンパと、生細胞におけるデュアルプローブ光学ハイライトするための手順を説明します。
要約
Photoconvertible蛍光タンパク質は、(PC - FPS)蛍光の色が特定の波長の光への曝露によって変更することができることを意味する、"光学式ハイライト"機能を持つ蛍光タンパク質のクラスです。光の強調表示は、非侵襲的蛍光分子の集団をマークすることを許可されているので、単一の細胞または細胞小器官を追跡するのに最適です。
効率的な光変換のための重要なパラメータは、光電変換光の強度と露光時間です。強度が低すぎる場合、光変換は全く発生が遅いかどうかになります。一方、多すぎる強度や長すぎる露出は、タンパク質の光退色し、それによって光変換の効率を減らすことができます。
このプロトコルは、どのようにPC - FPの光電変換アプリケーションのための共焦点レーザー走査型顕微鏡を設定する一般的なアプローチを説明します。まず、精製されたタンパク質の液滴の試料を調製するための手順を説明します。このサンプルフォーマットには、顕微鏡下で蛍光タンパク質の光物理的挙動を研究するために非常に便利です。第二に、我々は、光変換用の顕微鏡を構成する方法を示すために蛋白質の液滴のサンプルを使用します。そして最後に、我々はmOrange2とドロンパとのデュアルプローブ光学ハイライトを含む生きている細胞の光学強調表示、実行する方法を説明します。
プロトコル
1。蛍光タンパク質の液滴の試料の調製
蛍光タンパク質の液滴のサンプルでは、水相内に存在する蛍光タンパク質と1 - オクタノールのエマルジョンで構成されています。このエマルジョンは、顕微鏡のアプリケーションのための顕微鏡スライド、22 mm角のカバーガラスの間に挟まれている。
- 蛍光タンパク質の液滴のサンプルを作る前に、顕微鏡スライドとカバーガラスは、疎水化剤で洗浄し、コーティングする必要があります。
- アセトンで5分間洗浄することによりガラスを清掃し、空気が乾燥しておきます。 (オプションで、ガラス製品を洗浄した後、最適なコーティングの結果を得るために、プラズマクリーナーで30秒間処理することができる)。
- この溶液中で2分間のインキュベーション中に、アセトンとコートガラス製品では2%メチル溶液を調製します。コーティング後、溶液からガラスを取り除き、空気が乾燥しておきます。その後、スプレーボトルから70%エタノールで洗浄し、再び乾燥させておきます。 (オプションで、この時点でガラスは° Cの共有結合ガラスにコーティングをリンクするために80℃1時間焼成することができます)。コーティングされたガラス製品は、少なくとも一ヶ月間保存することができます。
- 蛍光タンパク質は、E.から彼の6 -タグ融合タンパク質として精製されていますコリ 1。精製されたタンパク質の吸光度スペクトルを測定し、STEバッファー(150mMのNaCl、10mMトリス- HCl pH8の、1mMのEDTA)で〜0.1の光学密度と株式の希薄化を準備、0.1%ウシ血清アルブミンを含む(BSA) 。加えて15 mlコニカルチューブ中の1 - オクタノールとSTEバッファーの1:1混合物の10mlを準備し、積極的に混ぜる。相分離が完了するまで、休暇を混合した後。上部相は、1 - オクタノールです。 (注意:1 - オクタノールは、強い香りを持っているので、それは1 - オクタノールと接触するすべてのもののために密閉廃棄物の容器を使用することが重要です。)
- エマルジョンピペット45μlの1 - オクタノールとマイクロチューブに5μlの蛍光タンパク質を作るまで。エマルジョンの形成を開始してから、超音波浴中で30秒間チューブを超音波処理するために、指でチューブを数回タップします。で一方、コーティングされた顕微鏡スライドとカバーガラスの準備をする。超音波処理した後にエマルジョンは完全に曇りにする必要があります。すぐにコーティングされた顕微鏡スライド上に管の途中から超音波ピペット4μlのエマルジョンの後、コーティングされたカバーガラスで覆う。
- 手続きが行われている場合、正しくエマルジョンは、顕微鏡のスライドとオブジェクトのガラスの間に均等に分散する必要があります。分以内にサンプルの直径を変えて〜10μmの厚さの蛍光滴から成る、安定している必要があります。最大の液滴は、試料の中心に近く、小さい方は、エッジに向かってさらに配置されています。
2。光電変換実験のセットアップ
次の手順では、蛍光タンパク質の光電変換テストを設定するための一般的な戦略です。この手順は、生きている細胞のためだけでなく、タンパク質の精製に適用することができます。
- 以下のパラメータは、光変換の実験を設定する一般的な出発点を提供します。
40倍1.3NA油浸対物レンズ
画像サイズ= 512 × 512ピクセル
スキャンズーム= 4
ピクセルは、時間= 6マイクロ秒に住む。
Z -解像度(ピンホールのサイズ)= 3μmの - 初期とphotoconverted蛍光だけでなく、"光電変換チャネル"の2つの検出チャンネルを設定します。この例ではオレンジ色から赤色photoconvertible蛍光タンパク質であるmOrange2タンパク質を、精製された使用します。オレンジ色の種は、561 nmの励起を用いて検出されると蛍光を570 nmと630nmの間に収集されます。 photoconverted赤い種は、633nmの励起を用いて検出されると蛍光が640 nmと700 nmの間に収集されます。 "光電変換チャネル"のために488 nmの励起を選択し、490nmのと540nmの間に蛍光を収集する。 (注:イメージング光電変換チャネルは、必ずしも必要ではありません。)
- イメージングレーザパワーと、最適な画像品質のための検出器のゲインを調整するために連続スキャンと初期の蛍光のチャネルを使用してください。
- 光電変換チャネルをアクティブにし、低レーザパワーを選択。撮影時間の経過のシリーズを起動し、初期の蛍光の漂白著しいが観察されるまで徐々に光電変換レーザーを増加させる。初期の蛍光が約75%漂白になるまでスキャンを続行。
- 光電変換チャネルを停止し、photoconverted蛍光の検出チャンネルをアクティブにします。高い検出器のゲインと低レーザパワーとイメージングを起動し、photoconverted蛍光が検出されるまで徐々にレーザーパワーを増加させる。一度あなたがレーザーのパワーと、最適な画像品質のための検出器のゲインを調整することができますphotoconverted蛍光を検出する。
- 最後に、レーザパワーは、使用光変換だけでなく、光変換の持続のために最適化する必要があります。光電変換レーザパワーを増加させると、光変換の速度を加速する、しかしあまりにも多くのレーザパワーは、タンパク質を退色されます。
- 一度、最適な光変換レーザーのパワーと持続時間が決定されている、これらのパラメータは標準の光退色やFRAPモジュールを構成するために使用することができ、"光電変換チャネルは、"不要になります。
3。 mOrange2とドロンパとのデュアルプローブ光学ハイライト
ために赤方偏移したスペクトル特性から、mOrange2は、4個のセル(オルガネラ)の集団を選択的に強調表示を可能にするデュアルプローブ光学ハイライトのための緑のphotoswitchable蛍光タンパク質Dronpa(ドロンパ)と組み合わせて使用することができます。
- 細胞をガラス底マテック皿に成長し、標準Lipofectamine2000トランスフェクション1を使用して撮影する前に24時間トランスフェクトされる。
- としてセクション2で説明mOrange2光変換用の顕微鏡を設定します。
- ドロンパのphotoswitching用顕微鏡を設定します。ドロンパの蛍光がmOrange2"光電変換チャネルを"(ステップ2.2参照)を使用して画像化することができます。 (注意:あまりにも多くのレーザーパワーがドロンパの不活化の原因となりますので、画像ドロンパのために使用されるレーザーパワーを最小化。)ドロンパの光活性化のためのチャネルを追加します。我々は、光活性化のために800nmの二光子励起を使用しますが、代わりにこれを405nmの励起を用いて達成することができます。イメージング、光活性化、そしてドロンパ蛍光の光不活性化するために必要なレーザーパワーを決定します。
- 注意:mOrange2の光変換とドロンパの不活性化は、両方とも488 nmの励起によって起こる。このためにも、ドロンパの蛍光を不活性化するmOrange2光変換に必要な高いレーザーパワーの。一方、ドロンパの不活性化は非常に低いレーザーパワーで既に発生し、大幅なmOrange2光変換することなく行うことができます。
- mOrange2光変換し、ドロンパのphotoswitchingのパラメータを設定したら、デュアルプローブ光学ハイライトは以下の手順によって実現されます。最初に、低消費電力488 nmの励起で視野全体でドロンパの蛍光を不活性化する。第二に、ハイパワー488 nmの励起との利益とphotoconvert mOrange2の領域を選択します。最後に、ドロンパの蛍光をアクティブにするために関心領域を選択します。
4。代表的な結果
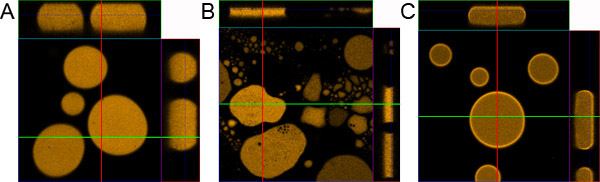
図1。液滴試料調製を。)正しく滴のサンプルを用意した。 B)サンプルはコーティング顕微鏡スライドとカバーガラスなしで準備。 C)サンプルは、0.1%BSAを添加することなく準備。
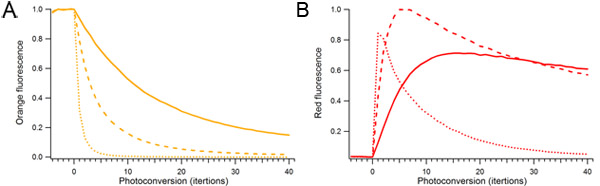
図2。 mOrange2タンパク質を含むmOrange2光変換で光電変換レーザーのパワーと持続時間の影響。単一液滴が連続して488 nmのレーザパワーの異なる量を使用してphotoconvertedていた。光変換のために使用される相対的なレーザーパワーが10%(固形)、25%(破線)、および100%(点線)であった。 A)オレンジ蛍光種。 B)Photoconverted赤色蛍光種。
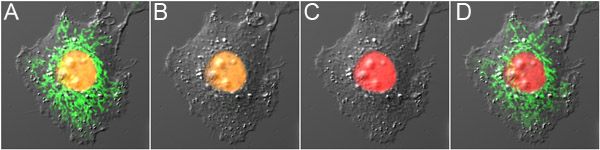
図3。 mOrange2とドロンパとのデュアルプローブ光学ハイライト。ミトコンドリアの核と緑色蛍光のオレンジ色の蛍光を示す光変換前mOrange2 -ヒストンH2Bとドロンパ-水戸の発現)細胞、。 B)ドロンパの蛍光がmOrange2の最小限の光変換を引き起こし、低消費電力488 nmの励起をオフにした。 C)mOrange2は、高出力488nmの励起で赤色にphotoconvertedした。 D)ドロンパの蛍光は再び800nmの2光子励起を使用してオンにした。パネルは、微分干渉コントラスト画像と一緒に蛍光画像のオーバーレイです。
ディスカッション
精製した蛍光タンパク質の液滴のサンプルでは、光退色反応速度論と光電変換反応速度を研究するために、例えば、蛍光タンパク質の光物理的特性評価のための非常に便利なサンプルフォーマットです。非常に小さな液滴の体積(〜20ピコリットル)のキュベットベースのシステムで実行することが困難な場合も退色や光変換の実験を、容易に。ここに示されているように加えて、液滴?...
開示事項
謝辞
我々は、蛍光タンパク質をコードするプラスミドDNAを提供するためのマイクW.ダビッドソン(フロリダ州立大学)を感謝。この作品は、厚生助成金GM72048(DWPへ)の国立研究所によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Microsope slides | VWR international | 48312-003 | |
| 22 mm cover glass | Corning | 2940-245 | |
| 1-octanol | Sigma-Aldrich | O4500 | |
| methyltrimethoxysilane | Sigma-Aldrich | M6420 | |
| MatTek dishes | MatTek Corp. | P35G-1.5-14-C | |
| Lipofectamine2000 | Invitrogen | 11668-019 |
参考文献
- Kremers, G. J., Hazelwood, K. L., Murphy, C. S., Davidson, M. W., Piston, D. W. Photoconversion in orange and red fluorescent proteins. Nature Methods. 6, 355-358 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved