Method Article
大人と胚骨格筋のMicroexplantの文化と骨格筋幹細胞の単離
要約
ミクロ解剖植技術は、骨格筋幹細胞のソースとして、若年成人や胚の筋肉から増殖性骨格筋細胞を単離するための堅牢で信頼性の高い方法です。一意に、これらの細胞は、クローン的に生体移植のために使用される骨格筋幹細胞株を生成するために導出されている。
要約
培養胚と成体の骨格筋細胞は、異なる用途の数を持っている。この章で説明するミクロ解剖植技術は、骨格筋幹細胞のソースとして、若年成人や胚の筋肉から増殖性骨格筋細胞の比較的大きな数字を隔離するための堅牢で信頼性の高い方法です。著者らは、野生型およびジストロフィー筋の骨格筋細胞の増殖特性を分析するためのマイクロ解剖外植片培養を使用している。組織の成長の各コンポーネント、すなわち細胞生存、増殖、老化や分化は、ここで説明する方法を使用して個別に分析することができます。成長のすべてのコンポーネントの正味の効果は、外植片の伸長率を測定する手段を確立することができます。マイクロ植方法はここで説明されているように、さまざまな筋肉の種類と幅広い年齢層からの初代培養を確立するために使用することができ、胚骨格筋の前駆体の分離を有効にするために、著者によって組み込まれています。
一意に、マイクロ植培養は生体移植のために拡大して使用することができる骨格筋幹細胞(SMSC)の行をクローン(単一細胞由来)を導出するために使用されている。 生体内に移植SMSCがとしての機能、組織特異的、衛星細胞の動作をこれは、骨格筋線維の再生に貢献するだけでなく、マイクロ植法を用いて培養に再単離することができる未分化幹細胞の小さなプールのように(サテライト細胞のニッチで)保持されている。
プロトコル
二つのアプローチは、増殖性骨格筋細胞を分離するために用いることができる。第一筋肉組織に酵素的に1アウトプレーティング前に、単一細胞を単離するために消化されています。第二の方法は、細胞はインキュベーション2、3中に成長できるようにする文化に筋肉組織片を外植することです。第二の方法は、このプロトコルで説明されています。組織の文化自体は移植片培養でそのルーツを持っています。 2007年は彼がリンパ4滴を掛けるの神経外植片をインキュベートすることにより、ニューロンのoutgrowthsを得ているハリソンの古典的な実験の100周年だった。植片培養技術は、大人と胚細胞4,5の増殖初代培養を生成する手段として、その後の100年間に異なるさまざまな場面で使用され、洗練されてきました。植技術の原理は、しかし、まったく同じものであり、豊富な栄養培地でoutgrowing細胞を提供しながら、細胞の伸長の重要な初期段階で、親組織の三次元構造を維持することによって、一次細胞分離の外傷を最小限に抑えるためにこれで増殖する。骨格筋では筋組織を切ることの行為は、筋線維の外傷、衛星細胞の活性化、遊走と増殖3、6の通常のトリガーを模倣するので、移植片培養を使用する追加の利点がある。成人骨格筋衛星細胞は(も筋芽細胞と呼ばれる)筋線維の修復と成長の7の責任増殖性幹細胞の集団である。
骨格筋の外植片は、このように再生筋肉の中の生体内環境を模倣し、幹細胞の遊走と分裂を刺激する。 somitomeresと鰓弓はヘッド8,9の筋肉を生じさせるものの、胚では、脊椎動物の骨格筋の大部分(幹と四肢の筋肉が)、体節に由来する。筋節は、2つの別個のグループとして識別することができますMyf - 5はそれぞれ、差別化体節の背側、内側と外側のエッジに位置する発現している幹細胞。それぞれ、これらの細胞は、in situでの差別戻って、の軸上の筋肉を生成し、体節10から筋幹細胞の移動を必要とする腹側と横軸下の筋肉(四肢、腹部と呼吸筋)。胚筋幹細胞の遊走は、パックス3 11の制御下にある。 Myf - 5の発現は、胚筋組織の確立に不可欠であり、この重要性は、出生後の筋肉のどこに活性化された衛 星細胞はMyf - 5の98%以上に保持されます。 Myf - 5は、したがって、大人と胚の両方の組織で増殖する骨格筋幹細胞集団の信頼性と特異的なマーカーである。胚筋幹細胞は(とも呼ばれる筋細胞の前駆細胞、骨格筋の前駆体、筋芽細胞あるいは胚性衛星細胞)初期段階のマウス、ニワトリおよびカエル胚13体節から単離することができる。古い胚の胚骨格筋から筋原性の文化を分離するために、著者らは、胚組織のためのマイクロダイセクション植技術を適応している。同様のアプローチは、コッスらによって使用されます。14胚葉体節から14クローン細胞集団を生成する。
(1)骨格筋幹細胞のin vitroでの細胞培養において (SMSC)
SMSCは、クローンの主骨格筋植培養物から派生されている単一の細胞由来の細胞株です。彼らは十分な注意が取られれば、標準組織培養の手法を用いて培養することができる。特に指示がない限り、記載されたすべての操作は層流フード(クラス1またはクラス2の滅菌キャビネット)とすべての文化の試薬を用いて無菌条件下で行われている、という注℃のウォーターバスで使用する前に37まで加温している。
- 液体窒素貯蔵からSMSCを持って(ダウン法凍結用のセクション1.2を参照)cryovialsは急速に解凍し、中身はDMSOを除去するために5 mLをあらかじめ温めておいた(37℃)直ちに遠心分離用DF10培地(3分間1000 G)に転送する必要があります。細胞を解凍するために最善の方法は、遠心チューブに移す前にバイアルに予め温めておいた培養液の少量の繰り返しピペッティングによりです。凍結保存した細胞は、室温で細胞(LD50約2分)への毒性が10%のDMSOを含むので、解凍細胞のプロセスは非常に迅速に行われるべきである。
- さらに5mLのDF10に再懸細胞ペレットで、次の遠心分離上清を除去し、細胞を洗浄し、その後以前と同様に遠心分離。
- ペレットを5 DF10の溶解と得られた細胞懸濁液との二度目の混合されているセルは小型の25cm 2のプラスチック培養VEに転送されます。SSEL。
- 培養は37℃に維持されています°加湿インキュベーター中、Cは、空気中5%CO 2を含む。血管がフィルタキャップで使用されている場合を除き、フラスコのキャップは、わずかに培養容器内の空気はインキュベーターで平衡化し、培地を酸性化できるように、数時間のために緩めておく必要があります。培地のpHは、培養培地にフェノールレッド色素のpH指示薬を組み込むことによって監視されます。
- 解凍した細胞は、常にメッキ後24時間を監視し、( 注1及び2を参照)、細胞の破片や残留毒素の除去を確実にするために新鮮なDF10培地を再供給する必要があります。
1.1。サブカルチャー
確立されたSMSC回線の場合、細胞は約95%コンフルエントに達したとき、彼らは、それらの培養容器から取り出し希釈し、さらなる成長を可能にするため、新鮮な容器に配置する必要があります。この継代培養の手順は、トリプシン/ EDTAが最も頻繁に( 注3を参照)使用されているさまざまな酵素の手続きの数によって達成することができます。それは彼らが成長の三日目に継代する必要が密度で細胞を成長させるために通常の(と良い)練習です。ほとんどのSMSの細胞株では、これは各継代培養で分割セル1 / 10を達成することができます。これは、細胞の慎重なモニタリングを可能にし、即時にその変換または培養条件の適応によって引き起こされるapoptosisのreductionとしてセルラインにphenotypicの変更を示している可能性unusual成長挙動(例えば、より速い成長)を識別するために組織培養を行うものを可能にします。さらに、一貫性の慎重な継代培養のルーチンは、大幅にそのような事象の発生率を低下させる。
- トリプシン(トリプシン処理)の船舶を使用してサブカルチャーのためのインキュベーターと吸引によって廃棄されたそれらのメディアから削除されます。
- 次いで、細胞を無菌カルシウムおよびマグネシウムを含まないリン酸緩衝生理食塩水(PBS)、洗浄あたり10 mLを、吸引することにより、各時間を外した状態で2回洗浄する。
- 細胞単層(25ミリメートル2フラスコ)を1mLの細胞が( 注4を参照)デタッチし始めるまで1トリプシン/ EDTAを添加し、2 3分間室温で細胞に残っている。付けを解除するこれは、フラスコが( 注5を参照)の光に保持されているわずかに不透明な単層に形成する小さな穴のような経験のあるユーザーが見ることができます。細胞は単一の細胞懸濁液を確実にするために十分な時間のためにトリプシン処理する必要がありますが、これは細胞死と細胞が再メッキされている貧しいアタッチメントの高いレベルにつながるので、注意がトリプシン処理にSMSC露出オーバーしないように注意してください。
- 停止するにはトリプシンの反応、血清含有培地(DF10)は2ボリューム(すなわち、トリプシン溶液の二倍量)の最小値に追加されます。 25ミリメートル2フラスコに継代培養をする際には、この段階で9 mLのDF10を追加すると便利です。細胞の1 / 10分割は、簡単に新鮮なDF10培地のさらに9 mLで一緒に新たな25ミリメートル2培養フラスコに得られた細胞懸濁液1mLを希釈することによって行うことができます。残りの細胞は、(参照凍結保存細胞の拡大(大血管への転送)に使用(1.2節参照)またはカウントされ、増殖と生存アッセイ、分化、増殖因子の治療や他の目的のために実験的な料理、井戸またはプレートに播種することができます下)。
1.2。細胞株および初代培養の凍結保存
- 凍結細胞は継代培養のための彼らの組織化単分子膜( セクション3.1.1)から解離し、遠心分離(1,000 gで3分間)によりペレット化のために。
- 上清を吸引除去され、彼らは遠心分離することで、再ペレット化される前に細胞は、慎重にかつ迅速にミックスダウン凍結を10 mL(DF10の10%DMSO)に再懸濁している。
- この時間は、ペレットを(表1参照)クライオバイアル当たり細胞懸濁液0.5 mLを可能にするためにミックスダウンに十分な凍結に再懸濁させ、直ちに℃で一晩80に配置されます。
- Cryovialsは、長期保存( 注6参照)のために翌日液体窒素に転送されます。細胞の融解と同様に、凍結保存のこのプロセスが迅速に実施しなければならない。 DMSOは、凍結時に細胞膜の保護となっている間は、非凍結温度で細胞毒性が非常に強い。
1.3。セル番号の決定
- 単一の細胞懸濁液(以下のサブカルチャー)の細胞濃度を決定するためにノイバウアーのhaemocytometerを使用することができます。カバースリップのカウントの正確さを確保するためにしっかりと( 注7参照)haemocytometerのベースにマウントされている必要があります。
- 細胞懸濁液の小滴は、カバースリップの端の近くに配置されており、毛細管現象により取り上げられる。
- 次いで、細胞を位相コントラスト照明付き倒立顕微鏡を使用してカウントされます。最終細胞濃度、cの精度を高めるために彼らは、元の細胞懸濁液を希釈する必要があり、細胞を再度カウントされない場合カウントチャンバー内のエルズは、重複しないようにしてください。クランピングは、トリプシン処理中に細胞を徹底的に解離することによって回避されるべきであると知られている表面の面積以上の100〜200細胞は、細胞数の正確な見積もりを得るためにカウントする必要があります。ノイバウアーのhaemocytometerを使用して便利な方法が2つ以上の16㎡のセット内のセルをカウントすることです。ミリリットル当たりの細胞密度は、カウントセットの数(例えば2)で合計を割り、10 4を乗じて得られる。例えば、100細胞は2 × 16の正方形のセット= 100 / 2 = 5 × 10 5細胞/ mLの中にカウント。
2。主骨格筋のMicroexplantの文化の確立
プライマリマイクロ片培養は、前部と後肢、ダイアフラム、背中と腹部の筋肉の個々の筋肉を含むアクセス可能な任意の骨格筋からSMSCを分離するために使用することができます。青少年と成人の筋肉からmicroexplant文化を導出するための方法は、スミスとスコフィールド3で詳細に説明され、その後、若年成人と高齢者のマウスの筋肉からSMSの細胞を得るために広く使用されています。メソッドは、魚24とヒト骨格筋(ラオとスミス、未発表)から培養骨格筋細胞を導出するために使用することができます。マウスの筋肉microexplantからSMSCの伸長を図1a、bに示されています。方法は、胚の筋肉前駆細胞( セクション3を参照)を単離するために変更されました。基本的な方法は以下の通りです:
- 新鮮なカリングマウスからターゲットの筋肉の無菌解剖(s)は、滅菌器具を用いて70%エタノールのスプレーのクリーンな作業領域と自由な使用を実現しています。
- 隔離された筋肉は、DF20培地の二つの変更によって洗浄され、60 MM 2皿の中で新鮮なDF20培地に配置されます。ステレオ解剖顕微鏡の筋肉を使用することは慎重に脂肪、結合組織や骨を除外するために無菌条件下で顕微されています。
- きれいに筋肉片を50μLDF20を( 注8を参照)を含む96ウェルプレートの中央に60ウェルに個別に配置され、宝石商の鉗子を用いて、400μmの3立方体にカットされています。ウェルズは、顕微鏡下でチェックし、インキュベーター内に配置されています。外側のウェルは、外植片(3)を含むウェルから乾燥を防ぐために、生理食塩水で満たされている。
- Microexplantの添付ファイルと伸長は24〜48時間のインキュベーション後に、その後48〜72時間の間隔(培養されて筋肉の成長の速度に依存)での得点が記録されます。
- SMSの細胞の拡大と単離のために、伸長培養物を、個別に主にSMSC形態、( 図3.1Bを参照)集約クラスターに成長し、高屈折率を持つ、すなわち球状の単核の細胞と細胞を監視する必要があります。
- 媒体が増加し、細胞密度に起因する酸性化するときに一度外植片の伸長は、個々のウェルには培地を50μLずつ添加することにより( 注9を参照)に供給されて確立されます。よくはフルとほぼコンフルエント培養細胞である場合、ウェルを細胞から分泌される"コンディショニング"の要因(; セクション2.1クローニングの下での馴化培地上でのコメントを参照)の維持を確保するために培地各時間の50%の交換によって供給されています。分化を抑制するには、60〜70%コンフルエントの主植outgrowthsでは、セル3に供給するためにカルシウム枯渇DMEM/F12(すべてのサプリメントは同じまま)のためにDF20培地に置換することによってカルシウム枯渇培地に切り替えられます。
- 馴化培地を植片(クローニング法のため、2.1節、図1c fを参照)、この段階で培養物から調製し、一次SMSCの拡大とクローニング時に使用するため保存することができます。培養物は、( セクション3.5を参照)ディスパーゼ法を用いて継代培養している。
- クローン由来のSMSCは、筋肉内注射( 図3.1 GK)19によりin vivoで解析することができます。
- 核型分析は、( セクション2.2、図3.1 lを参照)25を二倍体の状態を確認するためにクローン由来SMSCラインで行うことができます。
- このメソッドは、培養胚筋肉( セクション3)に適合させることができる。
2.1。クローン導出
一次外植片の筋芽細胞の培養( 図1a、b)は、野生型と変異体骨格筋では異なる成長のさまざまなパラメータを確立するための有用かつ正確なツールです。クローン導出、単一細胞からの細胞株の単離は、骨格筋幹細胞の分離に必須のステップであり、また、RNAiコンストラクトまたは導入遺伝子をトランスフェクトしたSMSCの行をサブクローニングするために使用することができます。確立されたSMSCおよび主要外植培養は非常に密度依存していると意志"CRASH"(皿からデタッチと死ぬ)が低すぎる細胞密度でプレーティングした場合。成長と細胞の生存を維持するために必要とされるSMSCのリリースの液性因子が。高密度培養をシミュレートし、中にこれらの要因を供給するためですクローニングのプロセスは、SMSCは、自己調整培地でクローニングされています。馴化培地に加え、個々の細胞が分離された環境で増殖できるようにするために不可欠であることが判明した。
- 馴化培地を33〜75%コンフルエントの間で48時間培養し、増殖SMSCから調製される。
- これらの細胞が増殖されているメディアは、48時間後に除去し、0.2μmのシリンジフィルターを用いて濾過され、これは、馴化培地の無菌性を保証し、すべての残りの細胞および残骸を削除します。
- この条件培地を新鮮な培地と1:1の比率で混合される(クローニング培地、 注10を参照)、単一細胞クローニング用培地として使用されます。
- 単一細胞の希釈液の細胞を達成するために慎重にトリプシン処理(SMSCを確立)またはディスパーゼ処理することにより、単一の細胞懸濁液(一次外植培養)に解離し、100μLのクローニング媒体ごとに一つの細胞の濃度に希釈。
- この細胞懸濁液50μLを、96ウェルプレートの中央に60ウェルの各々にめっきすることができる。
- 細胞は37℃でインキュベーションすることによって接続を許可されている℃で6時間と各ウェルの5%CO 2のCは、慎重に細胞の存在、得点が記録されます。 0または複数のセルを含むウェルは、この段階で割り引かれている。
- 単一のセルから派生した唯一の植民地は、、存在することを確保するために単一の接続されたセルを含むウェル慎重に明記されており、この単一細胞に由来するコロニーが注意深く監視されている(最初の数日間の間毎日)。細胞株は、1セルを含むウェルから得られた。 図1c - eは 、単一細胞由来のコロニーの拡大を示しています。
- かつて植民地は、それが48ウェルプレートの1つのウェルに継代培養することができる96ウェルプレートでコンフルエントに達する。
- 十分な細胞が25cm 2のフラスコにプレートに利用可能になるまで、6ウェルプレート-クローン化細胞株は、その後慎重に24に拡張することができます。
- これらの培養物の骨格筋の起源は、MyoDやパックス7などのMyf - 5( 図1F)または他の骨格筋に特異的なマーカーの発現により実証することができます。
- この段階では行は(表1参照)さらに拡大する前にダウンして凍結されています。
2.2。染色体分析
染色体分析では、モニタリングの細胞表現型の重要な方法です。クローンの導出によって得られた細胞株は、彼らの表現型に影響を及ぼす可能性のある総染色体再配列することなく二倍体の染色体の補数を保持していることを保証するためにkaryotypedされるべきである。
- 核型細胞の培養における有糸分裂細胞の割合を最大化するために25cm 2の培養容器で後期指数増殖期(80%コンフルエント)(2日間継代培養後)に栽培されています。
- 細胞の染色体分析の前に二十四時間を10mLの新鮮な培地を供給している。 10 mg / mlのコルヒチンの0.2mLの( 注11を参照)その後、37℃でさらに1時間インキュベートされているセルに追加される℃に
- 1時間後、細胞は培養液とPBSの洗浄の両方を収穫有糸分裂細胞の数を最大化するために保持されることを除いて標準的なトリプシン処理のサブカルチャーの手続きの対象となります。
- 解離細胞は、培地およびPBSの洗浄は漂白剤に削除され、破棄されたセルと上清をペレットに3分間、1,000 gでスピンしている保持。
- 細胞は再び遠心分離によりペレット化する前に細胞ペレットを、正確に4分間0.0075 Mの塩化カリウムの5mLに再懸濁している。
- 上清のほとんどは、再懸濁用チューブに少量(〜50〜100μL)を残して、吸引される。セルのスラリーが得られるまでファルコンチューブのベースをフリックして細胞を再懸濁します。その後、細胞を氷の上に置かれ、新鮮な氷冷固定液(メタノール:氷酢酸3:1の割合で)で修正されている次のように固定液10mLを徐々に小さなガラスパスツールピペットを(使用して、細胞に滴下するこれは)細胞の凝集を防ぎます。
- 細胞は、細胞ペレットを0.5mlの新鮮な固定液に再懸された後の遠心分離によってペレット化し、30分間氷上に置くとされています。
- スライドは45 °の角度で開催された(セクション3.2.2.1を参照)、準備スライド上に固定された細胞懸濁液をドロップすることによって生産されています。よく間隔の分裂を確保するためには、ピペットが30 cm以上のスライドの上に保持する必要が広がります。
- 染色体を可視化するために、スライドは使用直前にガーバッファーpH 6.8の三巻で希釈し、リーシュマンのステインで2分間染色する。
- スライドは、室温で乾燥させ、DePex封入剤でマウントされます。
2.2.1。染色体分析のためのスライドの準備
- スライドガラス(プレミアム顕微鏡スライド、VWRインターナショナル、英国)は硫酸の大(ガラス)容器で一晩置くことにより、核型のプロトコルで使用するために用意されています。
- スライドはその後8時間水道水を下に配置され、必要とされるまで、70%エタノールに格納されています。
- ご使用の前に、スライドは更に30分間水道水を実行し、1〜2時間室温で空気乾燥で洗い流してください
3。胚からプライマリマイクロ植文化の確立
3つのマウス系統は、MDXとCAV3KO(ジストロフィーの変異体の両方)と一緒にこのメソッドを、(C57BL/10)野生型を検証するために使用されていました。 C57BL/10で自発的に発信されたジストロフィン欠損mdxマウスは、この行は、1991年にBullfieldの実験室から得られたものであり、以来、継続的に私たちの近交系コロニー26に維持されている。カベオリン3遺伝子の変異を含むCAV3KOのジストロフィーマウスは、、この研究27で使用される前に10世代のためのC57BL/10背景に飼育した。各マウスのラインは、各菌株の特定と、異なるステージの胚だった確実に再現性の伸長、増殖と生存のプロファイルを生成する。次のプロトコルは、本質的にメリック21として、スミスとスコフィールドPNから胚(1994)3に採用されました。
3.1。胚のコレクション
- 得るためには、自然の(1:1)交配と女性は膣栓のために毎朝チェックしてペアが設定されて、胚を上演。プラグの検出の日に、胚はE0.5日間(12時間後の受精)としてカウントされます。
- 膣栓が検出されると男性は、胚の病期分類の精度を確保するためにケージから削除されます。
- 目的の胚のステージは、母親は頸椎脱臼によって殺されている(E11.5 E17.5まで)に到達すると、腹部を剃毛され、皮膚とその周辺地域は、70%アルコールでswabbedされると子宮が水平腹部切開によって除去され滅菌解剖器具を使用して確立されました。
- 子宮は、解剖の前に新鮮なPECMを含む小さな皿に置かれる前に(PECM)一次移植片培養培地で一度洗浄される。
- E17.5胚へE11.5は解剖顕微鏡を使って子宮から解剖し、詳しいマイクロダイセクションのための準備でPECMを含むペトリ皿に個別に配置されます。
3.2。胚のマイクロダイセクション
- 個々の胚は、さらに( 図2a参照)骨格筋における豊富な領域を分離するために解剖されています。ハインドと前肢は(軸下の骨格筋)だけでなく、上半身と下半身の壁(主に軸上の骨格筋)として、より解剖されています。これを行うには胸部の長さに沿って切開、腹部と骨盤は胎児の内臓が除去できるように作成されます。
- 胚骨格筋幹細胞(eSMSc)のために豊かにし、頭部、脊髄とすべての臓器は、その後削除されます。
- 古い胚(E15.5 - E17.5胚)で、それは文化で筋肉細胞の割合を増やすには再度、皮膚と軟骨/骨を削除することも可能です。
3.3。胚Microexplantの文化を設定
- 彼らは新鮮なPECMに配置されているうち一度前肢、後肢と上半身と下半身の壁を切除され、さらに同じ大きさ(〜0.5 mm 3に 、 図2a)の組織の小さなキューブを生成するために顕微。
- これらmicroexplantsは、ウェルあたり50μLPECMを含む96ウェルプレート(ウェルごとに植)の中心60ウェルに入れられます。よく当たり1外植片を含む60ウェルの最小値が確立され、あたりの胚の研究。
- 培養胚の場合はセンター60ウェルは、外植片は( 図2b)から派生したどこ示す領域に細分化することができます。この設計では、それぞれ15ウェルの各々を含む、、前肢、上体の壁、後肢と下半身の壁の外植片21をすることができます。
3.4。モニタリングの伸長
伸長率は、胚骨格筋の外植片の成長率の信頼性の尺度であり、ここで説明を注意深く制御された条件下で高い再現性です。
- 外植片は3週間37℃および5%CO 2でインキュベートし、倒立顕微鏡を用いて培養中、第3回7日、14日と21日目に採点されます。外植片は、よく、個々の細胞( 図3a、E)の合流点のレベルに応じて採点されます。
- 文化の写真画像は、顕微鏡と100 ASA富士(色)またはコダックTMAX(白黒)プロフェッショナルフィルム( 図3F)に接続されている一眼レフカメラを使用して、例えば、撮影することができます。
- 骨格筋特異Myf - 5に特異的な抗体がeSMScの骨格筋の起源を実証するために使用できる、ひずみに応じてこのメソッドを使用して単離された細胞の80〜95%がMyf - 5陽性である。このようなMyoDやパックス7のような他のマーカーも、これらの細胞集団の骨格筋の起源を実証するために使用することができます。これらの細胞は胚骨格筋幹細胞の非常に高い割合を含んでいますが、それは彼らが骨格筋由来のまたはそれらがすべての幹細胞であることのすべてであることを(特に若い胚のための)想定することはできません。純粋な幹細胞集団を分離することは、セクション2.1で説明したようにクローンの主植文化を導出する必要があります。
3.5。二次培養一次胚植
かつてSMSCの形態学的特徴( 図3f)を表示コンフルエント、外植片培養はFOLLOWS 3、21として継代培養することができます。
- 培地は、選択したウェルから除去さ0.2μmのアクロディスクR_シリンジフィルターを用いて濾過し、条件培地として使用するために保持されます。培地を1週間に4℃で保存することができます。
- PECMのディスパーゼ1:10に希釈液100μLを各ウェルに添加し、プレートはその後20分間37℃のインキュベーターに戻されます。
- ピペットの先端をゆっくりウェルの表面から緩めの細胞をこすり取る際に使用されます。
- 細胞懸濁液は、細胞をペレット化し、上清を除去し、廃棄されるまで3分、1,000 gで遠心分離される。
- 細胞は、馴化培地とPECMの1:1混合物200μLに再懸濁されている。
- セルミックスはさらに拡大するための48ウェルプレートに転送されます。
- in vitroでの解析細胞のために48ウェルプレート(各9 MM 2滅菌ガラスカバースリップを含む)、または8ウェルガラスチャンバースライドのいずれか2 5 × 10 3細胞/ cmの密度でめっきすることができる。それらは固定する前に、3日間分化を許容培地(in vitroでのメソッドの詳細についてはセクション4を参照)に転送される前に、差別化のために分析の細胞は50〜60%コンフルエントに一晩増殖されています。
(4)骨格筋幹細胞と初代培養のin vitroでの解析で
4.1。細胞の調製
- ディスパーゼ継代培養(3.3節 )一次胚移植片培養物は、3 × 10 3細胞/ cm 2の密度で48ウェルプレートでカバースリップの上にPECM /ならし培地に播種し、接着するまで許可されています。
- アポトーシスと細胞増殖のカバースリップの評価のためにさらに10分間PBS洗浄に続いて、室温で20分間PBSで( セクション4.2を参照)4%パラホルムアルデヒドで固定し、PBSで2回洗浄する。
- この方法を用意カバースリップは、4℃のPBSまたはPBS /グリシンの1週間までのCで保存することができる。
4.2。パラホルムアルデヒド固定液の準備
- ドラフト内で、4gのパラホルムアルデヒドの重量を量る(PFA、Sigma - Aldrich社、英国)とマグネチックスターラーを滅菌PBS 100 mLのガラスの瓶に追加。フェイスマスクと手袋は保護のために着用してください。
- 粉が溶けるまでドラフト内で、解決策は、磁気ホットプレート上で加熱し、継続的に撹拌する。これは、65℃で約5〜10分かかりますケアは70の上方の温度上昇を防ぐために注意しなければなりません° C、高温下で爆発する解の危険性があるとして。
4.3。アポトーシスと増殖アッセイ
- 固定カバースリップは、( セクション4.1のように調製)で3分間10μg/ mLのDAPIで染色されています。
- カバースリップをPBS(5〜10分)で一度洗浄し、スライドガラス17、18日にメディアをマウントするvectashieldのスポットに反転されています。
- カバースリップの端をマニキュア( 注12参照)で密封されています。
- ストレージの場合、スライドはホイルでラップされ、20℃に置く
- カウントするために、スライドは正立顕微鏡に蛍光(UVフィルター)で観察され、接眼レンズの目盛りを用いてアポトーシスや細胞分裂、細胞のために獲得しています。二十ランダムに分散グリッドは(〜1000細胞を表す)はカウントされ、そして細胞は形態学的に非アポトーシス、アポトーシスや細胞分裂( 図3 g)として特徴付けられる。
- 有糸分裂とアポトーシス指数は、全細胞の割合として計算されます。
4.4。免疫組織化学
カバースリップの上に固定された細胞は、免疫組織化学に使用することもできます。圧力鍋のカバースリップを使用して抗原を取得するための標準的なペーパークリップを使用してスライドガラスにしっかりと取り付けられている必要があります。免疫染色は、(参照Myf - 5(1 / 1、000希釈)に抗体を使用して、アイデンティティを確立するために、Ki67(1 / 1、000希釈)に抗体を使用して、増殖細胞を同定するため、または遺伝子の発現を調査するために使用することができますセクション4.5)。免疫染色は、多くの方法は、以下の((28、29)で説明されている)筆者らが日常的に使用されているを使用して達成することができます。
- クエン酸ナトリウム緩衝液を圧力鍋で事前に加熱される。抗原検索のために、組織切片を含むスライドは、加熱されたバッファに配置され、2分間減圧下で加熱。圧力は、しっかりと圧力鍋の蓋をロックし、重量に置くことで達成されます。 2分の検索時間が経過した後は圧力鍋は、慎重に圧力を減らすために冷たい水道水を流しの下に配置されます。まで沸騰バッファを防止するため、注意が圧力が大気圧と等しくするまでふたを削除しないように注意してください。体重は簡単に削除(力なし)と蓋を取り除くことができるときに圧力が十分に低減されます。スライドをバッファから削除し、10分間室温でPBSで洗浄されています。
- スライドは、5分間、3%過酸化水素/水道水の中に浸漬することにより事前にブロックし、PBS +0.05%Tween 20を(洗浄あたり10分)で3回洗浄する。
- ブロッキングは、室温でTNBブロッキングバッファー(TSAキットに付属)で30分間のインキュベーションによって達成されます。
- 一次抗体は、適当な希釈するTNBバッファーで希釈(滴定で到着、 注12を参照)と一晩4℃で(あるいは室温で1〜2時間)インキュベートする。
- PBS + 0.05%ツイーン20で3つの10分の洗浄後、スライドは、TNBバッファーで希釈した適切なビオチン化二次抗体で室温で1時間インキュベートする。
- PBS +0.05%Tween 20をでさらに3つの10分の洗浄後、スライドは(TSAキットに付属)ストレプトアビジン- HRPで30分間インキュベートするTNBバッファーで1:100に希釈して3回(10分ごと)を洗浄しPBS + 0.05%ツイーン20。
- ビオチニルチラミド(増幅試薬、TSAキット)は、その後8〜15分間(正確な時間を最適化実験で求める必要がある)のための各セクションに追加されます。
- 以下の増幅、洗浄は、SA - HRPで30分間インキュベート後、PBS + 0.05%ツイーン20で3回(10分ごと)をスライドして。
- PBS + 0.05%ツイーン20でさらに3つの洗浄(10分ごと)に続いて、5〜10分間3,3 _ジアミノベンジジン四塩酸塩発色(DAB)を用いて可視化。その後、ヘマトキシリン及び封入でスライドを対比する前に水中で2つの最終的な洗浄を行う。 DABは、既知の発がん性物質であると(コルヒチン、3.2.2項のように)注意して取り扱ってください。
4.5。分化
- ( 注13を参照)カバースリップまたはチャンバースライドに播種SMSCは、筋管の解析のための固定の前に区別することができます。
- これらの実験のために細胞を10 4 / cm 2の密度で播種し、6〜8時間の接続を許可されています
- 次いで、細胞を3日間分化する条件下( 注14参照)に切り替えられます。
- 分化培地は、DMEMで構成されている+ FCS、2%ウマ血清および1%グルタミンを添加した0.5%。この分化寛容な培養培地を48時間間隔で置き換えられます。
- カバースリップは、( セクション3.4.1および3.4.2)上記のように4%パラホルムアルデヒドで固定されています。
4.6。 SMSCのトランスフェクション:トランスジーンとshRNAiコンストラクトの発現
幹細胞や初代培養は、トランスフェクションに抵抗性であるとメソッドの大部分をSMSCと主要骨格筋細胞におけるトランスフェクション率は、一過性トランスフェクションの手法の使用を防止する、(<10%)非常に低いです。これを克服するためには、リン酸カルシウムまたはリポフェクタミンと、次のトランスフェクション(3.2.1項を参照)導入遺伝子トランスフェクションした培養細胞からクローンの誘導体を分離するために我々の研究室で標準的となっています。あるいは細胞を効率的にウイルスのパッケージ構造の感染症を用いてトランスフェクトすることができます。図1mがPD50A、pIRV感染後G418選択下で分離されたクローンSMSC誘導体、複製neo/G418抵抗とβ-ガラクトシダーゼ(19)の遺伝子を運ぶ欠損性レトロウイルスのβ-ガラクトシダーゼの安定した発現を示しています。この細胞株は、正式にSMSCが( 図3.1参照)、in vivoで機能的な幹細胞として振る舞うことを証明するために使用されていました。マーカー遺伝子を発現する安定なクローン細胞株の生成は、 生体内の幹細胞の移植実験では望ましいですが、それはin vitroでの遺伝子機能を解析するのに時間がかかり、不満足な方法です。これらの理由から、著者らは最近、60〜70%のトランスフェクションレートを実現することができるリポフェクタミン2000トランスフェクション試薬の最適化された変更を開発した。これにより、導入遺伝子またはRNAiの一過性トランスフェクションを用いた遺伝子機能の解析は、SMに構築できますSCまたは一次外植培養( 図3H、I)。著者らは、SMSCのmRNA発現の遺伝子特異的ターゲティングが可能なshRNAi構造を生成する短鎖ヘアピンRNA干渉ベクトル(pSHAGのRNAi)(30)を使用します。 shRNAi技術の成功は、2つの要素に依存する:(a)効率的なトランスフェクション法と具体的に標的遺伝子を認識する短いヘアピン配列の(b)の設計。 shRNAi eGFPのために向けられたコンストラクトは、RNAiノックダウン方式( 図3J、m)を検証するために使用することができます。
4.7。 SMSCの最適化されたLipofectamineTM 2000トランスフェクションプロトコル
- 細胞は250μLDF10培養培地中でチャンバースライドに5〜10 4細胞/ cm 2でめっきされたものであり、95%コンフルエント(各細胞株に最適な合流は異なる密度でトランスフェクション率を評価することによって設立された)に達するまでの18時間培養した。
- 各ウェルに、DNA(shRNAiベクトル、導入遺伝子)の0.5μgのは、2mMのグルタミンを補充し、滅菌したエッペンドルフチューブに穏やかに混合し、無血清DMEM 33μLに追加されますのために。
- 各ウェルについて、リポフェクトアミン2000の1.25μLを別々に、無血清培地DMEM +グルタミンのさらに33μLで希釈し穏やかに混合し、室温で5分間保持されます
- DNAとリポフェクトミックスはその後、急速に、一緒に追加されたピペッティングにより60秒間穏やかに混合し、DNAリポフェクタミン2000複合体が形成できるように、19分室温でインキュベートする。
- トランスフェクションのために、複雑なミックスの66μLを各ウェルチャンバーに添加し、スライドを穏やかに複合体の平等な分配を確保するために10秒間揺れています。
- 細胞は37℃、5%CO 2で24〜72時間インキュベートする。構造、機能的な遺伝子発現またはshRNAiのノックダウンにもよりますが、最初の8時間と24時間後にトランスフェクションの間に検出されます。
5。代表的な結果
外植片を慎重に植成人骨格筋からまたは胚から植されている場合37℃(5%CO 2 /空気)( 図3A)のインキュベーションの72時間まで数時間以内に細胞を生成するために開始されます。これが発生するのに要する時間は、外植片のソースに依存します:胚の外植片は、より迅速に高齢者の骨格筋の外植片よりも大きくなるでしょう。我々の経験では伸長のタイミングは、29 3高度に再現可能です。細胞集団の拡大は、(これらの培養物の図は、 図3B - Fを参照)SMSの細胞初代培養を集約する高い密度を生成するための日(胚の外植片)または週(古い骨格筋植)の期間にわたって行われます。 図1&3骨格筋および胚の外植片、クローン派生との骨格筋の起源を説明するために、成体幹細胞は、β-ガラクトシダーゼのラベリング、染色体分析および胚SMSCのmyf - 5免疫組織化学を派生骨格筋のin vivoでの移植の成功を導出し、文化の代表的な結果を示す。胚筋初代培養細胞の形態;アポトーシスとshRNAiのトランスフェクションのプロトコルのためのDAPI染色細胞集団図3は、突起のスコアリング(SMSCを視覚化するMyf - 5免疫組織化学を使用して)の代表的な結果を示しています。詳細は、これら2つの図に関連する図の説明文に記載されています。 図2は、胚骨格筋幹細胞の濃縮された集団を生成するために胚のマイクロダイセクションから手順を示す。
表1:プロトコルダウン細胞の凍結時の最大細胞の生存に必要なcryovialsの数を推定する計算表
| プレート/フラスコ/チャンバースライド | 培養培地の容積 | PBSで洗浄 | トリプシンの体積 | バイアルダウン凍結の数(3.1.2) |
| 96ウェル | 50μL | 2 X 100μL | 25μL | N / |
| 48ウェル | 150μL | 2 X 200μL | 50μL | N / |
| 24ウェル | 500μL | 2 X 700μL | 200μL | N / |
| 6ウェル | 3 MLS | 2 X 3 MLS | 500μL | 1 |
| 小(25cm 2の ) | 10mlの | 2 × 10 MLS | 1 mLの | 2 |
| 培地(80 cm 2で ) | 10mlの | 2 × 10 MLS | 3 MLS | 4 |
| 大型(175cm 2の ) | 10mlの | 2 × 10 MLS | 5mlの | 8 |
| よくチャンバー | 500μL | 2 X 500μL | 100μL | N / |
N / A =該当なし、複数のウェルを一緒にダウン凍結されていない限り、セルに数字がダウンしてフリーズする低過ぎる。
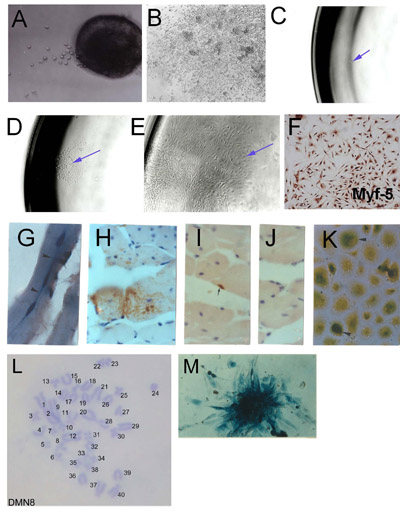
図1。 microexplantsから骨格筋幹細胞(SMSC)の分離:外植成人骨格筋(2日目)から(A)初期伸長集約された文化と、高い細胞密度を示す(B)設立植伸長。。 SMSCのクローン導出。(C)単一細胞が96ウェルプレートに単離された。Myf - 5免疫組織化学を使用してSMSCアイデンティティの(D)の単一細胞由来のコロニー。(E)クローン集団を設立。(F)の検証。 SMSCク ローン3ヵ月後の宿主マウスのPD50A(β-ガラクトシダーゼを発現する)(G)と(HJ)に由来する細胞は、14ヶ月、マウス前脛骨筋。に2000 PD50A細胞のポスト噴射(G)三は、最近(中心部核融合)β-ガラクトシダーゼ陽性の筋線維(縦断面)の細胞(染色青)。β-ガラクトシダーゼ陽性の筋線維の細胞(染色茶色、抗β-ガラクトシダーゼ抗体により検出される)(横断面の(H)豊富な貢献)。(I)β-ガラクトシダーゼ陽性衛星細胞(染色茶色、抗β-ガラクトシダーゼ抗体により検出される)。(J)二次抗体のコントロール(無染色)。(K)β-ガラクトシダーゼ陽性細胞(染色ブルー)注入されたホストの筋肉から分離するときに文化の中で増殖して12ヶ月後の注射。(L)PD50A細胞のコロニーではβ-ガラクトシダーゼの発現を示す通常の二倍体の染色体を補完する。(M)組織化学を示すマウスクローンSMSCライン(DMN8)の核型( AACRプレス、スミスとスコフィールド、1997)から許可を得て複製した図3.1 G、K、。
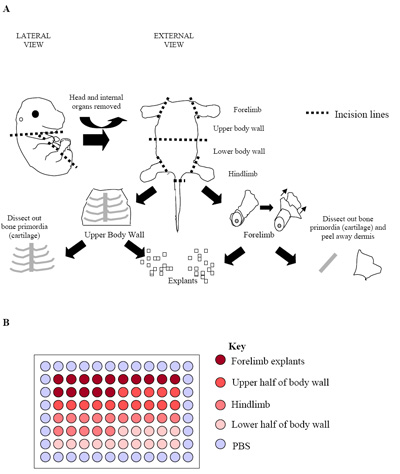
図2。胚の解剖のプロセスの()イラスト。図は、(軟骨)原初の骨を簡単に識別し、周囲の骨格筋組織の自由な解剖できるE15.5胚を表します。この段階で、後の段階の胚(E15.5 E17.5)で、真皮にも得られる骨格筋細胞の割合を最大にするために削除されました。96ウェルプレートで一次外植培養の(B)のセットアップ。それぞれの胚は、上で見たように一つのプレートを製造するために使用された。通常の練習は、プレートになります伸長率を確立するために3つの別々の胚(3枚のプレート= 180ウェル)の複製。
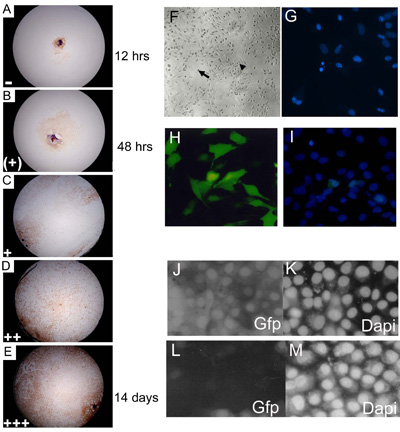
図3。胚性一次外植培養は、培養3、7、14および21日で得点と合流レベルの伸長レベルの担当者に割り当てられていました。 15 24%(+)、、25 49%(+)、50 74パーセント(++); 75 100%(0 14%()説明するために、Myf - 5で染色した(AE)C57BL10 E15.5一次胚外植培養+ + +)合流のレベル。伸長の各レベルを示す井戸の割合は、(得点のそれぞれの日に)任意の数を乗じて(= 1;(+)= 2; + = 3; + + = 4と+ + + = 5)のデータを照合する前に最終的な伸長の値を得た。野生型(C57BL/10)主eSMScの約85%が骨格筋細胞のマーカーMyf - 5用に染色。倍率は10です。(F)を設立胚培養が成人SMSC、双極細胞(小矢印)と球状単相細胞(大矢印)の形態的特徴を有する。DAPI染色を用いてアポトーシス核の断片化(G)の同定。(HI)高レベルの(〜75%)に最適化されたリポフェクトアミン2000トランスフェクション法。(I)総細胞数のカウントを使用してSMSの細胞株にGFP発現コンストラクトのトランスフェクションのDAPI対比が助けになる。 pSHAGshRNAigfp(JM)を使用して、RNAiは、SMSCのGFPの発現を(コントロールとして使用されるこの構造の例(29)参照)廃止。GFP SMSCのラインでGFPの発現を示す(J)コントロール(モックトランスフェクション)。(K)DAPI制御トランスフェクション後の(L)shRNAiGfp 24時間。(M)でshRNAiGfpトランスフェクトされた細胞のためのDAPI制御(L)。
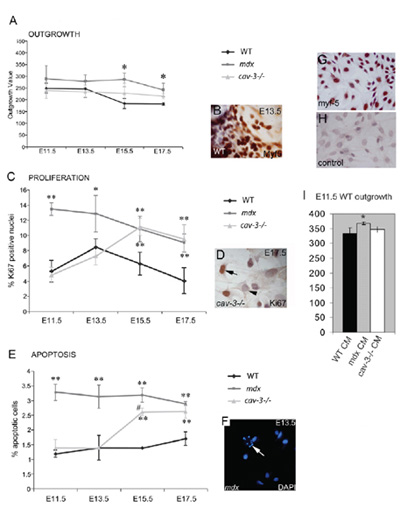
図4。栄養障害性、胚Myf5陽性筋芽細胞が過剰増殖とアポトーシスを起こしやすいです。筋肉の移植片培養iから胚筋芽細胞の(A)伸長率並列で培養WT外植片と比較した場合、sはE15.5およびE17.5でE11.5からMDX変異体ではとCAV - 3 (-/-)変異体の両方で増加した。(B)Myf5 -免疫染色植。(C) MDXの胚のE11.5からとしてKi67陽性免疫反応性(D)によって決定されるE15.5からE11.5からMDX変異体およびCAV - 3 (-/-)変異体の胚筋芽細胞の過剰増殖は。(E)アポトーシスの上昇ととしてDAPI染色(F)で示されるCAV - 3 (-/-)胚におけるE15.5、から、F点での矢印アポトーシス細胞へ。 * P <0.05 WTと比較して、** P <0.01は、WTと比較して、。Myf5染色と* P <0.05 CAV - 3 (-/-)でMDXを比較する際に(G、H)E15.5初代培養WT胚筋芽細胞(G)と二次抗体のコントロール(H)。(I)E11.5 WTの外植片の伸長率は、E11.5 MDX植付の培地(CM)ではなく、CAV - 3(* P <0.05)に増加(-/-)またはWTのCM。エラーバーはSDこの図は、執筆者の著作権下に再現され、最初のメリックら 、2009年に生物学者の会社によって発行されたことを示しています。
6。注:重要なステップと実行可能な変更
- 解凍された細胞は非常に低い細胞密度で接続したとき、それは文化のクラッシュを防ぐために半分だけ培地を交換するのが賢明です。
- ジストロフィー筋から分離されたSMSCは、アポトーシスを受けやすく、特に慎重に扱われなければならない。ジストロフィーのSMSCは、(例えば、5週齢ジストロフィー(MDX)マウスから得られた骨格筋から設立されたDFD - 13細胞株、などの)筋芽細胞の通常より高い細胞密度で栽培する必要があります。このようなアポトーシス感受性細胞ラインはまた、より高い密度(セクション1.1と1.2を参照)(19)で凍結保存されています。
- 単分子層から細胞を除去する別の方法は、それがFCSとカルシウム(DF10に存在する両方)の存在下で実施することができるという利点と、細胞解離の穏やかな方法を提供するディスパーゼを、利用しています。ディスパーゼは、したがって、サブカルチャーに使用し(セクション2および3を参照)主な骨格筋植文化とearlystage SMSCのクローンを展開することができます。
- 75ミリメートル2フラスコ(3 mLのトリプシン)と175ミリメートル2フラスコ(5 mLのトリプシンを):次のように大きなフラスコのために使用されるトリプシン/ EDTAの量をスケールアップする必要があります。同様に小さい表面積のために(表1参照)に使用さトリプシンの量を減らす。
- また、解離は、これは初心者のために推奨されて、倒立顕微鏡を使用して監視できます。
- 細胞株の凍結保存は、通常、コンフルエント大(175 mm 2)のプラスチック容器を用いて行われる。 7〜9 cryovialsは凍結保存されている細胞株の生存のプロファイルに応じて、1つのような大きな容器から得ることができる。初代培養し、新しく設立された細胞株は、多くの場合、手続きを凍結する非常に難治性です。二つのアプローチこのような細胞を凍結の回復と成功を向上させるためには、(別々にまたは組み合わせて)使用することができます。 (A)混合ダウン凍結のFCS含有量を10%(最大50%まで)から増やすことができます。 (B)プロセスダウンフリーズは、液相にバイアルを転送する前に、12〜24時間N2の気相でcryovialsを配置することによって低下することができます。
- haemacytometerカバースリップの会社の添付ファイルをチェックする便利な方法は、オープンハンドの上に逆さまにhaemacytometerを保持するために、カバースリップ上あるいは(ガラスの虹の反射)ニュートンリングを探すことです。
- 植方法の変化が免疫組織化学、増殖またはアポトーシスアッセイにおける使用のための短期的な文化のために用いることができる。マイクロダイセクションにより植片は、8ウェルチャンバースライドを用いてガラス上に配置されます。別の方法は9mmを24ウェルプレートに配置された2カバースリップを使用することです。両方の場合、2つの外植片は、150μLDF20培地を各ウェルに転送されます。また、初代培養は、ディスパーゼの方法で継代培養し、または直接8ウェルチャンバースライドに24ウェルプレートに配置されたカバースリップの上にプレーティングすることができます。
- 伸長率の定量分析のためにも当たり1外植片を含む60ウェルの最小値は、筋肉/マウス系統ごとに、確立されている。少なくとも3つの別々の動物が株に成長パラメータを確立するために使用されている必要があります。伸長が得点されている間にプレートと個々のウェルが供給されていません。
- クローニングは、SMSCのラインを確立するためには、馴化培地とDF10培地の1:1混合での培養単一細胞に十分です。一次外植片の場合は20%に培地の血清含有量を増加させることが必要です。
- コルヒチンは毒性の高いと知られている発がん性物質であり、適切な取り扱いには注意してください。二重手袋と指定されたトレイの範囲での作業が不可欠です。すべての消耗品(すなわち、ギルソンヒント)大量の水follo -ウィング日で処分する前に一晩(5%次亜塩素酸ナトリウム)漂白剤のビーカーに配置されます。
- 我々は現在1 / 1、000希釈でそれぞれKi67およびMyf - 5に特異的一次抗体を使用してください。一次抗体の最適希釈率は、同じソースから取得した場合でも、同抗体の異なるバッチのために理想的にも使用できるので、各抗体について経験的に確立する必要があります。
- チャンバースライドも、このアッセイに使用することができます。 4%PFAで細胞を固定する前に、培養培地を除去し、細胞を37◦C滅菌PBSで2回洗浄。よくチャンバー、ガスケットや接着剤を除去し、ガラスがスライドして静かに25分間ジャイロロッカーR_シェーカーに揺れるされ、室温で新しく調製した4%パラホルムアルデヒドを含む50mLのガラスコプリンジャーに配置されます。スライドをPBSで2回洗浄(室温)とのどちらか4ですぐに使用またはPBS中に保存されている◦C(短期、1〜2週間)免疫組織化学(IHC)分析のため。
- より広範な筋管形成が必要な場合は主要な骨格筋細胞は、最大8日間分化させることができる。
ディスカッション
マイクロダイセクション外植片培養を確実かつ再現性良く増殖Myf - 5正の骨格筋幹細胞(SMSC)の非常に高い割合(〜85%)を含む細胞集団を分離するために使用することができます。厳密に制御された培養条件下で一次外植培養を遺伝的変異マウスのSMSCの成長挙動を特徴付けるために使用することができると分化過程のin vitroでの解析の詳細のための筋管を生成する手段として使用することができますここで説明する。これらの培養物の入念なメンテナンスや操作は、長期培養と拡張することができます。メソッドを使用すると、単一のセルの希釈によって外植片培養物からのクローナルな骨格筋幹細胞株を導出することも可能ですここで説明する。 "馴化培地"は、高密度培養のためのこれらの細胞の正常な要件を模倣するために使用され、クローニング手順の間に分離された単一細胞の増殖を達成するために。方法は(胚、成人、老人、成体組織に(変更あり)に適用され、マウスに加えて、人間(ラオとスミス、未発表)を含む他の種の骨格筋から細胞、ニワトリ胚や魚を隔離するために使用することができます。鮭)24。クローン由来のSMSCは、筋肉内移植によるin vivoで解析することができますし、注入されたこれらの条件下で、SMSCは、ハイブリッド筋線維を形成するためにホストの筋管で結合します。筋肉内注射SMSCは、腫瘍を形成しないと彼らは衛星幹細胞niche.These細胞による内在性コントロールの対象となることを示唆し、注入後の年以上の衛星細胞の位置にホストの筋肉で発見されている注入から再単離することができる12カ月以上19ホストの注入後の増殖SMSCのようなホスト。
開示事項
謝辞
我々はshRNAiシャトルベクターの彼の贈り物のためにパトリックパディソンに感謝。アンジェラスローンは、 図3のGFPのRNAi画像を生成する。我々はまた彼らのサポートについては、次の助成団体に感謝:
筋ジストロフィーキャンペーン承認番号RA2/592/2は、承認番号02BHM04、王立協会の助成金番号574006.G503/1948./JEとBBSRCの助成金番号6/SAG10077スパークス。
資料
| Name | Company | Catalog Number | Comments |
| DMEM/F12 1:1 mix | Sigma-Aldrich | Liquid medium: (Dulbecco’s Modified Eagles’s medium and Ham’s F12 medium, 1:1 v/v) | |
| 100× Glutamine (200mM) | Sigma-Aldrich | Diluted in medium to a 1× concentration of 2 mM (Glutamine HYBRI-MAX R) | |
| Fetal calf serum (FCS) | From a number of different companies | Batch tested on primary cultures and skeletal muscle cell lines. 10-20% supplement to liquid media | |
| Heraeus Labofuge 300 | Heraeus Instruments | Lab centrifuge capable of reaching 1,000 rpm | |
| 15 ml Falcon centrifuge tubes | Fisher Scientific | Must fit lab centrifuge | |
| Tissue culture plasticware (25, 75 or 175 mm2 tissue culture vessels; 96-well tissue culture plates. 60 mm Petri dishes). | Nalge Nunc international | ||
| Humidified CO2 incubator (Heraeus) | Heraeus Instruments | Ours is copper lined, recommended for reducing contamination | |
| Sterile hood with laminar air flow (Heraeus) | Heraeus Instruments | Ours is a Class II hood – suitable for use with Human tissues | |
| Water Bath | Grant Equipment | Maintained always at 37°C | |
| Inverted microscope | Leica Microsystems | ||
| 70% Ethanol | For sterilization (animals, dissection instruments) and swabbing benches, hood, etc. | ||
| Calcium- and magnesium-free phosphate-buffered saline (PBS) | Sigma-Aldrich | Cell culture-tested PBS (Dulbecco’s formula) is purchased as a ready-mixed powder or in tablet form and made up with doubledistilled water before sterilization by autoclave. PBS consists of 2.68 mM potassium chloride (KCl); 1.47 mM potassium phosphate monobasic (KH2PO4); 0.137 M sodium chloride (NaCl); and 8.1 mM sodium phosphatedibasic (Na2HPO4). PBS can be prepared from scratch as follows: 200 mg KCl, 200 mg KH2PO4, 8 g NaCl and 1.15 g Na2HPO4/l of double-distilled water followed bysterilization by autoclave. | |
| CryoTube vials | Nalge Nunc international | ||
| A Neubauer haematocytometer and coverslips | Fisher Scientific | For estimating cell counting | |
| Hand counter | Fisher Scientific | ||
| Dissection microscope, Zeiss Stemi 1000 | Carl Zeiss, Inc. | For preparation of explants | |
| Small sterile hood | |||
| Sterile dissection instruments (including Jeweler’s forceps) | Sterilised by autoclave | ||
| Sterile plastic collecting vessels (7 ml bijou tubes or 20ml universals) | Nalge Nunc international | ||
| Warm PECM | Sigma-Aldrich | Made up in the sterile hood and warmed to 37°C in the tissue culture waterbath. DMEM:F-12 supplemented with 20% FCS, 1% glutamine and + 1% penicillin & streptomycin solution | |
| Dispase (50 μg/ml, equivalent to 6 units/mg) | Available from MP Biomedicals, UK | ||
| 10 μg/ml 4_,6 Diamidino-2-phenylindole, dihydrochloride (DAPI). | Sigma-Aldrich | For microscopic visualization of apoptosis and mitosis | |
| Vectashield fluorescent mounting fluid | Vector Laboratories | ||
| Fluorescent upright microscope with ultraviolet filter (we use a Nikon Eclipse E600) | Nikon Instruments | ||
| Digital camera and imaging software (we use a Nikon Coolpix 995 camera; A Nikon D3 camera | Nikon Instruments | ||
| OpenLab4.0a software | PerkinElmer, Inc. | ||
| Photoshop CS4 | Adobe |
参考文献
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1997).
- Askanas, V., Engel, W. K. A new program for investigating adult human skeletal muscle grown aneurally in tissue culture. Neurology. 25, 58-67 (1975).
- Smith, J., Schofield, P. N. The effects of fibroblast growth factors in long term primary culture of dystrophic (mdx) mouse muscle myoblasts. Exp Cell Res. 210, 86-93 (1994).
- Fell, H. The cell in culture. J Clin Pathol. 11, 489-495 (1958).
- Stewart, D. C., Kirk, P. L. The simultaneous measurement of several parameters of embryo heart explants growth in vitro. J Cell Physiol. 40, 183-198 (1952).
- Harvey, A. L., Robertson, J. G., Witkowski, J. A. Maturation of human skeletal muscle fibres in explant tissue culture. J Neurol Sci. 41, 115-122 (1979).
- Zammit, P. S., Heslop, L., Hudon, V., Rosenblatt, J. D., Tajbakhsh, S., Buckingham, M. E., Beauchamp, J. R., Partridge, T. A. Kinetics of myoblast proliferation show that resident satellite cells are competent to fully regenerate skeletal muscle fibers. Exp Cell Res. 281, 39-49 (2002).
- Konigsberg, I. . The embryonic origin of muscle. , (1986).
- Trainor, P. A., Tan, S. S., Tam, P. P. Cranial paraxial mesoderm: regionalization of cell fate and impact on craniofacial development in mouse embryos. Development. 120, 2397-2408 (1994).
- Tajbakhsh, S., Rocancourt, D., Cossu, G., Buckingham, M. Redefining the genetic hierarchies controlling skeletal myogenesis Pax-3 and Myf-5 act upstream of MyoD. Cell. 89, 127-138 (1997).
- Tremblay, P., Dietrich, S., Mericskay, M., Schubert, F. R., Li, Z., Paulin, D. A crucial role for Pax3 in the development of the hypaxial musculature and the longrange migration of muscle precursors. Dev Biol. 203, 49-61 (1998).
- Tajbakhsh, S., Bober, E., Babinet, C., Pournin, S., Arnold, H., Buckingham, M. Gene targeting the myf-5 locus with nlacZ reveals expression of this myogenic factor in mature skeletal muscle fibres as well as early embryonic muscle. Dev Dyn. 206, 291-300 (1996).
- Tam, P. P. A study of the pattern of prospective somites in the presomitic mesoderm of mouse embryos. J Embryol Exp Morphol. 92, 269-285 (1986).
- Cossu, G., Kelly, R., Donna, S. D. i., Vivarelli, E., Buckingham, M. Myoblast differentiation during mammalian somitogenesis is dependent upon a community effect. Proc Natl Acad Sci USA. 92, 2254-2258 (1995).
- Shainberg, A., Yagil, G., Yaffe, D. Control of myogenesis in vitro by Ca2+ concentration in nutritional medium. Exp Cell Res. 58, 163-167 (1969).
- Dodson, M. V., Martin, E. L., Brannon, M. A., Mathison, B. A., McFarland, D. C. Optimization of bovine satellite cell-derived myotube formation in vitro. Tissue Cell. 19, 159-166 (1987).
- Smith, J. Muscle Growth factors, ubiquitin and apoptosis in dystrophic muscle: Apoptosis declines with age in the mdx mouse. B Appl Myol. 6, 279-284 (1996).
- Smith, J., Fowke, G., Schofield, P. Programmed cell death in dystrophic (mdx) muscle is inhibited by IGF-II. Cell Death Differ. 2, 243-251 (1995).
- Smith, J., Schofield, P. N. Stable integration of an mdx skeletal muscle cell line into dystrophic (mdx) skeletal muscle: evidence for stem cell status. Cell Growth Differ. 8, 927-934 (1997).
- O Shea, L., Johnson, C., Rooney, M., Gleeson, R., Woods, K., Smith, J. Adipogenesis and skeletal muscle ageing. Mech Ageing Dev. 122, 1354-1355 (2001).
- Merrick, D. . A role for Igf-2 in fast skeletal muscle specification during myogenesis in dystrophic and wild type embryos [dissertation]. , (2006).
- Stadler, L. K. J., Merrick, D., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Abstr. Genet.Res. 90, 281-289 (2008).
- Merrick, D., Stadler, L. K. J., Larner, D. P., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Dis Model Mech. 2, 374-388 (2009).
- Matschak, T., Stickland, N. C., Smith, J. Explants of embryonic Atlantic salmon muscle in culture. Proc Soc Exp Biol A. 1, 23-23 (1997).
- Smith, J., Hooper, M. L. Dominance and independent segregation of metabolic cooperation competence and pluripotency in an embryonal carcinoma cell hybrid. Exp Cell Res. 181, 40-50 (1989).
- Bulfield, G., Siller, W. G., Wight, P. A., Moore, K. J. X chromosome linked muscular dystrophy (mdx) in the mouse. Proc Natl Acad Sci USA. 81, 1189-1192 (1984).
- Hagiwara, Y., Sasaoka, T., Araishi, K., Imamura, M., Yorifuji, H., Nonaka, I., Ozawa, E., Kikuchi, T. Caveolin-3 deficiency causes muscle degeneration in mice. Hum Mol Genet. 9, 3047-3054 (2000).
- Westbury, J., Watkins, M., Ferguson-Smith, A. C., Smith, J. Dynamic temporal and spatial regulation of the cdk inhibitor p57 (kip2) during embryo morphogenesis. Mech Dev. 109, 83-89 (2001).
- Merrick, D., Ting, T., Stadler, L. K. J., Smith, J. A role for Insulin-like growth factor 2 in specification of the fast skeletal muscle fibre. BMC Dev Biol. 7, 65-65 (2007).
- Paddison, P. J., Caudy, A. A., Hannon, G. J. Stable suppression of gene expression by RNAi in mammalian cells AQ4. Proc Natl Acad Sci USA. 99, 1443-1448 (2002).
- Smith, J., Merrick, D. Skeletal Muscle Microexplant Culture and Isolation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 633, (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved