Method Article
誘電泳動と層流を用いたマルチチャネルマイクロ流体デバイスの分離ビーズと細胞
要約
誘電泳動(DEP)は、細胞を操作するために有効な方法である。プリント回路基板(PCB)は、マイクロ流体デバイス内に非接触で細胞操作のために、安価な再利用可能で効果的な電極を提供することができます。プリント基板上にカバーグラスを持つPDMSベースのマイクロ流体チャネルを組み合わせることで、我々は、マルチチャンネルマイクロ流体デバイス内でビーズと細胞操作と分離を示しています。
要約
マイクロ流体デバイスは、細胞を選別し、計数、操作、勉強のためにセルの規模で動的な流体環境を提供することにより、細胞の研究を進めてきた。しかし、流体領域内のセルを操作することが課題のままとバルブと電極を形成するための複雑な製造プロトコルを必要とする、または光ピンセットのような特殊機器を必要とします。ここで、我々は(PCB)は、従来のプリント回路基板を示すbioactuationするため、およびマルチチャネルマイクロ流体の細胞とビーズの分離のための層流の分野でのビーズと細胞操作のための採用誘電泳動(DEP)による細胞の非接触操作に使用することができますデバイス。最初に、我々は、DEPの電極とマイクロ流体デバイスの組み立て、およびDEPのために細胞を調製するためのプロトコルを提示する。その後、我々は、ポリスチレンビーズでDEPの動作を特徴付ける。最後に、我々は、マルチチャンネルマイクロ流体デバイスのビーズと細胞分離の代表的な結果を示す。要約すると、DEPは、マイクロ流体デバイス内での粒子(ビーズまたはセル)を操作するための効果的な方法です。
プロトコル
機器のセットアップの一般的な図を図1Aに示されています。 PCB -サンプルのアセンブリはさらに、図1Bにおける断面模式で詳述されます。
1。 PCBの電極の準備:
- 不均一な電界を生成するために、目的の形状に設計PCB電極。カスタマイズされたPCBの電極チップは、商業の製造設備(図1C)を介して注文することができます。
- 印刷された各金属電極(図1D)の最後に半田付け、16ゲージのワイヤでのプレハブPCB電極を準備します。
- 電極の端の上に線を置きます。ワイヤを加熱するホットはんだごてによるPCBの金属部分の所定の位置にワイヤーを保持する。
- 半田で線を埋めるために電熱線にはんだ少量の餌。
- 線が半田で充填した後、はんだの温度が下がる一方な場所にワイヤーを保持している、はんだごてを削除します。
- PCB上の各電気的な接続(図1D)のためのはんだ付けプロセスを繰り返します。
2。マイクロ流体チャネルを準備します。
- ポリジメチルシロキサン(PDMS)ベースのマイクロ流体チャネルをPDMSエラストマー、ダウコーニングからSylgard 184を用いて調製される。チャネルを定義するマスター金型は、通常シリコンウェハとSU - 8フォトレジストを使用して標準的な微細加工プロセスを経て作成されます。
- 5分間10:1の比で硬化剤に主剤を混ぜる。
- プレハブSU - 8マスター鋳型に液状PDMSを注ぎ、数分間真空に液体PDMSを公開することにより、気泡を取り除く。完全にすべての気泡を除去するために必要に応じて真空プロセスを繰り返します。
- 70 PDMS℃で2時間を治す。
- ウェハを壊さないように注意して、カミソリの刃を持つウェハからマイクロ流体チャネルをPDMSのスラブを削除します。
- マイクロ流体デバイスに体液と細胞を導入するためのパンチ穴。 (注:シリンジポンプ、重力や表面張力ベースのフローがすべてのDEPを使用することができます。)
- それは、ほこりやごみの自由であることを保証するためにマイクロ流体デバイスを検査する。 PDMSのクリーニングは簡単に3Mスコッチマジックテープを使用して達成することができます。
- クリーンNo.0の厚さ(80〜130μm)のカバースリップの血漿結合はPDMSマイクロ流体チャネル。 15分の最小値は100℃でカバースリップ - マイクロアセンブリを加熱する。
3。低導電性のメディアを準備します。
- 低導電性媒体は、8.5%ショ糖を混合して調製された脱イオン(DI)水で+ 0.3%グルコース(w / v)の1。
注:我々は以前に細胞が短い期間(約30分)のために低い伝導性にさらされた後、従来の細胞培養培地で日間培養することができることが示されている11。
4。 PCBの電極上にマイクロ流体チャネルを組み立てます。
- PCBとカバーガラスの間に緊密な接触を確保するため、PCB上にミネラルオイルを少量(約10μL)に置きます。
注:電極の可視化を減少させるためのオプションの手順では、黒の油性マジックや塗料の非常に薄い層で被覆するには、PCBの表面です。 - カバースリップは、石油(カバースリップダウン)との接触を形成するとともに、油を塗ったPCB上にカバースリップ-マイクロ流体チャネルのアセンブリを置きます。ゆっくりと良好な接触を確保し、細胞とビーズの可視化を損なうことができる空気の気泡を最小限に抑えるためにカバースリップ - マイクロアセンブリを押し込みます。完成したデバイスの例は、図1Dに示されています。
5。ソートするとDEPを使用してビーズとセルを集中。
- DI水または低伝導率のメディアとマイクロ流体チャネルを充填します。プラズマボンディングプロセスが一時的に通常は疎水性のPDMS表面を親水性にすることで、マイクロ流体チャネル内に水溶液を簡単にロードを容易にします。
- チャンネルリザーバー(図1C)に細胞および/またはポリスチレンビーズをご紹介。ここでは、ヒト大腸腺癌(HT - 29)細胞を使用してください。
- AC電源のアンプの入力にファンクションジェネレータの出力を接続し、電極の配線にアンプの出力を接続する。衝撃への潜在的な暴露からユーザーを保護するために電気テープを使用してセットアップのすべての電気配線と表面を覆う。機器のセットアップの概略図を図1Aに示されています。
- 1.0から1.5 MHzの正弦波出力を生成するためにファンクションジェネレータを設定します。出力の振幅は、PCBを80 - 100Vの出力を生成するRFパワーアンプ用に調整する必要があります。この作業でRFパワーアンプは、220から330 mVの周りの入力電圧を必要とします。別々のセルとビーズに、層流の速度は、ターゲットチャネルにメインチャネル(幅w =100μmの、高さh = 27μmの)内のセルとビーズを移動させる(幅w =100μmのDEPの力に準拠している必要があります、高さh = 27μM)。
注意:mを決定するためにPCBの製造業者に相談このようなPCBの過熱や溶融などの問題を回避するためにaximum動作電圧。安全な動作設定を決定するファンクションジェネレータとパワーアンプのメーカーの機器の製造元の仕様を確認してください。 - ソートの細胞とビーズにDEPを開始する。ポリスチレンビーズは、指定された周波数内で不均一な電場で負のDEPを体験し、一方のセルは、正DEPを経験する。これは、DEP力活性化のbioactuationと細胞と電極として手頃な価格で再利用可能なプリント基板を使用してマイクロ流体デバイス内の他の粒子の分離が可能になります。
6。代表的な結果:
DEPが作動細胞または粒子で効果的であるときは、不均一な電場内で堅牢なアラインメントは、静的なバスまたは低速流体の速度のために観察される。高い流体速度の条件下では、細胞または粒子挙動は電場の軸流と流速の相対的な向きに依存する。さらに、細胞と粒子の挙動も、電界強度および電場内の非均一性の程度に依存しています。細胞または粒子の典型的な行動は、"真珠のチェーン、"サイクリング、失速、または回転などがあります。
妥協または廃止DEPは、流体、弱電界の強さ、過度の流速、厚すぎるカバーガラス、またはカバースリップとPCBの電極間の導電性溶液中の塩または他のイオン性分子の存在を含めることを条件(例えばクラックカバースリップが誘発することができます)水と鉱物油の混合。
ここで、0番厚みのカバースリップ(80〜130μm)との電極間隔(231μm)を使用しているとき、電界強度の二乗の勾配は、HT - 29細胞とビーズに適用さが2の間と推定される-8〜6-8 V 2 /μmの3 1
DEPの力は、静的な流体(図2A - B)にDEPによって操作される粒子の速度を、測定することによって推定することができる。粒子の小さな慣性とマイクロ流体チャネルの粘性の高い環境のために、流体抵抗力が等しくなるが、DEPの力と反対の方向です。低導電性媒体における平均的なビーズ速度は、DEPの93 Vppの電圧と1.5 MHzの34.5μm/ sのです。流体抗力は次式で計算することができます。1
F ドラッグ =6πηRv
20℃の低導電性の媒体の平均粘度η° Cは1.27 mPa ・•sでビーズ半径Rは7.5μmである。ポリスチレンビーズのための流体抵抗力が6.19 pNのと推定される。 (図2C - F)マイクロ流体チャネル内にビーズを作動させる能力を示すために、我々は、表面張力の媒介の流れを用いることによって、低導電性の媒体の流れを開始した。個々のチャネル内の平均速度が565μmの/秒(図2C)に減少したのに対し、単一の入力チャネルの平均ビーズ速度は、1540ミクロン/秒であった。 DEPを開始することによって、ビーズはむしろサイドチャネルに放出されているよりも中央のチャネル内に保持された。従って、これらの条件下で、DEP軍は2つのサイドチャンネルに流体の抗力に打ち勝つのに十分であった。
同じ原理は、単にDEPの電極(図2E - F)のようにチャンネルとビーズの流れの向きを変更することにより、中央の運河からのシングルサイドチャネルにビーズをそらすために使用されていました。ビーズは三つの部分に分かれることのポイントに近づくとDEPが開始された単一の入口チャネル、の側に金属電極を釣りことにより、ビーズをチャネルの側面に導かれた。そこに、DEP軍は層流がチャネル(図2F)がそれらを推進するために続け側のチャンネルの一つにビーズを引っ張るために十分であった。
細胞とポリスチレンビーズが不均一な電界で分極し、作動させる能力に明らかな違いを持っているので、我々は同時に、細胞とビーズのオンチップ分離を実行する能力を実証するためにDEP使用。我々は、図2E - Fで設定した同じ流体チャネルの構造と基板電極を使用するが、単一の入口チャネル(図3)に、低導電性の媒体でHT - 29細胞とビーズの懸濁液を導入しました。ビーズは右上の個々の出力チャネルに保持されたのに対し、DEPが導入されている場合、およびこれらの条件下で、HT - 29細胞は、2つの左出力チャンネルに保持された。それらは左出力チャネルで収集されるここで細胞が特徴的な"真珠チェーン"の動作を示す。時折ビーズと細胞は、それらはしばしば細胞の出力チャンネルで、一緒に回収された一緒に添付さになる。この実験かららのデータは、我々は713分あたりの粒子(細胞とビーズ)、または20分に14260細胞とビーズの同等のようにソート率を決定する。取得された細胞とビーズの数は、分子生物学、イメージング、生化学およびラボオンチップアプリケーションに関連すると便利です。

図1。マイクロ流体チャネルの細胞および粒子のPCBベースのDEP。(A)DEPベースの作動のための機器のセットアップは、の信号強度を高めるためにして、パワーアンプを電気信号の周波数と振幅を定義するためにファンクションジェネレータで始まるPCB上で生成される電界。 (B)サンプルの作動のためのマイクロ流体デバイスアセンブリは、不可逆的に無にバインドされたPDMSマイクロ流体チャネルから構成されます。細胞および/またはビーズを入浴するには、0の厚さの酸素プラズマを介してカバースリップ(80〜130ミクロン)、非導電性の媒体。 (C)PCBの電極は、電極が強力な不均一な電界を生成するために櫛歯されている2つの領域から構成されてここで使用。 (D)完成した装置:シングルカバースリップ上でtrifurcatedマイクロ流体デバイスとPCBは、挿入図は、電極ワイヤで全デバイスを示しています。 (CD)のスケールでは、PCBの測定値は8.4センチ(L)、2.1 CM(w)は、5ミリ幅の電極としています。
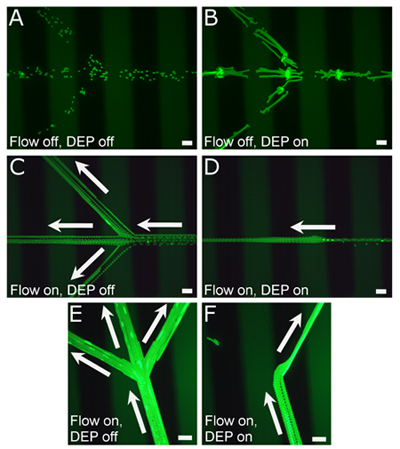
図2。 DEPアクチュエーション前および実行中にチャネルの細胞とビーズの代表的な画像。()層流のないPDMSマイクロ流体チャネル、(時間経過、1.23秒)内の低伝導率のメディアソリューションで15μmの蛍光ポリスチレンビーズ。 (B)DEP開始されると、ビーズは、電極(時間経過、8.18秒)の間にPCBの電極パターン(ブラックストライプ)ではなく、向かって移動。 (C)層流の下で同じチャンネル内のビーズが3つのチャンネル(経過時間、5.3秒)の間で分割され、DEPが(D)開始されるとき、ビーズは中央のチャネルにのみ流れるように作動している(時間経過、4.3秒)。 (E)PCBの電極へのチャネルの向きを変更することにより、ビーズを差動ではなく、(D)に示すような中央のチャンネルよりもDEPを使用する側のチャネル(F)に向けることができる。 (EF)の経過時間はそれぞれ、8.23秒と5.16秒です。すべてのスケールバー= 100μmの。

図3。前にDEP、ヒト大腸腺癌の混合溶液(HT - 29)3つの個別出力チャネルに1つのチャネルからの細胞とビーズの流れを開始する前とDEP作動中。チャンネル (AB) の細胞とビーズの代表画像 。オープン矢印は層流とチャネルの方向は方位と明確化のための破線で囲まれている識別します。特定されるように(CD)誘導DEPにより、ビーズと細胞が選択的に別々のチャンネルに作動している。ビーズは右チャンネルを終了するのに対し、HT - 29細胞は、中央と左チャンネルを終了します。ビーズと細胞の特徴的な真珠のチェーンは、DEP作動中に観察される。マイクロチャネル中の細胞とビーズの(A、C)微分干渉コントラストイメージングは、ビーズが簡単に見えるレンダリングします。同じDIC画像(、C)のグロースケールの強度画像(B、D)は、チャネル中の細胞の可視化を向上させる。反射金属電極((A、C)の光のストライプと(B、D)黄色と緑色)効果的なDEPベースの作動のために電極にマイクロチャネルを揃えるための著名なランドマークを提供する。スケールバー= 100μmの。
ディスカッション
マイクロ流体デバイスの細胞操作では、ソートまたは単一細胞の選択的配置、または人口調査のための望ましい2層流をマイクロ流体デバイス内のセルを操作するためのバルブとポンプと組み合わせて使用されている。しかし、単独でこれらのメソッドは、チャレンジングなものであり、詳細な製造プロセスやスキルを必要とする3遠心分離は、セルの配置のための要求を簡素化することができますが、同時イメージングが課題となって、希望する操作と考えると効果を設計する際に、さらに、遠心分離用チャネルのアーキテクチャは、慎重に検討する必要があります。求心力の4レーザーピンセットは、セルの配置に使用することができますが、方式はコストとハイスループット細胞選別のための従順ではない。しかし、5、DEPが有効なセル配置のための"電気ピンセット"の効果的なシステムとして実証されている、特性評価と操作。6,7
特に、DEPは、細胞塊の測定のために共鳴センサーの細胞を収集するための7-10と、選択的に生活と死細胞のオンチップ処理のために細胞を捕捉し、ソートするために使用されています。11我々は以前にDEPを増やすことによっていることを実証した流体抗力上記細菌またはビーズ上での力、ポリスチレンビーズ及びリステリアモノサイトゲネスV7のオンチップ濃度とトラッピングを達成することができる。E. 12混合集団は、 大腸菌とL.リステリア菌の細菌はまた、DEPのパルスによって誘導し、リリースすることができます。小さ な粒子が捕捉されていませんが、流体の流れで削除されるのに対し、さらに、より大きな粒子は、差動、大きな粒径に基づいて、電極上に捕捉、濃縮することができます。13 DEPの力が粒子上に流体ドラッグする力を克服していないときは、ビーズや細胞がキャプチャではなく、流体ストリーム内で移動されていません。図2Cに示すように、ビーズは中央のチャネルでビーズを保持するのに十分な流体の流れの中央部に集中することができます。これは、DEPが強制的に、これらの組み合わせ、または他のいくつかの未定義の効果をドラッグするよりも大きい流体速度の電界内の粒子間の粒子の影響の相乗効果が原因である可能性があります。
非接触DEPの新しい進歩は、このようにDEP操作中に、最大限に、細胞の種類を保護する、必要最小限のフィールドで、セルのキャプチャと操作を最大化を可能にする。1,9接触DEPは、ソートのためのマイクロ流体のコミュニティへの約束、収集とポジショニングの細胞を提供していますマイクロ流体デバイス内で。我々は、増加の需要、およびマイクロ流体デバイス内で操作するためのDEPの実装で、更なる発見と技術革新がDEP力の理解と影響力を拡大すると予想している。
PCBは、その実用化のための良いプラットフォームを作り、迅速な製造の所要時間と手頃な価格で大量生産工程を経て製造することができる。さらに、PCB類は使いやすく、オンチップ細胞操作やソートのための分野の範囲での科学者のためにアクセス可能です。
PCBの電極のレイアウトを設計する際に、考慮が必要な粒子/細胞軌道に与えられるべきである。検討のための主要な要因は、粒子サイズと種類(ビーズおよび/または細胞)、細胞型、マイクロサイズ、流速、電極間隔(電界強度を決定する)、カバーの厚さ、および流体の導電性が含まれています。これらの要因は、粒子または細胞、および最終的には分離効率を操作するために必要な、利用可能な力に影響を与える。ここで紹介する我々のプロトコルは、ミクロスフェアおよび細胞分離のためにDEPを開始するための効果的なセットアップを示しています。潜在的なアプリケーションの場合、ユーザーは各アプリケーションの効率を最適化するために、細胞とビーズの所望の流路だけでなく、電極パターンとマイクロ流体チャネルの設計のアーキテクチャと一致している必要があります。電極間隔とカバーガラスの厚みは、マイクロ流体チャネルのレイアウトを設計する以前に報告されたガイドラインに従って使用することができます1。
細胞はそのまま維持しながら細胞/粒子と周囲の媒体の導電率と誘電率は、正または負のDEPを容易にするために十分異なっている必要があります。球状粒子のDEPの極性は、DEPの電圧の周波数ωで、次のクラウジウス - Mosotti因子の複雑な値の実数部から決定することができます。
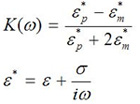
式(1)
この式のεに、誘電率、σは導電性であり、そしてε*は複素誘電率である。添え字のpとmそれぞれ、粒子やメディアを表す。セルがメディアよりも高い誘電率を持っている、またはクラウジウス - Mosotti係数の実部が正になるときは、粒子は周囲の媒体よりも偏光になります。不均一な電界により、粒子の偏光が不均一になり、これは、より高い電界強度を持つ地域に向けてセルを描画するポジティブDEP(+ DEP)力を作成します。細胞が周囲の媒体よりも低い誘電率、またはクラウジウス - Mosotti因子負になるの実部を持つ場合、それは負のDEPを(- DEP)受けることになる、とセルは最小限のフィールド領域に向かって強制される。セルとメディアがほぼ同じ複素誘電率を持っている場合、力はセルを操作するために生成することはできません。このような理由から、純粋な水は、DEP粒子操作用の優先メディアです。しかし、純水からの細胞に浸透圧ストレスを回避するために、低導電率のメディアは、導電率を据え置くことを定式化したが、細胞に浸透圧ストレスを減少させるために浸透圧を増加させる。従来の細胞培養培地やDMEMまたはPBSのような生理的緩衝液は、DEPの操作には適していない高導電率を、持っている。
我々はまた、以前に細胞が低導電性の媒体を使用してDEPを持つセンサーで捕捉することができることを実証した。細胞接着のための短い期間の後、低導電率のメディアは、日間、細胞の成長をサポートするために必要な細胞培養培地に置き換えることができます。11
我々の経験から、蛍光ビーズは生細胞の蛍光に関して非常に明るい、従ってそれは生きていると蛍光セルの強さにビードの強度に合わせて、挑戦することができます。細胞とビーズの両方の可視化を改善するために、我々は、イメージング用正立顕微鏡の両方でDIC顕微鏡を使用していました。細胞とビーズを表示するには、我々は、見やすくするための幅広い色スペクトルのデータを保持する強度グロースケール画像、内のデータを発表した。従って、関心の研究を設計する際に、画像パラメータおよびリソースを考慮する必要があります。
要約すると、我々は選択的にDEPを使用して別々のチャンネルにビーズと細胞を作動させる能力を示す。細胞生物学、生化学および生物工学のアプリケーションのためのマイクロ流体チャネルの増加ユーティリティを使用すると、DEPは、セルのコレクション、配置、および並べ替えのための望ましいオプションです。 PCBの電極の製造が安価で便利ですが、電極は使いやすく、そして迅速な製作時間は、DEPの実装に最適です。
開示事項
謝辞
我々は機器のセットアップの彼の援助のためのtrifurcating DEPアクチュエーションのためのチャネルとミッチェルCollensへの提供のためのウジンチャンに感謝の意を表したい。作業は、グラントOISE - 0951647を通じて、グラント99-2911-1-002-007を通じて台湾NSCによる米国NSFによってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Sylgard 184 kit (PDMS) | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Dow Corning Sylgard |
| 16 awg hook-up wire | Belden | 8521 | (Type MW) Mil-W-76C-PVC |
| Gold seal Cover Glass | Ted Pella, Inc. | 260320 | No. 0 thick, 24 x 60 mm |
| Miltex Biopsy Punch | VWR international | 95039-104 | Miltex, assorted sizes |
| Custom PCB electrodes | Bay Area Circuits | Custom parts | |
| Mineral oil | Fisher Scientific | O121-1 | |
| Deionized water | House DI water supply | None | Use filtered DI water |
| D-Glucose Anhydrous Granular AR | Mallinckrodt Baker Inc. | 4912-06 | |
| Sucrose, Crystal | Mallinckrodt Baker Inc. | 8360-06 | |
| Fluorescent polymer microspheres | Bangs Laboratories | FS07F/9277 | 15μm Dragon green microspheres |
| HT-29 cell line | ATCC | HTB-38D | Human colon adenocarcinoma |
| Typsin 0.05% EDTA | Invitrogen | 25300054 | |
| Eclipse E600FN upright microscope | Nikon Instruments | Eclipse E600FN | |
| Phantom V310 High-speed imaging camera | Phantom | V310 | |
| BX51 upright research microscope | Olympus Corporation | BX51 | |
| SpotFlex high resolution color camera | Diagnostic Instruments | FX1520 | |
| Function generator | Agilent Technologies | 3325A | |
| RF Power amplifier | EIN | 2100L |
参考文献
- Park, K., Suk, H. J., Akin, D. Dielectrophoresis-based cell manipulation using electrodes on a reusable printed circuit board. Lab Chip. 9, 2224-2224 (2009).
- Nilsson, J., Evander, M., Hammarstrom, B. et al., Review of cell and particle trapping in microfluidic systems. Anal. Chim. Acta. 649, 141-141 (2009).
- Fu, A. Y., Chou, H. P., Spence, C. An integrated microfabricated cell sorter. Anal. Chem. 74, 2451-2451 (2002).
- Rhee, S. W., Taylor, A. M., Cribbs, D. H. External force-assisted cell positioning inside microfluidic devices. Biomed. Microdevices. 9, 15-15 (2007).
- Zhang, H., Liu, K. K. Optical tweezers for single cells. J. R. Soc. Interface. 5, 671-671 (2008).
- Hunt, T. P., Westervelt, R. M. Dielectrophoresis tweezers for single cell manipulation. Biomed. Microdevices. 8, 227-227 (2006).
- Vahey, M. D., Voldman, J. An equilibrium method for continuous-flow cell sorting using dielectrophoresis. Anal. Chem. 80, 3135-3135 (2008).
- Burgarella, S., Bianchessi, M., Merlo, S. A Modular Platform for Cell Characterization, Handling and Sorting by Dielectrophoresis. Cytometry A. 77A, 189-18 (2010).
- Shafiee, H., Sano, M. B., Henslee, E. A. Selective isolation of live/dead cells using contactless dielectrophoresis (cDEP). Lab Chip. 10, 438-438 (2010).
- Vahey, M. D., Voldman, J. High-Throughput Cell and Particle Characterization Using Isodielectric Separation. Anal. Chem. 81, 2446-2446 (2009).
- Park, K., Jang, J., Irimia, D. Living cantilever arrays' for characterization of mass of single live cells in fluids. Lab Chip. 8, 1034-1034 (2008).
- Gomez-Sjoberg, R., Morisette, D. T., Bashir, R. Impedance microbiology-on-a-chip: Microfluidic bioprocessor for rapid detection of bacterial metabolism. J. Microelectromech. Syst. 14, 829-829 (2005).
- Li, H. B., Zheng, Y. N., Akin, D. Characterization and modeling of a microfluidic dielectrophoresis filter for biological species. J. Microelectromech. Syst. 14, 103-103 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved