Method Article
イメージング C.エレガンス胚
要約
市販 C.エレガンス胚は、細胞生物学と開発を研究するための強力なシステムです。我々はのライブイメージングのためのプロトコルを提示 C.エレガンス容易に入手できる落射蛍光顕微鏡とオープンソースソフトウェアを使用してDIC光学系や蛍光を利用した胚。
要約
このような染色体の組み立て、偏析や細胞質分裂などの細胞プロセスは、本質的に動的です。蛍光標識レポータータンパク質または微分干渉コントラスト(DIC)顕微鏡を用いた生細胞のタイムラプスイメージングが、そうでない場合は、固定サンプル1,2の分析から推論されるこれらの動的なイベントの時間的進行の検査が可能になります。また、細胞プロセスの開発規制の研究は、開発中に無傷の生物にタイムラプス実験を必要とする。 Caenorhabiditis elegansの胚は、このように4,5と開発6月9日細胞生物学の質問を研究するための理想的な実験モデルを提供する、光透過的であり、3系統知られている細胞と急速な、不変の発生プログラムを持っています。C.は虫は前進遺伝学(ランダム変異誘発10,11に基づいて)と特定の遺伝子を標的とする逆遺伝学(RNAiによる干渉に基づいており、変異導入12月15日を対象)で遺伝子操作に修正可能です。さらに、トランスジェニック動物が容易に蛍光タグタンパク質や記者16,17を表現するために作成することができます。これらの特性はそれが容易にin vivoで 18から21 に基本的な細胞や発生過程を制御する遺伝的経路を識別できるように組み合わせる。このプロトコルでは、Cのライブイメージングのための方法を提示化合物落射蛍光顕微鏡でDIC光学系やGFPの蛍光を用いて線虫の胚。我々は通常、固定サンプルのイメージングに使用容易に利用できる顕微鏡が、、また、イメージングプロセスを自動化するオープンソースのソフトウェアを使用してタイムラプス解析に適用することができる容易さを示しています。
プロトコル
ワームの準備
- 前の画像22〜適切なプレート18 - 24にL4幼虫のワームを転送します。これは、初期胚の十分な供給のための卵有利子大人を持って保証されます。
- ワセリンとアガロースのチューブを準備します。我々はマイクロ波のビーカーにワセリンを溶融し、チューブ4〜5 mLずつに分注して、いくつかの15mlのファルコンチューブを準備する。同様に2〜3パーセント(w / v)のバッファーのアガロース(M9または卵バッファ)とファルコンチューブに分注し4-5 mLを溶かす。蒸発を最小限に抑えるために過剰に沸騰しないように注意してください。イメージングの日に、65〜70℃のヒートブロックにワセリンの1チューブを溶融し、電子レンジでアガロースの1チューブを溶かす、何度も沸騰最小限に抑えるように注意してください。溶融状態でワセリンやアガロースを保つためにヒートブロックにチューブを保管してください。
- アガロースパッドを作る。各ガイドのスライドの上部と底部に付着一般的な実験のテープの単層によって覆わスライドである2ガイドのスライドの間に新しい顕微鏡のスライドを、置きます。新しいスライドに溶融アガロースの2〜3滴を配置する決裂エンドでパスツールピペットを使用してください。それがカバーし、薄い正方形のパッドを作成するためにアガロースを広めるのに役立つように、元のスライドに2回目のスライドに垂直でカバー。第2のスライドは、ガイドのスライド上にテープの上にくるようにしてください。アガロースの濃度は、厚いパッドを5%に増加させることができる。
- 解剖範囲と白金線を使用すると、18ミリメートル× 18 mmのカバースリップ上にM9や卵バッファの9 -12μLドロップする、転送2大人のワームを"選ぶ"。
- 針(我々は27G1 / 2の針を使用)または胚を解放するためにメスで開いているワームをカット。ワームの途中でカットしてみてください。
- 胚を含む18 × 18 mmのカバースリップの上にアガロースパッドを(下に寒天の側で)下げてください。かみそりの刃と、カバースリップの端から伸びる寒天をトリミング。
- カバースリップの四隅に溶かしたワセリンを適用するペイントブラシや細い木の棒を使用して、シールのカバースリップ。
(卵の殻が正常に形成しない場合など)は胚が圧力の影響を受けやすい場合ハングアップしている寒天のマウントの代わりに23をドロップします。イメージングは、受精や減数分裂のような初期のイベントに追従するように子宮内で行うことができます。ワームは、レバミゾール24と麻酔でなければなりません。開発の特定の段階から、胚の数を増やすために、いくつかのワームは、一度、ゆっくりとピペット精密チップやまつげのブラシを使って一緒に位置付け胚でまたは口のピペッティングによって解剖されることがあります。
4DノマルスキーDIC(微分干渉コントラスト)映画
- オリンパスBX61顕微鏡をオンにします。カメラはそれが最初に、最後の水銀球(GFPや蛍光ために必要に応じて)オンになっている他の機器から放出される電磁波に敏感ですので。すべてが上になるとマイクロマネージャを起動します。 DICまたは蛍光イメージングのための適切な設定ファイルを選択してください。大きな違いは、DICファイルは、蛍光シャッターの制御が含まれていないことです。各ファイルには、適切なフィルタキューブとカメラのゲイン設定を選択します。
- 10倍対物レンズを用いて顕微鏡で胚を見つける。イメージング分野内の複数の胚を得るために若い胚のグループのためのワームの本体の近くに見える。最高のイメージのためのワーム内部に胚を避けてください。
- イメージングのための高倍率(100倍に40倍)と分解能(1.4〜NA 0.9)客観的にソフトスイッチを使用する。
- 、ノマルスキー微分干渉光学系を(次のWebサイトが参考になったDIC光学の説明や用語が含まれている調整するhttp://www.olympusmicro.com/primer/techniques/dic/dichome.html
http://microscopy.berkeley.edu/Resources/instruction/DIC.html)- 私たちのオリンパスBX61上重要なコンポーネントは次のとおりです。
- 偏光板 - コンデンサーの下のスライダ
- コンデンサーウォラストンプリズム - タレットコンデンサーで、ちょうどステージの下。
- 客観的なウォラストンプリズム - フィルタキューブの下のスライダ
- 第2の偏光板(アナライザ) - DICの位置でフィルターキューブ
- 光路(ソフトウェアが起動時にこれを実行してください)で分析(第2の偏光板)を配置するためにDICにフィルターキューブを切り替えます。
- 2枚の偏光板が適切に(交差)合っていることを確認してください。両方ウォラストンプリズムは光路から外れているときに視野が暗くなるはず。必要に応じてこれが正しくなるまで、コンデンサー下の偏光板を回転させる。
- 光路内に目標(上段)ウォラストンプリズムを挿入します。
- 使用している客観的に一致するウォラストンプリズムを選択するためにコンデンサーでタレットを回転させる。
- レンズのNAに合わせて、この櫓の下のスライダを調整します。
- 最適なケーラー照明用のコンデンサーを当てる。
- 上部のウォラストンぷりを調整するSMは、スライダーのつまみを回転させることで最適なコントラストを得るために。
- ソフトウェアの起動によって制御されるその他の設定は、カメラのゲイン(0に設定)と、8ビットではない16ビットのTIFFファイルとして保存するファイルへの切り替えが含まれています。
- 私たちのオリンパスBX61上重要なコンポーネントは次のとおりです。
- 素敵なイメージを与えるために光のレベルを調整します。 (通常は4.7ボルトを使用)(ソフトウェア経由で制御)。我々は、最も明るいピクセルがちょうど飽和レベルより下になるようにサンプルを照らすために好む。
胚における卵黄顆粒が明らかに目立つ3次元的な顔で画像の良好なDIC光学結果。これはサンプルを照らす光は、試料の片側(またはサンプルの機能)などの角度から照らすように見えるかのように記述することができる代わりに明るく点灯し、反対側は影にあり、暗く表示されます。 - あなたがイメージする胚を含むように関心領域(ROI)を選択し、ウィンドウを減らすためにROIのボタンを設定]をクリックします。
- 多次元収集ウィンドウを開きます。 Z -スタック(スライス)と時間のポイント]を選択します。
- 胚の底部(フォーカスのある卵黄顆粒と最後の焦点面)を見つけるために顕微鏡のフォーカスノブを使用してください。選択底をクリックしてください。胚の上部を識別し、設定する手順を繰り返します。我々は通常、1ミクロンのステップサイズを使用し、〜20の焦点面で終わる。胚や細胞が比較的厚いので、我々は一般に各時点で、複数の焦点面を収集する。さらに、細胞が異なる方向に分割するために始める場合は特に、彼らは元の焦点面の内外に移動させる胚の周りに他のセルを置換することができます。あなたの顕微鏡は、フォーカスモータを持っていない場合は、手動で興味のある方は、セルまたはプロセスに従うようフォーカスを調整することができます。
- 必要な時点との時間間隔の入力数。我々は、通常15秒間隔を使用し、500時間ポイントの最大値を設定します。我々は、必要な時に我々が取得を必要とすると停止できますより多くの時点で始まります。あなたがイメージング複数の焦点面である場合、タイムポイント間の間隔の焦点面のすべてを取得するのに十分な時間があることを確認してください。
- データを保存する場所を選択または作成します。ソフトウェアは、最後の画像を表示するように設定されていることを確認してください。ファイルに名前を付けて取得]をクリックします。それが正常に動作しているように、最初にいくつかの時間ポイントの自動画像収集を監視します。
- あなたが10倍目標に買収、スイッチを停止し、次のスライドを準備したいときは、[停止]をクリックします。
- 終了したらイメージングは、光パスからDICのコンポーネントを削除します。客観的な必要に応じてオフクリーンなオイル。カメラから始まるオフすべてを切ります。
GFP作品
- 顕微鏡を起動し、上記のように胚を見つける。蛍光シャッターのソフトウェア制御を含む構成ファイルを使用してください。
- 上部のDICプリズム(スライダ)は、光パス内にないことを確認してください。
- FITC / GFPにフィルターキューブを切り替えて(起動時に自動的に設定)
- 16ビットTIFF(自動的にこの設定ファイルと起動時に設定)に255のカメラのゲインとイメージファイルを変更します。
- 白色光をオフにします。
- プレビュー画像に画像をライブ]をクリックします。光曝露を最小限に抑えるために迅速に働く。また、単一の画像を収集するスナップ画像を使用してください。
- 良い画像を得るために水銀球のパワー/ NDフィルター、露出の長さを調整します。一般的に、あなたは蛍光シグナルのセルと退色する光損傷を軽減するデータを取得するサンプルを到達minimum光を使用する必要があります。
- 時間間隔、時間のポイント数と焦点面の数を設定します。私たちはしばしば50〜10秒間隔と1-3焦点面を使用してください。
- ROIを選択して、以前のステップ13から19で説明したように画像取得のためのパラメータを設定します。
分析する作品
- データは入力したと4Dスタックの各イメージのTIFFファイルの一連の、テキストファイルや、暴露レベルと時間間隔などのメタデータを含むXMLファイルを含む名前のフォルダに保存されます。
- TIFF画像は、2つのメソッドを介してImageJを開くことができます。 (方法a)最初は、最も単純であり、また、各ファイルのメタデータが読み取られます。 (方法b)第二はImageJに割り当てられるメモリの量よりも大きなサイズのファイルを開くために仮想メモリを使用することが可能ですが、それはメタデータが含まれていません。
- マイクロマネージャーのプラグインを使用する
- マイクロマネージャーは上に構築し、ImageJを使用しています(それはあなたが以前にインストールされている可能性がある他のバージョンと異なるものになるImageJの新しいバージョンをインストール)し、データを開くにはプラグインが組み込まれています。別の方法としては、ImageJの別のバージョンのプラグインフォルダにMicro-Manager-1.3/pluginsのフォルダの内容をコピーすることができます。
- Pluginsメニューに移動し、マイクロマネージャーと[開く]マイクロマネージャーのファイル]を選択します。
- を表示し、[OK]をクリックしたいデータを含むフォルダを選択します。
- ZとT寸法で再生。
- plugi遺伝子座を使用したBioFormatsインポーターでムービーを開くにはnを入力。
- tiffファイルを含むフォルダからxmlとtxtファイルを転送し、データセットの名前を一致させるには、2つのファイルの名前を変更します。
- ImageJの内、データブラウザやバイオフォーマットのどちらかして輸入を、プルダウンメニューLOCIを選択し、プラグインにアクセスしてください。
- あなたのTIFFスタックを持つフォルダを見つける。オープン後、最初のTIFFファイルをクリックしてください。
- Hyperstackでスタックを表示します。データセットの組織の下:同じ名前が、スワップの大きさとグループファイルを選択して、すべてのシリーズを開きます。メモリ管理の下で:選択してください:(特に大きなデータセットの場合)の仮想スタックを使用してください。 [OK]をクリック
- プラグインは、データセットの次元を決定する(#タイムポイントと焦点面の)と<>括弧のセットの間の範囲が表示されます。 [OK]をクリックするか、時間のポイントおよび/または開くように焦点面の数を変える。
- 各シリーズに対応する寸法を確認してください。
- ZとT寸法で再生。
- マイクロマネージャーのプラグインを使用する
代表的な結果

図1初期のC.の間に正常な細胞事象を示すノマルスキー微分干渉ムービーから静止画elegansの胚発生:前核移行(0-5:45)、非対称第一分裂(6:45-14:45)と非同期第二事業部(14:45-27:00)。データは、60倍1.35 NAのレンズで集めていた。 1ミクロン間隔で20の焦点面は、40μsの曝露では15秒ごとに収集された。その後方では右と腹ダウンしていることですので、画像が回転させた。スケールバーは10ミクロンを表す。
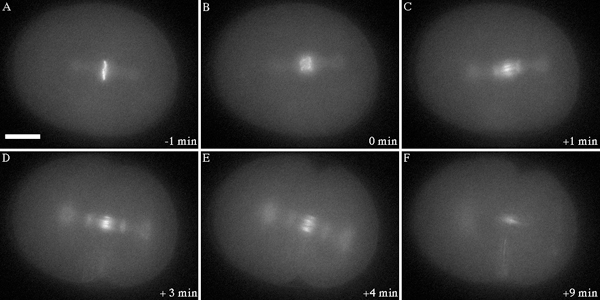
図2。中期から初期の後期(Cまで)後期にスピンドルmidzoneに表示される前までに染色体上に存在する染色体パッセンジャー複合体のGFP標識サブユニット(AIR - 2)のダイナミックな動きを示す蛍光映画からスティルス細胞質分裂が完了すると(FのC)。データは、60倍1.35 NAのレンズで集めていた。単焦点面を50マイクロ秒露光で10秒ごとに収集されました。その後部が右になるように画像が回転させた。スケールバーは10ミクロンを表す。
ムービー1野生型胚のノマルスキームービー。
図1を対応するムービー。後部には、右の腹底になります左下にあります。元のデータセットの単一の焦点面を示しています。画像はバック毎秒14コマに設定されて15秒ごとと遊びを集めていた。 ビデオを見るためにここをクリック
GFPを発現する野生型胚の動画2蛍光ムービー::AIR - 2。
図2に対応する映画。後部には、右上にあります。映画は単焦点面として回収した。画像は10秒ごとに、プレイバック毎秒14コマに設定されて回収された。 ビデオを見るにはここをクリック
ディスカッション
ライブタイムラプスイメージングのための主要な考慮事項は、細胞や生物の完全性と実行可能性を維持することです。 DIC顕微鏡は、試料を照明光源からの紫外線や過度の加熱にさらされていないことの利点を提供します。 DIC顕微鏡は、よく細胞遊走や細胞質分裂などの細胞の形状変化を検出し、そのような有糸分裂紡錘体や核膜などのいくつかの細胞内構造を、識別するために適しています。レポータータンパク質の蛍光イメージングは、追加の細胞内コンパートメントを特定し、特定のタンパク質の可視化を可能にすることによってDIC顕微鏡を補完します。蛍光イメージングの間に胚に光毒性と被害の危険性を軽減するために、我々は、通常照明の削減のUV光の強度と持続時間を相殺するためにカメラのデジタルゲインを増加させる。微弱な蛍光トランスジェニックレポーターのために、バックグラウンドを減らすために焦点のずれた光やぼけ修正アルゴリズムを再割り当てするデコンボリューションアルゴリズムにより、撮影した画像の品質を向上させることができます。このような共焦点顕微鏡や多光子システムなどの高度な顕微鏡は、時々必要であるが、我々は高品質な画像をもたらし、多くの蛍光レポーターがこの落射蛍光顕微鏡のセットアップを使用して画像化することができることを見出した。
マイクロマネージャーは(http://www.micro-manager.org)、無料であることに加えて、代わりに多くの商用ソフトウェアパッケージの独自のファイル形式のTIFF形式への直接ファイルを保存します。これは大幅にImageJを、Photoshopや他の画像編集ソフトで画像ファイルを読み込むために必要なファイルの変換ステップを排除することによって私たちのデータの分析を簡素化します。
開示事項
謝辞
内部の制度資金とミシガン大学の生物科学の奨学金プログラムは、この作業を支持した。
資料
浜松オルカ- ERのカメラでオリンパスBX61顕微鏡。 10倍プランの蛍石(NA 0.3)と60倍PlanAchromat(NA 1.35)の対物レンズ
マイクロマネージャ1.3.46(http://www.micro-manager.org)
画像J 1.43(http://rsbweb.nih.gov/ij)
loci_tools.jar(http://www.loci.wisc.edu)
アガロース - 分子生物学/ゲル電気泳動グレード
フィッシャーSuperfrost /プラス顕微鏡スライド(カタログ番号12-550-15)
実験室のテープ(フィッシャーカタログ#15から901シリーズ)
18ミリメートルx 18のmm#1.5カバーグラス
M9(242 mMのKH 2 PO 4、40mMののNa 2 HPO 4、9ミリグラムのNaCl、19 mMのNH 4 Clをし、MgSO 4)
(http://130.15.90.245/wormlab_recipe_book.htm)。
卵バッファー(118 mM塩化ナトリウム、48 mMの塩化カリウム、2mMのCaCl 2を 、2mMのMgCl 2、25mMのHEPES、pH7.3)を25。
ワセリン
ブラシ/スティック
剃刀の刃
ヒートブロック
解剖顕微鏡
ワーム22
白金線は、22を選ぶ
27G1 / 2精密グライドニードル(ベックトンディッキンソン)や小さな刃を持つメス
参考文献
- Gerlich, D., Koch, B., Dupeux, F., Peters, J. M., Ellenberg, J. Live-cell imaging reveals a stable cohesin-chromatin interaction after but not before DNA replication. Curr Biol. 16, 1571-1578 (2006).
- Nabeshima, K. Dynamics of centromeres during metaphase-anaphase transition in fission yeast: Dis1 is implicated in force balance in metaphase bipolar spindle. Mol Biol Cell. 9, 3211-3225 (1998).
- Sulston, J. E., Schierenberg, E., White, J. G., Thomson, J. N. The embryonic cell lineage of the nematode Caenorhabditis elegans. Dev Biol. 100, 64-119 (1983).
- Oegema, K., Hyman, A. A. Cell division. WormBook. , 1-40 (2006).
- Heuvel, S. v. a. n. d. e. n. Cell-cycle regulation. WormBook. , 1-16 (2005).
- Chisholm, A. D., Hardin, J. Epidermal morphogenesis. WormBook. , 1-22 (2005).
- Gonczy, P., Rose, L. S. Asymmetric cell division and axis formation in the embryo. WormBook. , 1-20 (2005).
- Nance, J., Lee, J. Y., Goldstein, B. Gastrulation in C. elegans. WormBook. , 1-13 (2005).
- Priess, J. R. Notch signaling in the C. elegans embryo. WormBook. , 1-16 (2005).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
- O'Connell, K. F., Leys, C. M., White, J. G. A genetic screen for temperature-sensitive cell-division mutants of Caenorhabditis elegans. Genetics. 149, 1303-1321 (1998).
- Fire, A. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans [see comments]. Nature. 391, 806-811 (1998).
- Jansen, G., Hazendonk, E., Thijssen, K. L., Plasterk, R. H. Reverse genetics by chemical mutagenesis in Caenorhabditis elegans. Nat Genet. 17, 119-121 (1997).
- Liu, L. X. High-throughput isolation of Caenorhabditis elegans deletion mutants. Genome Res. 9, 859-867 (1999).
- Bazopoulou, D., Tavernarakis, N. The NemaGENETAG initiative: large scale transposon insertion gene-tagging in Caenorhabditis elegans. Genetica. 137, 39-46 (2009).
- Praitis, V., Casey, E., Collar, D., Austin, J. Creation of low-copy integrated transgenic lines in Caenorhabditis elegans. Genetics. 157, 1217-1226 (2001).
- Stinchcomb, D. T., Shaw, J. E., Carr, S. H., Hirsh, D. Extrachromosomal DNA transformation of Caenorhabditis elegans. Mol Cell Biol. 5, 3484-3496 (1985).
- Piano, F., Schetter, A. J., Mangone, M., Stein, L., Kemphues, K. J. RNAi analysis of genes expressed in the ovary of Caenorhabditis elegans. Curr Biol. 10, 1619-1622 (2000).
- Gonczy, P. Functional genomic analysis of cell division in C. elegans using RNAi of genes on chromosome III. Nature. 408, 331-336 (2000).
- Sonnichsen, B. Full-genome RNAi profiling of early embryogenesis in Caenorhabditis elegans. Nature. 434, 462-469 (2005).
- Mohler, W. A., Isaacson, A. B. Imaging embryonic development in Caenorhabditis elegans. Cold Spring Harb Protoc. , (2010).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Bembenek, J. N. Cortical granule exocytosis in C. elegans is regulated by cell cycle components including separase. Development. 134, 3837-3848 (2007).
- Poteryaev, D., Squirrell, J. M., Campbell, J. M., White, J. G., Spang, A. Involvement of the actin cytoskeleton and homotypic membrane fusion in ER dynamics in Caenorhabditis elegans. Mol Biol Cell. 16, 2139-2153 (2005).
- Bianchi, L., Driscoll, M. Culture of embryonic C. elegans cells for electrophysiological and pharmacological analyses. WormBook. , 1-15 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved