Method Article
シナプス伝達とイメージシナプス前終末を研究するために齧歯類の脳スライスからの神経細胞のVibrodissociation
要約
この報告書は、添付されたシナプス前boutonsを保持する個々の実行可能な神経細胞の機械的な分離のためのテクニックを示しています。 Vibrodissociatedニューロンは、隣接セルからの影響のない急速な生産、優れた薬理学的制御と空間のクランプの改善の利点を持っている。このメソッドは、シナプスの要素のイメージングやパッチクランプ記録に使用することができます。
要約
中枢神経系から神経細胞の機械的な解離は、シナプス前boutonsは関心の分離されたニューロンに接続されたままという利点があります。これは細胞外とシナプス後細胞内環境を良好に制御することができる条件下でのシナプス伝達の検査が可能になります。 vibrodissociationとして知られているプロテアーゼの使用せずに振動ベースの技術は、機械的な分離のための最も人気のあるテクニックです。小さなボール状にファイアーポリッシュ先端とマイクロピペットは、P1 - P21齧歯類から作られる脳のスライスに置かれます。マイクロピペットは、スライス面に平行に振動し、分離されたニューロンの解放をもたらすスライスの厚さによって低下する。分離されたニューロンはvibrodissociationの数分以内に研究のための準備が整いました。細胞外環境の優れた制御隣接セルの影響から自由;適合電気生理学とイメージングの研究に適した実行可能な、比較的成熟した神経細胞の急速な生産:このテクニックは、などの一次ニューロン培養、脳スライスと酵素的に分離された神経細胞の使用上の利点があります。迅速な薬剤のアプリケーションおよび総細胞灌流を用いて十分に制御された薬理学的実験のため、およびスライスまたは細胞培養調製物中の神経細胞への相対的な細胞全体のレコーディングにおける空間クランプ改良。この製剤は、シナプス生理学、薬理学、変調と可塑性を調べるために使用することができます。生きている細胞とboutonsでプリとシナプス後要素の両方のリアルタイムイメージングはvibrodissociatedニューロンを用いても可能です。プリとシナプス後要素の分子成分のキャラクタリゼーションは、免疫学とイメージングベースのアプローチで達成することができる。
プロトコル
1。炎シールガラスのマイクロピペットの準備
- 微小電極のガラスを使用して、フレーミング、ブラウンまたは同等のマイクロピペットプラー(先端直径約2ミクロン)を標準のパッチクランプピペットを引き出します。 200から300ミクロンの直径を持つ溶融ボール形になるまで〜2秒のためのブンゼンバーナーから炎への場所のマイクロピペットの先端。
- 急速に圧電バイモルフ、リレー、または同等に効果的なデバイスを使用して(走行距離100から200μm)を横方向に振動することができるマイクロマニピュレータ上にホルダーの上に場所は火炎密封パッチピペット。
2。 P1 - P21ラットまたはマウスの脳スライスを準備
- 124のNaCl、4.5 KClを、1.2のNaH 2 PO 4、26のNaHCO 3、および10 D -グルコース:以下の組成(mMで)で人工脳脊髄液(ACSF)を準備する。 〜15分間95%酸素/ 5%CO 2ガスによる気泡のソリューションは、その後、2mMのCaCl 2及び1mMのMgCl 2を加える。
- 脳切片を切断:
- ハロタンやイソフルランで動物を麻酔。動物を刎ねる - 脳を削除 - 所望の配向(等、冠状、矢状、横)のブロックの脳を関心領域を含むように。
- 接辞はACSFに浸した振動脳スライサーの段階にブロックされた脳 - 250から400μmの厚さで、セクションの脳 - ACSFの場所のスライスは、流体/すべての表面上のガスの曝露を可能にするネット上の"プレインキュベーション"チャンバー内carbogenでバブリング - スライスは、少なくとも1時間この培地中で平衡化することができます。
3。 Vibrodissociation
- とNaOHを用いて150のNaCl、5のKCl、10 HEPES、1のMgCl 2、2.5のCaCl 2、10 7.4に設定されたpHを有するD -グルコース:以下の組成(mM)でのHEPES緩衝生理食塩水で35 mm径の培養皿を埋める浸透圧は、ショ糖を使用して〜300 mOsMに調整。培養皿には皿の底に強力な細胞接着の必要性に応じて、例えば、ポリ- L -リジンで被覆されたサスペンションの皿、標準細胞培養皿、ガラスのカバースリップの挿入と培養皿、または料理があります。
- 培養皿にスライスを置き、250 xで解剖ステレオスコープと可視化重量として動作するようにスライスの上面に配置曲がった白金線を(直径0.5mm)を使用して底にスライスを保持する。
- 希望する脳の領域におけるスライス面上の火炎密封されたマイクロピペットの先端を合わせます。遠足の距離〜100μm程度で、10〜30 Hzで横方向に先端を振動させるマイクロマニピュレータをアクティブにします。マイクロマニピュレータを使用して、それは〜30秒内でスライス全体を通るようにスライスの組織に深く先端を移動します。特定の脳領域から得られる単離したニューロンの数を最大化するために、必要に応じてこの手順を繰り返します。
- 鉗子でスライスをピックアップし、ゆっくりと溶液中ではまだながら、それを横に振る - - その後、完全にスライスを削除し、破棄スライスからヒントを削除します。
- 解離細胞が少なくとも10分間シャーレの底に沈降し、遵守することができます。
4。電気生理学的記録
- 倒立顕微鏡のステージ上のニューロンを含んでいる皿を置き、63 ×対物レンズに10 ×と視覚化する。円滑な特許膜、無ブレブ形成、および検出可能ですが、大型ではない核の神経細胞を探します。位相コントラスト光学系が使用されている場合は、あまりにも青ではない、黄がかった相明るいニューロンを探します。目的の塩、栄養素、受容体拮抗薬を含む細胞外液で表面かん流する細胞は、等(当社の標準は、上記のHEPES緩衝生理食塩水である(3.1節))、多くの場合、5μMの2,3 - ジオキソ-6 - ニトロ- 1、を補足2,3,4 - テトラヒドロベンゾ[F]キノキサリン-7 - スルホンアミド二ナトリウム(NBQX)、および高速なGABAの分離を可能にするイオンチャネル型グルタミン酸受容体をブロックするために25から100μMD - 2 - アミノ-5 - phosphonopentanoic酸(AP5)受容体を介した性IPSC 1,2。
- フレーミング - ブラウンまたは同等のプーラーを使用して標準的なパッチのマイクロピペットを引き出します。 -ベースのソリューション-ピペットチップ抵抗は、ClでいっぱいMΩ2-4(標的細胞のサイズに応じて)でなければなりません。
- 標準的な電気生理学的手法を用いて可視化ニューロンからホールセル記録を確立する。
- ギャップのないデータ収集プロトコルを使用して自発性シナプス後電流(sPSCs)を記録。 0.2から1μMのテトロドトキシンおよび/ または低Ca 2 +を適用する-ミニチュア性シナプス後電流(mPSCs)を記録するために細胞外溶液を含む。
- ソリューションおよび薬理学的作用物質を直接細胞に適用することができます。我々は、ステッピングモータ駆動マニピュレータに取り付けられたチューブの横方向の移動を伴うソリューションの交換との融合正方形の先端がガラス管からローカル灌流を使用してください。このアロ細胞外分子の含有量の急激な変化、受容体アゴニストの応用、等を達成するためにミリ秒の100〜10秒で解決策の交換のためにあった
- 赤池らは、単一のシナプス前boutons 3,4を刺激する技術を開発しました。マイクロピペットは、可視化ブートンと刺激の近くに配置されます(5-10μAの負の刺激電流を、0.1から0.2ミリ秒持続時間)が与えられます。ユニタリ性IPSCが記録され、そしてそのような失敗の方法などのメソッドは、シナプス前及びシナプス後機能の変化を調べるために使用することができます。
5。イメージングシナプス前終末
- シナプス後ニューロンは、パッチピペットを介して各種の染料を充填することができる。神経細胞はまた、選択された細胞集団における緑色蛍光タンパク質(GFP)などの蛍光蛋白質(fps)を発現するマウスから作製することができる。
- シナプス前終末には、特定の介在ニューロンの集団でFPSを表現したマウスから作られたvibrodissociatedニューロンで可視化することができる。例えば、グルタミン酸デカルボキシラーゼ65(GAD65)プロモーターによって駆動されるGFPを発現するマウスは、海馬バスケット細胞および他の介在ニューロンにおける緑のsomaの複数形とプロセスを示しています。海馬CA1領域からVibrodissociated錐体細胞は、彼らのsomaの複数形と近位樹状突起(図1A)に並列したGFP陽性軸索終末を持っている。エクスプレスsynaptopHlourinは(pH感受性GFP変異体は、シナプス小胞関連VAMP2タンパク質に融合された)THY1プロモーターの制御下でもpH感受性蛍光(図1B)を示すFP陽性添付boutonsを持っていることをマウスからvibrodissociated錐体細胞。
- シナプス前boutonsは、AM -エステル化合物5を用いてカルシウム指示薬染料と他の蛍光分子で読み込むことができます。図2は、カルシウムインジケーター色素Fluo4 - AMを使用してロードの例を示します。最初に、1〜2μmAM -エステル色素が10分間37℃での神経細胞に適用されます。染料は無料、細胞非透過性と消されていない染料をもたらす、分子開裂をエステラーゼ細胞内環境、中に侵入することができます。このアプローチは、両方の前とシナプス後細胞の要素を読み込みます。ローディング後、細胞をHEPES緩衝生理食塩水で洗浄し、さらに10分間37℃に保った。ガラスピペット電極とGΩシールを行う前に、細胞は外部の緩衝液で3回洗浄されています。
- 全細胞記録は、その後、染料を含まない細胞内液を用いて確立されます。録音の2〜5分間後に、色素は主にみたFluo - 4 -ロードされたシナプスboutonsの可視化を可能にする、シナプス後ニューロンから削除されます。この手法は、Yeら5によって開拓された。
- 色素負荷boutonsは、どちらのカメラベースや多光子顕微鏡で高倍率、高開口数の対物レンズを用いて可視化することができる。同時ホールセル記録し、カルシウムイメージングを図3に示すように、セットアップを使用して達成することができます。図2Cに示すように、ニューロンとboutonsの画像は、電荷結合素子(EMCCD)カメラを乗じて電子を捕獲した。励起用光源の消費電力は12%の出力に調整ニュートラル濃度1.0フィルタとアイリスフィルタと1.2%に減弱した。緑のシナプス前boutonsからのカルシウムの過渡電流が観察され、リアルタイムで記録、およびオフラインで測定することができます。
6。代表的な結果:
Vibrodissociatedニューロンの自発及び電流注入誘発射撃
典型的なvibrodissociated海馬のCA1錐体ニューロンからの記録は、図4Aに示されています。自発的なオーバーシュートの活動電位は、ラット基底外側扁桃体、海馬とVTA 1,5から解離錐体ニューロンで観察することができます。十分な大きさの分極電流は強い電流注入に対する応答の中程度の電流レベルと非収容活動電位を持つ典型的な遅延発火パターンとオーバーシュートの活動電位を誘発しながら、電流注入を過分極CA1錐体細胞からの中に、現在のクランプ記録は、(典型的な電圧の応答を生成する図4B)。
Vibrodissociatedニューロンにおける自発的とミニチュアGABA作動性抑制性シナプス後電流
塩化セシウムベースの細胞内液との電圧クランプ記録中に、自発的なシナプス電流(図5A)が観察されています。これらのイベントは、低カルシウム含有溶液2,6で除去され、そしてほとんどの神経細胞の種類に完全にGABAなどビククリンやgabazine(図5B、C)のような受容体拮抗薬は、これらのGABA放出と活性化により媒介sIPSCsであることを示すことによって、ブロックされるこのイオンチャネル型受容体サブタイプの。しかし、このような基底外側扁桃体2と腹側被蓋野5,7、GABA受容体遮断などの脳領域からの主ニューロンにおけるAMPA型受容体のグルタミン酸作動性活性化により媒介される期間が短いのEPSCsを明らかにする。興味深いことに、ほとんどの毒素感受性の電位依存性ナトリウムチャネルの遮断に特異的な濃度でTTXのアプリケーションは、いくつかの脳領域(図6A)2,4,7からvibrodissociatedニューロンで観察sIPSCsの周波数と振幅を低減します。このように、ナトリウムチャネル活性は、ピンチオフシナプスboutonsでGABA放出に参加しています。本格的なナトリウムの活動電位は、これらの端子に発生した場合、それはまだ明らかではない。それはしっかりと密封されて1μMの直径の軸索端子の入力抵抗がよくGΩ範囲内である可能性が高いことは注目に値します。このように、ナトリウムチャネルの小さな数からオープンにすることによって、励起分泌カップリングを媒介するカルシウムチャネルを活性化するための端子を脱分極するのに十分かもしれません。これらのカルシウムチャネルをテーマに、証拠は、NとP / Q型チャネルは海馬CA1および他の8からvibrodissociated製剤におけるGABA作動端子でのリリースに参加することを示唆している。
神経伝達物質と受容体の数によって変調し、伝送の可塑性はvibrodissociatedニューロンの3,4,9を使用して検討されている。そのような調節作用を有することが示されて神経伝達物質は、アデノシン、GABA、セロトニン、内在性カンナビノイド、など2,6,10,11,12です。さらに、そのような抑制(DSI)の内因性カンナビノイド依存脱分極による抑制などの短期シナプス可塑性は、またこの準備2,11に記載されている。これらの知見は、内因性の神経修飾物質による受容体を介したおよびtrans -シナプス伝達の多くの形態がvibrodissociated準備で無傷であることを示している。
Vibrodissociated準備中のカルシウムトランジェントと軸索終末の小胞リリース
上記の記述EMCCD装備倒立顕微鏡を使用して、我々はvibrodissociatedニューロン-ブートンの準備にシナプス前終末のカルシウムトランジェントを検討した。図2は、海馬のCA1錐体ニューロンにおけるAM -エステルであるFluo - 4およびその後のシナプス後色素希釈を持つセルの負荷を示しています。自発的カルシウムトランジェントは、図6Bに関心の領域(ROI)として示されているいくつかの色素で満たされたboutonsで観察される。 1μMのテトロドトキシン(TTX)のアプリケーションは、それらがその後のカルシウムの上昇につながる、自発的にboutonsで活性化される電位依存性ナトリウム電流の活性化によって媒介されていることを示す、これらの自発的なトランジェントを除去します。シナプス前終末(図7A)に対応するROIをで測定されるように、高速溶液交換して40mMのに10mMから外KClを大きくすると、蛍光増生成します。シナプス後ニューロンから同時記録はsIPSCsを監視し、イベントの頻度が高K +脱分極(図7B)増加しているかどうかを確認するために使用されます。
我々はsynaptopHlourinがTHY1プロモーターの制御下に構築発現するマウスを使用しているシナプス前boutonsにおける小胞融合を視覚化へ(spH21マウスのラベル)。黄道pHlourin(拡張されたpH感受性を持つGFP変異体)12を膜タンパク質(VAMP2)13に関連する小胞にリンクされている分子構造のSynaptopHluorin。この構成は、比較的酸性の環境では蛍光消光する小胞の内腔にpHlourinモチーフをsituates。小胞融合時に、このモチーフは、小胞/シナプス前終末に対応していることに涙点における蛍光の結果がより高く、より中立的な細胞外環境にさらされている。 spH21マウスから海馬ニューロンのVibrodissociationは、GABA作動性の端末(図8A)のために予想されるサイズと位置の蛍光涙点の可視化が可能になります。これらの端子の蛍光外液の増加を含む、そしてこの効果は細胞外カルシウムが0.2mm(図8B)に還元される外部溶液の存在下でブロックされている-高K +のアプリケーション。従って、蛍光の脱分極誘発性の増加はニューロン-ブートンの準備のGABA作動性シナプスで興奮分泌連関を反映するように表示されます。
ニューロン - 神経繊維末端の準備の軸索末端にシナプス前カルシウムトランジェントと小胞融合を測定する能力は、私たちは興奮分泌連関とエキソサイトーシス/エンドサイトーシスに関与するシナプスメカニズムの虐待とシナプス可塑性の神経修飾物質、薬剤の効果を調べることができます。これらの技術はまた、シナプス前機能とモジュレーション/可塑性における特定のタンパク質の役割を調べるために他の分子ツールと遺伝子改変マウスと組み合わせることができます。
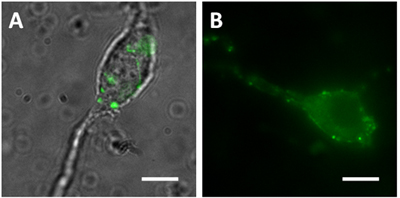
図1海馬CA1領域からVibrodissociatedニューロン()DICの合併のイメージGAD65マウスからND緑色蛍光画像。 DIC画像は明らかにsynaptophluorin(spH21)マウスから(B)蛍光画像の緑の端子の場所を表示するためにマージされます。バー=10μmのスケール

図2カルシウムインジケーターローディングの手順:(A)全細胞がAM -エステル色素がロードされている、(B)ホールセル記録では、色素希釈、(C)端子は、関心領域(矢印)として可視化する。。

図3。vibrodissociatedニューロンのシナプス前終末における同時ホールセル記録し、カルシウムイメージングのための実験セットアップの模式図。 EMCCD =電子は、電荷結合素子を乗じて。

vibrodissociated CA1ニューロンから()自発的な活動電位と(B)膜電位応答がCA1のニューロンからの電流クランプ記録で、現在の注射を過分極と脱分極することを示す4。代表波形図 。
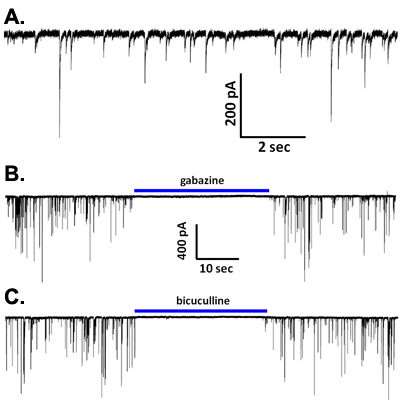
図5()CA1錐体ニューロンからの自発性IPSCの代表波形。またはビククリン(20μM、C)、(BC)性IPSCはgabazine(B 10μM)のどちらかによってブロックされました。
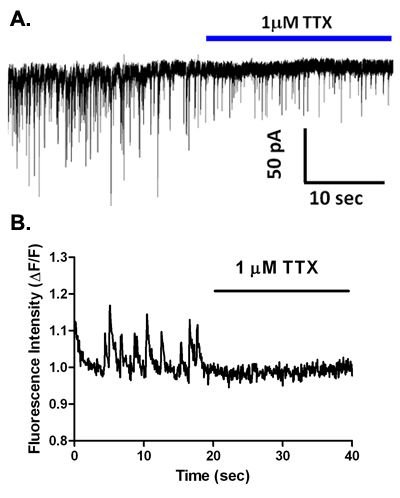
図6。TTXは、自発的なGABA作動性シナプス伝達を阻害し、vibrodissociated海馬準備にシナプス前カルシウムトランジェントを除去します。 TTXのアプリケーションの実行前および実行中に、vibrodissociatedニューロンから(A)録音。周波数とsIPSCsの振幅の減少に注意してください。 (B)TTXのアプリケーションの実行前および実行中に、vibrodissociatedニューロンにみたFluo - 4 -ロードされたシナプス前終末で観測されたカルシウムトランジェントを。トランジェントの完全な損失に注意してください。
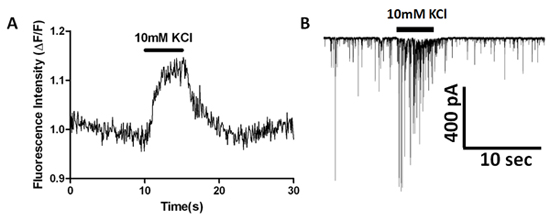
図7。同時カルシウム指示薬のイメージングと高K +刺激の効果を示すsIPSCホールセル記録。 (A)蛍光はみたFluo - 4AMの染料でロードされたシナプス前神経繊維末端から経時的に測定。 (B)、高K +アプリケーション中のsIPSC周波数と振幅の同時増加を。

図8。Ca 2 +依存性の高K +応答海馬CA1領域からspH21錐体ニューロンのシナプス前boutonsインチvibrodissociatedニューロンの(A)蛍光画像。 (B)、高K +アプリケーション(黒のバーで示される)私たちの通常の細胞外Ca 2 +含有溶液(2 mMのCa 2 +の )の存在下で蛍光の持続的な増加をもたらした。は蛍光の増加は、低細胞外Ca 2 +(0.2mMのCa 2 +)の時に観察されなかった。グラフ内のデータは、事前に高K +蛍光レベルに正規化、および3 boutonsから平均的な応答を示していた。
ディスカッション
成功vibrodissociationはスライスが健康な神経細胞が含まれているし、間質の神経細胞が毒性損傷を与えることなくスライスを終了するのに十分な柔軟性であることが必要です。健全なスライスが成人の脳スライスで発見されているよりも少ないグリア/ interstiatial材料で作ることができるとき、したがって、技術は、出生後早期年齢(P1 - 21)で最適に動作します。我々の経験では、しかし、スライス自体のニューロンの生存のためのスライス標本を最適化することvibrodissociation技術のための逆効果かもしれません。我々は日常的にショ糖がvibrodissociationのために準備+、スライスが私たちの通常記録のACSFで(例えばカット)を調製することができる細胞外のNa +とCa 2の多くのために置換されたコールド変更したACSFを使用してその場の記録でのスライスを用意するのに対し。スライス自体の個々のニューロンからの記録のためにスライスを作成するときに我々はまた、Cだけのセクショニング後に35℃で通常のACSFでスライスを配置し、室温に戻す前に、この温度で30〜60分間のためにそれらを残す。しかし、vibrodissociationのために準備のスライスは、単にスライスした後、室温に即座に移動されます。これらの手順は、ニューロンがより容易にスライス自体から緩い動揺することができる会社間質組織の不足のため、おそらくvibrodissociation後の健康なニューロン、高収率を提供しています。我々が日常的に特定の日に私たちの記録とイメージング実験のための十分な神経細胞を得ることとして我々は徹底的に、スライスの調製条件を検討していない。それは、スライス厚やpreincubatonの手続きの変更などの追加修正は、、健康な神経細胞の収率を高めるために行われる可能性があります。非常に軽度のプロテアーゼ処理は、セルの歩留まりを向上させ、高齢動物で動作するように技術を得るための努力で試みられている。しかし、いつもにも軽度のプロテアーゼ処理は、シナプスの機能を混乱させるようだ。このように、間にプロテアーゼおよび機械的解離の組み合わせは、まだそれが日付に前脳ニューロンの信頼性が実証されていない動作するように見つけることができる。
それはvibrodissociation後の健康な神経細胞の比較的低い収率はテクニックが豊富な神経細胞サブタイプ、主に投射ニューロンを研究するために主に有用であることを意味するにも留意すべきである。小さな神経細胞サブポピュレーションを容易に識別可能なGFP発現マウスの可用性は、これらのまれな神経細胞を研究の可能性が高まります。神経細胞の収率が大幅に向上させることができる場合を除きしかし、これらのニューロン上のデータの蓄積が相対的に遅くなる可能性があります。
いくつかのステップは、カルシウム感知染料による神経細胞のロードが成功のために不可欠であることが証明されている。 AM -エステル化された色素への暴露は、37 ° Cで行われ、そして我々はより低い温度で色素負荷しようとするに成功していない。染料の濃度は、それが色素ローディングのそれより高い濃度がシナプス前boutonsでカルシウム濃度を低下させる表示されるので、ロード時間と温度の両方を考慮して最適化する必要があります。我々はより高い濃度でロードすると、周波数とsIPSCsの振幅を減少させることを観察した。小さなシナプス前boutonsの緩衝能力は相馬では異なる可能性があるとboutonsのサイズが一致していないので、カルシウム感知vibrodissociatedニューロンのシナプス前終末に染料をロードする場合、注意が必要です。ニューロンを含む料理は、色素ローディング、以下のHEPES緩衝外部溶液で洗浄し、洗浄後の回復時間が非常に重要ですしている。さらに、細胞全体の記録のための良好なシールを作るために、細胞は、外側の細胞膜からの非内部化色素分子を取り除くために徹底的に洗浄する必要があります。
電気生理学および生細胞イメージングのためのvibrodissociated神経細胞の使用に加えて、免疫細胞化学的手法はこれらの細胞11,12に適用することもできます。細胞は容易に固定し、抗体の多様、および他の細胞のマーカーで染色することができます。これらの細胞の使用は、GABA作動性シナプス前終末でのタンパク質発現の可視化のためのクリーンな準備を提供します。 GABA作動性ニューロンに特異的プロモーターの制御下に蛍光タンパク質を発現するマウスを使用すると、捜査官がvibrodissociated準備(図1)で個々のシナプス端末を識別することができます。このタイプのイメージング蛍光マーカーは、レーザーベースの顕微鏡とSTEDのような新しいテクニック(刺激の排出枯渇顕微鏡)を用いて端末の形態学的測定を可能にすることができる。シナプス小胞サイクリングを報告する色素で可視化は、この準備でも可能です。赤池らは、生きた細胞4の端子を視覚化するスチリル色素、FM1 - 43でGABA作動端子ラベルを貼っている。
またvibrodissociatedでプロファイルRNA発現する単一セルの逆転写酵素PCRを行うことができるはずですニューロン。このテクニックは、日常的に細胞培養で増殖させた酵素的に解離ニューロンとニューロンに適用されます。
開示事項
謝辞
我々は、博士に感謝します。書かれた原稿の書式設定の支援のための初期の技術の集合まで、および博士ヴェロニカアルバレス中に彼らの援助のためのping Jun朱と進小山。この研究は、NIAAAの学内臨床と医学研究の部門によって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| アイテム | 会社 | カタログ# | コメント |
| 振動組織スライサー | ライカマイクロシステムズ株式会社 | VT1200S | |
| 細胞培養用ディッシュ(35 mm)に | BDファルコン | 353001 | |
| ガラスボトムディッシュ | Willco皿 | GWSB - 5040またはGWSB - 3522 | イメージングのための0.16〜0.19ミリメートルのガラスの厚さ |
| 圧電マニピュレータ | EXFO -バーレイ | LSS - 3000 | また、リレーなどを使用することができます |
| SD9スクエアパルス刺激 | グラステクノロジー | SD9K | 圧電マニピュレータをトリガするための |
| 解剖ステレオスコープ | ワイルドHeerbrugg | TYP 374590 | また、任意のステレオスコープを使用することができます |
| /ブラウンマイクロピペットプラーフレイミング | サターのインストゥルメント | P - 97 | |
| 薄い壁ガラス管 | 世界の精密機器 | TW - 150F - 4 | 火炎密封したガラスマイクロピペットとパッチマイクロピペット用 |
| 6チャンネルの潅流バルブコントロールシステム | ワーナーインスツルメンツ | VC - 6またはVC - 6M | |
| 灌流ファーストステップ | ワーナーインスツルメンツ | SF - 77B | |
| 20 - 63x目標と倒立顕微鏡 | ニコン | TS200 Diaphot | |
| EMCCDカメラ | アンドールテクノロジー | IXON EM + DU - 888 | |
| エキサイト蛍光照明光源 | EXFOフォトニクスソリューション(株) | X - Citeの120PC | |
| カルシウム指示薬回答にみたFluo - 4、 | 分子プローブ | F14201 |
参考文献
- Zhu, P. J., Lovinger, D. M. Ethanol potentiates gabaergic synaptic transmission in a postsynaptic neuron/synaptic bouton preparation from basolateral amygdala. J Neurophysiol. 96, 433-441 (2006).
- Zhu, P. J., Lovinger, D. M. Retrograde endocannabinoid signaling in a postsynaptic neuron/synaptic bouton preparation from basolateral amygdala. J Neurosci. 25, 6199-6207 (2005).
- Akaike, N., Moorhouse, A. J. Techniques: Applications of the nerve-bouton preparation in neuropharmacology. Trends Pharmacol Sci. 24, 44-47 (2003).
- Akaike, N., Murakami, N., Katsurabayashi, S., Jin, Y. H., Imazawa, T. Focal stimulation of single gabaergic presynaptic boutons on the rat hippocampal neuron. Neurosci Res. 42, 187-195 (2002).
- Ye, J. H., Wang, F., Krnjevic, K., Wang, W., Xiong, Z. G., Zhang, J. Presynaptic glycine receptors on gabaergic terminals facilitate discharge of dopaminergic neurons in ventral tegmental area. J Neurosci. 24, 8961-8974 (2004).
- Koyama, S., Matsumoto, N., Kubo, C., Akaike, N. Presynaptic 5-ht3 receptor-mediated modulation of synaptic gaba release in the mechanically dissociated rat amygdala neurons. J Physiol. 529, 373-383 (2000).
- Deng, C., Li, K. Y., Zhou, C., Ye, J. H. Ethanol enhances glutamate transmission by retrograde dopamine signaling in a postsynaptic neuron/synaptic bouton preparation from the ventral tegmental area. Neuropsychopharmacology. 34, 1233-1244 (2009).
- Murakami, N., Ishibashi, H., Katsurabayashi, S., Akaike, N. Calcium channel subtypes on single gabaergic presynaptic terminal projecting to rat hippocampal neurons. Brain Res. 951, 121-129 (2002).
- Zhu, P. J., Lovinger, D. M. Persistent synaptic activity produces long-lasting enhancement of endocannabinoid modulation and alters long-term synaptic plasticity. J Neurophysiol. 97, 4386-4389 (2007).
- Inada, H., Maejima, T., Nakahata, Y., Yamaguchi, J., Nabekura, J., Ishibashi, H. Endocannabinoids contribute to metabotropic glutamate receptor-mediated inhibition of gaba release onto hippocampal ca3 pyramidal neurons in an isolated neuron/bouton preparation. Neuroscience. 165, 1377-1389 (2010).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with ph-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Li, Z., Burrone, J., Tyler, W. J., Hartman, K. N., Albeanu, D. F., Murthy, V. N. Synaptic vesicle recycling studied in transgenic mice expressing synaptophluorin. Proc Natl Acad Sci U S A. 102, 6131-6136 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved