このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
全体のマウント
要約
この全体のマウントその場でハイブリダイゼーションプロトコルは、E8.5、E11.5日齢のマウス胚において遺伝子発現研究のための再現性の高品質な結果を確保するための重要なステップを説明します。
要約
in situハイブリダイゼーションホールマウントは、胚における遺伝子発現パターンを定義するための非常に有益なアプローチである。 in situハイブリダイゼーションの手順で 、長く技術的に一括して最終結果の質の向上に寄与する複数の重要なステップで求められています。 このプロトコルを詳細にプローブのラベリングとパフォーマンスを最適化するためのいくつかの重要な品質管理手順を説明します。全体的に、我々のプロトコルは、詳細な説明を提供しています再現性よく高品質な結果を得るために必要な重要なステップの。まず、PCRによって生成されたDNA鋳型のインビトロ転写を介して、ジゴキシゲニン(DIG)標識RNAプローブの生成を説明します。我々は、量、整合性とDIG標識プローブの比活性を決定するために、3つの重要な品質管理検定法を説明します。これらの手順では、全体のマウス胚における内因性mRNAを検出するために十分な感度のプローブを生成するために重要である。加えて、我々はin situハイブリダイゼーションのためのE8.5-E11.5日齢のマウス胚の固定とストレージのための方法について説明します。そこで我々は、非特異的なプローブハイブリダイゼーションを削除するには、ハイブリダイゼーション条件、ハイブリダイゼーション後の洗浄とRNase処理の詳細は、続いて再水和された胚の限られたプロテイナーゼK消化のための詳細な方法について説明します。 AP標識抗体が標識されたプローブを可視化し、内因性の転写産物の発現パターンを明らかにするために使用されます。代表的な結果は、成功した実験と典型的な次善の実験から示されています。
プロトコル
1。 インビトロ転写を介したリボ生成
- in vitroでの転写テンプレートのPCR産物を調製した。
- その5 '末端におけるファージ転写プロモーター配列を有するPCRプライマーの設計。
注:プロモーター配列は、センス鎖のPCRプライマーの5 '末端に追加されたセンスプローブを転写するために使用され、アンチセンスPCRプライマーの5'末端に追加されたプロモーター配列はアンチセンスプローブを合成するために使用されます1-3。我々は唯一のコアプロモーター配列対コアプロモーターに加え、追加の5 '配列を含むテンプレートを含むテンプレートの間に転写効率に差が検出されていない。このメソッドは、T3、T7およびSP6ファージプロモーターと共に使用されています。
彼らは非特異的なハイブリダイゼーションおよびtherebをもたらすことができるので非常に遺伝子ファミリーメンバー又は高度反復配列の間で保存された配列は避けるべきであるyはバックグラウンド染色を増やす。高GC含量とプローブはT残基の失点はジゴキシゲニン分子間の立体障害のためにDIG-UTPの取り込みを制限することになると限られたジゴキシゲニンrUTP定款及びDNA鋳型配列を持つことになります。プローブの長さは300bpから1キロバイトの範囲で指定できます。しかし限り、上記の基準が満たされているように、通常より長いプローブは高い比活性を有する。 - PCR用のテンプレートは、プラスミドクローン、ゲノムクローンまたはゲノムDNAであってもよい。一般的に我々は、PCRのテンプレートとして使用するためにフルレングスのESTクローン(ATCCまたはOpen Biosystems社からなど)を購入。プロモーター配列を含むPCR産物を生成するために、標準的なPCR手順を用いて鋳型DNAを増幅する。我々は一般的に8×50μlのPCRを設定し、複数のプローブの合成反応をサポートするのに十分なプローブ·テンプレートを作成するには。反応は、次のステップのためにプールされています。 一般的に少数の大容量のPCRまたは複数の小さな反応(例えば、我々が使用する50μlの反応など)いくつかのプローブ合成反応のための十分なテンプレートを生成するのに十分な再。
- 夾雑タンパク質を除去するために、プラスミド調製中のRNaseの特に痕跡は、少なくとも30分間55℃で20mg/ml Proteinase Kを1μlの持つPCR反応の各100μLを消化。このプロテイナーゼK消化後に使用した全ての試薬およびその他の項目は、RNaseフリーであると具体的にRNAの仕事のために捧げてください。
- プロテイナーゼK消化中は、PCR産物の整合性を確認するためにゲルでPCR反応のサンプルを実行します。私たちは、品質管理分析の場合はサイズの大きいPCR産物(> 600から700 bp)を解決するために、より小さいPCR産物(未満600から700 bp)とアガロースゲルを解決するために、アクリルアミドミニゲルを使用しています。あなたは、ゲル上の複数のバンドが表示された場合、我々はあなたが正しいサイズの単一のPCR産物を得るようにPCR反応を最適化することをお勧めします。
- 徹底的にフェノール/クロロホルム(1:1)mixtの1等量のProteinase K消化したPCR反応を抽出UREは、クロロホルムの1等量で抽出した。少なくとも30秒間チューブをボルテックスすることにより、各ステップで混ぜる。これらのステップは、化学ドラフト内で行う必要があります。
- 3M酢酸ナトリウム、100%エタノールの2倍量の0.1倍量を添加することにより精製したPCR産物を沈殿させた。少なくとも30分間-20℃のままにしておきます。
- 遠心機で13,000 rpmで5分間スピンし、上清を除去し、70%エタノールで洗浄してください。 DNAペレットが完全に乾燥することができます。
- 1xTE適当量のDNA(例えば、50μlの)を再懸濁します。蛍光光度計を用いてDNA濃度を測定します。
- ファージプロモーター配列またはプローブの内部配列に対応するプライマーを用いたPCRの各テンプレートの準備の塩基配列を決定します。これはプローブテンプレートが正しい順序であることを保証する重要な品質管理工程である。
- DNAは、in vitro転写でのテンプレートとして使用する準備ができているイオン。 4℃でDNAテンプレートを保存する
- その5 '末端におけるファージ転写プロモーター配列を有するPCRプライマーの設計。
- テンプレートとしてPCR産物を用いたin vitro転写インチ
- 50μlの最終体積中のRNA転写反応を設定します。転写反応は、500が含まれています- 10X転写バッファー(100mMのDTTと)5μlのテンプレートDNAの1000 ngは、RNAポリメラーゼの10μlの2.5mMのDIG-NTPのミックス、3μl(50〜90単位)、1μlのα-32 P] CTPを(最大生後6ヶ月)と、ボリュームの残りの部分は、ジエチル処理水を加えることによって構成されています。 2.5mMのDIG-NTPのミックスは、通常、10μlの10mMのCTPを、10μlの10mMのGTP、10μlの10mMのATP、6.5μl10mMのUTP、3.5μl10mMのジゴキシゲニン-11 UTPを含む40μlのワーキングストックとして構成されています。転写反応を組み立てる際には、反応成分(酵素を除く)の全てを室温に温めていることを確認してください。最初のDNAと水を混ぜた後、反応バッファー、ミックスを追加し、他のコンポーネントを追加さもなければ転写バッファー内スペルミジンはDNAを沈殿させる。使用されるRNAポリメラーゼのための推奨温度で2時間インキュベートする。
注:[α-32 PはあなたがRNAプローブに組み込まれている出発ヌクレオチドプールの割合を決定することを可能にする反応に添加される。これは、反応の効率の重要な尺度である。次のすべての手順は、32 Pを処理するための手順に従ってください
合成されたRNAプローブの量を測定するための別の方法は、小容量の分光光度計を使用することです。これは、32 P標識の使用を回避する(ステップ1.3.1の注記を参照) - インキュベーションの最後の数分の間に、製造元の指示に従って、クイックスピンカラム(Roche)を準備します。
- インキュベーション後、10分間37℃でRNaseフリーのDNase Iとインキュベート1μlを追加します。
- 反応希釈バッファー(20mMトリスを50μlと100μlの希釈にpH7.5、1%SDS、20mMのEDTA、100mMのNaClを(RNaseフリー、室温で50ミリリットル在庫や店舗を作る))。合計始まるカウントのシンチレーション計数用及びゲル分析のための1μlを(通常1×TEの4μlに)を取る。
- テーブルトップの臨床遠心分離機で4分間1100×gでカラムベッドとスピンの中心に反応の残りの部分を適用します。スピンした後のRNAプローブは、コレクションチューブになっています。
- 溶出反応に100%エタノールの2ボリュームを追加します。よく混ぜ、5分(または-20°Cまたは30分)のために氷上で保存する。
- RNAプローブペレット〜5分間最大rpmで遠心チューブをスピン。
- 完全にピペットで上清を除去し、ペレットを空気乾燥してみましょう。それを溶解するために非常に困難になりますので、ペレットの過乾燥を聞かせてはいけません。
- 100μlの1xTEまたはDEPC-H 2 O - RNAを50μlのプローブを溶かすdenatにパーセント取り込みを決定するために、分析のために1μlのサンプルを取るアクリルアミドゲルをuring。推定収量に応じて100 ng /μlににプローブ濃度を調整します。
- すべての3つの品質管理に合格したプローブは、6〜12ヶ月間、-20℃に保存することができます。私たちは通常、12ヶ月以内にプローブを使い尽くす。これは、プローブが-20Cで非常に長期間保存することができる可能性が非常に高い。
- 50μlの最終体積中のRNA転写反応を設定します。転写反応は、500が含まれています- 10X転写バッファー(100mMのDTTと)5μlのテンプレートDNAの1000 ngは、RNAポリメラーゼの10μlの2.5mMのDIG-NTPのミックス、3μl(50〜90単位)、1μlのα-32 P] CTPを(最大生後6ヶ月)と、ボリュームの残りの部分は、ジエチル処理水を加えることによって構成されています。 2.5mMのDIG-NTPのミックスは、通常、10μlの10mMのCTPを、10μlの10mMのGTP、10μlの10mMのATP、6.5μl10mMのUTP、3.5μl10mMのジゴキシゲニン-11 UTPを含む40μlのワーキングストックとして構成されています。転写反応を組み立てる際には、反応成分(酵素を除く)の全てを室温に温めていることを確認してください。最初のDNAと水を混ぜた後、反応バッファー、ミックスを追加し、他のコンポーネントを追加さもなければ転写バッファー内スペルミジンはDNAを沈殿させる。使用されるRNAポリメラーゼのための推奨温度で2時間インキュベートする。
- リボプローブの品質評価-測定プローブの収量。
- プローブの収量を推定するために、スピンカラム(プローブ合成プロトコルで採取した試料を用いて測定)前の反応でカウントすることにより、スピンカラム後に回収カウントを割ります。この反応のため、100%の取り込み= 33μgの。成功した反応は、通常15から50パーセントの収率を与える。 15%未満の取り込み(<5μgの収率)を持つプローブを使用すべきではありません。
注意:プローブの収量を測定するための代替方法は、小容量の分光光度計や蛍光光度計を使用することです直接スピンカラムクロマトグラフィー後の本のRNAの量を測定することができる。この代替方法は、32 Pのトレース標識の使用を避けることができます。我々は、BioTekエポックマイクロプレート分光光度計を用いてリボプローブ濃度を測定した。 32 Pの取り込みからリボプローブの質量の推定に分光光度計から得られた値の比較は、次の2つのメソッドは、最終的なプローブ調製から似たような少量(2μL)サンプルを使用して同等の結果を与えることを示した。
ほとんど常に非常に低い、あるいは全く収量はPCRの鋳型として用いプラスミド調製に由来RNaseの混入によるものである。ステップ1.1.3で説明したようにプロテイナーゼKであなたのプラスミドDNA、PCR産物を扱うようにしてください。
- プローブの収量を推定するために、スピンカラム(プローブ合成プロトコルで採取した試料を用いて測定)前の反応でカウントすることにより、スピンカラム後に回収カウントを割ります。この反応のため、100%の取り込み= 33μgの。成功した反応は、通常15から50パーセントの収率を与える。 15%未満の取り込み(<5μgの収率)を持つプローブを使用すべきではありません。
- リボプローブの品質評価-特定の活性を測定する。
- ジゴキシゲニンの程度を測定するために - UTPの取り込みは、スポットテストを実行します。これはCRUである金融品質管理試験。
100 ng /μlにするプローブ濃度を調整します。ハイボンド-N +(GEヘルスケア)または他の同等のナイロンフィルター82ミリメートルの直径上にプローブの連続希釈のスポットを1μl(10 -2〜10 -5)。陰性対照として未標識DNAサンプルが含まれています。架橋125mJoulesでUV架橋剤で直ちに湿らせたフィルターまたは使用しているナイロンフィルターについては、製造元の説明書に従って行った。
次のすべての手順は、(1.4.2 - 1.4.6)室温でロッキングプラットフォーム上でシャーレで実行されます。あなたは、フィルター上のプローブ希釈液をスポッティングした後にRNaseを心配する必要はありません - 1Xテネシー州にある1%ブロッキング試薬(Roche)(10Xテネシーバッファ= 1MトリスpH7.5、1.5M NaCl)の10ミリリットル中に室温で30分間、フィルターをブロック
- 1×10ミリリットル1X TN緩衝液中で15分間洗浄します。
- 30分間1X TN緩衝液で1/5000希釈で抗ジゴキシゲニンFab断片でインキュベートする。
- 2×10ミリリットル1X TN緩衝液中で15分間洗浄します。
- 呈色反応は、BMパープル基板(皿に5ミリリットル程度必要)を用いて行われる。色は30分で10 -4希釈からその場で表示されるはずです。その時点で、5分5X TEで各2回洗浄することにより呈色反応を停止します。信号が10 -4希釈に相当する場所に表示されていない場合、プローブは捨てられるべきです。
注:我々の経験では、不十分な特定の活動にのみ短いプローブで検出された。このプロトコルで指定された他の設計基準に準拠しながら、プローブテンプレート(最大1キロバイトまで)のサイズを大きくすると、プローブの特異的活性を増加させる必要があります。低比活性は、信号の低または検出不可能なレベルにつながる。
- ジゴキシゲニンの程度を測定するために - UTPの取り込みは、スポットテストを実行します。これはCRUである金融品質管理試験。
- 5パーセント変性アクリルアミドゲルによる電気泳動によって、プローブの整合性をテストします。
これはもう一つの重要な品質管理アッセイである。このプロトコルは、プローブが合成反応(ステップ1.2.1を参照)中に32 Pで標識されていることを前提としています。我々は、私たちは容易に分解または不完全なプローブを検出することができ、非常に高い解像度を提供するために、変性アクリルアミドゲルを使用しています。典型的には5%変性アクリルアミドミニゲル(7.5グラム尿素、1.9ミリリットル40%アクリルアミド、1.9ミリリットル2パーセントビスアクリルアミド(または20:1アクリルアミド使用:ビスアクリルアミド溶液)を、1.5ミリリットル10X MOPSゲル緩衝液(0.2Mモルホリ酸、pH7.0、50mM酢酸ナトリウム5mMのEDTA)および15 mlの最終体積にH 2 O)はこのプロトコルに使用される範囲でサイズのプローブを解決するために非常に適しています。
注:別の方法として、TBE-尿素プレキャストゲルは、様々なサプライヤーから購入することができます。プレキャストゲルを実行するため、製造元の指示に従ってください。- ゲルローディングバッファー(Ambion社)と等量のサンプルを混ぜて、よく混ぜる。
- 〜95℃の暑さの任意の二次構造を変性させ、5分間。
- Immediately再アニーリングを防ぐために、ゲルにロードする前に、氷の上で涼しい。
- 青い色素がゲルの最後に実行されるまで、200Vで一緒にカラム·サンプル前と後に実行します。ゲルは1X MOPSゲル緩衝液中で実行されます。
- プラスチックラップでゲルをラップし、放射性標識されたRNAを検出するX線フィルムや蛍光イメージャ画面にそれを公開しています。 32 Pの標識が使用されていない場合は、RNAを検出するために、従来の蛍光色素でゲルを染色することができます
- 成功プローブ合成はゲルの上に非常に近いシャープなバンドとして泳動されたRNAプローブになります。
2。マウス胚の収集と蓄積
- マウス胚を氷冷PBST(PBS + 0.1%Tween 20を、(処理ジエチル(DEPC)))に収集し、解剖中に氷の上で保たれるべきである。
- 胚は4 mlのスクリューキャップ付きガラスバイアル中で処理されます。複数の胚は、1バイアル中に固定することができます。できるだけ多くの15から10としてE9.5または5 E10.5胚は単一バイアルに固定することができる。胚の増加サイズのため、E11.5胚は、ハイブリダイゼーション時のプローブアクセスを支援するために固定する前に、カミソリの刃でhemisectedされるべきである。最大3 hemisected E11.5胚は単一バイアルに配置することができます。
- このプロトコルの手順の有効性を最大限にするために、胚へのダメージを軽減するために、胚の固定とだけ小さな気泡が残っているように、すべての洗浄は、他にいない限り、バイアルの首の下のレベルまで満たさソリューションをサンプルバイアルに実行される指定された。洗浄ステップのすべてのためにバイアルがロッカープラットフォーム上で彼らの側に敷設されています。
- PBSTで4%パラホルムアルデヒド(PFA)で4℃ロッキングテーブルの上で一晩〜6時間を修正しました。バイアルは4℃でロッカープラットフォーム上に水平に置き、揺れなければならない
- 固定後、胚を氷上で5分間PBSTで各2回洗浄され、メタを通して脱水段階ガラスパスツールピペットを用いてバイアルにソリューションを置き換えることにより、NOL / PBSTシリーズ(PBST中25%メタノール、PBST中50%メタノールとPBST中75%メタノール)100%メタノールに。胚は8ヶ月に100%メタノール中で、おそらく長い-20Cで保存することができる。
3。全体マウス胚へのジゴキシゲニン標識プローブのハイブリダイゼーション
- 穿刺心とE10.5と古い胚の頭顕微解剖ナイフで胚が(これは、解剖時に行われていない場合)をメタノールにまだある間。この簡単なステップは、洗浄溶液が脳胞とそれによってバックグラウンド染色を減らす心腔を入力することができます。
- 各メタノール濃度で5〜10分間、メタノール/ PBSTシリーズで連続洗浄(PBST中75%メタノール、PBST中、50%メタノール、次にPBST中25%メタノール)によって胚を再水和する。 100%PBSTで5分間ずつ洗浄2回洗浄する。
- 30%H 2 O 2:4:1 PBST中でインキュベート氷上で1時間インキュベートした。その後1X PBST中で3変化各5分間洗浄する。
- 最後のPBSTで洗浄を取り外し、1ミリリットル10μg/ mlのプロテイナーゼPBST中Kで置き換える。プロテイナーゼK消化場所中にチューブを垂直に25℃の水浴中でラックインチ
注:プロテイナーゼKのソリューションは自己消化のために時間をかけて活性を失う。最大値と一貫性のある活動を確保するため、プロテイナーゼK溶液は、各使用直前に新鮮な作られなければならない。使用するたびに、それを薄める1mg/mlの株式を少量作る。インキュベーション時間は、プロテイナーゼK粉末のロット毎及び各胚時代の決定すべきである。それは、通常25℃で20〜30分間であるE10.5のためたとえば、E9.5胚のために良い時間は、通常25℃で10〜15分℃ですプロテイナーゼKのインキュベーション時間もバイアルの間に、実験の間に有効な比較を可能にするために実験中に正確に測定する必要があります。温度は慎重に高めるために消化中に維持されるべきである再現。 1のような小さな違い℃は実験間の消化量を変更することができます。それは強くプロテイナーゼK消化をインキュベーターまたは正確な温度制御のための水浴中で行うことをお勧めします。このステップでは、プローブは強固な信号を生成する組織に浸透させるために重要です。しかし、過剰消化が胚を損傷すると、彼らは徐々に残りの手順の過程で崩壊する。 - PBST中で作りたて2 mg / mlのグリシンと室温で5分間2回、各洗浄を洗浄することにより、プロテイナーゼK消化を停止します。その後、PBST中で2回(各5分間)洗浄します。
- 4%PFA / PBST、0.2%グルタルアルデヒド(Polysciences社)に室温で20分間消化した胚を固定してください。過剰またはunderfixしないでください。 PBSTで各5分間3回洗浄する。
- この時点で、胚はハイブリダイゼーションのためのグループに分割する必要があります。 PBSTを削除します。 1ミリリットルハイブリダイゼーション緩衝液(50%ULT追加rapureホルムアミド(Invitrogen社製)、5×SSC、pHを5、1%SDS、50μg/ mlのヘパリン(アクロス)、50μg/ mlのトルラRNA(シグマ))65℃(プローブなし)に温めてきた。胚は沈ませ、その後hybrizationバッファのすべてを削除して、プローブなし1ミリリットル新鮮温めておいたハイブリダイゼーション緩衝液と交換してください。
- 振盪水浴やロッキングプラットフォーム(例Boekleシェイク'n'を焼くオーブンについては、表1を参照)のオーブンで65℃で1時間プレハイブリダイゼーション。あなたがインキュベートした場合、水浴中でバイアルは水がなく、バイアルのトップス、の上に立ち上がることを確認してください。ハイブリダイゼーション温度は、65歳以上70℃のハイブリダイゼーション温度まで上げることができ℃のは、我々がテストしたほとんどのプローブとの信号強度や背景には影響しません。胚は、半透明の粘着性がある、とホルムアミドバッファでもろくなり(例えば、ハイブリダイゼーション緩衝液)、それらを処理するときには注意が必要です。
- で0.4ミリリットルハイブリダイゼーションバッファーを含むプローブを用いてハイブリダイゼーションバッファーを交換0.25から1μg/ mlの濃度。最大約E8.5の胚のためのプローブの0.5μg/ mlを使用します。年上の胚では、プローブは、低バックグラウンド(通常は0.25から0.5μg/ mlのかそこら)との良好な信号のための最適な濃度を決定するために1から0.1μg/ mlのから滴定されるべきである。大きいブリダイゼーションボリュームが大きい胚のために必要であるかもしれないことに注意。 65℃で一晩ハイブリダイズ℃、
- 胚はオーバープロテイナーゼKで処理されている場合、彼らは非常に透明に表示されます。彼らはまた、バイアルの側面に固執するか、バラバラになることがあります。このように表示される胚はプロトコルのこの時点で破棄されるべきである。さらにそれらを処理すると、解釈可能なデータにはなりません。
- 暖められた溶液70のI(50%ホルムアミド、5×SSCのpHを5、1%SDS)℃でのハイブリダイゼーションバッファーを交換E8.5胚、E9.5歳以上の方洗浄あたり30分間、3回各30分洗浄2回洗浄する。
- 50パーセント溶液II(0.5:あらかじめ温めておいた50%溶液Iで1回洗浄する70でMのNaCl、10mMトリス塩酸pH7.5、0.1%Tween 20)で°Cで10分間。
- 室温で溶液IIで洗浄あたり5分間、3回洗浄する。
- ソリューションIIは100μg/ mlのは、RNase T1、100単位/ mlのRNaseを含有する緩衝液を交換してください。洗浄あたり30分の2倍、37℃で暖かい部屋でロッカーでインキュベートする。RNaseの洗浄は、非特異的にハイブリダイズしたプローブに起因するバックグラウンドを低減するために不可欠です。
- 、E8.5のための各洗浄℃で二回、30分間65℃溶液III(50%ホルムアミド、2×SSC pH5乃至)でE9.5および古いのための洗浄あたり30分間、3回洗浄する。
- 1X TBSTでは、水の適切な量の10X TBSを希薄にするために1X TBST(10×TBSの100ミリリットルの水に8グラムのNaCl、0.2グラムのKCl、12.5ミリリットル2MトリスHCl pHは7.6が含まれていますと洗浄あたり5分間3回洗浄し、 )0.1%の最終濃度になるようにTween20を追加
- 指定のない限り、すべての洗浄は、より低いレベルまで充填ソリューションをサンプルバイアルに実行されバイアルの首。すべての洗浄工程では、バイアルはロッカープラットフォーム上で彼らの側に敷設されています。
4。ジゴキシゲニン標識プローブの抗体検出
- 胚は、0.5ミリリットル1X TBST + 10%熱処理ヒツジ血清で事前にブロックされます。その後、少なくとも2.5時間室温(〜20℃)で垂直にバイアルを揺する。
- アルカリホスファターゼ結合ヒツジ抗ジゴキシゲニンFab断片(胚アセトン粉末と共にインキュベートすることにより減算、下記参照)の1:5000希釈 - 新鮮1X TBSTでブロッキング溶液+ 1:2000を含む10%の血清を交換してください。バックグラウンドを最小限に抑えるために、最大1:5000、E9.5、古い胚に対してより高い希釈液を使用しています。 4℃で一晩ロッカーに縦にインキュベートする。
注:我々は胚アセトン粉末と抗ジゴキシゲニンFab断片のインキュベーションは、このプロトコルでバックグラウンド染色のレベルを減少させることを見出した。胚アセトン粉末を準備するには、プールされたE12.5-14.5マウスembrを均質PBSの最小体積でヨーヨー。氷冷アセトン、ミックスの4巻を加え、氷上で30分間インキュベートする。 10分間、10,000 xgで回転させて上清を除去します。氷冷アセトンでペレットを洗浄し、再度スピン。ペレットを広げてフィルター紙に粉に挽く、それは空気乾燥することができます。粉体は、その後何年も4℃で気密チューブに保存することができます。
抗体減算については、抗体は、事前遮断時、または前に非特異的結合を低減するために、胚のアセトン粉末に事前に吸収されるべきである。 4℃で少なくとも1時間の血清1xTBST/10%の胚粉に少量の(量は重要ではありません)で1/100で抗体をインキュベート揺らしながら°C。 4℃で10分間遠心機で回転させることによって粉末を除去減算された抗体は少なくとも6ヶ月間、4℃で保存することができます。 - 過剰な抗体を除去するために、室温で1時間ごとに、その後3回、各5分間1XのTBSTで5〜6回洗浄する。もしp呼ばれ、バックグラウンドを低減するために、4℃で一晩延長洗浄を行う。一晩洗浄が劇的にそれによって信号対雑音比を増加させるバックグラウンドレベルを減らすことができます。
- 作りたてアルカリホスファターゼバッファー(100mMのトリス、pH 9.5、50mMのMgCl 2を 、100mMのNaClを、0.1%Tween20で洗浄あたり20分間2回洗浄する。0.5mg/mlレバミゾール、内因性APの阻害剤、E9.5および以前のバージョンを追加胚)。
- 室温に温め、BMパープルAP基質(ロシュ)との最後の洗浄を交換してください。
- 解剖顕微鏡を介して、室温でインキュベートし、定期的に信号を監視する呈色反応を可能にします。拡張色反応(一晩に数時間)のためにバイアルは光から遮蔽されるべきである。豊富なmRNAの信号が15分以内に表示されるはずです。反応は、あなたが信号に満足しているときに停止、またはバックグラウンドが問題になることを開始したときにすべきである。ソリューション自体が暗くなり始めた場合は、Cを拡張することができます基質溶液を取り替えることによってolor反応。
- 1X PBST/5mM EDTAで洗浄あたり5分間2回洗浄することにより反応を停止。
- 数時間から一晩、再修正するために4%パラホルムアルデヒド/ PBSTに転送する。または胚は年を4%paraformaldehyde/1X PBST中に格納することができますまたは直ちにセクショニングのために処理することができます。この最後の固定ステップは染色パターンの長期保存のために重要である。
5。染色された胚の埋め込みとパラフィン切片
- 胚が発色反応後に修正される前に、染色レベルが所望の強度である場合(ステップ4.8)ホールマウント染色された胚の写真を撮影されています。全胚が濃い青色になるまで全体の胚における発現パターンを文書化した後、彼らは、室温で24時間に一晩BM紫基板中でインキュベートされる。このステップでは、染色が目に表示するのに十分に暗くなることを確認することですeの組織切片。胚の青色がすべて胚表面上の顔料の非常に薄い層の堆積によるものであることに注意してください。このバックグラウンド染色はセクショニング後に目的の組織内では検出されないでしょう。
- 過剰基板は沈殿物を除去し、4℃で4%PFAで一晩固定するためにPBSで3回ステンド胚を洗う℃に
- PBSで3回洗浄した後、100%メタノール(として2.4で説明)に胚を脱水する。
- キシレンとの最後のメタノールを交換してください。胚が明らかになるまで、キシレンで2分間ずつ洗浄、2〜3回洗浄する。それはそれは非常に困難な無傷のセクションを回復すること埋め込まれた後、それは組織が非常に脆いことになるのでキシレンで洗浄すぎないこと。視覚的に確認して胚がちょうど明確であることのポイントにされていることを確認し、キシレンインキュベーションがこのポイントを超えて拡張することができないように非常に慎重でなければ各キシレンインキュベーションを監視します。
- 移植胚(E10.5と古い)生検確かテックカセット(Fisherbrand)に、15のためにワックスで全体のカセット(Fisherbrand)〜65℃で30分インキュベートするさらに15〜30分のために新鮮なワックスに変更してから、もう一度変更します。小さい胚/組織トランクは短いワックスインキュベーション時間を必要とします。 E9.5胚は全てワックス変更用の金型を埋め込む組織に配置することができます。これらのケースでは、かわりに胚を移すの金型からワックスを除去することができます。
- 3ワックスの変更、組織の埋め込み型に移植胚(Polysciences社)の後、新鮮なワックスで埋め込む。慎重にセクショニングの所望の平面のための胚を置きます。固化するまでワックスが冷却させてから。
- セクション標準ミクロトーム(例えばライカRM2155)を使用して、8〜14μmのスライスにワックスブロック。顕微鏡スライド上のセクション(Fisherbrand)を採取します。
- スライドがslidewarmerに平らに置くと、乾燥しましょう。スライドは月間4℃で保存することができます。
- 乾燥されたセクションは、2つの5分xylenによって蝋アールeの洗浄およびシリアルメタノール/水洗浄(100%メタノールで2分間、100%メタノールで2分間、90%メタノール/水2分、70%メタノール/水2分、脱イオン水で5分間)により水に再水和された。
- 1分間核ファーストレッド(Sigma社製)染色液でセクションを染色。核ファーストレッド染色液を生成するには、5の水溶液中での核ファーストレッド(0.1%、水に5%硫酸アルミニウムにおける核ファーストレッド、ワットマン濾紙を通して熱とフィルターで溶解)を1:5の濃縮ストックを希釈%硫酸アルミニウム。染色した後、水が透明になるまで流水でスライドを洗浄します。核ファーストレッド対比として働き、節の全体的な組織構造を明らかにする。その色は、RNAプローブの局在をマーク紫青色染色とよく対比しています。核速い赤は飽和汚れており、染色強度は、染色液の濃度によって制御される。もし核ファーストレッド染色の強度あなたがより濃縮された核の速い赤色の溶液を使用してこの手順を繰り返すことができ、この染色液を使用する際には不十分である。
- 90%メタノール/水キシレンで2回洗浄し、100%メタノールで2回洗浄し、続いて、次の一連のソリューションのそれぞれで洗浄することによって、取付カバースリップ用のスライドを準備します。洗浄のそれぞれで2分間スライドをインキュベートする。
- Cytoseal 60取付媒体(リチャード·アラン·サイエンティフィック)でスライドをマウントします。その水性マウントメディアは核ファーストレッド染色を溶解しますのでご注意ください。
注:我々はまた、優れた結果を4で染色された胚のセクションを生成するためにプラスチック包埋樹脂(免疫ベッド、ポリサイエンス社)を使用しています。
6。代表的な結果:
図1は、このプロトコルを使用して得られた代表的な結果を示しています。図1Aは、E10.5マウス胚におけるGATA3の発現パターンを示しています。このパネルには、良いrを示しバックグラウンド比の高い信号と成果●。図1Cは、対照的に、部分的に分解されたRNAプローブを使用GATA3 mRNAのin situハイブリダイゼーションで失敗を示しています。 低比放射能プローブは背景のコントラストに低信号と同様の結果になります。パネルの比較では、AとCが重要であることを示して高品質な結果を確保するためのプローブの品質を慎重に品質管理の評価を行う。 Foxg1プローブ(図1B)で得られた結果は、脳の他の部分で低いバックグラウンドで終脳における特異的染色との良好な結果を示している。脳や心臓、プローブトラッピングによるバックグラウンド染色の一般的なサイトです。ピンセットで脳や心臓を穿刺する(ステップ3.1を参照)胚を最小限に抑え、バックグラウンド染色にソリューションを洗うことができます。図1Dは、脳がパンクしていない場合に見られる典型的な淡いブルーの背景を示しています。これはPax1プローブを用いて得られた準最適な結果を示しています。 Pax1は、脳のどの部分で発現し、この胚の脳に見られる染色のすべては、非特異的な背景によるものではありません。
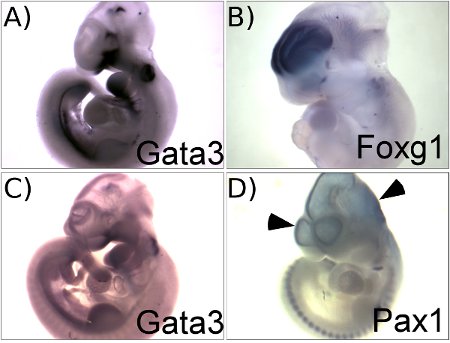
結果(A、B)は成功したのと次善の(C、D)の例を示す図1:代表的な結果は、A. E10.5胚はGATA3プローブとハイブリダイズした。B. E11.5胚がFoxg1プローブとハイブリダイズした。C. E10。 5胚は全胚全体を通して非常に弱い信号ではなく、高いバックグラウンドを示す一部分解されGATA3プローブとハイブリダイズした。D. E10.5胚が心室(矢頭)で、バックグラウンド染色を示し、頭に穴をあけることなくPax1プローブとハイブリダイズした。
ディスカッション
このプロトコルで説明する方法は、さまざまなソースから適応し、ホールマウントE8.5-E11.5日齢のマウスの胚に最適化されています。脊椎動物の胚のin situハイブリダイゼーションホールマウントするための方法は、まず、1990年代初頭2,5-12で登場しました。このプロトコルは、主にアフリカツメガエル胚7,8と同様にマウス2,11のために開発された方法から脚...
開示事項
特別な利害関係は宣言されません。
謝辞
この作品は、NIHの助成R21MH082360(BGC)とR01HD056315(NRM)と同様にジョージア大学によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments | |
| 名前 | タイプ | 会社 | カタログ番号 | 注釈 |
|---|---|---|---|---|
| ジゴキシゲニン-11-ウリジン-5'-三リン酸 | 試薬 | ロッシュ | 11209256910 | |
| リボヌクレオシド三リン酸セット | 試薬 | ロッシュ | 11277057001 | |
| 放射性標識RNA精製用のクイックスピンカラム | 供給 | ロッシュ | 11274015001 | |
| T7 RNAポリメラーゼ | 試薬 | ロッシュ | 10881767001 | |
| SP6 RNAポリメラーゼ | 試薬 | ロッシュ | 10810274001 | |
| T3 RNAポリメラーゼ | 試薬 | ロッシュ | 11031163001 | |
| CTPは、[α-32P] - 800Ci/mmol 10mCi/ml、250μCiの | 試薬 | パーキンエルマー | BLU008X250UC | |
| DNase Iを換え、RNaseフリー | 試薬 | ロッシュ | 4716728001 | |
| 尿素、無色から白色の結晶又は結晶性の粉末 | 試薬 | フィッシャー | BP169-500 | |
| ゲルローディングバッファー | 試薬 | アンビオン | AM8547 | |
| ハイボンド-N +、アマシャム | 供給 | GEヘルスケア | RPN82B | |
| 紫外線Stratalinker 2400 | 機器 | ストラタジーン | ||
| ピロ炭酸ジエチル | 試薬 | シグマ | D5758-100ML | |
| ヘパリンナトリウム | 試薬 | アクロス | 41121-0010 | |
| 水中での過酸化水素30パーセント | 試薬 | フィッシャー·サイエンティフィック | BP2633-500 | |
| グルタルアルデヒド、8%のEMグレード | 試薬 | ポリサイエンス | 0/710 | 製造者の指示に従って、注意して使用すること |
| ブロッキング試薬 | 試薬 | ロッシュ | 11096176001 | -20℃で、5%の株式と店に確認します |
| プロテイナーゼK | 試薬 | ロッシュ | 3115852001 | |
| RNアーゼ | 試薬 | ロッシュ | 10109142001 | 作るとして-20℃で10 mg / mlの株式や店舗 |
| リボヌクレアーゼT1 | 試薬 | ロッシュ | 10109193001 | |
| ULtrapureホルムアミド | 試薬 | インビトロジェン | 15515-026 | |
| 塩酸レバミゾール | 試薬 | ICNバイオメディカル。株式会社 | 155228 | |
| トルラ酵母からリボ核酸、タイプVI | 試薬 | シグマ | R6625 | フェノール/クロロホルムを数回抽出し、沈殿させ、DEPC-dH2Oに再懸濁し、-20℃で保存 |
| 抗ジゴキシゲニン-AP Fab断片 | 試薬 | ロッシュ | 11093274910 | |
| BMパープルAP基質、沈殿させる。すぐに使用できるソリューションを提供します。 | 試薬 | ロッシュ | 11 442 074 001 | |
| 4mLの、クリア、クローズドトップ、ストレージバイアルコンビニエンスキット | 供給 | 国立科学 | B7800-2 | |
| シェイクN焼くハイブリダイゼーションオーブン | 機器 | Boekel科学 | 136400 | |
| 検確かテック | 供給 | Fisherbrand | 15から200-402C | |
| Paraplastプラス組織包埋媒質 | 試薬 | Fisherbrand | 23-021-400 | |
| ピールウェイ使い捨てプラスチック組織埋め込み型 | 供給 | ポリサイエンス | 18646A | |
| Colorfrostプラス顕微鏡スライド | 供給 | Fisherbrand | 12-550-17 | |
| 核ファーストレッド | 試薬 | シグマ | N8002 | |
| Cytoseal 60 | 試薬 | リチャード·アラン·サイエンティフィック | 8310から16 |
参考文献
- Divjak, M., Glare, E. M., Walters, E. H. Improvement of non-radioactive in situ hybridization in human airway tissues: use of PCR-generated templates for synthesis of probes and an antibody sandwich technique for detection of hybridization. J. Histochem. Cytochem. 50, 541-548 (2002).
- Wilkinson, D. G., Nieto, M. A. Detection of messenger RNA by in situ hybridization to tissue sections and whole mounts. Methods Enzymol. 225, 361-373 (1993).
- Logel, J., Dill, D., Leonard, S. Synthesis of cRNA probes from PCR-generated DNA. Biotechniques. 13, 604-610 (1992).
- Maddox, D. M., Condie, B. G. Dynamic expression of a glutamate decarboxylase gene in multiple non-neural tissues during mouse development. BMC Dev Biol. 1, 1-1 (2001).
- Conlon, R. A., Rossant, J. Exogenous retinoic acid rapidly induces anterior ectopic expression of murine Hox-2 genes in vivo. Development. 116, 357-368 (1992).
- Krauss, S. Zebrafish pax[zf-a]: a paired box-containing gene expressed in the neural tube. EMBO J. 10, 3609-3619 (1991).
- Hemmati-Brivanlou, A. Localization of specific mRNAs in Xenopus embryos by whole-mount in situ hybridization. Development. 110, 325-330 (1990).
- Harland, R. M. In situ hybridization: an improved whole-mount method for Xenopus embryos. Methods Cell Biol. 36, 685-695 (1991).
- Herrmann, B. G. Expression pattern of the Brachyury gene in whole-mount TWis/TWis mutant embryos. Development. 113, 913-917 (1991).
- Conlon, R. A., Herrmann, B. G. Detection of messenger RNA by in situ hybridization to postimplantation embryo whole mounts. Methods Enzymol. 225, 373-383 (1993).
- Parr, B. A., Shea, M. J., Vassileva, G., McMahon, A. P. Mouse Wnt genes exhibit discrete domains of expression in the early embryonic CNS and limb buds. Development. 119, 247-261 (1993).
- Rosen, B., Beddington, R. S. Whole-mount in situ hybridization in the mouse embryo: gene expression in three dimensions. Trends Genet. 9, 162-167 (1993).
- Quiring, R. Large-scale expression screening by automated whole-mount in situ hybridization. Mech. Dev. 121, 971-976 (2004).
- Thut, C. J., Rountree, R. B., Hwa, M., Kingsley, D. M. A large-scale in situ screen provides molecular evidence for the induction of eye anterior segment structures by the developing lens. Dev. Biol. 231, 63-76 (2001).
- Neidhardt, L. Large-scale screen for genes controlling mammalian embryogenesis, using high-throughput gene expression analysis in mouse embryos. Mech. Dev. 98, 77-94 (2000).
- Gordon, J., Bennett, A. R., Blackburn, C. C., Manley, N. R. Gcm2 and Foxn1 mark early parathyroid- and thymus-specific domains in the developing third pharyngeal. 103, 141-143 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved