Method Article
HOエンドヌクレアーゼの形成の定量と分析でアニーリングシングルストランドによる染色体転座を刺激サッカロマイセスセレビシエ
要約
HO -刺激転座アッセイは、一本鎖二倍体における複数の遺伝子座におけるDNA二本鎖切断の作成後アニーリング監視サッカロマイセスセレビシエ。この機構は、電離放射線の高用量への暴露後に高等真核生物の体細胞ではゲノムの再編成をモデル化することがあります。
要約
遺伝的変異が頻繁にすべての真核生物のゲノムに存在する分散した反復的な要素間の相互作用によって生じるゲノム再編成によって媒介される。このプロセスは1-3間および生物内の多様性を生成するための重要なメカニズムです。ヒトゲノムには、LINESと正弦4の品種を含むレトロトランスポゾン由来の約40%反復配列、から構成されています。これらの反復的な要素間の交流イベントは、自己免疫と心血管疾患5、だけでなく、人間の6-9の癌をもたらすことができます遺伝子量と式を混乱させることができる転、を含む、ゲノムの再編成につながることができます。
反復的な要素間の交流は、さまざまな方法で行われます。完全な(または完全に近い)と相同性を共有する配列間の交流はプロセス相同組換えと呼ばれる(HR)によって発生します。これとは対照的に、非相同末端結合には、(NHEJ)交換10,11のために少しまたはない配列相同性を使用していません。 HRの主な目的は、有糸分裂細胞では、二本鎖の異常なDNA複製と酸化的損傷によって内生的に生成された切断(DSB)、または電離放射線(IR)、およびその他の外因性のDNA損傷物質への曝露によって修復することです。
アッセイは、ここで説明では、DSBは、同時にガラクトース誘導性HOエンドヌクレアーゼ( 図1)によって二倍体の細胞内の異なる2つの染色体遺伝子座での組換えの基質を境に作成されます。壊れた染色体の修復がアニーリング一本鎖(SSA)で染色体転座を生成する、相同染色体の両端に隣接配列プロセスは、共有結合熱処理に続いて参加しています。基板、HIS3 -Δ3の一つは、切り捨てられたHIS3対立遺伝子'、3'スクリプトが含まれており、ネイティブのHIS3遺伝子座での染色体XVのコピーに位置しています。第二の基板、HIS3 -Δ5'は 、染色体IIIのコピー上でLEU2遺伝子座に位置し、5が含まれている"HIS3対立遺伝子を切り捨てて。両基板は、HOエンドヌクレアーゼによる切開を対象とすることができますHOエンドヌクレアーゼの認識部位が隣接している。 MAT遺伝子座へのネイティブHOエンドヌクレアーゼ認識部位は、染色体IIIの両方のコピーに、すべての菌株で削除されています。これは、組換えの基質とアッセイに干渉するから、他の壊れた染色体の両端間の相互作用を防ぐことができます。 KAN - MX -マークガラクトース誘導性HOエンドヌクレアーゼの発現カセットは、染色体IVのTRP1遺伝子座に挿入されます。基板のシェア311 bpまたはSSAで修理のためのHR機械で使用できるHIS3コード配列の60塩基対。 HRが壊れた染色体を修復するために、これらの基質を使用しているセルはそのままHIS3対立遺伝子とTXVを形成して::メディア欠けヒスチジン( 図2A)上に成長する能力によってのために選択することができますIII染色体転座。 HRによる転座の頻度は、非選択培地( 図2B)に適切な希釈液をめっき後に発生した生存細胞の合計数によって選択培地上で発生ヒスチジン原栄養のコロニーの数で除して計算されます。 DNA修復突然変異体の様々なこのシステムは12-14を使用してSSAにより、転座の形成の遺伝的制御を研究するために使用されている。
プロトコル
1。 HO -刺激転座の頻度
- 目的の遺伝子型の単一のコロニーでYPGly /ラック培地(1%酵母エキス、2%ペプトン、3%のグリセロールと3%乳酸)の10-20独立した1 mlの培養液に接種する。 ° Cローテーター上で、または穏やかに振とうしながら30で、約5 × 7 × 10 8細胞/ mlの細胞密度に達するのに十分な時間、一晩、または文化をインキュベートする。
- HIS3 -Δ3"(染色体III)とHIS3 -Δ5"におけるHOエンドヌクレアーゼ主導のDSBが(染色体XV)転座の基質を誘導するために2%の最終濃度に文化にガラクトースを追加。
- 30℃で4時間インキュベート℃でローテーター上で、または静かに撹拌する。
- 4の後に培地欠けヒスチジンへYPD上にH、文化のプレートに適切な希釈液(1%酵母エキス、2%ペプトン、2%デキストロース)プレート当たり約100〜200個のコロニーを得ること、および細胞の十分な数は、観察を得た彼+組換えコロニーの数。 30℃でプレートをインキュベート℃で2〜3日間。
注:ステップ1.4培地欠けヒスチジンに文化をめっきすること、選択的な条件下で転座の頻度の決定を説明する。このアッセイはまた、メッキのYPD上に培養し、レプリカメッキ2〜3日後に、彼のプレートに生じるコロニーが、非選択的な条件で行うことができる。これらのメソッドは、転座の同じような周波数( 図2C)を生成する。
- 播種生存細胞の合計数(YPD上にメッキの希釈によって決定される)によってヒスチジン原栄養のコロニーの数を割ることによって転座の頻度を決定します。中央転座の頻度を決定し、95%信頼区間15。
2。メッキ効率
- それぞれの一晩培養からの細胞のアリコートを削除し、血球計数(バクスターヘルスケアコーポレーションCatolog#。:B3178 - 1)で細胞数を決定します。
- YPD上に適切な希釈を用いてプレート約100〜200細胞。 30 ° C( 例えば 1 × 10 8細胞/ mlの細胞密度で培養には、一皿あたり10〜5倍希釈のプレート100〜200μlのはず)で2〜3日間インキュベートする。
- 2%の最終濃度に培養液に20%のガラクトースを追加。
- YPDに適切な希釈を用いて4時間後、、各培養物から細胞のアリコートを削除する血球計数で細胞数を決定し、そしてプレート約100〜200細胞。 30℃で2〜3日間インキュベート℃、
- 播種した細胞の数でYPDに表示される、と100でこの商を乗じてコロニーの数を割ることによって、めっき効率を決定する。 95%信頼区間との割合の中央値を決定します。
3。ゲノムサザンブロット解析
- それぞれ独立した試験から、単一の彼の+組換えコロニーを選択して、ゲノムDNA 16を準備する。
- BamHI制限エンドヌクレアーゼでDNAの約4μgのダイジェスト。
- 別BamHIでは0.7%アガロースゲル上でフラグメントを消化し 、正に帯電したナイロン膜(Hybond N +、GEヘルスケア製品コード。:RPN303B)に転送する17。
- HIS3遺伝子を含む1.8キロバイトのBamHI / BamHIでゲノムクローンに:ランダムプライミング(RPN1604。アマシャムバイオサイエンス製品コード)で得られた32 P -標識したプローブとハイブリダイズする。
- オートラジオグラフィーまたはphosphorimagingによってDNA断片を可視化する。
4。で分離された染色体を用いて染色体のブロット分析輪郭クランプ均一な電場(CHEFを):
- アガロースプラグ18の選択された彼の+の組換え体から染色体を準備します。
- 彼+候補TXVの液体培養を拡大::IIIの約1〜2 × 10 8細胞/ mlにYPD 5mlに組換え染色体を含有する。
- スピンダウンし、50mMのEDTAで細胞を2回洗浄する。
- ℃の50mMのEDTAの約200μlに懸濁し、そして50〜暖かい
- 低融点アガロースを50℃まで、徹底的にミックスを持って来た2溶融%の等量(W / V)を追加します。
- プラグの型に約80μlを分注し、それらは4で30分間冷却することができます℃まで
- 押し出しは、12ウェルディッシュに金型からプラグ。最大5つのプラグには、各ウェルに配置することができます。
- 各ウェルに、新たに調製したspheroplastingソリューションを3 ml(14 mMの2 - β-メルカプトエタノール、20mMのEDTA、0.5 mg / mlのザイモリアーゼ20T、10mMトリス- HCl、pHを7.5、1 Mソルビトール)を追加します。 ℃で4時間穏やかに撹拌しながら37℃でインキュベートする。
- spheroplasting溶液を除去し、LDS溶液(10mMトリス- HCl、pH8.0の、100mMのEDTA、1%(w / v)のドデシル硫酸リチウム、adjus 3mlで置き換える8.0へのtのpHは)。 37℃で穏やかに振とうさせながら15分間インキュベートする。
- LDSの溶液を除去し、LDSの別の3 mlのアリコートと交換してください。穏やかに撹拌しながら37℃で一晩インキュベートする。
- LDSを取り外し、0.2 X NDS(0.6グラムトリスベース、93グラム二ナトリウムEDTA二水和物、5gのN -ラウロイルサルコシン、pHを8.0に調整し、のdH 2 Oで500 mlにもたらした)3mlで置き換えます。おだやかに振とうしながら30分間室温でインキュベートする。 NDSを削除し、2回を繰り返します。
- NDSを削除し、3ミリリットルのTEと交換してください。室温で30分間穏やかに撹拌しながら洗浄する。 4回繰り返します。
- 店は4でプラグ° C TE 2溶液に加えた。プラグは1年間は保つことができる。
- 14でBio - RadのCHEF - DRIIの装置を使用して1%アガロースゲル上で別々の染色体° C(カタログ番号:170〜3612)。
パラメータ:第1ブロック :70のスイッチの時、6V/cmで15時間。
第2ブロック:120秒のスイッチ時間、6V/cmで11H
- UV Stratalinker(Stratagene社製)で紫外線の60ミリジュールで照射し、30分間1μg/mlのエチジウムブロマイド染色により染色体を可視化する、とのdH 2 O中で30分間脱染色メンブレンへの効率的な転送を可能にするためにエチジウムブロマイド染色した染色体のニックのDNAを照射する。
- 変性条件下での毛管現象(0.4NのNaOH、1.5M NaCl)中で:正に帯電した膜(RPN303B。ハイボンドN +、GEヘルスケア製品コード)に染色体を転送する。
- HIS3遺伝子17を含む1.8キロバイトのBamHI / BamHIでゲノムのクローンで:ランダムプライミング(RPN1604。アマシャムバイオサイエンス製品コード)で得られた32 P -標識したプローブとハイブリダイズする。
- オートラジオグラフィーまたはphosphorimagingによって染色体を可視化する。
5。代表的な結果:
転座アッセイのグラフィカルな表現は、染色体レベル( 図1)で描かれている。実験手順の概略は、( 図2A)が表示されます。両方の事前と事後誘導メッキ効率は血球計数( 図4B)によって決定される培養中の細胞体の合計数で実行可能な、コロニー形成細胞の総数で割ることにより決定されています。事前事後誘導メッキ効率は野生型細胞(p値= 0.1400)( 表1)に対しては有意差はなかった。
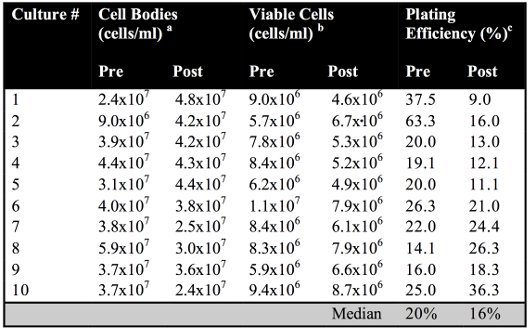
表1。プレと野生型細胞で誘導後メッキ効率。
ミリリットル当たりの細胞体の数は、血球計算盤の数によって決定されます。
Bミリリットル当たり生存細胞の数は〜100から200コロニーを生成するために、非選択培地上に適切な希釈物をメッキすることによって決定されています。
C前後の誘導メッキ効率は血球計算盤の数によって決定された培養における細胞体、の合計数で実行可能な、コロニーが形成、細胞の総数で割ることにより決定されています。
これは、転座染色体の有無は、DSBの形成を生き残る能力に影響しないことを示唆している。染色体転座の頻度は、YPD上にメッキ( 図2B)によって決定される生細胞数の合計でヒスチジン原栄養のコロニーの数で除して算出することができます。 ( - / -すなわちrad51Δ)このアッセイは、タンパク質機能の損失がSSAにどのように影響するかを識別するために、異なる遺伝子型の菌株を用いて行うことができる。異なる株で決定した組換えの頻度は、( 図2C)SSAによるHOエンドヌクレアーゼ誘発DSBのを修復するためにこれらの株の能力の差を比較するためにグラフ化することができます。転周波数が選択的に得ながら、選択の下で野生型二倍体株(2.2x10 -2)と条件(2.17x10 -2)、非選択的に得られる転座の頻度は、(p値= 0.9131)は互いに統計的に差はなかったrad51Δ付き(6.0x10 -2)と非選択的(11.9x10 -2) - / -ホモ接合体は似ていますが(p値= 0.0089)、統計的に異なっていた。 RAD51との両方を選択的に(p値= 0.0001)と非選択的に(p値= 0.0002)が得られる周波数° - / -ホモ接合体は野生型株と対応する条件を用いて得られたものから統計的に異なっていた。
推定される転座ベアリングクローンをさらにゲノムサザンブロット及び染色体ブロット解析( 図3)によって調べることができます。サザン分析のために、ゲノムDNAは32にブロッティングし、ハイブリダイゼーション、前にアガロースゲル電気泳動へのBamHIエンドヌクレアーゼで消化され診断0.8キロバイトhis3Δ200を可視化するためにP -標識1.8キロバイトHIS3プローブ、1.7キロバイトHIS3 -Δ3"、4キロバイトtIII::XV、5 KB TXV::III、および8キロバイトHIS3 -Δ5'フラグメント( 図3B.1) 。無傷の染色体を調製し、CHEF( 図3B.2)で区切られ、ナイロンにブロットし、染色体XV、0.8 MB TXV無傷1.1 MB可視化するために32 P -標識1.8キロバイトHIS3プローブとハイブリダイズすることができます:IIIの転座染色体、0.6 MBをtIII:XVの転座染色体、および0.3 MB無傷の染色体III( 図3B.3)。グラフィカルなマップを、BamHIエンドヌクレアーゼ消化ゲノムDNA断片を期待し、親と組換え染色体、( 図3A)描かれて描いた。

図1。アニーリング一本鎖(SSA)によって転座染色体の形成。1)DSBはは、文化へのガラクトースの添加後HOエンドヌクレアーゼによりHIS3 -Δ3"とHIS3 -Δ5"基質(染色体XVとIII、それぞれ)で作成されます。 2)DSBはが壊れた染色体の末端に3'一本鎖を生成するために処理されます。 3)SSA機械のアニール、相補311または組換えの基板のそれぞれに形成された60ヌクレオチドの一本鎖HIS3シーケンス。非相同焼鈍時に形成された尾は、エンドヌクレアーゼ消化によって除去されています。 HOエンドヌクレアーゼ消化により形成された残りの染色体断片上の相補的four bpのオーバーハングもアニールすることがあります。 SSAによるIIIの転座染色体::4)ライゲーションはそのままHIS3遺伝子とTXVの作成 を終了します。この染色体を持つ細胞は、培地欠けているヒスチジンに増殖する能力によって選択することができます。 :NHEJのようなメカニズムにより、XVの転座染色体:ライゲーションには、相互tIIIを生成することがあります。
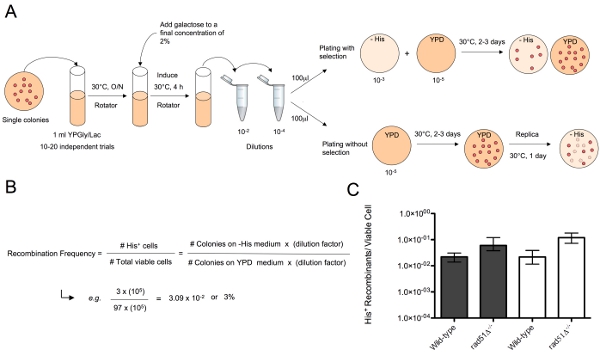
図2。 SSAで転座の頻度を決定するためのアッセイ。)1mlをYPGly /ラック文化がセレクト遺伝子型の細胞の単一コロニーを接種し、約5 × 10 7 × 10 8細胞/ mlの適切な密度に栽培されている。ガラクトースは、染色体IIIとXVでの再結合の基質でDSBのを作成するには、2%の最終濃度に追加されます。選択的な条件の下でアッセイを行うために、適切な希釈液を約100〜200細胞をYPDに蒔きされるように作られ、細胞が十分な数の彼の+組換えコロニーの観察数を得るために培地欠けヒスチジン上にプレーティングされています。選択なしでアッセイを行うために、約100〜200細胞が、YPD上に播種培地欠けているヒスチジンに蒔き、単一のコロニーと、レプリカに2〜3日間栽培されている。 B)転座の頻度は、YPD上で成長率によって上、彼のプレートに成長したコロニーの数で割ることにより決定することができます。 C)異なる遺伝子型( すなわち、野生型とrad51Δの株の転座の頻度は、 - / - )SSAによるDSBのを修復するためにこれらの株の能力の差を比較するためにグラフ化することができます。
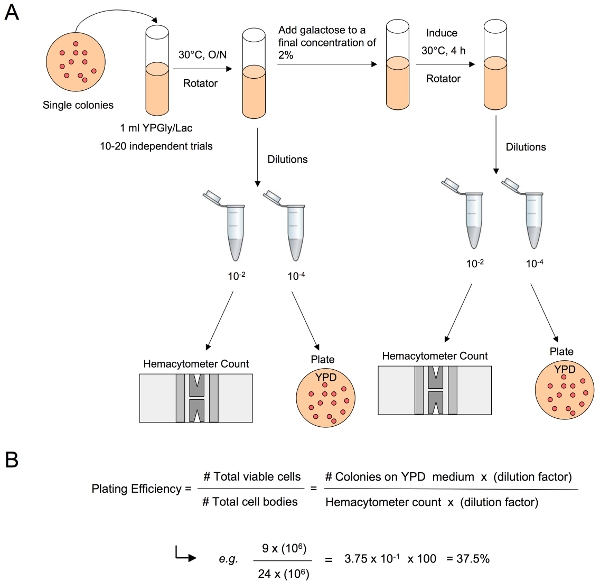
図3。メッキの効率を決定する。(A)細胞のアリコートを一晩前に文化やポストDSBの誘導から取られ、適切な希釈液は、培養のmlあたり細胞体の合計数を決定するために血球計カウントに続いて、作られています。適切な希釈液をYPDに表示されるコロニーを計数することにより、mLあたりの生細胞の総数を決定するために、非選択培地上にプレーティングされています。 (B)メッキの効率は、細胞体の合計数によって生存細胞の合計数を割って、100でこの商を乗じて決定されます。
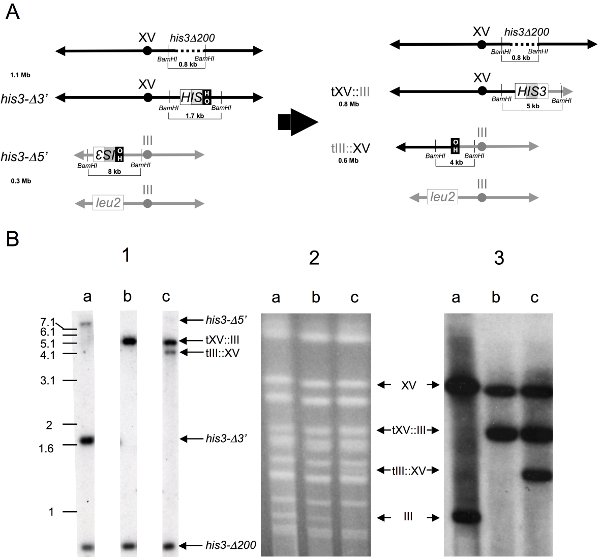
図4。ゲノムサザンブロットおよび染色体のブロット分析により、染色体転座のイベントの検出。
A)の前(左)と転座の形成(右)の後に関連する染色体のグラフィカルな表現が。
親と組換え体のサイズがメガベース-ペア(MB)に記載されています。親と組換え株からゲノムDNAのBamHI消化によって生成された、関連する配列を含む制限酵素断片のサイズ、および1.8 kbのBamHI HIS3ゲノムクローンとのハイブリダイゼーションによりブロットで明らかになったが、キロベースペア(KB)に記載されています。染色体は、正寸ではありません。
B)の推定転座-ベアリングクローンの物理的な分析を。
(1)ゲノムサザンブロット解析を - ゲノムDNAは、BLO、ゲル電気泳動にて分画し、BamHI制限エンドヌクレアーゼで収集し、消化し、ナイロンにtted、および以下の断片を可視化するために32 P -標識1.8キロバイトHIS3プローブにハイブリダイズ:0.8キロバイトhis3Δ200、1.7キロバイトHIS3 -Δ3を"、4キロバイトtIII::XV、5 KB TXV::III、および8キロバイトHIS3 -Δ5"。レーン:)親の二倍体、b)の組換えHis +非相互転座、C)彼の+相互転座の組換え。
(2)CHEFゲル - 無傷の染色体は、エチジウムブロマイドで染色し、紫外線下で可視化、CHEFで区切られた、アガロースプラグに調製した。レーン:上記のように。
(3)染色体のブロット-分離された染色体はナイロンにブロットし、以下の染色体可視化するために32 P -標識1.8キロバイトHIS3プローブとハイブリダイズさせた:1.1 MB無傷の染色体XV、0.8 MB TXV:IIIの転座染色体、0.6 MB tIII:XVの転座を染色体、および0.3 MB無傷の染色体III。レーン:上記のように。
ディスカッション
電離放射線の高用量は、DSBの19の多数の世代を通してゲノム不安定性の固有のリスクを提示する。真核生物ゲノムの転座および他のゲノム再編成20,21を生成するための優れた基質である反復配列であふれています。 DSBのが反復配列12,21,22の間に導入されている場合、HRによる染色体転座が頻繁に観察される。圧倒的な証拠は、このメカニズムは、真核生物22,23で発生したどのような理解の重要性を強調、白血病およびリンパ腫染色体転座に起因することができます関連付けられているゲノム不安定性の多くを示唆している。我々は、酵母とヒトのゲノム全体に分散反復要素の大きさが似ている別の染色体上に相同の短い領域の間にDSB誘発HRによる転座染色体の形成を調べるために出芽酵母でシステムを開発した。
アッセイでは、HIS3 -Δ3"転座の基板は、染色体XVのコピーに位置しています。他のHIS3対立遺伝子(HIS3 -Δ200は )修理24のテンプレートとして使用されてからこのシーケンスを防止HIS3プロモーターとコード配列の〜1キロバイト欠失を有する。 HIS3 -Δ5"基板を変更せずにLEU2対立遺伝子( 図1)を含む染色体IIIの他のコピーで、染色体IIIのコピー上でLEU2遺伝子座に位置しています。 KAN - MXでマークされたガラクトース誘導性HOエンドヌクレアーゼ発現カセットは、染色体IV(::GAL - HO - KAN - MX TRP1)のTRP1遺伝子座に挿入した。各転座基板を培地にガラクトースの添加によりHO遺伝子の発現を誘導することによって開裂を対象とすることができますHOエンドヌクレアーゼの認識配列が隣接しています。 HIS3 -Δ3"とHIS3 -Δ5"基板におけるHOエンドヌクレアーゼ誘起開裂した後、細胞が効率的に転座染色体を生成し、HRによって壊れた染色体を修復するHIS3配列相同性の共有短路(311塩基対または60塩基対)を使用することができます無傷のHIS3対立遺伝子12-14,25と。
親細胞がHIS3遺伝子の正常なコピーを欠いているため、彼らはメディアのHisに成長することはできません。転座のイベントを受けている唯一の細胞は、培地欠けヒスチジン上で選択することができます。したがって、染色体転座の頻度は、YPD上にメッキにより決定されるメッキ生細胞の総数によってヒスチジン原栄養のコロニーの数を割ることによって計算することができます。ゲノムDNAと無傷の染色体は、代表的な彼の+のコロニー、およびゲノミックサザンと染色体のブロット分析によって検証転座染色体の存在から単離することができる。
慎重な分析は、私たちはアッセイ約12追加の重要な情報を収集することができました。ゲノムサザンブロット解析では、HOエンドヌクレアーゼの誘導の30分後の染色体XVとIIIの事実上完全に切断があるという証拠を提供しているため、カットされていない染色体基板の有意な背景は、(G.マンタイ&A. Bailis、人口ではありません未発表結果)。彼のゲノムサザン及び染色体ブロット分析-生存者は、細胞が頻繁に1つ、他の、または両方のカットの染色体を失うと(L.リデル&A. Bailis、未発表結果)実行可能なままことを示しています。重要なのは、非選択培地上でほぼ同等のメッキ効率がHOエンドヌクレアーゼの発現の誘導の前と後の転座染色体を保持するために壊れた染色体を修復に失敗したこと、また障害がどちらもDSBの形成を生き残る能力に影響を与えることを示しています。これと一致し、TXV:IIIの転座染色体は選択の不存在下で有糸分裂細胞において不安定であることが示されている。これは、TXVを成長させることにより実証された::IIIは、非選択的に一晩彼の+の組換え体を含む非選択プレート上の単一コロニーをめっき、ヒスチジンを欠く選択培地上にレプリカのメッキ。 :IIIの転座染色体(N. Pannunzio&A. Bailis、未発表結果):これらのプレート上に生じたコロニーの十〜70%はTXVを失っていた。
ヒトでのIR露光時に発生する転座染色体は同じような不安定性26を示す。これは、その転座の形成は、ヘテロ接合性の消失を促進することによって腫瘍形成の初期段階でのイベントに貢献することを示唆している。第二に、広範な遺伝学的および分子生物学的解析は、SSA、HRの非保守的な義務的に効率的なメカニズムは、2本の染色体12,27,28にDSBが同時作成を以下のHRで転座の形成の主要なメカニズムであることを示唆している。これは共同です。知見とnsistentそのHRによる酵母のゲノムに複数の繰り返し配列に隣接して休憩を作成するための十分なDSBの密度、および転座の形成の高周波におけるIRの結果の大量投与。一緒に、これらの観測からは発癌性ヒトでのIR曝露の影響かもしれない、部分的に、彼らの固有の不安定性を介して、その打ち上げの腫瘍形成遺伝子の変化を促進し、転座を生成することを人事の効率的なメカニズムによってDSBが修復の結果。放射線は、多くの場合、放射線誘発DSBが修復の結果は、患者に頻繁に発生する二次がんの発生に寄与することががん、ゲノムの再編成を治療するために使用されているため。したがって、このモデルは、私たちはIR治療に重要な臨床反応の遺伝と分子基盤の理解を深めるのに役立ちます。
開示事項
利害の衝突は宣言されません。
謝辞
この作品は、健康とシティオブホープのベックマン研究所の国立研究所からの資金によって支えられている。私たちは、原稿を明確に追加された彼らの建設的なコメントのためのレビューに感謝します。
資料

参考文献
- Sen, S. K. Human genomic deletions mediated by recombination between Alu elements. The American Journal of Human Genetics. 79, 41-53 (2006).
- Han, K. Alu recombination-mediated structural deletions in the chimpanzee genome. Plos Genetics. 3, 1939-1949 (2007).
- Zhang, F. Copy number variation in human health, disease, and evolution. Annual Review of Genomics and Human Genetics. 10, 451-481 (2009).
- Goodier, J. L., Kazazian, H. H. Retrotransposons revisited: The restraint and rehabilitation of parasites. Cell. 135, 23-35 (2008).
- Lanktree, M., Hegele, R. Copy number variation in metabolic phenotypes. Cytogenet Genome Res. 123, 169-175 (2008).
- Mullighan, C. Genome-wide analysis of genetic alterations in acute lymphoblastic leukaemia. Nature. 446, 758-764 (2007).
- Mattarucchi, E. Microhomologies and interspersed repeat elements at genomic breakpoints in chronic myeloid leukemia. Genes Chromosomes Cancer. 47, 625-632 (2008).
- Stenger, J. Biased distribution of inverted and direct Alus in the human genome: implications for insertion, exclusion, and genome stability. Genome Res. 11, 12-27 (2001).
- Hedges, D., Deininger, P. Inviting instability: Transposable elements, double-strand breaks, and the maintenance of genome integrity. Mutat Res. 616, 46-59 (2007).
- Symington, L. Role of RAD52 epistasis group genes in homologous recombination and double-strand break repair. Microbiol Mol Biol Rev. 66, 630-670 (2002).
- Lewis, L., Resnick, M. Tying up loose ends: nonhomologous end-joining in Saccharomyces cerevisiae. Mutat Res. 451, 71-89 (2000).
- Pannunzio, N. R., Manthey, G. M., Bailis, A. M. RAD59 is required for efficient repair of simultaneous double-strand breaks resulting in translocations in Saccharomyces cerevisiae. DNA Repair (Amst). 7, 788-800 (2008).
- Nicholas, R., Pannunzio, G. M. M., Bailis, A. M. RAD59 and RAD1 cooperate in translocation formation by single-strand annealing in Saccharomyces cerevisiae. Curr Genet. 56, 87-100 (2010).
- Manthey, G. M., Bailis, A. M. Rad51 Inhibits Translocation Formation by Non-Conservative Homologous Recombination in Saccharyomyces cerevisiae. Plos One. 5, (2010).
- Hoffman, C. S., Winston, F. A ten-minute DNA preparation from yeast efficiently releases autonomous plasmids for transformation of Escherichia coli. Gene. 57, 267-272 (1987).
- Sambrook, J., MacCallum, P., Russell, D. . Molecular Cloning: A Laboratory Manual. , (2001).
- Iadonato, S. P., Gnirke, A. RARE-cleavage analysis of YACs. Methods Mol. Biol. , 75-85 (1999).
- Argueso, J. L. Double-strand breaks associated with repetitive DNA can reshape the genome. Proc. Natl. Acad. Sci. U. S. A. , 11845-11850 (2008).
- Batzer, D. A. Alu repeats and human disease. Molecular Genetic Metabolism. 67, 183-193 (1999).
- Fasullo, M., Dave, P., Rothstein, R. DNA-damaging agents stimulate the formation of directed reciprocal translocations in Saccharomyces cerevisiae. Mutat. Res. 314, 121-133 (1994).
- Richardson, C., Jasin, M. Frequent chromosomal translocations induced by DNA double-strand breaks. Nature. 405, 697-700 (2000).
- Look, A. T. Genes altered by chromosomal translocations in leukemias and lymphomas. The Genetic Basis of Human Cancer. , (2002).
- Fasullo, M. T., Davis, R. W. Direction of chromosome rearrangements in Saccharomyces cerevisiae by use of his3 recombinational substrates. Mol. Cell. Biol. 8, 4370-4380 (1988).
- Manthey, G. M., Naik, N., Bailis, A. M. Msh2 Blocks an Alternative Mechanism for Non-Homologous Tail Removal during Single-Strand Annealing in Saccharomyces cerevisiae. PLoS One. 4, e7488-e7488 (2009).
- Muller, I. Time-course of radiation-induced chromosomal aberrations in tumor patients after radiotherapy. Int. J. Radiation Oncology Biol. Phys. 63, 1214-1220 (2005).
- Lin, F. L., Sperle, K., Sternberg, N. Model for homologous recombination during transfer of DNA into mouse L cells: role of DNA ends in the recombination process. Mol. Cell. Biol. 4, 1020-1034 (1984).
- Ivanov, E. L. Genetic Requirements for the single-strand annealing pathway of double-strand break repair in Saccharyomyces cerevisiae. Genetics. 142, 693-704 (1996).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved