Method Article
FSLは構築:生物学的マーカーの範囲でセル/ビリオン表面を変更するための簡単な方法を彼らの生存率に影響を与えず
要約
機能 - スペーサー - 脂質(FSL)の構造は、生きた細胞とウイルス粒子の表面特性が活力を失うことなく変更することはできません。メソッドは、セル/ビリオンと自然と安定した表面の取り込みとFSL構造のソリューションの唯一の単純な接触が発生する必要があります。
要約
変更/生体表面を可視化し、in vitroでの範囲および in vivo の環境で修飾された細胞/ビリオンを研究する能力は、特定の分子またはエンティティ全体の機能さらなる洞察を得ることが不可欠です。生物学的表面改質の研究は、一般的に生物の遺伝子工学や細胞表面の1,2の化学的部分の共有結合に制限されています。しかし、これらの伝統的な技法は、化学反応に細胞をさらす、またはそれらは重要な操作は、それらが煩雑、望ましい結果を達成するために必要、と彼らはまた、誤って修飾された細胞の生存能力/機能に影響を与える可能性があります。無害に細胞の表面を修正する簡単な方法が必要です。
最近、新しい技術、KODE Technologyは3つのコンポーネントからなる新規の構成要素の範囲を導入した:機能的な頭部基(F)、スペーサー(S)と脂質の尾部を(L)と機能 - スペーサー - 脂質またはFSLとして知られていますconstructs3。スペーサー(S)を水に分散可能な構造を提供するように選択され、まだ自発的に、安定して膜に組み込む予定。
FSLは、(F)これまでの血液型関連の決定、シアル酸、ヒアルロン酸多糖、蛍光色素、ビオチン、放射性標識、およびペプチド3-12の範囲を含む糖類の範囲を含む官能基を構築する。 FSLのコンストラクトは、上皮/子宮内膜細胞、赤血球、およびビリオンは、細胞接着/相互作用/分離/固定化を変更するには、品質管理システムと診断パネルを作成するには、ゼブラフィッシュ、精子、胚を変更することで使用され、in vitroおよびin のためにされている細胞/ビリオン3-12のin vivoイメージング。
細胞/ビリオンを変更するプロセスは一般的で非常に簡単です。最も一般的な手順は、37℃で1-2時間FSLの構造のためのソリューション℃で40から10を持つ細胞(脂質フリーメディア)のインキュベーションです。インキュベーションの間にFSLは、自発的に細胞膜に組み込む構築し、プロセスは完了です。洗浄はオプションです。ビリオンはkodevirions 10である間、FSLの構造によって改変された細胞は、kodecytes 6月9日として知られている。
直接注入とkodecytes / kodevirionsが実験動物モデル7,8,10で使用されているとしてFSLが構築されます。すべてkodecytes / kodevirionsはFの部分7,8,10,11の新しい機能を得ながら、通常の活力や機能を保持するように見える。
生体適合性メディア、細胞膜への自発的な組み込み、および見かけの低毒性の分散性の組み合わせは、FSLは、細胞とウイルス粒子の研究のために貴重な研究ツールを構築することができます。
プロトコル
次のプロトコルは、生体膜へのFSLコンストラクトの挿入(図1)のために一般的な手順を説明します。簡単にするためにプロトコルは、唯一の100%の濃度にある細胞(kodecytes)、を参照します。しかし、長期的細胞はビリオン(kodevirions)または生物または細胞構造と互換であり、希釈剤でそれらの濃度は重要ではない、それは常にテスト、コントロール、および実験間で一貫して提供。赤血球を充填したセルの容積は、通常80%ですが、ビリオン、胚および他の細胞と、それは典型的には1%未満です。方法は非常に堅牢であり、そのバリエーションのいずれかで使用されるときに変更の膜を生成しますが、細分化は、特定のアプリケーションに必要な変更の度合いを最適化し、標準化する必要があります。
1。 FSLコンストラクトの調製
- ドライFSLの製品(表1)製品のバイアルに希釈剤の1.0mL(または製品添付文書に指定されているような)の添加によりFSL構造の原液第一再構成を準備する。簡単に言うと(30秒)超音波処理。これは、100μLの滅菌容器に分注し、2〜8℃で1週間までのCで保存されている、または3ヶ月間まで凍結することができます1mg/mLソリューションを、ご用意しております。
- FSLは、任意のミセルを均質化する(30秒)ストック溶液を簡単に超音波処理、使用直前に挿入するためのソリューションを、構築作業の準備に。必要に応じて範囲や必要な濃度に緩衝液でFSL構造を(できれば脂質または疎水性の高い物質を含まない)で希釈します。
注意事項:
- FSLの構造は、通常、脂質含有培地で細胞に挿入されますが、通常は同じくらいPBSまたは他の脂質の無料メディアの場合より50倍FSL使用濃度として必要になります。
- 動作範囲の希釈は、アプリケーション、検出方法の感度、FSL構造の種類、および必要な修正の度合いに依存します。通常は希釈の範囲は、炭水化物FSLの構造のために希釈剤のmL当たりFSLの10から500μgの間になると他のFSLのための100から100μg/ mLのは、このような蛍光色素やビオチンのように構築されます。
- 複数FSL構築物を含む挿入の希釈剤を準備する場合、単にそれらの通常の使用濃度で同じ希釈剤で一緒に構文を追加します。 1つの構成が他のよりもはるかに高い濃度である場合、濃度の一部の調整(増加)が低い構造のために必要となる場合があります。あるいは構造は、好ましくは最も高い濃度で、順次追加される可能性がありますあまり続いて、最初に構築する。
- FSL千μg/ mLの上記の濃度を構築するには、細胞膜への脂質の有意な量を導入してもよいし、細胞の形状を変更したり、溶解にそれが影響を受けやすくなる場合があります。
- FSLは、2〜8℃で保存されていると、数日以内に使用すべき作業ソリューションを構築する。
- FSLの構造は、水で希釈することもできるが、安定性が減少しているし、時間以内に使用しなければなりません。添付文書は再構成の希釈剤として水を指定する場合はバイアルの製品はまた、塩を(添付文書に指定されているなど)が含まれます。
2。膜へのFSLのコンストラクト(s)の挿入
- 最初の遠心分離により未結合の脂質のFSL修正無料で細胞を洗浄し、洗浄液として、PBSまたは脂質フリーセルのメディアを使用して。
- セルをパックまたは希釈剤の100μLに懸濁する。
- 同時に理想的には良性、しかし関連FSL構造で修飾した修飾されていない細胞(PBSではなく、FSLの溶液と共にインキュベート)及び/または細胞の両方あるべきコントロールを用意する。
- 細胞にFSLソリューション(1つ以上のFSLの構成メンバーを含む)の適切な希釈液100μLを追加し、37℃で1〜2時間インキュベート℃に同様の結果が25℃6時間のインキュベーションによって得られる4℃または一晩(18時間)° C - 重い細胞懸濁液が使用されている場合、混合は、数時間ごとに推奨されます。
- 任意の空きFSLの構造を削除し、適切な懸濁液を調製するためにPBSまたはメディアで(省略可能)二回を洗ってください。
注意事項:
- 細胞を中断するために使用される希釈剤は、細胞培養培地、PBS、セルのストレージソリューション、などであってもよいが、好ましくは脂質(例えばウシ胎児血清)や界面活性剤(例えば、TWEEN)なしでできます。
- 別のボリューム(100μL以上)の比率(1:1セル/ FSLのソリューションより)または、時間と温度のインキュベーションの条件は、再現性のある結果を得るために使用されるのと同じ比率、濃度、およびボリュームを使用してもよい。
3。取扱いおよび可視化
- FSLの変更処理が完了するとkodecytesは、脂質の無料メディア4-8℃で保存または使用することができます。
- Kodecytesとkodevirionsは、一般的に変更されていないセル/ビリオンと同じように動作してhandlすることができますEDと通常のテストシステム(顕微鏡、血清学的検査、フローサイトメトリー、など)で観察。彼らは通常、溶媒/洗剤/膜からの脂質の構造を溶出させることができる脂質の回避を除いて特別な要件はありません。
注意事項:
- 細胞の寿命のための脂質の無料メディアに保存されている場合の構文は、そのような赤血球などの不活性細胞の膜に残ります。アクティブな膜を持つ細胞で、構造は細胞膜の活性に依存する速度で、内在化と代謝されます。
- 死んだ細胞は通常、FSLの構造を高レベルで含まれますが、これは生細胞から成長できない細胞を分離するのに使用できます。
- kodecytesがこのような血清/血漿として、メディア/環境を含む脂質で(またはin vivoで使用)保存されている場合構造は徐々に温度と脂質濃度/組成に応じて、数時間または数日の期間にわたって膜から溶出されます。
4。代表的な結果:
- 以下の代表的な結果は、その挿入された濃度と検出システムの相対的な感度と特異度(S)、(表1)使用される管理構造によって異なります。一般的にはすべてのFSLの構文は、1時間後に細胞内に挿入されますが、最適な条件は、それぞれの状況に応じて確立する必要があります。
- FSLコンストラクトは、生細胞の多様3-9,11,14の外側にラベルを付けるために使用することができます。図に示した例ではさまざまな段階で2胚は、(彼らは壊れやすい細胞であるとして)使用されたが、他の細胞(図3)または包まビリオン(図4)もラベルを付けることができます。 FSL -ビオチンおよびその他FSLの構造はそれらの存在(図5)を表示する二次検出システム(通常はアビジン/抗体/レクチン)の使用が必要な場合がありますFSL -フルオレセインは、表面の直接標識(図2-4)を可能に。
- ヒトまたは動物の特異性の血液マーカーは、赤血球4-9(図6)を含む細胞、に接続することができます。 kodecyte上FSL構造の量が4〜6制御可能かつ再現可能であるため、抗体の定量のためのkodecytesを行うことができます(表2および図6)。それによってのみ互換性抗原に確実に重要ではない、彼らはどんな種になることができる、あるいは抗体のソースと同じ起源の細胞の実際のソースは、FSL 7,8(図6)によって導入されたということです。
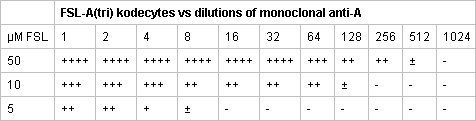
表2つの異なるFSL - A(トリ)赤血球kodecytesの代表的な血清学的反応は、モノクローナル抗の希釈に対してテスト。グループO赤血球の等量とインキュベートFSL - A(トリ)の50μMのソリューションは、モノクローナル抗の1:512希釈によって検出される可能性がある強力な抗原陽性細胞を、作り出した。 5 - および10倍低いFSL - A(トリ)ソリューションは、以下の血液型抗原の発現とkodecytesを作り出した。

図1。FSL構造の概要。花FSLの構造と同様に3つの主要コンポーネントで構成されています。 FSL構造の場合で機能的なヘッド(F)は、異なる生物学的に種々の官能基、、離れて細胞膜からのFの間隔を誘発する水分散性を改善し、血清と非反応性であるように設計スペーサー(S)、することができますジアシル脂質は、構築が自発的に表面に組み込むことができます一方。 (私は)血液グループGBの3(またはP、K)とFSL - GB3は、エピトープのGalα4Galβ4Glcβを三糖。 (II)血液型とFSL - A(三)三糖エピトープGalNAcα3(Fucα2)Galβ。 (III)FSL -フルオレセイン。 (IV)単ビオチンのFの部分とFSL -ビオチン。構造IVのスペーサーがcarboxymethylglycine -アジピン酸に基づいている間にI - IIIの構造の官能基は、ジオレオイルホスファチジルエタノールアミンの活性化アジピン酸誘導体(DOPE)とコンジュゲートです。
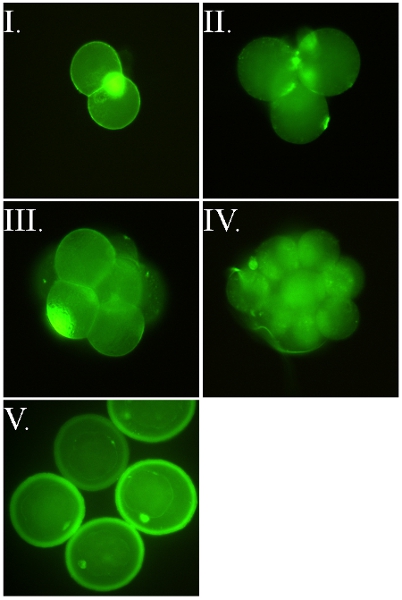
図2。FSL -フルオレセインは、マウス胚のラベルが付いた。すべての画像はそれらの透明帯(ZP)は(すなわちFSLは、胚の内側にラベルを付けるためにZPを通過構築)無傷だったときにラベル付けされたライブ胚からです。画像I - IVは、FSL -フルオレセインとの酸tyrodesポストラベリングとそのZPから放出ZP -フリー胚からです。同一の染色に関係なく胚がFSLはZP無傷またはZP無料で変更されたかどうかの発生します。胚は直接無血清細胞培養培地で2時間37℃の方法、洗浄した後、蛍光顕微鏡下で観察することによって、FSL -フルオレセインで標識されています。 (I)ZPフリー二細胞マウス胚は、また古典的な激しい極体の染色を示す。 (II - III)ZPフリー4セルと8セルマウス胚、両方ともアウトされているセルの影の染色を示すIDE焦点の顕微鏡の平面。 (IV)ZPフリー16細胞マウス胚。胚と帯の両方が標識されている(V)ZP無傷のマウス胚盤胞の胚(D4 - D5)。

図3。FSL -フルオレセインおよびゼブラフィッシュ14。 (I)ミクロ血管造影は52 HPF(時間後に受精)ゼブラフィッシュの幼虫に直接FSL -フルオレセインとの循環に注入。ゼブラフィッシュの血管が染色される。 (II)FSL -フルオレセイン異種ゼブラフィッシュ腎臓の組織細胞(ZK kodecytesは)52 HPF受信者のゼブラフィッシュの循環中にマイクロ注入。ZKのkodecytesのin vivoでの観察ではその後、ex vivoで作成されたものの撮影で2時間ポスト噴射を行ったタイムラプス顕微鏡と蛍光下血管系。示され、大規模な動きの遅いまたは不動の細胞(オレンジ色の矢印で示される)と、高速移動する細胞( - 緑の矢印で示される運動による画像のぼやけ)を持つ単一のビデオフレームです。標識は、動作と生体内分布ZKのkodecytes の in vivo観察にリアルタイムで可能になります。 (III)FSL -フルオレセインの経口摂取は5日までのメディアを含むFSL -フルオレセインでゼブラフィッシュ胚を浸漬することにより達成。洗浄はないFSLの構造を(少なくとも6時間が必要ですが、数日間になることができます)含まない培地に胚を移すことによって達成された。 (IIIa)のFSL -フルオレセインの明視野顕微鏡では、隣接する蛍光画像(IIIb)のに対応するゼブラフィッシュを扱う。 fluoresenceが優先的に腸管内に位置していた。は染色は、未処理の対照の胚(IVaおよびIVb)で観察されなかった。

ビリオン10 VSVとH1N1の図4。FSL -フルオレセインラベリング。 (I)水胞性口炎ウイルス(VSV)は直接37 10μg/ mlの2時間FSL -フルオレセインで標識した° C、4%パラホルムアルデヒドとし、フローサイトメトリーで固定が続く。 VSV kodevirionポストFSLラベルのない精製は必要ありませんでした。 (II)ヒト/プエルトリコRico/8/1934(H1N1)に感染した豚精巣細胞のフローサイトメトリーは、FSL -フルオレセインを用いて標識kodevirions。非感染細胞は、黒いラインと見られている一方、蛍光細胞(赤線)でST細胞の結果とH1N1 kodevirionの融合。
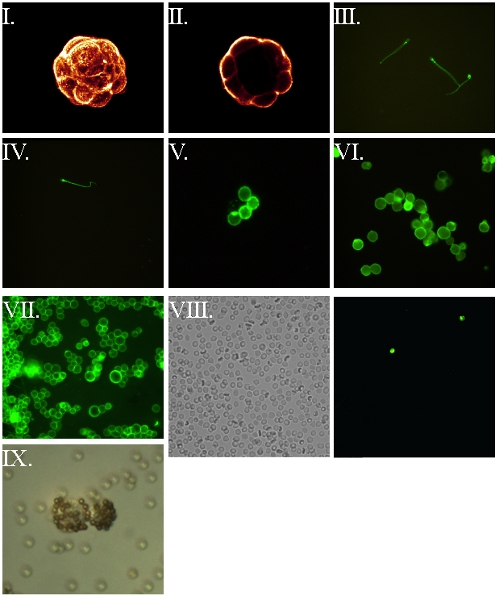
図5。FSL -ビオチン標識された細胞と標識アビジン7,8を経由して、その後の可視化。すべての細胞は、最初、37℃で1時間CのためにFSL -ビオチンで標識し、アビジン標識された蛍光体、蛍光顕微鏡用にマウントされて洗浄とウェットと反応させ洗浄した。 (私は)マウス胚の胚盤胞の共焦点画像をコンパイル。 (II)上記の画像から胚の中央共焦点スライスを。 (III)運動性の人間の精子をライブ - ぼかしは、彼らの動きの結果として発生します。 (IV)固定(4%パラホルムアルデヒドポストの挿入)人間の精子。 (V)ヒト赤血球。 (VI)固定(4%パラホルムアルデヒド、事前挿入)RL95子宮内膜ヒト癌。 (VII)未定RL95子宮内膜のヒト癌細胞株。 (VIII)ビオチンRBCは(VIIIB)がフィールドに存在する2つのkodecytesを識別するため、蛍光下で観察、同じフィールドのときに2時間が(VIIIA)光学顕微鏡下で観察フィールドを表すとkodecytesの点滴静注を投稿採取した血液サンプルで観察kodecytes - ビューの。未標識細胞にkodecytesの比率を計算することにより、生存率の指標として使用することができます。 (IX)ヒト子宮内膜ビオチンkodecytesがアビジンビーズに結合することによって可視化ライブ。

図6。血清学的プロファイリングのために血液マーカーを追加するには、FSL -糖鎖。 (I)ヒト赤血球ガリリのkodecytesは、FSL -ガリリの設定濃度(500μg/ mL)を使用して作成し、ヒト血清の希釈に対して試験した。人間の赤血球は、自然に異種抗原ガリリ抗原では発生しません。そのようなkodecytesは、血清中の抗体の定量的なレベルに使用することができます。この例では、ドナーは1時32分の抗ガリリ力価を有すると決定された。 (II)抗体を検出するFSL("抗原の力価")、最適な抗原のレベルの減少レベルkodecytesを作成することで(この例ルAで)決定することができます。細胞は、抗体のレベルが特定の力価を超えたときに肯定的な結果だけを付与するために作成することができます。肯定的な結果を得るのに必要なFSLの抗原のレベルが検出される抗体の質やレベルによって異なります。糖鎖抗原の場合は、100μg/ mLのFSLのソリューションは、一般的に強い陽性反応になります。 (III)人間のグループO赤血球は、アリの特定のレベルを持つように変更されましたIGEN(kodecytes標準化)、そして正確かつ再現ヒト血清中の抗定量するために使用。この例では、グループO血清テストにおける抗力価は1:32であり、kodecytesは、ドナー自身の赤血球から調製した。 (IV)血液型と同時に、単一のグループO赤血球サンプルに挿入B抗原が弱い B 弱い kodecytesを作成するために使用されています。これらkodecytesは、ABO品質管理の目的に使用することができます。この結果は、抗Aと抗B試薬に対してテスト具体的に定式化弱い B 弱い kodecyteの分析を示すと予想される弱い反応を与えます。
ディスカッション
FSLの構造と変更細胞とウイルス粒子は非常にシンプルで堅牢なテクニック3月11日です。変更されていない細胞から改変された細胞とウイルス粒子を構成FSLを記述し、区別するために、それらはそれぞれ60から10 kodecytesとkodevirionsと呼ばれているが、導入した官能基は、その膜上に存在することを示すことができるときだけ。 kodecytesのFSL構造の異なる濃度で加えられた場合、それらは、例えば15μgの/ mLのkodecytes、または複数のFSLを使用した場合は、combined term、その作成に使用FSL構造の溶液の濃度によって参照することができます+ビオチンkodecytes 7,8を例えば。異なる細胞が説明の細胞型を含む、比較される際には、推奨され、例えば、赤血球のビオチンkodecytesまたは子宮内膜ビオチンkodecytes 7,8。
挿入のプロセスは(異なるレートではあるが)非常に堅牢で挿入ですがと、4から大規模な温度範囲で行われます - 37℃、数分から数時間、接触時間、温度、FSLの濃度(の再現可能な挿入厳格な制御を取得する)希釈剤製剤を含めて、そしてより少ない程度の細胞濃度には必要です。これまでに、すべてのFSLの構造が同じ技法4月11日で細胞を変更するために使用できる、しかしそれは一定の条件を変更する作業の流れ及び/または細胞/ビリオンの最適な処理要件へのより有利になることが期待される。望ましい効果を達成するために正確なFSLの濃度は、ユーザ4によって決定される必要があります。結果FSLは、改変された細胞を構築/ビリオンは、通常、生物学的または分析システム4-11の変更されていないセル/ビリオンと同じ方法で使用することができます。 FSLの構造がときに脂質のソリューション7,8との接触で徐々に修正された表面から溶出される、またはアクティブセル11によって消費されるように、これらの問題は時間の期間にわたって得られる信号や活動のレベルに関して考慮する必要があります。挿入は、固定液は脂質溶出溶剤が含まれていないと官能基が固定と互換性が提供された後Kodecytes(例えば、グルタルアルデヒド/ホルマリン)に固定することができる。あるいは固定された細胞は、FSLの構文を使用して変更することができます。
細胞とウイルス粒子表面の改質に加えて、FSLの構造は、循環細胞のin vivoで修正7引き起こす実験動物の循環に直接注入することができるとウイルス12、毒素、12および抗体7を阻害する。 FLSの構文は、リポソームを飾るために使用されており、それらが固定化、紙の表面13上に印刷することができますし、診断アッセイに使用することができます。
簡単にFSLコンストラクトの増加範囲で生きている細胞を変更する機能は、細胞表面の生物学の研究のための有用な研究と開発ツールであることを証明する必要があります。
開示事項
デボラA.ブランクとスティーブンM.ヘンリーは、KODE技術の特許権者を限定KODEバイオテックの社員と株主です。ダンベスはこのビデオ、記事の制作を後援しているSigma - Aldrichは、の従業員です。
謝辞
著者らは、ビデオを提示するためのSigma - Aldrich社からダンベスに感謝。我々はまた、ドン支店、エブゲニイCherny、スコットChesla、エリザベスHadac、アマンダハリソン、ダミアンヒースコート、アニカハルト、チュアン - チンラン、スザンナマッキントッシュ、Sarvani Komarraju、エレナKorchagina、キャロラインオリバー、マーティンオルソン、スティーブンパーカー、イゴールRodinovを、感謝その結果、設計、FSLの構造の合成と生物活性を決定への貢献のためのアレクサンダーTuzikov、とエレノアウィリアムズ。
資料

このホワイトペーパーで説明されている表1。市販FSL構造。
参考文献
- Waehler, R., Russell, S. J., Curiel, D. T. Engineering targeted viral vectors for gene therapy. Nat. Rev. Genet. 8, 573-587 (2007).
- Strable, E., Finn, M. G. Chemical modification of viruses and virus-like particles. Curr. Top. Microbiol. Immunol. 327, 1-21 (2009).
- Henry, S., Bovin, N. The development of synthetic peptidolipids, glycolipids and other lipid-linked structures to create designer red cells. Transfusion. 48, Suppl 2S. 194A-194A (2008).
- Frame, T., Carroll, T., Korchagina, E., Bovin, N., Henry, S. Synthetic glycolipid modification of red blood cell membranes. Transfusion. 47, 876-882 (2007).
- Hult, A. K., Frame, T., Henry, S., Olsson, M. L. Flow cytometry evaluation of red blood cells transformed with variable amounts of synthetic A and B glycolipids. Vox Sang. 95, Suppl 1. 180-180 (2008).
- Henry, S. Modification of red blood cells for laboratory quality control use. Curr. Opin. Hematol. 16, 467-472 (2009).
- Oliver, C., Blake, D., Henry, S. In vivo neutralization of anti-A and successful transfusion of A antigen incompatible red cells in an animal model. Transfusion. , Forthcoming (2011).
- Oliver, C., Blake, D., Henry, S. Modeling transfusion reactions and predicting in vivo cell survival with kodecytes. Transfusion. , Forthcoming (2011).
- Heathcote, D., Carroll, T., Wang, J. J., Flower, R., Rodionov, I., Tuzikov, A., Bovin, N., Henry, S. Novel antibody screening cells, MUT+Mur kodecytes, created by attaching peptides onto erythrocytes. Transfusion. 50, 635-641 (2010).
- Hadac, E. M., Federspiel, M. J., Chernyy, E., Tuzikovb, A., Korchagina, E., Bovin, N. V., Russell, S. J., Henry, S. M. Fluorescein and radiolabeled Function-Spacer-Lipid constructs allow for simple in vitro and in vivo bioimaging of enveloped virions. J Virol Meth. 10, Forthcoming (2011).
- Blake, D., Lan, A., Love, D., Bovin, N., Henry, S. Fluorophore-kodecytes - fluorescent function-spacer-lipid (FSL) modified cells for in vitro and in vivo analyses. FEBS J.. 277, Suppl 1. 199-199 (2010).
- Harrison, A. L., Olsson, M. L., Brad Jones, R., Ramkumar, S., Sakac, D., Binnington, B., Henry, S., Lingwood, C. A., Branch, D. R. A synthetic globotriaosylceramide analogue inhibits HIV-1 infection in vitro by two mechanisms. Glycobiology. 27, 515-524 (2010).
- Barr, K., Diegel, O., Parker, S., Bovin, N., Henry, S. Function-Spacer-Lipid (FSL) constructs enable inkjet printing of blood group antigens. FEBS J. 277, Suppl 1. 235-235 (2010).
- Lan, C. -C. Modeling inflammatory bowel disease [dissertation]. , University of Auckland. Auckland. (1988).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved