Method Article
パーキンソン病における神経ペプチドのMALDIイメージングマススペクトロメトリー
要約
L-DOPAを用いたドーパミン補充薬物療法は、パーキンソン病の最も一般的に使用される対症療法ですが、不随意の異常な動き、と呼ばれる運動障害などの副作用が付属しています 1。ここでは、MALDIイメージング質量分析のためのプロトコルは、運動障害に関連したラット脳の神経ペプチドレベルの変化を検出し、その提示されます。
要約
MALDIイメージングマススペクトロメトリー(IMS)は、生体組織サンプル2(図1)の分子種の空間分析を容易にする強力なアプローチです。 12μmの薄い組織切片は、通常、MALDI TOF / TOF質量分析計を用いて、質量分析器で検出することができ無傷のペプチドおよびタンパク質の脱離とイオン化を容易にするMALDIマトリックスで覆われています。一般的にはピークの何百ものは、単一のラット脳組織切片で評価することができる。一般的に使用されるイメージング技術とは対照的に、このアプローチは、目的の分子の事前知識を必要とせず、高い分子特異性と感度2を維持しながら、複数の分子種の教師と包括的な分析が可能になります。ここでは、動物モデル、パーキンソン病(PD)のラット脳内の神経ペプチドの地域に固有のディストリビューションプロファイルを解明するためのMALDI IMSベースのアプローチを説明します。
PDは、年齢3,4の65歳以上の人々のための1%の有病率が一般的な神経変性疾患である。最も一般的な対症療法は、L-DOPA 5を使用してドーパミンの交換に基づいています。ただし、これは不随意異常な動き、と呼ばれるL-DOPA誘発ジスキネジア(LID)1,3,6を含む重篤な副作用が付属しています。 LIDの中で最も著名な分子変化の一つは、オピオイド前駆prodynorphin mRNAの7のレギュレーションです。ダイノルフィンペプチドは本質的に移動制御7,8に関与している脳領域で神経伝達を調節する。しかしながら、神経ペプチド前駆体の処理に由来する正確なオピオイドペプチドを最新の状態に特徴付けされていない。したがって、我々は実験的パーキンソン病とL-DOPA誘発ジスキネジアの動物モデルでMALDI IMSを利用した。
MALDIイメージング質量分析法は、神経ペプチド特性評価に関して特に有利であることが判明る、一般的に使用される抗体ベースのアプローチから知られたペプチド配列と以前に観察された翻訳後修飾を対象としています。これとは対照的にMALDI IMSは、新規ペプチドの加工製品を解明するため、神経伝達の神経変調の新たな分子メカニズムを明らかにすることができます。神経ペプチドの絶対量はMALDI IMSによって決定することはできませんが、ペプチドイオンの相対量は、健康と病気のレベルを変更する方法について洞察を与えて、質量スペクトルから、線引きすることができます。ここで示す例では、ダイノルフィンB、α-neoendorphinとサブスタンスPのピーク強度が大幅に背に増加することが認められたが、重度の運動障害を持つ動物の背内側、線条体(図顔面、体幹と口舌の筋肉を伴わない5)。また、MALDI IMSは、機能不活性化の以前に未知のメカニズムを表す、ジスキネジアの重症度とDES-チロシンα-neoendorphinのレベルとの相関関係を明らかにしたN末端 のチロシンの除去などの線条体におけるダイノルフィンのリザベーションがダイノルフィンのオピオイド受容体結合能力9を減らすことができます 。これは、MALDI IMSを使用して、LIDの神経ペプチドの特性に関する最初の研究であるとの結果は、生物医学研究のあらゆる分野のアプリケーションのための技術の潜在能力を強調表示します。
プロトコル
プロトコルは通常、複数のラットの脳切片、20〜30のセクションからMALDI IMSデータの統計分析の目的のために調整し、組織の調製物を含む5つの異なるステップで構成され、マトリクスアプリケーション、MALDI-TOF MS分析、データの評価、および神経ペプチド識別。手順は、概略、以下より詳細に説明されています。
1。組織標本
この手順では、それぞれの組織サンプルの収集と同様にIMS分析のために切片の組織が含まれています。タンパク質およびペプチド分析の特定の目的は、タンパク質分解を避けるためです。したがって、組織の解剖時に迅速かつ勤勉に働くことが不可欠である。
- 断頭によりラット(通常は250〜300グラム)を犠牲にし、-80℃の冷凍庫に転送する前に粉末状ドライアイス上では<30代、凍結の最大事後時間以内にラットの脳を削除します。液体窒素を使用して高速化凍結負のマトリックスの結晶化に影響を与える脳組織におけるmicrotearsのリスクを増加させることにより(図2D)、MSの質を減らすことができます。全体の脳は、MSの信号品質の損失なしでセクショニングの前に数年間保存することができます。
- 12μmのスライスと導電性のMALDIガラススライド上に解凍マウント組織切片(インジウムスズ酸化物被覆スライド、ダルトニクス)やMALDIターゲット(図2A-C)にクリオスタットミクロトームで凍結組織を切り取ります。
- -80℃で真空や店舗スライドの下で15分でさらに使用するまで、Cの乾燥したセクションを参照してください。組織切片を-80℃で保存されている場合であっても、セクショニング後、最短時間内に分析されるべきである℃、我々は、MSの信号品質が著しくストレージの年後に削減されることがわかります。タンパク質やペプチドの酸化を低減するために、貯蔵容器内の空気は、不活性ガス(例えばアルゴンまたは窒素)に置き換えることができます。
2。マトリックスアプリケーション
マトリックスアプリケーションステップでは、スペクトルの質に大きな影響を与え、組織の種類だけでなく、目的の分析に応じて複数のパラメータの最適化を必要とします。これらの要因は、このような行列のようなものとして化学的パラメータ、マトリックス濃度、pH、組織の洗浄と沈着10(図2D)の預金量、横方向分解能と数を含む有機修飾子と同様に楽器の設定が含まれています。大規模な実験のために、それは1日以内に、同一の演算子によって、すべてのセクションにマトリックスを適用することにより、例えば、分散を減らすために非常に重要である。サイズが100から150ピコリットル程度のような昇華するか、またはスプレー、小行列滴の配列の自動化された堆積などによってマトリックス溶液を適用するには、多くの戦略がありますが、様々な組織の小さな蛋白質と神経ペプチドの分析のために正常に使用されています、脳のセクション9、10,11、12、13を含む。
- 霜1時間デシケーター内のセクション私たちの。
- 実験は、演算子以外の者に目がくらんでいることを確認してください。再ラベル、すべてのサンプル。
- 10秒間70%エタノール(EtOH、室温で、RT)でのセクションでは、1X洗浄し、倍の95%10秒のEtOH(RT)。大規模な実験のために、すべてのガラスの洗浄を行うの変動を最小限に抑えるためにキュベットを使用して、一緒にスライドします。
- 10分間デシケーター内のセクションを乾燥させます。
- 顕微鏡下で組織切片を評価し、組織の歪み、microtearsとMALDI MSの品質(図2D)を損なわれ、小さな亀裂を確認してください。
- 50%メタノールで50 mg / mLのDHB、10%150mMの酢酸アンモニウム(AMAC)と水0.3%トリフルオロ酢酸(TFA)で構成された新鮮なマトリックス溶液を調製します。
- 行列アプリケーションは、化学のインクジェットプリンタ(CHIP、島津製作所)を使用して、長方形のパターンの離散液滴の沈着によって実行されます。最初のステップは、神経ペプチド分析includiのために行列アプリケーションの実験パラメータを最適化することであるngのパスごとの液滴の数、パスの数。この実験では、各配列は脳梁、皮質、および線条体などの類似した脳の領域をカバーしていることを確認しながら、同じ組織切片上で異なるアプリケーションパラメータを持つ複数のマトリックスアレイを適用することによって実行されます。同じ実験では、各時間パラメータは、異なる脳の構造など、特定の検体を対象とする別の行列を変更され、別のマトリックスの溶媒は、特定の分析対象成分の抽出に必要とされる場合に実行する必要があります。
- 組織切片のスライドグラスホルダーをスキャンして、ホルダーの位置を合わせます。組織切片上で行列アプリケーション用の配列を定義し、距離を見つけるために空間分解能すなわちスポットを指定します。化学物質のインクジェットプリンタで最適化されたプロトコルを使用して行列を適用します。 10滴(100 PL /ドロップ)、10個のアプリケーションパスとdを発見するスポット:この実験のために我々は次の印刷パラメータを有するペプチドイメージングのための最適化されたプロトコルを使用300μmのistance。
- スキャン最後の行列は、セクションを発見し、MALDIデータ集録(手順3.4)への事前登録のために画像を保存します。
- 真空下でデシケーター中でさらに使用するまでのセクションを格納します。
3。 MALDI MSデータの収集と処理
神経ペプチドのMS分析は、すべて単一の行列スポット14からソフトウェアアシストデータ収集を使用して、反射モードでの飛行計器のMALDI時間(ウルトラフレックスII、ダルトニクス、ドイツ)のオペレーティング·システムで実行されます。したがって、正確な空間的な教育は不可欠です。これは、MALDIの最適化、買収、特にターゲットの登録実験は、好ましくは、実験群に盲検化されるべき、同じ演算子によって実行されることが不可欠である。他の人が化学物質のインクジェットプリンタの動作中に複数のスライドガラスを持つ大規模実験では、MALDI実験は一人のオペレータによって実行することができます。
- 質量分析計にスライドガラスをロードします。
- 低分子量標準キャリブレーションミックス(ブルカーダルト)を使用して、MALDIの取得方法のキャリブレーションをチェックしてください。
- 取得パラメータを最適化します。
- MS信号を最適化し、隣接行列の堆積物からマトリックスを切除避けるために、組織にレーザーと最適な焦点の大きさは決定されるべきである。
- レーザーエネルギーはピーク分解能や飽和検出器を削減し、ベースラインを上昇させることなく、できるだけ多くの行列預金などから最大のMSの品質を確保するために設定されています。
- ノイズのみが検出されるまでの行列スポットごとのショットの最大数を評価し、多くの場合、1000年から2000年撮影。蓄積されるべきであり、スポット内でのレーザ位置の前に取得したショットの数は変更する必要がありますショットの数を推定する。均等に行列の各スポットをサンプリングするために、我々は実行された時間を使って24ステップの合計数は、25ショットの手順で600ショットを蓄積する各マトリックスの沈着からの移動のDOMパターン。
- FlexImagingを使用して、MALDIステージのモータ座標(V.2.0)が10〜すべての斑点セクションのスキャンを登録し、AutoXexuteBatchRunner.exeソフトウェアによってバッチモードでデータ収集を実行します。
- ASCIIファイル(*。DAT、*。txtまたは*。csv形式)としてエクスポート続いてベースライン減算(凸包V3)、平滑化と外部キャリブレーション(オプション)の手段によって、それぞれの単一スペクトルを処理します15
4。データ評価
最終的なデータの評価は、統計的分析に続いてピーク情報、に焦点を当てることによって、データのポスト処理およびデータ·リダクションを備える。
- 最初のステップとして、MALDI IMSセクションはovernormalization効果を評価した。これは簡単にFlexImaging(ブルカーダルト)またはBioMap(ノバルティス)などのデータ可視化ツールを用いることによって達成することができます。最初のステップとして、全イオンイメージはエヴァです。様々な著名なペプチドピークの単一イオン分布画像の手動検査に続いて、全イオン電流(TIC)正規化前luated。特徴的なピークの強度分布を探して、彼らは組織の機能(損害賠償)に関連している場合は、品質や正規化の効果を(図3)スポッティング。
- 組織学的特徴に応じて利益の領域(線条体など)が描く、ASCIIファイル形式で対応するスペクトルをエクスポートします。好ましくは、全イオン電流(TIC)のスペクトルの正規化は、この段階で行うことができます。
- オリジン(v.8.1、OriginLabの)、MATLAB(MathWorks社、ネーティック、マサチューセッツ州、米国)、またはR 16などのデータ処理ソフトウェアのASCIIファイルをインポートします。ピーク検出は、例えば、原産地やMatlabの "mspeaks"の "ピーク分析"のため、ソフトウェアに含まれてピークを見つけるツールを使用して実行することができます。一つのタブ区切りのテキストファイルとして、すべてのスペクトルからpeaklistsをエクスポートします。
- 検出されたペプチドのビンの境界を決定するためにピークは、ビニング分析は、適切なソフトウェアツール(例えばpbin 17)を使用して実行するか、または社内でここではMATLABまたはRのスクリプトを書かれたすべてのピークを含む単一のテキストファイルにデータを選んだソフトウェアにロードされ、ピークの境界を決定するためのパラメータが指定されているピークは実験のために関連しているために、スペクトル中に存在しなければならない頻度など。例えば、実験動物の2グループ、各グループの5匹の動物、100スペクトル興味のある各動物と地域から収集されますが含まれています。それは一つのグループ(3/5)で、これらの動物のスペクトル(接続可= 150スペクトル)の少なくとも半分の動物の少なくとも大部分に存在する場合、ピークは潜在的に興味深いであると仮定し、これは全体の割合を与えるだろう合計1000(2x5x100)スペクトルのうち、150の正のスペクトルの15%。 pbinツールを使用して、このステップは、取得したデータから決定されるすべてのビン幅を含む単一のbinrangeファイルを生成します。そのビンの境界を確認するために適切であり、それは元のスペクトルのトレースと一緒にOriginのビンを可視化することは容易である。
- ピーク面積の統合により、統計分析のために重要である分散を減らすことができます。我々は、手順4で決定したピークの境界間の曲線下面積を計算するRのために社内で書かれたスクリプトを使用します。統合されたピーク面積は、18日行われ、SAMツールを使用して、ノンパラメトリック対になっていないテストによってMS EXCEL(v.2007)と統計分析にインポートされます。
5。ペプチド同定
観測されたペプチドのアイデンティティのシーケンスの検証は、生物学的関連性を締結するために不可欠である。高いペプチド濃度が分析12,13この種のために必要されていますが最も正確な方法は、直接タンデム質量分析(MS / MS)によるペプチド断片を用いて組織から真のトップダウンの決定が含まれています。 CLOSと低豊富なペプチドまたは複数のペプチドのEM / z値(±0.5%)、上の組織の分析が損なわれるとpeptidomic戦略を使用してオフに組織分析は、抽出、分離、内因性神経ペプチドのMSベースの識別が含まれていることを利用されています。ここで紹介する実験では、中央の焦点は、これらのペプチドは、スペクトル内の他の神経ペプチドと比較して豊富な非常に低いので、特定の課題であるオピオイドペプチドの検出、にあった。さらに、これらのペプチドは、一般的なペプチドの抽出と分離技術を保持するために、それらは比較的親水性と困難になるではなく極性である..そこで我々は、ペプチドの同定9,19に基づく標準的なLC-MS/MSとの組み合わせで組織の抽出およびオピオイドペプチドprefractionationのために以前に報告されたプロトコルを適用した。
- 関心のある標的構造(;尾状被殻、CPU側坐核、NAC)の冠状断面を収集します。クリオスタットミクロトームで凍結ラットの脳をマウントし(COR周囲の脳材料を除去するメスでTEX、隔壁、脳梁)。解剖NACとCPUと解凍の別のスライドガラス上のセクションのNACとCPUの部品をマウントします。セクション(N = 50が30μm)を収集します。
- 2分間インキュベートし、100μLの5パーセントACN/0.1%TFAを追加することによって、組織からペプチドを抽出し、エッペンドルフ低タンパク質結合チューブに集める。この手順を2回繰り返します。
- 増加したイオン強度19で段階的に(n = 4)で溶出を使用した強陽イオン交換クロマトグラフィーによるペプチドprefractionationを実行します。 speedvacコンセントレータを使用して真空下で試料を乾燥させます。
- エレクトロスプレータンデム質量分析(LC-MS/MS)に接続ナノフローC18逆相液体クロマトグラフィー(1100、Agilent Technologiesは、サンタクララ、CA)によりペプチド画分を分析します。 MS実験はハイブリッドリニアiontrap /フーリエ変換イオンサイクロトロン共鳴(FTICR)楽器(LTQ FT 7T、サーモフィッシャーサイエンティフィック、ウォルサム、マサチューセッツ州)ペプチドfulscanスペクトル比(m / z 150に行った-2000)は、衝突誘起解離(CID)9によるiontrap 5最も強烈なペプチドのピーク以降の断片化に続いて高い質量分解能(100000)でFTICRアナライザで取得した。
- ペプチド配列の同定は、データベースの照合によって実行され、デノボシーケンス解析によって補完することができます。データベース検索のために、市販されている検索エンジンは(マスコット、XTandemまたはプロテインプロスペクター)20を採用しています。検索は、一般的に知られているか、または予測され神経ペプチドと神経ペプチド前駆体蛋白質21の配列の配列を含むデータベースに対して実行されます。
6。代表的な結果
約300モノアイソトピック分子種(平均スペクトルが示すように対応する1000以上のピークの検出の結果ここで説明されたプロトコールに従って作製した線条体の組織切片のMALDIイメージングマススペクトロメトリー図インチ1)。著名な分子イオンピークのデータの可視化は、Flexのイメージングソフトウェアを使用して達成され、解剖学的特徴(図3)に沿ったものもある特徴的なピークの強度分布を示した。 MALDI IMSのさらなる特徴は、その相対的な良好な再現性です。この実験では、検出されたすべての分子種のピーク強度の分散全体の係数は30%であったが、多くのピークが非常に低い変動と治療グループ内の高い再現性(図4)が表示されます。病変と無傷の両方の線条体の背と背内側の部分を含む関心の4つの異なる地域の相対的ピーク強度データは、統計分析に供した。同時に複数の比較のために調整するために、統計分析は、SAMツール18を用いてノンパラメトリックテストの手段によって行われた。最も顕著な変化は、ドーパミン神経除去、パーキンソン病線条体の背の部分で発見された。ここで、SIダイノルフィンB、α-neoendorphin(図5)、異なる治療群間でgnificantの変更は2ダイノルフィンペプチドが観察された。 、具体的には、50から60パーセントの両方ダイノルフィンのピーク強度の相対的な増加は、低運動障害の動物や病変のコントロール(P <0.05、F(2、15)= 12.8 DynB、F = 5.7 aNeoに比べて高い運動障害の動物で観察された図5)。
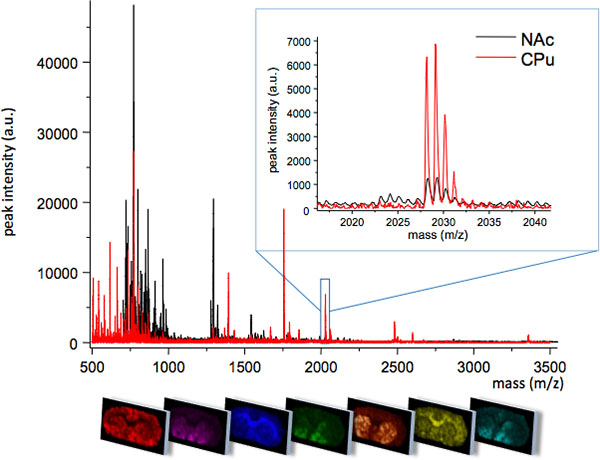
図1は線条体の2つの密接に関連する地域から得られた平均MSトレースが;尾状被殻(CPU)と側坐核(NAC)。二つの領域を一意に一つの地域、または別のピーク強度レベル(インサートは、m / z 2028)で発現していくつかの分子種で異なるMSプロファイルを表示します。各ピークの空間分布パターンは、特殊なイメージングソフトウェア(下パネル)を使用して可視化することができます。
2.JPG "/>
図2(A)脳埋め込 みメディア(OTC;矢印)を使用して、クライオスタットチャックに装着されている。、OTCは、ペプチドのOTCの原因イオン抑制以来切片なるように脳の領域を汚染しないように注意し取られます。 (B、C)薄切片(≈12μmの厚さ)MALDI互換性のあるガラススライド上に解凍マウントとC(D)Microtearsに見られるように凍結損傷を防ぐために、数秒間乾燥させたが、肉眼で検出することは難しいかもしれませんしかし、MALDIマトリクスの結晶化を阻害するとMALDI MS信号を消し去る。クレシルバイオレットで染色した同じセクションでは、microtearsやクラック(右下顕微鏡写真)を明らかにする。
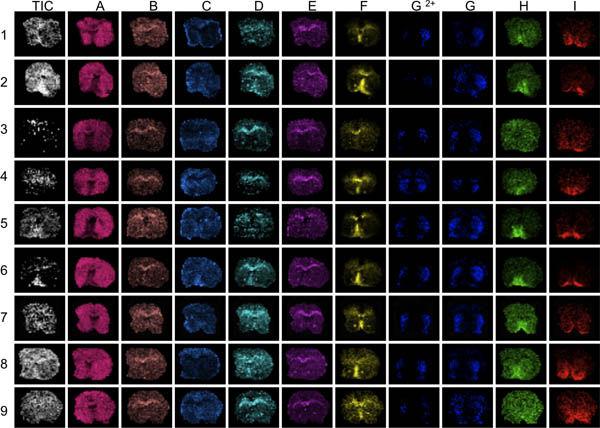
図3。データの評価の最初のステップは、(AI)を分析し、質量範囲にわたって、いくつかの異なるピークを可視化することである。ここでは、9匹から線条体切片をMALDI MSで撮像した。平均総iの可視化現在で目立つ高または低イオン強度の領域(矢印)を明らかにします。これらの領域は、上または下の正規化の効果や結果を犠牲に歪めデータの分析によって影響を受けることができます。ピークディストリビューションの貧しい人々の解剖学的な定義では、I.を通じて、例えば、セクション3と9のために、一般的に低いピーク信号対雑音比とピークFのセクションを明らかに
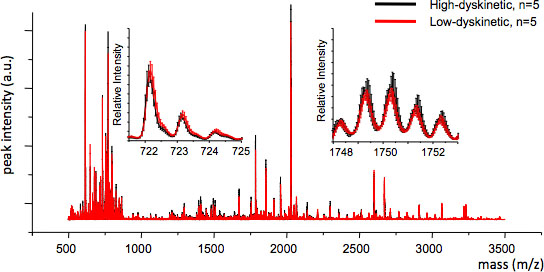
図4治療群間でMSの再現性は平均的なMSのトレースと各m / z値(挿入、のm / z 722および1749)の標準誤差を計算することによって評価することができる。良好な再現性は、有効な統計分析を保証します。
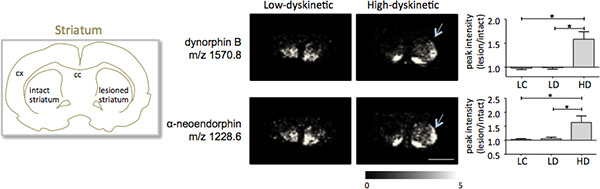
図5。ダイノルフィンB、α-neoendorphinピーク強度が大幅に6-OHDAで増加している·病変、パーキンソン病、高運動障害動物の線条体(HD;矢印)は、低運動障害(LD)と病変、対照群(LC)と比較されます。ペプチドピーク強度はそのまま側の平均倍の変化±SEM(無傷/病変側)で表されます。 * P <0.05; CX皮質、ccの脳梁。スケールバーは5mmである。
ディスカッション
神経ペプチドの研究ではMALDIイメージング質量分析を用いることのいくつかの利点があります。 MSデータの公平な分析は、特定の脳核を明らかにするか、線条体の背の部分は特定の病態生理学的状態に関連付けられているところここでしか示された結果のようにすることができます。空間情報を保持することにより、全体の脳切片の解析やペプチド抽出物を従来のペプチドミクス研究を使用した場合に比べて高い感度と低い変動と統計分析を実行するために関心領域を再定義することが可能である。また、MALDI IMSが容易に未知の翻訳後修飾を検出することができます実現するために重要であるが、構造解析では、変更された正確なアミノ酸の位置を決定するために従わなければなりません。
MALDI IMSデータを可視化する一般的な落とし穴がBLから線形光学スケールの最大ピーク強度のマッピングを含む代わりに、100%すべてのセクションの最大ピーク強度である共通の絶対的なスケールに、すべてのセクションをマッピングの実験シリーズ内の各セクション(図3)の色(100%)(0%)、ACK(図5) 。後者の方法は、グループデータと治療群間差の可視化の比較が可能になります。
MALDI IMS分析の主要な障害は、特定の質量ピークのペプチドの割り当てです。上の組織タンデム質量分析法は、可能な場合もありますが、多くの場合、13,14は非常に困難証明しています。我々は、逆相LC-MS/MSに続いて強陽イオン交換クロマトグラフィーで分取画など、多くの伝統的なアプローチが成功したシーケンスの多くの神経ペプチド、特にオピオイドペプチドに使用することができることがわかります。それはまだそのようなマスコットとして一般的な検索エンジンを使用して、任意のデータベースのエントリと一致しない良質のMS / MSスペクトルを取得することも珍しくありません。これらのケースでは手動でのde novoシーケンシングは、ONLです。yオプション。ピーク身元の最終的な証拠は、適切なノックアウトマウスからの組織切片のMALDI IMSすることによって得ることができる、しかし、これは常に可能か可能ではありません。代わりに、西部のイムノブロッティングや免疫組織化学によって、例えば、直径方向に異なる方法で結果を検証することです。これは多くの場合、抗体と新しい抗体を検証する作業のかなりの量を高めることを含めることができます。
このプロトコルで提示一般的な戦略は、いくつかのセクションに、実験条件を含む大規模な神経ペプチドMALDI IMS実験のために最適化されています。痛みのメカニズムと依存症の薬物に対する内因性の応答を含む研究の多様な分野で採用されるようにプロトコルは、特にオピオイドペプチドのために最適化されており、今後の研究に大きな影響を与えます。
開示事項
著者らは、開示することは何もありません。
謝辞
私たちは貴重な入力については、図3と教授ジョナス伝のためにデータを提供するためハンナワーナーに感謝します。スウェーデンの研究評議会(グラント522-2006-6416(MA)、521-2007-5407(MA)、オーケウイバーグ財団(MA、JH)、スウェーデン王立科学アカデミー(MA、JH)と、スウェーデンの化学社会(JH)は感謝して財政支援のために承認されています。
資料
1.1サンプルの収集と準備
- イソフルラン(Apoteksbolaget AB、スウェーデン)
- 手術ツール、はさみの2ペア、骨鉗子、へら
- 細かく粉砕ドライアイス
- ストレージ用のアルミ箔とビニール袋
- クライオスタット(マイクロモル、ハイデルベルク、ドイツ)
- インジウム - スズ酸化物(ITO)でコーティングされたMALDIスライド(ブルカーダルト、ドイツ)
- 最適な切削温度媒体(OCT)(サクラファインテックヨーロッパ、オランダ)
- 真空デシケーター
1.2マトリックスアプリケーション
- のアセトニトリル(ACN)、メタノール(MeOH)、エタノール(EtOH)プロ分析グレード(メルク、ドイツ)。
- トリフルオロ酢酸(TFA)(シグマアルドリッチ、セントルイス、MO)。
- 水のMilli-Q精製システム(ミリポア、ベッドフォード、MA)で精製した。
- CHIP-1000(島津製作所、日本)またはPortrait 630スポッター(LabCyte、サニーベール、カリフォルニア州)
1.3質量分析
- ULtraflex II(ブルカーダルト)
- FlexImagingソフトウェア(V 2.0、ダルトニクス)
- ペプチドまたはタンパク質校正標準(ブルカーダルト)
1.4データ処理
- 原点v.8.1(OriginLabの社、Norhampton、MA)
- Matlabのバージョン7.9.0.529(MathWorks社、ネーティック、マサチューセッツ州)
- pBin( http://www.vicc.org/biostatistics/software.php )
1.5ニューロ識別
- 超音波超音波
- 10kDaの分子量カットオフフィルター(ミリポア、ベッドフォード、MA)
- SPセファデックスC 25ゲル(Sigma社、ドイツ)
- Hypersilカラム(サーモフィッシャー)
- ピリジン、プロの分析グレードのギ酸(FA)、アセトニトリル(ACN)、メタノール(MeOH)、エタノール(EtOH)(メルク、ドイツ)。
- トリフルオロ酢酸(TFA)、シグマアルドリッチ(セントルイス、MO、米国)。
- Agilent 1100シリーズナノフローLC、microWPS、C18カラム(0.075x150mm)
- Agilent 1100シリーズマイクロfractioncollector、Prespotted anchorchipターゲットプレート(ブルカーダルト)
- BioToolsソフトウェア(バージョン3.1 SR2、ダルトニクス)
- バイオワークスソフトウェア(V.3.3、サーモフィッシャー。 www.thermoscientific.com )
- マスコットソフトウェア(V 2.2、MatrixScience。 www.matrixscience.com )
- Swepepデータベース( www.swepep.org )
参考文献
- Obeso, J. A., Olanow, C. W., Nutt, J. G. Levodopa motor complications in Parkinson's disease. Trends Neurosci. 23, S2-S7 (2000).
- Caprioli, R. M., Farmer, T. B., Gile, J. Molecular imaging of biological samples: localization of peptides and proteins using MALDI-TOF MS. MALDI-TOF MS. Anal. Chem. 69, 4751-4760 (1997).
- Obeso, J. A. The evolution and origin of motor complications in Parkinson's disease. Neurology. 55, S13-S20 (2000).
- O, W. H. Noncommunicable Diseases and Mental Health Cluster, Noncommunicable Disease Prevention and Health Promotion Department, Ageing and Life Course. Active Ageing: A Policy framework. , (2002).
- Schapira, A. H. Movement disorders: advances in cause and treatment. Lancet Neurology. , 6-7 (2010).
- Obeso, J. A., Rodriguez-Oroz, M. C., Rodriguez, M., DeLong, M. R., Olanow, C. W. Pathophysiology of levodopa-induced dyskinesias in Parkinson's disease: problems with the current model. Ann. Neurol. 47, S22-S32 (2000).
- Cenci, M. A., Lee, C. S., Bjorklund, A. L-DOPA-induced dyskinesia in the rat is associated with striatal overexpression of prodynorphin- and glutamic acid decarboxylase mRNA. Eur. J. Neurosci. 10, 2694-2706 (1998).
- Andersson, M., Hilbertson, A., Cenci, M. A. Striatal fosB expression is causally linked with l-DOPA-induced abnormal involuntary movements and the associated upregulation of striatal prodynorphin mRNA in a rat model of Parkinson's disease. Neurobiol Dis. 6, 461-474 (1999).
- Hanrieder, J. Alterations of striatal neuropeptides revealed by imaging mass spectrometry. Molecular & Cellular Proteomics. , (2011).
- Cornett, D. S., Reyzer, M. L., Chaurand, P., Caprioli, R. M. MALDI imaging mass spectrometry: molecular snapshots of biochemical systems. Nat. Methods. 4, 828-833 (2007).
- Ljungdahl, Imaging Mass Spectrometry Reveals Elevated Nigral Levels of Dynorphin Neuropeptides in L-DOPA-Induced Dyskinesia in Rat Model of Parkinson's Disease. PLoS ONE. 6, e25653 (2011).
- Groseclose, M. R., Andersson, M., Hardesty, W. M., Caprioli, R. M. Identification of proteins directly from tissue: in situ tryptic digestions coupled with imaging mass spectrometry. J. Mass. Spectrom. 42, 254-262 (2007).
- Andersson, M., Groseclose, M. R., Deutch, A. Y., Caprioli, R. M. Imaging mass spectrometry of proteins and peptides: 3D volume reconstruction. Nat. Methods. 5, 101-108 (2008).
- Deininger, S. -. O., Setou, M. . Imaging Mass Spectrometry. , 199-208 (2010).
- Norris, J. L. Processing MALDI Mass Spectra to Improve Mass Spectral Direct Tissue Analysis. Int. J. Mass. Spectrom. 260, 212-221 (2007).
- Ihaka, R., Gentleman, R. R. A Language for Data Analysis and Graphics. Journal of Computational and Graphical Statistics. 5, 299-314 (1996).
- Tusher, V. G., Tibshirani, R., Chu, G. Significance analysis of microarrays applied to the ionizing radiation response. Proc. Natl. Acad. Sci. U.S.A. 98, 5116-5121 (2001).
- Bergstrom, L., Christensson, I., Folkesson, R., Stenstrom, B., Terenius, L. An ion exchange chromatography and radioimmunoassay procedure for measuring opioid peptides and substance P. Life. Sci. 33, 1613-1619 (1983).
- Falth, M. Neuropeptidomics strategies for specific and sensitive identification of endogenous peptides. Mol. Cell. Proteomics. 6, 1188-1197 (2007).
- Falth, M. SwePep, a database designed for endogenous peptides and mass spectrometry. Mol. Cell. Proteomics. 5, 998-1005 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved