Method Article
インフルエンザウイルスのためのハイスループット検出方法
要約
この方法は、高感度で感染マウスの気管支肺胞洗浄(BAL)液中のH1N1を検出するための赤外線染料ベースのイメージングシステムの使用方法について説明します。試験材料の<10μlの体積を必要とし、複数の病原体の同時スクリーニングのための可能性を秘めている、または384ウェルプレート - この方法論は、96で行うことができ
要約
インフルエンザウイルスは、世界の複数の部分では毎年罹患率と死亡率の高い学位を引き起こす呼吸器病原体である。したがって、臨床サンプルの膨大な数の感染株と迅速なハイスループットスクリーニングの正確な診断は、パンデミックの感染の広がりを制御することが重要です。インフルエンザ感染症の現在の臨床診断は血清学的検査、ポリメラーゼ連鎖反応、直接試料の免疫および細胞培養1,2に基づいています。
ここでは、ライブのインフルエンザウイルスを検出するために用いられる新規な診断技術の開発について報告する。我々は、MDCK細胞4を使用して、この手法の有効性をテストするためにマウスに適合した人間A/PR/8/34(PR8、H1N1)ウイルス3を使用していました 。 MDCK細胞(ウェルあたり10 4または5×10 3)96中で培養した-またはPR8とウイルスタンパク質に感染した384ウェルプレートでは、IR色素標識秒、続いて抗M2を使用して検出された二次抗体。 M2 5ヘマグルチニン1は 、さまざまな診断アッセイに使用される2つの主要なマーカー蛋白質である。採用したIR-色素コンジュゲート二次抗体は、他の蛍光色素に関連付けられた蛍光を最小限に抑える。抗M2抗体の使用は、私たちは、ウイルス量の直接的な指標として抗原特異的な蛍光強度を使用することができました。蛍光強度を列挙するには、我々は、LI-CORオデッセイベースの赤外線スキャナを使用していました。このシステムは、蛍光物質を識別し、バックグラウンドノイズと区別するために2つのチャネルのレーザーベースのIRの検出を使用しています。最初のチャンネルは680 nmで励起し、バックグラウンドを定量化するために700 nmで発光する。番目のチャネルは780 nmで蛍光体を励起を検出し、800 nmで発光する。 IRスキャナでPR8感染MDCK細胞のスキャンは、ウイルスの力価に依存明るい蛍光を示した。 10 2 -10 5 PFUから始めてウイルス力価の蛍光強度の正の相関がCONかもしれませんsistently観察した。一貫して10 2 -10 3 PFU PR8ウイルス力価で見られた最小限のしかし、検出可能な陽性は近赤外色素の高感度を示した。信号対雑音比はモック感染またはアイソタイプ抗体処理MDCK細胞を比較することによって決定されました。
96からの蛍光強度を使用して - または384ウェルプレートフォーマットを、我々は標準的な滴定曲線を構築した。番目の変数は、蛍光強度でありながら、これらの計算では、最初の変数は、ウイルス力価である。したがって、我々は、ウイルス力価および蛍光強度の間に多項式の関係を決定するためにカーブフィットを生成するために指数分布を使用していました。総称して、我々はIR染料ベースのタンパク質検出システムは、ウイルス株を感染の診断と正確に感染する病原体の力価を列挙助けることができると結論する。
プロトコル
1。 MDCK細胞の培養
- 10%FBS、100 U / mlペニシリン、100μg/ mlのストレプトマイシン、1mMのピルビン酸ナトリウム、7.5%重炭酸ナトリウムの5%RPMI1640完全培地20 mlのT-75 cm 2のフラスコで一晩培養500万MDCK細胞37℃インキュベーター内の溶液および0.001%β-メルカプトエタノール、5.2%CO 2を注入した。
2。 PR8感染とBAL液のコレクション
- チャレンジC57BL / 6マウスの鼻腔内鼻孔を介して30μlの合計体積の無菌PBSでPR8ウイルスの5000 PFUた。ウイルスなしで唯一の滅菌したPBSを使用してモック感染を行っています。
- マウスで0、2、4、感染後7日を安楽死させると胸腔を開いて、それを公開するためにマウスの毛皮を通して気管に1cmの切開を平行にしてカット。
- 気管の近位面上の正中切開を行います。
- PBS-1%BSAを含む0.5 mlを気管を吹き込むとBAを吸引L液。使用するまでBAL液は、-20℃の冷凍庫に保存することができます。
3。 LI-CORのオデッセイとウイルス感染とウイルスのマトリックスタンパク質(M2)の検出
- 赤外線色素標識抗体、収穫光平底黒色96ウェル(ウェル当たり10,000細胞)または384ウェル(ウェルあたり5000細胞内のT-75 cm 2のフラスコやプレート、そこからMDCK細胞を用いたウイルス力価を定量化する)プレート。 RPMI1640完全培地での培養で、37一晩のためにMDCK細胞を℃にし、無血清DMEMにBSA(0.2%、重量/体積)、ペニシリン(100 U / ml)を、ストレプトマイシン(100μg/ ml)を、ナトリウムを含むで2回洗浄するピルビン酸(1mM)を、重炭酸ナトリウム溶液(7.5%の5%)とβ-メルカプトエタノール(0.001%)。
- BAL液(384ウェルプレート96ウェルプレートまたは10μlを50μl)あるいは同等のボリュームで、各ウェル内の既知の力価(96ウェルプレートまたは384のために10μlの50μlのPR8ウイルスのMDCK細胞をインキュベートします - ウェルプレート)DMEM培地中、を含むL-1-tosylamido -2 - フェニルエチルクロロメチルケトン(TPCK)は、トリプシン(0.2μg/ mlの)を処理。
- 感染1時間後、100μL(96ウェルプレート)または10%の20μL(384ウェルプレート)FBS含有各ウェルにRPMI1640完全培地を追加します。
- 感染症の別の16時間培養したMDCK細胞を継続し、PBS-1%BSA溶液を100μl(96ウェルプレート)または20μL(384ウェルプレート)で二回MDCK細胞を洗浄し、100μl(96ウェルで固定板)、または5分間、1%パラホルムアルデヒド20μlの(384ウェルプレート)。
- 固定後、100μL(96ウェルプレート)やブロッキングのためにPBS-1%BSAを20μl(384ウェルプレート)で30分間さらにMDCK細胞をインキュベートします。
- M2タンパク質に対する一次抗体(PBS-1%BSAで希釈した1:1000)で1時間のためにMDCK細胞をインキュベートしブロッキングした後。それぞれ、50希釈した抗体のウェルに20μlの当たり1μlあたり96ウェルまたは384ウェルプレートで使用してください。
- 100μL(96ウェルプレートで3回MDCK細胞を洗浄場合)またはPBSを含む50μlの(96ウェルプレート)または20μL(384ウェルプレート)ヤギ抗マウスIRDye @ 800二次抗体で1時間に1%BSAとインキュベートする(20μL(384ウェルプレート) 1:200希釈)。
- PBS-を含む1%BSAを100μlで3回MDCK細胞を洗浄します。または384ウェルプレートの読み取り - 96 LI-CORのオデッセイIRスキャナの読み取りガラスのプラットフォーム上で染色されたプレートを配置し、リーダーを設定します。
- 空白のネガティブコントロールのウェルは、LI-CORのオデッセイソフトウェアを使用して設定することができます。 LI-CORのオデッセイソフトウェアを使用して、プレート内でプレート全体または選択したウェルを定量化する。
- オートシェイプツールを使用して、テストの途中で96ウェルのターゲット領域(ROI)の境界線を描く - または384ウェルプレート。 ROIの作成は、ソフトウェアがウイルス滴定サンプルに定義された背景井戸を比較することができます。
- 全体の分析のベースライン値を設定するには、バックグラウンドのROIを使用しています。 measuにROI内オデッセイソフトウェアで提供される二つの相反する十字線を導入するよく全体の蛍光強度を再。
- 検出およびLI-CORのオデッセイIRスキャナの基準波長として680 nmの780 nmのチャネルを使用して、プレートをスキャンします。
- "読む"コマンドがアクティブになると、ROIの均一な間隔で蛍光強度を測定し、収集したデータポイントが統合されます。標準偏差の乗数は、ROIの決定に含まれているベースライン上の信号のレベルを決定します。
- 単独で制御し、試験ウェルの積分強度を推定するために使用されるバックグラウンドの蛍光がモック感染または二次抗体から定量されます。
- それが定義されている個々のスポットの純ピクセル量を表しており、機能のサイズとは無関係であるため、計算のための "積分強度"を選んだ。未知サンプルのウイルス力価を計算するために、既知のウイルス力価から標準曲線を使用しています。正確にウイルス力価を計算するために長い間の補間曲線を使用しています。 vを計算する標準曲線と試験サンプルの強度を比較することにより、試験サンプル中のiral価。
4。代表的な結果
IR染料ベースのハイスループットウイルス検出システムの標準化
PR8ウイルスはMDCK細胞に感染する可能性があるため、我々は、このアッセイを開発するために、これらの細胞を使用していました。我々は、インフルエンザウイルスのマトリックスタンパク質(M2)に対する一次抗体を使用してウイルス力価を測定した。他の方法とは対照的に、我々は近赤外色素にコンジュゲート二次抗体を使用していました。このメソッドは、M2タンパク質を検出しながら生成された蛍光強度を使用して簡単な、自動化されたPR8ウイルスの力価測定を提供します。インフルエンザウイルス感染後、M2タンパク質は、翻訳された輸送と細胞表面を含む宿主細胞内に蓄積されています。したがって、M2タンパク質の量は、ウイルスの量を決定するための測定可能なパラメータを表します。から強度を比較する標準曲線を使用してテストサンプルは、ウイルス力価の正確な測定を提供しています。
蛍光ベースの方法の有効性を決定するために、我々は一晩10 4 MDCK細胞を培養/ウェルチャンバースライドで。既知の力価のウイルスPR8株は別のプラーク形成単位(PFU)でウェルを複製することを加えて1時間のために細胞に吸着させた。細胞は、ウイルスが伝播できるようにするために、16時間インキュベートした。この後、チャンバースライドにMDCK細胞をさらに1時間AlexaFluor 488標識二次抗体に続いて1時間、の抗M2抗体で洗浄し、染色し、1%パラホルムアルデヒドで固定した。感染したMDCK細胞の共焦点顕微鏡分析は、付着した単層は、主に無傷だったとPR8由来M2タンパク質は、感染したMDCK細胞( 図1A)内に豊富に存在していた明らかにした。蛍光を発する細胞は、できるだけ低いウイルス力価と感染症で検出される可能性がある10 2 。これらの分析はまた、ウェル当たりMDCK細胞を蛍光の数が増加しPR8ウイルス力価に直接比例することが明らかになった。が、アルゴンレーザーベースの蛍光励起の光効率が特に低い滴定で、ノイズ比や細胞の自家蛍光の鮮やかな携帯電話の画像は、その狭い信号はウイルスの数量化が極めて困難にレンダリングしています。
したがって、正確なウイルスの推定法を確立するために我々はIR染料ベースの検出および定量化システムを採用しています。 MDCK細胞(10 4 /ウェル)を96ウェルPR8感染したプレート、ウイルスタンパク質で培養したが、IR色素標識二次抗体、続いて抗M2を用いて検出した。抗M2抗体の使用は、私たちは、ウイルス量の直接的な指標として抗原特異的な蛍光強度を使用することができました。蛍光強度を列挙するには、我々は、LI-CORオデッセイベースの赤外線スキャナを使用していました。このシステムは、2つのチャンネルレーザー-BASを使用していますED IRは検出された蛍光物質を識別し、バックグラウンドノイズと区別するために。最初のチャンネルは680 nmで励起し、バックグラウンドを定量化するために700 nmで発光する。番目のチャネルは780 nmで蛍光体を励起を検出し、800 nmで発光する。 LI-CORのオデッセイのPR8感染MDCK細胞のスキャンは、ウイルスの力価に依存した明るい蛍光( 図1B)を示した。 M2の正の蛍光MDCK細胞は、ウェル( 図1B)の内部はっきりと見えた。 10 2 -10 5 PFUから始めてウイルス力価の蛍光強度の正の相関が一貫して観察することができた。アッセイの感度の上限を設定し、細胞死、10 6 PFUのリードよりも高いPR8ウイルスの滴。一貫して10 2 -10 3 PFU PR8ウイルス力価で見られた最小限のしかし、検出可能な陽性は近赤外色素の高感度を示した。信号対雑音比は、mocを比較することによって決定されましたK-感染またはアイソタイプ抗体処理MDCK細胞。これらのコントロールの両方が蛍光の無視または検出不可能なレベル( 図1B)となりました。
さらに感度を向上させ、試験試料の必要量を減らすために、我々は5×10 3 MDCK細胞に感染/ウェル、384ウェルプレートで。 PR8の異なるPFUsは、シリアルつのログ希釈( 図1C)として試験した。 384ウェルプレートからの検出感度は96ウェルプレートアッセイと同等であった。 10 1、10 2 PFUはどちらも96ウェルプレートに比べて384ウェルプレート内で一貫して優れていました。 96からの蛍光強度を用いて-または384ウェルプレートフォーマットで、我々は標準的な滴定曲線を( 図1D)を構築した。番目の変数は、蛍光強度でありながら、これらの計算では、最初の変数は、ウイルス力価である。したがって、我々はdetermにカーブフィットを生成するために指数分布を用いウイルス力価と蛍光強度との間の多項式関係をピペリジン。また、PR8ウイルスの核タンパク質(NP)(データは示さず)に対して向けられている別の抗体を用いて我々の観察を検証しています。 PR8株の明確なソースはまた、抗NPまたは抗M2抗体(データは示さない)でテストされたMDCK細胞に感染するために使用された。総称して、我々はIR染料ベースのタンパク質検出システムは、ウイルス株を感染の診断と正確に感染する病原体の力価を列挙助けることができると結論する。
ウイルス力価を計算するための数学的な考慮事項
後述するように蛍光強度と力価測定の数学的計算が行われています。染色手順に従って、全体のプレートまたはプレート内の選択したウェルは、LI-CORのオデッセイソフトウェアを使用して定量化されています。オートシェイプツールを使用して、ターゲット領域(ROI)の境界は、96の試験ウェルの中央に描かれた - または384 - 我々LLプレート( 図2AおよびB)。 ROIの作成は、ソフトウェアがウイルス滴定サンプルに定義された背景井戸を比較することができます。バックグラウンドのROIは全体の分析のベースライン値を設定するために使用されていました。二つの相反する十字線(白)( 図2C)も渡って蛍光強度を測定するためにROI内に導入されました。右側に、 図2Cの代表的な井戸の下の曲線は、これらの十字線に沿ったピクセルの強度を表しています。 ROIの均一な間隔で蛍光強度を測定し、収集したデータ·ポイントが統合されました。標準偏差の乗数は、ROIの決定に含まれていたベースライン上の信号のレベルを決定した。バックグラウンド蛍光はモック感染または二次抗体単独でコントロールから定量化し、試験ウェルに積分強度を推定するために使用されていました。それはrepresので、我々は計算のための積分強度を選択しましたエント定義されている個々のスポットの正味のピクセル量と機能のサイズとは無関係です。さらに、積分強度は、分解能が実質的に独立しています。全強度/ピクセル(I)は、画素領域(IS)と、画素領域(b)の背景に起因する信号にも選択に起因する信号強度に対応しています。したがって、ピクセルの 'I':
I I = Iの i + b iは
ピクセル量は信号の大きさとそれが配布されている領域の両方を表します。信号領域は、信号を生成しているサンプルの分布に関連しています。ピクセルのボリュームは、ピクセルの領域では 'i'()倍の高さ(I)ピクセルで測定された全信号に等しくなります。したがって、ピクセルの 'I':
VI = I I
総画素ボリュームは、このように領域全体からの総信号の総和である。
| ; | N | N | |
| V = | ΣvI | = | aΣII |
| i = 1の | i = 1の |
積分強度は、円/矩形の面積(mm 2を数える)を乗じた機能で囲まれたすべてのピクセルの強度値の合計です。したがって、積分強度=
(ΣII - b)の
ここで、bは平均的な背景のピクセルの強度を表しています。この式は、コントロールまたは実験的な井戸の統合された信号強度を算出し、これにより標準曲線を確立します。テストサンプル中のウイルス力価は、この標準曲線を用いて計算した。濃度(強度)を定義しROI内の蛍光の存在量として定義されています。テストサンプル中の濃度はcalculaです同じ画像での標準の定義されている濃度の相対的なテッド。正確なウイルス力価を計算するために、各濃度の標準の強度をプロットし、長い間の補間曲線が装備されています。試験サンプルの濃度は標準曲線内の領域の強度を比較することによって計算されます。
インフルエンザ感染マウスのBAL液からウイルス力価の決定
臨床検査検体中の生インフルエンザウイルス粒子の検出は重要な意義がある。したがって、我々は次の我々が実験室での試料中のウイルス力価を決定するためにこのメソッドを利用することができるかどうかを検討した。 BAL液は、非免疫マウスから採取し、PR8ウイルスの既知量を添加した。スパイクBAL流体は直線的にウイルス力価を列挙するための滴定した。スパイクBAL液のアリコートを、96ウェルプレートにMDCK細胞に感染するために使用される固定されており、抗M2およびIR色素コンジュゲートsecondarで染色したyの抗体。 図3Aに示した結果はスパイクBAL液中のウイルス力価が検出された、標準曲線のPR8価と相関することを示している。標準曲線を用いて、スパイクと滴定BAL液中の正確なウイルスの数字を定量した。指数関数カーブフィットの計算は、スパイクBAL液( 図3B)におけるウイルス力価を計算する手段を提供しました。このメソッドを介して我々は、このアプローチ( 図3C)を検証し、計算され、スパイクウイルス力価との間の優れた相関を得た。
次に、我々は、PR8感染マウスからBAL液を分析した。 PR8は広く人間の病理および抗ウイルス免疫3を理解することがマウスモデルで使用されています。マウスのグループは、鼻腔内にPR8 5,000 PFUで感染させた。マウスは、体重減少、背を丸めてバックの外観、フリル毛皮やその他の臨床症状をモニターした。 0日、2、4、7、感染後の10日、マウスを屠殺し、BAL液を回収した。これらの実験室のサンプルを利用するには、MDCK細胞を96ウェルプレートで17時間、50μlの最終容量でBAL液の段階希釈とともにインキュベートした。株式PR8ウイルスの既知の力価は感染したMDCK細胞の対照ウェルには、標準曲線を生成するために役立った。感染後、細胞を洗浄し、固定されており、近赤外色素標識二次抗体、続いて抗M2一次抗体で染色した。モック感染または感染が力価計算のためのバックグラウンド蛍光の強度を提供した後、アイソタイプコントロールで処理したMDCK細胞。
BAL液の分析は、実験試料中のPR8ウイルスはIR染料ベースのアッセイシステムを介して検出可能であることを実証した。 BAL液中のウイルス量の有意な増加が日2 および4、感染後( 図4A)で観察された。積分強度の計算は、2日目および4からBAL液iを投稿することが示されたnfectionはPR8ウイルスの有意水準( 図4B)が含まれています。我々の結果は、疾患の重症度を示す、PR8感染の初期段階で徐々にしかし、有意な体重減少を示しています。それにもかかわらず、ほとんどのマウスは、7日後に感染症( 図4C)の病気の症状から回復し、体重が増え始めました。 10日、感染後のマウスにも体重の増加と病気の症状にはかなりの減少と相関してウイルスのクリアランスを示す任意の検出可能なPR8を欠いていた。
さらに、このアッセイのアプリケーションを拡張するために、我々はIR染料ベースの抗体検出システムを隔離する2009 A(H1N1)のヒトインフルエンザのテストを行い、リアルタイムPCRアッセイと比較した。この臨床サンプルが疑われる患者から得られた複合鼻/咽頭スワブから分離された。ミルウォーキー衛生局研究所でMDCK細胞株で増殖させ分離します。テスト結果はCOMPAましたリアルタイムPCRアッセイ( 図5)IR染料ベースの方法の感度を確認して赤い。結果は、IR染料ベースの抗体検出システムは、PCRベースのアッセイ(10 TCID 50 / ml)で同等であると臨床的意義の範囲内10 3 TCID 50 / mlで、できるだけ低いウイルス量を検出する可能性を秘めていることを示しているほとんどの患者検体の範囲。これらの結果は、IR染料ベースのアッセイシステムは、研究室や臨床現場でウイルス力価の列挙に適用されるのに十分な感度と可能性を秘めているという強い証拠を提供しています。

図1。インフルエンザウイルスのIRは、染料ベースの免疫検出。(A)8ウェルチャンバースライドでインフルエンザに感染したMDCK細胞の共焦点顕微鏡分析。免疫蛍光顕微鏡分析は付着MDCK単層は、ウイルス由来のMの大部分は無傷およびロードであることを実証2タンパク質。 IR染料とLI-CORのオデッセイシステムに基づいてウイルス力価の(BC)の定量。標準曲線、指数曲線近似プロファイルの(D)の生成。 ADに提示されたデータは、5つの独立した実験の代表的なものである。
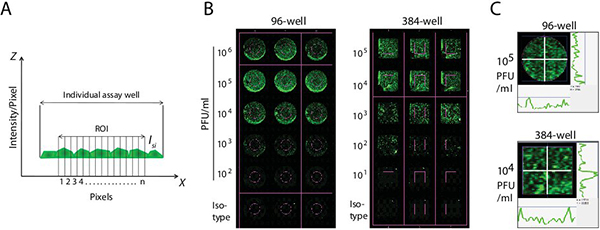
図2。 IR染料を使用してウイルス力価を決定するための方法論(A)統合された蛍光強度の測定。試験井戸(ROI)内の定義された領域は、蛍光強度を測定するためにマークされています。または384ウェルプレート - オートシェイプのツールを使用して、ROIの境界は、テスト96のウェルの中央に描かれていました。蛍光は、ROI内の個々の画素(ピクセル= n)として測定した。積分強度は、円/矩形の面積(mm 2を数える)を乗じた機能で囲まれたすべてのピクセルの強度値の合計です。 (B)アッセイウェル中の統合された蛍光強度を決定する。 ROIの作成ウイルス滴定サンプルに定義されている背景の井戸を比較するためにLI-CORスキャナができました。バックグラウンド蛍光はモック感染または二次抗体単独でコントロールから定量化し、試験ウェルに積分強度を推定するために使用されていました。 ROI内のデータポイントの(C)コレクション。二つの相反する十字(白)も渡って蛍光強度を測定するためにROI内に導入されました。右側に、代表的な井戸の下の曲線は、これらの十字線に沿ったピクセルの強度を表しています。

図3。 PR8スパイクBAL液中のウイルス力価の検出および定量。()MDCK細胞は一晩96ウェルプレートで培養し、PR8-スパイクBAL液で追加されました。プレートは、LI-CORのオデッセイシステムで読み取った。 (B)は外因的に添加したBAL液は、標準曲線と比較した。 (C)の比較は、予想されるVIRに計算ら価。指数曲線の当てはめはy = 9.4784e 0.0014xを提供した 。 ACで提示されたデータは3つの独立した実験の代表的なものである。
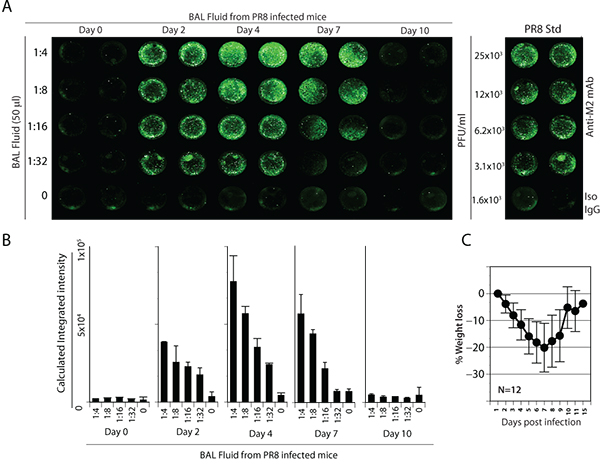
図4。 PR8感染マウスからのBAL液中のインフルエンザウイルスの検出および定量。(A)マウスのグループは鼻腔内にPR8 5,000 PFUで感染させた。 MDCK細胞を96ウェルプレートで17時間、50μlの最終容量でBAL液の段階希釈とともにインキュベートした。感染後、細胞を洗浄し、固定されており、IR色素標識二次抗体、続いて抗M2一次抗体で染色した。右端のパネルには、標準曲線を表しています。 (B)感染マウスのBAL液中のウイルス力価の定量。 PR8感染時のマウスの(C)重量損失は、ウイルス量と相関していた。 ACで提示されたデータは3つの独立した実験の代表的なものである。
再5 "SRC =" / files/ftp_upload/3623/3623fig5.jpg "/>
図5。 2009年の検出および定量(H1N1)パンデミック(PDM)インフルエンザは、ヒトの患者から隔離します。感染したMDCK細胞株の半分倍滴定のために(A)IR染料ベースの抗体蛍光システムを検出します。蛍光の結果は、アッセイは10 3 TCID 50 / mlでの低ウイルス量を検出する可能性があることを示します。 (B)培養液から抽出した核酸は、CDCのリアルタイムPCRアッセイを12で分析された分離株は既知の力価H1N1のシリアル10倍希釈と一緒に分離します。リアルタイムPCRの検出限界は、10 TCID 50 / mlであった。
ディスカッション
東南アジアにおける鳥インフルエンザと新型インフルエンザのパンデミックの世界的な恐怖の最近の流行の流行は、公衆衛生と安全に多大な懸念を課す。重要な焦点は、インフルエンザウイルスの既存および新しい株のワクチンを生成するのに専念してきました。正確な検出と正確なウイルス力価計算のための迅速なハイスループット技術の可用性は飛躍的に治療を向上させます。ウイルス力価を計算するために最もよく使用される技術は、プラーク形成、インフルエンザ赤血球凝集アッセイが含まれています。プラーク形成アッセイは、最初のバクテリオファージの力価を推定するために開発され、動物のウイルス力価4を計算するためにレナート·ダルベッコで採択された。このアッセイを実行するために、6ウェルプレートでのインフルエンザの在庫や、BAL液などの動物標本の10倍希釈液を調製し、0.1ミリリットルのアリコートを、MDCK細胞の単層に接種されています。ウイルスは、広告に続いてMDCK細胞に吸着する許可されている栄養培地及びアガロースのdition。インキュベーション中に、元の感染した細胞にのみ、隣接するセルに広がるウイルスの子孫を解放します。インフルエンザウイルス感染の細胞変性効果はプラークと呼ばれる感染細胞の円形のゾーンを生成します。各プラークは、おそらくウイルスの複製に続いて、単一のウイルス粒子を持つ単一の細胞の感染後に形成されています。生きている細胞とプラークの間にコントラストがそのようなクリスタルバイオレットなどの色素によって強化することができます。このアッセイの主な欠点は、再現性と実験中で巨大なバリエーションの欠如である。インフルエンザウイルスの力価を決定するために使用される別のアッセイは、赤血球凝集アッセイである。インフルエンザウイルスの表面の赤血球凝集素タンパク質が存在すると、効率的な哺乳類と鳥類の赤血球1のN-アセチルノイラミン酸含有タンパク質に結合する。インフルエンザウイルスと赤血球との間のこの相互作用は、格子状に凝集につながります。リットル凝集のevelは、試験片におけるインフルエンザウイルスの力価を推定するために使用されています。赤血球凝集アッセイは、既知のウイルスの滴定を決定するためにのみ使用され、株の同定を目的として使用することはできません。このアッセイは、ライブや死んだウイルスを区別しませんので、ウイルス力価の正確な計算を得ることが困難である。
インフルエンザ感染症の現在の臨床診断は血清学的検査、ポリメラーゼ連鎖反応、直接試料の免疫と細胞培養1,6に基づいています。ここで説明した新しいメソッドでは、臨床および実験室診断可能性を秘めています。インフルエンザ検出キットディレクインフルエンザ(BD Biosciences社、カリフォルニア州サンノゼ)とBinaxNow(Binax社、スカーバラ、ME)の使用イムノクロマトアッセイのような核タンパク質7のようなウイルス抗原を検出する。これらのキットを使用して、ウイルスの検出は、15分以内に達成することができますが、すべての負のサンプルは、さらにsとする必要があります細胞培養法によりcreened。様々な研究はまた、感染が軽度または8低く、特にこれらのキットの感度が低い、報告されています。提案手法では、我々は一貫してウイルスの100 PFUのように低い検出します。これは感染症が軽度の場合でも、私たちの技術は、臨床サンプル中のH1N1ウイルスを検出するのに有用であることを示唆している。ウイルス抗原を検出する蛍光ベースの方法のいずれか鼻咽頭吸引検体を直接分析したか、ウイルスの増殖とその後の分析の9の感受性細胞の単層に接種したところ、報告されています。しかし、これらの方法は、診断目的のために限られており、ウイルス力価の計算には適していませんされています。 Q-PCRは、ウイルスRNAの存在を識別するのに役立ち、ライブウイルスの感染性を推定することはありません。これらのアッセイに比べて、IR染料ベースのアッセイシステムは、臨床検査試料中に検出し、ウイルス力価の列挙に役立ちます。インフルエンザの流行の場合には、それは、短い期間で数千のサンプルを診断することが重要。 384ウェルプレートおよびIRスキャナに基づいて、提案手法では、したがって、他の直接蛍光法に比べて大きな利点を提供し、時間(> 2000サンプル)で6プレートをスキャンすることができます。臨床サンプルの数千人の迅速な処理の実現可能性は、アッセイ時間とコストの長さを試験のばらつきを減らすことができます。 M2-特異的抗体の使用は、HとN蛋白質の系統差に依存しないという利点を提供しています。 M2蛋白質は、比較的人間に感染するほとんどのインフルエンザ株に保存されている。循環汚れに特異的な抗体は、我々のシステムと組み合わされた場合は、1つは、ウイルスの両方の力価を測定し、ひずみを識別することができます。 M2はアマンタジンのような薬物のターゲットであるため、しかし、変異体は、ここで使用されるモノクローナル抗体の結合部位を変更するかもしれない発生する可能性があります。これは、これらの薬剤によって治療されている個人で、このシステムの潜在的な制限を表しています。
複数アッセイは、試験サンプル中のインフルエンザ抗体価を列挙するために使用されています。ウイルス力価、50%組織培養感染量(TCID 50)と卵の尿膜腔液ベースアッセイが広く使用されている1,10を計算することができます。ただし、複数の日の要件は、これらの方法は信頼性が低くなります。さらに、これらの方法でプラーク数の50%の変化に基づいて計算が正確に理論的ではなくウイルスの滴定を提供しています。アッセイをプラーク形成は、96時間以内に行うことができますが、再現性の欠如は、ウイルスの力価計算の主要な関心事である。ここで説明した本手法は、いくつかの明確な利点を持っています。まず、一貫性のある結果と再現性の高い手法である。第二に、ウイルス力価の計算は、定義された標準曲線と比較される蛍光強度のシンプルな定量化に基づいています。第三に、二つ以上の一次抗体は、与えられたサンプル中の複数の血清型を診断するために使用することができます。また、IR色素標識抗体は、ミニムを持っているら蛍光とは、細胞イメージング11に使用されています。高い量子収率内因性の蛍光物質の存在に起因する高い細胞自家蛍光のUVや視覚的な放射線(300から600 nM)の結果。これらは芳香族アミノ酸、リポ顔料、ピリジンヌクレオチド(NADPH)、エラスチン、コラーゲン、フラビン補酵素が含まれています。細胞のこの本質的なプロパティは、プローブが特定のタンパク質の発現を定量化するとして、それは困難な放射のこれらのソースを利用できるようになります。対照的に、近赤外色素は、励起と670から1000 nmの間放出されます。多くの宿主細胞分子や多環芳香族炭化水素は、この波長で励起すると低光散乱のために、極めて低いバックグラウンド蛍光を放出しない。さらに、背景と特異的検出との間のウィンドウは非常に近赤外蛍光色素の高い消光係数による改善されています。光安、優れた信号対雑音比は、ウイルス力価の定量化に非常に関連があります。 microflの使用uidic室は、ロボットコントロールを介してスクリーニングプロセスを自動化し、私たちは容易に非常に伝染性の臨床サンプルをテストする可能性があります。したがって、これらのメソッドの近赤外色素の利用は、組織サンプル中のウイルス力価を列挙するのに理想的で信頼性の高いです。
開示事項
我々は、開示することは何もありません。
謝辞
この作品は一部NIHの助成金R01 A1064826-01、U19 AI062627-01 NO1-HHSN26600500032C(SMに)でサポートされています。私たちは、原稿の重要なレビューのためにティナ·ハイル、議論と技術的な助けを我々の研究室のメンバーに感謝します。我々は、ウイルス培養とPCRのためにデビッド·ビナ、ミルウォーキー衛生局研究所に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| ウシ血清アルブミン | アトランタバイオ | S11750 | |
| PR8ウイルス | 博士トーマス·M·モランから | ||
| ヤギ抗マウスIRDye @ 800 | LI-COR Biosciences社 | 926から32210 | 1:200希釈 |
| LI-CORオデッセイIRスキャナ | LI-COR-バイオサイエンス | 9201から01 | |
| 384ウェル平底プレート | Nalge Nunc社国際 | 164730 | |
| 96ウェル平底プレート | Nalge Nunc社国際 | 165305 | |
| DMEM培地 | Invitrogen | 11965126 | |
| RPMI培地 | インビトロジェン | 11875135 | |
| 重炭酸ナトリウム | インビトロジェン | 25080 | |
| L-グルタミン100倍 | インビトロジェン | 25030 | |
| Trypson-EDTA | インビトロジェン | R001100 | |
| ピルビン酸ナトリウム | インビトロジェン | 11360070 | |
| 抗M-2抗体 | 博士トーマス·M·モランから | ||
| 抗NPモノクローナル抗体 | CDC | V2S2208 | MTAを用いて得られた |
参考文献
- Hirst, G. K. The agglutination of red cells by allantoic fluid of chick embryos infected with influenza virus. Science. 94, 22-23 (1941).
- Jonsson, N., Gullberg, M., Lindberg, A. M. Real-time polymerase chain reaction as a rapid and efficient alternative to estimation of picornavirus titers by tissue culture infectious dose 50% or plaque forming units. Microbiol. Immunol. 53, 149-154 (2009).
- Kalter, S. S. Hemagglutinating Behavior of Mouse and Egg-adapted Type A (PR8) Influenza Virus. Science. 110, 184-184 (1949).
- Dulbecco, R. Production of Plaques in Monolayer Tissue Cultures by Single Particles of an Animal Virus. Proc. Natl. Acad. Sci. U. S. A. 38, 747-752 (1952).
- Deyde, V. M., Nguyen, T., Bright, R. A., Balish, A., Shu, B., Lindstrom, S., Klimov, A. I., Gubareva, L. V. Detection of molecular markers of antiviral resistance in influenza A (H5N1) viruses using a pyrosequencing method. Antimicrob. Agents Chemother. 53, 1039-1047 (2009).
- Jonsson, N., Gullberg, M., Lindberg, A. M. Real-time polymerase chain reaction as a rapid and efficient alternative to estimation of picornavirus titers by tissue culture infectious dose 50% or plaque forming units. Microbiol. Immunol. 53, 149-154 (2009).
- Rahman, M., Kieke, B. A., Vandermause, M. F., Mitchell, P. D., Greenlee, R. T., Belongia, E. A. Performance of Directigen flu A+B enzyme immunoassay and direct fluorescent assay for detection of influenza infection during the 2004-2005 season. Diagnostic Microbiology and Infectious Disease. 58, 413-418 (2007).
- Landry, M. L., Ferguson, D. Suboptimal detection of influenza virus in adults by the Directigen Flu A+B enzyme immunoassay and correlation of results with the number of antigen-positive cells detected by cytospin immunofluorescence. J. Clin. Microbiol. 41, 3407-3409 (2003).
- Herrmann, B., Larsson, C., Zweygberg, B. W. Simultaneous detection and typing of influenza viruses A and B by a nested reverse transcription-PCR: comparison to virus isolation and antigen detection by immunofluorescence and optical immunoassay (FLU OIA). J. Clin. Microbiol. 39, 134-138 (2001).
- Reed, L. J., Muench, H. A simple method of estimating fifty percent endpoints. Am. J. Epidemiol. 27, 493-497 (1938).
- Doerr, A. Fluorescent proteins: into the infrared. Nat. Meth. 6, 482-483 (2009).
- Shu, B., Wu, K. H., Emery, S., Villanueva, J., Johnson, R., Guthrie, E., Berman, L., Warnes, C., Barnes, N., Klimov, A., Lindstrom, S. Design and performance of the CDC real-time reverse transcriptase PCR swine flu panel for detection of 2009 A (H1N1) pandemic influenza virus. J. Clin. Microbiol. 49, 2614-2619 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved