このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
複雑なサンプル中の特定のタンパク質のグリコシル化の多重化ハイスループットプロファイリングのための化学的にブロックされた抗体マイクロアレイ
要約
本研究では、特定のタンパク質のグリコシル化プロファイリングに使用することができるレクチン検出法による多重化、ハイスループット抗体マイクロアレイのための改良プロトコルを記述します。このプロトコルは、新しい信頼性の高い試薬を備えており、前の手順に比べて大幅に時間、コスト、およびラボ機器の要件を軽減します。
要約
In this study, we describe an effective protocol for use in a multiplexed high-throughput antibody microarray with glycan binding protein detection that allows for the glycosylation profiling of specific proteins. Glycosylation of proteins is the most prevalent post-translational modification found on proteins, and leads diversified modifications of the physical, chemical, and biological properties of proteins. Because the glycosylation machinery is particularly susceptible to disease progression and malignant transformation, aberrant glycosylation has been recognized as early detection biomarkers for cancer and other diseases. However, current methods to study protein glycosylation typically are too complicated or expensive for use in most normal laboratory or clinical settings and a more practical method to study protein glycosylation is needed. The new protocol described in this study makes use of a chemically blocked antibody microarray with glycan-binding protein (GBP) detection and significantly reduces the time, cost, and lab equipment requirements needed to study protein glycosylation. In this method, multiple immobilized glycoprotein-specific antibodies are printed directly onto the microarray slides and the N-glycans on the antibodies are blocked. The blocked, immobilized glycoprotein-specific antibodies are able to capture and isolate glycoproteins from a complex sample that is applied directly onto the microarray slides. Glycan detection then can be performed by the application of biotinylated lectins and other GBPs to the microarray slide, while binding levels can be determined using Dylight 549-Streptavidin. Through the use of an antibody panel and probing with multiple biotinylated lectins, this method allows for an effective glycosylation profile of the different proteins found in a given human or animal sample to be developed.
Introduction
Glycosylation of protein, which is the most ubiquitous post-translational modification on proteins, modifies the physical, chemical, and biological properties of a protein, and plays a fundamental role in various biological processes1-6. Because the glycosylation machinery is particularly susceptible to disease progression and malignant transformation, aberrant glycosylation has been recognized as early detection biomarkers for cancer and other diseases 7-12. In fact, most current cancer biomarkers, such as the L3 fraction of α-1 fetoprotein (AFP) for hepatocellular carcinoma 13-15, and CA199 for pancreatic cancer 16, 17 are all aberrant glycan moieties on glycoproteins. However, methods to study protein glycosylation have been complicated, and not suitable for routine laboratory and clinical settings. Chen et al. has recently invented a chemically blocked antibody microarray with a glycan-binding protein (GBP) detection method for high-throughput and multiplexed profile glycosylation of native glycoproteins in a complex sample 18. In this affinity based microarray method, multiple immobilized glycoprotein-specific antibodies capture and isolate glycoproteins from the complex mixture directly on the microarray slide, and the glycans on each individual captured protein are measured by GBPs. Because all normal antibodies contain N-glycans which could be recognized by most GBPs, the critical step of this method is to chemically block the glycans on the antibodies from binding to GBP. In the procedure, the cis-diol groups of the glycans on the antibodies were first oxidized to aldehyde groups by using NaIO4 in sodium acetate buffer avoiding light. The aldehyde groups were then conjugated to the hydrazide group of a cross-linker, 4-(4-N-MaleimidoPhenyl)butyric acid Hydrazide HCl (MPBH), followed by the conjugation of a dipeptide, Cys-Gly, to the maleimide group of the MPBH. Thus, the cis-diol groups on glycans of antibodies were converted into bulky none hydroxyl groups, which hindered the lectins and other GBPs bindings to the capture antibodies. This blocking procedure makes the GBPs and lectins bind only to the glycans of captured proteins. After this chemically blocking, serum samples were incubated with the antibody microarray, followed by the glycans detection by using different biotinylated lectins and GBPs, and visualized with Cy3-streptavidin. The parallel use of an antibody panel and multiple lectin probing provides discrete glycosylation profiles of multiple proteins in a given sample 18-20. This method has been used successfully in multiple different labs 1, 7, 13, 19-31. However, stability of MPBH and Cys-Gly, complicated and extended procedure in this method affect the reproducibility, effectiveness and efficiency of the method. In this new protocol, we replaced both MPBH and Cys-Gly with one much more stable reagent glutamic acid hydrazide (Glu-hydrazide), which significantly improved the reproducibility of the method, simplified and shorten the whole procedure so that the it can be completed within one working day. In this new protocol, we describe the detailed procedure of the protocol which can be readily adopted by normal labs for routine protein glycosylation study and techniques which are necessary to obtain reproducible and repeatable results.
プロトコル
1。アッセイ用の抗体マイクロアレイを印刷する
- リン酸緩衝生理食塩液、pH7.2(PBS)で0.5 mg / mlにすべての抗体を希釈する。
- 384ウェルソースプレートに各抗体のアリコートを40μl。
- Scienion sciFLEXARRAYERのマイクロアレイ上に384ウェルソースプレートをロードします。
- ターゲットとしてマイクロアレイ上20 PATHマイクロアレイスライドをロードします。
- 27抗体および制御タンパク質が9x9のパターン( 図1E、1F)に三重で発見された48同一のサブアレイを印刷し、マイクロアレイを設定します。
- 抗体マイクロアレイスライドを印刷するためにマイクロアレイを開始します。
- 抗体マイクロアレイスライドを収集し、乾燥したスライドカセットに保存します。真空シーラー(Foodsaver)を使用して、ビニール袋にカセットを密封し、真空。
- 4℃の冷蔵庫に密封されたマイクロアレイスライドを格納します。
2。化学的にGBPを防止するための抗体マイクロアレイをブロック捕捉抗体に結合する
マイクロアレイアッセイ、マイクロアレイスライドを化学的にブロックされて一度起動して、約8時間持続します。一度マイクロアレイアッセイを開始する(ステップ2から8まで)を完了する必要があります。
- マイクロアレイは、冷蔵庫の外にスライドして取り、30分間室温に平衡化させます。
- 0.1%ツイーン(CBT0で15 mM酢酸ナトリウム緩衝液pH 5.0で、ストレージボックスからスライドを削除すると簡単に洗面器を洗浄し、スライドに一回0.1%ツイーン20(PBST0.1)とリン酸緩衝生理食塩水pHは7.2で、それらを洗い流して、シーケンシャル方式で0.1)。スライド洗濯盆地で10分間CBT0.1でスライドをインキュベートします。
- 15mMの酢酸ナトリウム緩衝液5.0(CB)で、新鮮な150mMの過ヨウ素4を準備し、使用する前に光を避けながら、冷蔵庫の中に洗面器を洗浄し、スライドにに保管してください。
- CBからスライドを削除し、抗体側に新鮮な過ヨウ素4を含む流域に入れて上向き。光を避け、穏やかな冷蔵庫で4℃で振とうしながら2時間スライド流域をインキュベートするためにアルミ箔と流域をカバーしています。
- CB中の10mMヒドラジドグルタミン酸(ブロッカー)300 mLを準備します。
- 流域からスライドを削除して、簡単にスライド洗濯盆地で各5分間の時間CBを3回で洗ってください。
- 穏やかに撹拌しながら室温で2時間洗浄流域のブロッカーでスライドをインキュベートします。
- 流域からスライドを削除し、3分間PBST0.1でそれらを洗ってください。
3。ウシ血清アルブミンとマイクロアレイへの非特定のバインディングをブロック(BSA)
- スライド洗濯盆地では0.5%ツイーン(PBST0.5)とリン酸緩衝生理食塩水pH7.2の1%のBSAの300ミリリットルを準備し、穏やかに振とうしながら室温で1時間流域のマイクロアレイスライドをインキュベートします。
- 3分ごとに時間PBST0.1で3回スライドを洗浄します。
- スライドを置くスライドラック、およびマイクロアレイスライドを乾燥させる2分間遠心分離上の1200×gでスピン。
4。各サブアレーを分離するためのマイクロアレイスライド上にプリントワックスグリッド
- 70℃でワックスインプリンタを予熱5分のC。
- ワックスに直面している抗体側とワックスインプリンタにブロックされたマイクロアレイスライドをロードします。穏やかに均等にスライド上にプリントワックスへのハンドルを引き出します。
5。マイクロアレイスライド上に血清サンプルを適用します。
- ステップ2.4の間に、1つのサンプルの糖鎖プロファイリングアッセイ(5.1.1)、または複数のサンプルの間で、単一の糖epiptope測定(5.1.2)のいずれかの血清サンプルを準備します。
- 複数のGbpsを使用して1つの血清サンプル中の複数の血清糖タンパク質の糖鎖測線の実験(サンプル実験1を参照)では、1の血清サンプルは、すべてのサブ配列に適用されます。このケースでは、40μlの血清十分な、0.1%を含むPBS 360μLに希釈されTween-20を、0.1%BRIJ 35、マウスIgG、ラットIgGを100μg/ mLで、ウサギIgGを100μg/ mLと100μg/ mLで、ヤギの100μg/ mLのロバIgGのIgGおよび100μg/ mlの。このボリュームは、それぞれのサブアレイに希釈した血清溶液6μlを適用するために十分である。
- 1 GBP検出(サンプル実験2を参照)を使用することで、複数の血清サンプル間で複数の血清蛋白質の1つの糖鎖測定の実験である。このケースでは、1μlの血清十分な、0.1%Tween-20で、0.1%BRIJ 35、マウスIgG、ラットIgG、ウサギIgGの100μg/ mLと100μg/ mLのは100μg/ mLを含有するPBS中、第9μLに希釈され、ヤギIgG、ロバIgG抗体の100μg/ mLと100μg/ mLで。このボリュームは、それぞれのサブアレイに希釈した血清溶液を6μLを適用するために十分である。
- ステップ4のワックスの押印後、慎重にスライドの各サブアレイに希釈したサンプルまたは対照サンプル6μL(PBST0.1)を適用します。室温で濡れたペーパータオルで加湿カセットでスライドをインキュベート1時間インキュベートした。
- 3分ごとに時間PBST0.1 3回スライドを洗浄します。
- 2分のために1,200 xgでそれを回転させてスライドを乾燥させます。
6。スライド上にビオチン化GBP(レクチンまたは抗糖鎖抗体)を適用
- ステップ2.4の間に、PBST0.1にビオチン化レクチン/ Gbpsの10μg/mlのを準備します。
- 複数のレクチンとそのプローブつのサンプル(サンプル実験1)糖鎖プロファイリング実験では、すべてのサブアレイのために十分であるビオチン化レクチンの350μLを準備します。
- 複数のレクチンを用いて複数のサンプル内の単一の糖鎖エピトープ/バイオマーカーのスクリーニングでは、一方の部分配列で十分です各ビオチン化レクチンの10μlを準備します。
- スライドの各サブアレイに希釈したビオチン化レクチン(s)の6μLを適用し、1時間室温で湿紙タオルで加湿スライドボックスでインキュベートします。
- 各TIは、3分間PBST0.1 3回スライドを洗浄します私を。
- 2分間遠心機で1,200 xgでそれを回転させてスライドを乾燥させます。
7。蛍光検出用色素標識ニュートラビジンを適用します。
- すべてのサブアレイには十分ですDylight 549標識されたニュートラの350μLを準備します。
- 各サブアレイにDylight 549標識されたニュートラの6μLを適用し、1時間室温で加湿スライドカセット内のスライドをインキュベートします。
- 3分ごとに時間PBST0.1 3回スライドを洗浄します。
- 2分間遠心1200×gでそれを回転させてスライドを乾燥させます。
8。スライドをスキャンすることによって、マイクロアレイスライドのイメージを取得する
- 10μmの分解能での蛍光マイクロアレイスキャナーを用いてスライドをスキャンします。レーザーとPMTの設定が可能な限り強力なはずですが、全くの飽和点が観察されていません。
9。データの抽出と分析
- ArrayPro 3.2で画像を開きます。
- 抗体スポットの位置を示しています。配列マップに従って配列のテンプレートを設定します。慎重に画像内の対応する場所に、各テンプレートの円の位置を合わせます。
- さらに分析するためのExcelファイルに各スポットの強度を抽出します。
10。代表的な結果
サンプルの実験1
複数のレクチンの検出と化学的にブロックされた抗体マイクロアレイを用いた肝細胞癌患者血清サンプル中の複数の血清糖タンパク質の糖鎖プロファイリング。
この実験の目的は、レクチンの検出と化学的にブロックされた抗体マイクロアレイを用いて肝細胞癌(HCC)患者の血清サンプル20糖タンパク質の個々の糖鎖プロファイルを探ることである。 Sで説明したように26抗体およびビオチン-BSAを含む48同一の部分配列を含む抗体マイクロアレイは、設計·製造されました1 TEP。これら26の抗体は、 表1に示すように、質量分析、タンパク質の同定12、32と組み合わせてレクチンベースの免疫沈降を用いてHCC患者の早期診断値を有望として識別20血清糖タンパク質に反対した。代表的な一サブアレイに三重に印刷された抗体のスポットパターンと配置は、それぞれ、 図1E及び1Fに示されています。他のいずれかが( 図1B)、分析化学的にブロッキング手順の重要性を実証するために、同じ糖鎖プロファイリング実験を行うために使用されたされたときに2つの同一のマイクロアレイスライドを、1は、化学的に、( 図1A)ブロックされませんでした。化学的にブロックされたスライド( 図1B)では、実験では、ステップ2で開始し、どれも化学的にブロックされたスライド( 図1A)は、実験では、ステップ3からスタートしました。実験はfollowinによって運ばれましたグラムステップ5.1.2と6.1.2を除き、プロトコルに記載されたすべての手順を実行します。ステップ5.2では、PBST0.1対照試料は、カラム1と3の部分配列に適用され、プールされたHCCの血清サンプルは( 図1Gに示すように)列それぞれ2と4、のサブアレイに塗布した。この比較は、化学的に遮断した後に有効性、手続きの効率化だけでなく、抗体の抗原結合親和性を示すことです。グリコシル化のプロファイリングについては、 図1Gに示すように、別の糖鎖18、20に固有の各サブアレイに適用されたことを22ビオチン化レクチン(表1に示すように)。プロトコルに従うことにより、糖鎖プロファイリングアッセイの後に化学的にブロックされた( 図1B)および非化学的にブロックされた( 図1A)マイクロアレイの画像。のような非化学的にブロックされたマイクロアレイ( 図1Aおよび図1C)、列1と3の部分配列で示されているのみPBST0.1は、抗体を取得するためにバインドされているほとんどのレクチンを適用し、血清試料が適用された、これらの列2のサブアレイおよび4に匹敵することが非常に高いバックグラウンドを示した。これはマイクロアレイスライドから糖鎖プロファイル情報を取得することは不可能です。逆に、同じ実験を化学的にブロックされた抗体マイクロアレイスライド上で行われたときに、1列目だけPBST0.1が適用された3の部分配列は、ほとんどのレクチンは、抗体を捕捉するには、noまたは非常に低いバインディングを示さなかった。一方、高い抗原バインディングはまだ血清試料( 図1B及び1D)が適用された、2列目と4にサブアレイで観察された。これらの結果は、化学的にブロッキング手順は、抗体に捕捉された糖タンパク質の糖鎖の測定は前面の重要なステップであることを示した。プロトコルに従うことによって、肝細胞癌血清中の22糖タンパク質の糖鎖プロファイルを得ることができます。
実験2
変更されたfucos用画面差別肝硬変と肝細胞癌患者に対するバイオマーカーとして特定の血清糖タンパク質上にylation。
この実験の目標は、肝硬変と肝細胞癌(HCC)患者を識別するバイオマーカーとしての特異的血清糖タンパク質の変化したフコシル化のために画面になります。このアッセイで唯一の血清サンプルはすべてのサブアレイに塗布し、様々なレクチンをプローブとした実験1、、、HCCと肝硬変患者から合計40種類の血清サンプルとは異なる、それぞれのサブアレイ上に塗布し、1レクチン(AALでプローブした。)そのようなTテスト、受信者動作特性(ROC)曲線、などの統計分析は、ディストリビューションまたはすべての血清サンプル中の個々のタンパク質の糖鎖epiptope /バイオマーカーの診断性能を評価するために行われました。我々は、この研究では抗CA19-9と抗シアリルルイスX抗体を除いて実験1で製造された同じ抗体マイクロアレイを使用していました。 experimentは、5.1.1と6.1.1ステップ以外のステップ9に9月2日から実施されました。合計20肝硬変から40の血清サンプルと20のHCC患者は、陰性コントロールとしてPBSをサンプルと一緒に48サブアレイのランダムな部分配列で適用された。各捕捉されたタンパク質のフコシル化は、その後、ビオチン化フコース特異的レクチンを用いて検出した。 図1に示されているマイクロアレイの画像は、代わりにキャプチャされた抗体のマイクロアレイ( 図2D)(図2E)でキャプチャされた血清タンパク質に結合したレクチンAALを示した。全てのスポットのAAL結合強度は、次に抽出し、HCCと肝硬変群との間差別の各血清タンパク質のフコシル化(AAL結合強度)の性能を評価するためにTテストとROC曲線を用いて分析した。結果は、GP73タンパク質のフコシル化= 0.03および pを持つ2つのグループ間で最高の差別を与えたことが明らかになったエリアで、ROC曲線の曲線は0.72に等しい。この実験では、この手順を示した複数のタンパク質内の複数のサンプルの糖鎖エピトープ/バイオマーカーのスクリーニングのための迅速、効率的な方法です。
| ID | 試薬の名前 | 略語 | 会社 | カタログ# |
| L1 | ビオチン化コンカナバリン | ConAを | ベクターラボラトリーズ | BK-1000 |
| L2 | ビオチン化したニワトコニグラレクチン | SNA | ベクターラボラトリーズ | B-1305 |
| L3 | ビオチン化したレンズマメレクチン | LCA | ベクターラボラトリーズ | BK-2000 |
| L4 | ビオチンヒマ凝集素I | RCA | ベクターラボラトリーズ | BK-1000 |
| L5 | ビオチン化したヒイロチャワンタケレクチン | AAL | ベクターラボラトリーズ | B-1395 |
| L6 | ビオチン化エリスリナ属Cristagalliレクチン | ECL | ベクターラボラトリーズ | BK-3000 |
| L7 | ビオチン化Griffonia(Bandeiraea)SimplicifoliaレクチンII | GSL II | ベクターラボラトリーズ | BK-3000 |
| L8 | ビオチン化した小麦胚芽凝集素 | WGA | ベクターラボラトリーズ | BK-1000 |
| L9 | ビオチン化したインゲンマメのErythroagglutinin | PHA-E | ベクターラボラトリーズ | BK-2000 |
| L10 | ビオチン化したインゲンマメのLeucoagglutinin | PHA-L | ベクターラボラトリーズ | BK-2000 |
| L11 | バイオtinylatedピーナッツ凝集素 | PNA | ベクターラボラトリーズ | BK-1000 |
| L12 | ビオチン化エンドウレクチン | PSA | ベクターラボラトリーズ | BK-2000 |
| L13 | ビオチン化Dolichos Biflorus凝集 | DBA | ベクターラボラトリーズ | BK-1000 |
| L14 | ビオチン化したチョウセン朝顔のレクチン | DSL | ベクターラボラトリーズ | BK-3000 |
| L15 | ビオチン化槐ジャポニカ凝集 | SJA | ベクターラボラトリーズ | BK-2000 |
| L16 | ビオチン化ダイズ凝集素 | SBA | ベクターラボラトリーズ | BK-1000 |
| L17 | ビオチン化したジャガイモ(ジャガイモ)レクチン | STL | ベクターラボラトリーズ | BK-3000 |
| L18 | ビオチン化Griffonia(Bandeiraea)SimplicifoliaレクチンI | GSL I | ベクターラボラトリーズ | BK-2000 |
| L19 | ビオチン化したソラマメVillosaレクチン | VVL | ベクターラボラトリーズ | BK-2000 |
| L20 | ビオチン標識トマトソバ(トマト)レクチン | LEL | ベクターラボラトリーズ | BK-3000 |
| L21 | ビオチン化Ulex Europaeus凝集素I | UEA I | ベクターラボラトリーズ | BK-1000 |
| L22 | ビオチン化ジャカリン | ジャカリン | ベクターラボラトリーズ | BK-3000 |
| A1 | ヤギF(ab ')2フラグメント抗ヒトIgM、Fc5μ抗体 | IgM抗体 | ジャクソンイムノリサーチ | 109-006-129 |
| A2 | ロバのF(ab ')2フラグメント抗ヒトIgG(H + L)抗体 | AB1 | ジャクソンイムノリサーチ | 709-006-149 |
| A3 | マウス抗ヒトIgG F(ab ')2のモノクローナル抗体 | AB3 | ジャクソンイムノリサーチ | 209-005-097 |
| A4 | ヤギ抗ヒトα2マクログロブリンポリクローナル抗体 | A2M | GeneTex | GTX62924 |
| A5 | ウサギ抗ヒトα-1アンチトリプシンポリクローナル抗体 | A1AT | リーBiosiences | CA1T-80A |
| A6 | マウス抗ヒトα-1アンチトリプシンモノクローナル抗体 | A1AT | シグマアルドリッチ | SAB4200198 |
| A7 | ウサギ抗ヒトα-1アンチトリプシンポリクローナル抗体 | ACT | NeoMarkers | RB-367-A1 |
| A8 | ウサギ抗ヒトα-1-アンティークhymotrypsinポリクローナル抗体 | ACT | フィッシャー·サイエンティフィック | RB9213R7 |
| A9 | マウス抗ヒトトランスフェリンモノクローナル抗体 | トランスフェリン | GeneTex | GTX101035 |
| A10 | ウサギ抗ヒトトランスフェリンポリクローナル抗体 | トランスフェリン | GeneTex | GTX77130 |
| A11 | ヤギ抗ヒトアポリポタンパク質Jポリクローナル抗体 | ApoJ | アブカム | ab7610 |
| A12 | マウス抗ヒトGP73モノクローナル抗体 | GP73 | アボット | 14H4-23 |
| A13 | マウス抗ヒトGP73モノクローナル抗体 | GP73 | SANTA CRUZ BIOTECHNOLOGY INC | SC-101275 |
| A14 | ウサギ抗ヒトα-1フェトプロテインポリクローナル抗体 | AFP | GenWay | GWB-41C966 |
| A15 | マウス抗ヒトα-1フェトプロテインモノクローナル抗体 | AFP | フィッツジェラルド | 10-A05A |
| A16 | マウス抗ヒトヘモペキシンモノクローナル抗体 | ヘモペキシン | Assaypro | 60190から05011 |
| A17 | マウス抗ヒトグリピカン3(1G12)モノクローナル抗体 | GPL3 | サンタクルスバイオ | SC-65443 |
| A18 | マウス抗ヒトキニノゲン(LMW)モノクローナル抗体 | キニノゲン | Assaypro | 20333から05011 |
| A19 | ウサギ抗ヒトMMP-21モノクローナル抗体 | MMP21 | Epitomic | 1955から1 |
| A20 | マウス抗ヒトCEACAM-1モノクローナル抗体 | CEACAM | R&Dシステムズ | MAB1180 |
| A21 | ラット抗ヒトDPPIV/CD26モノクローナル抗体 | DPPIV | R&Dシステムズ | MAB22441 |
| A22 | マウス抗ヒトPIVKA IIモノクローナル抗体 | PIVICA | 結晶化学 | 8040 |
| A23 | マウス抗癌胎児性抗原 | CEA | 米国の生物学 | C1300 |
| A24 | マウス抗CA125癌抗原 | CA125 | 米国の生物学 | C0050-01D |
| A25 | マウス抗CA19-9がん抗原 | CA19-9 | 米国の生物学 | C0075-18 |
| A26 | マウス抗ルイスxモノクローナル抗体 | ルイスX | カルビオケム | 434631 |
| バイオ | ビオチン化BSA(ポジティブコントロール) | バイオ | ホームメイド | N / A |
このプロトコルで使用されているレクチンと抗体の表1のリスト。
| 試薬/ sの機器の名前 | 会社 | カタログ番号 |
| 非接触マイクロアレイ | BioDot株式会社 | sciFLEXARRAYER |
| 384マイクロプレート | フィッシャー | 14-230-243 |
| FoodSaver | FoodSaver | V3835 |
| 極薄のニトロセルロースcoateマイクロアレイスライド | Gentel | パス |
| スライドインプリンタ(オプション) | ゲルカンパニー | WSP60-1 |
| シェーカー | フィッシャー | 15-453-211 |
| 遠心分離 | エッペンドルフ | 5804 000.013 |
| 盆地/スライド染色ディッシュwiを洗濯スライド番目のリムーバブルラック | フィッシャー | 08から812 |
| スライドインキュベーションチャンバー/顕微鏡スライドボックス | フィッシャー | 03-448-5 |
| BRIJ 35、水に30 w / v%の溶液を | アクロスオーガニック | AC32958-0025 |
| Tween-20を | フィッシャー | P337-100 |
| 過ヨウ素酸ナトリウム(過ヨウ素4) | シグマ | 311448 |
| L-グルタミン酸γ-ヒドラジド | シグマ | G-7257 |
| 酢酸ナトリウム、無水(CH 3 COONa) | シグマ | S2889 |
| ウシ血清アルブミン(BSA) | Lampire生物学研究所 | 7500804 |
| リン酸緩衝生理食塩水(PBS)(10X) | デンヴィル科学 | CP4390-48 |
| Dylight 549コンジュゲートニュートラ | サーモ | 22837 |
| プロテアーゼインヒビターカクテル錠 | ロシュ社 | 4693159001 |
| ChromPureヒトIgG、Fcフラグメント | ジャクソンイムノ | 009-000-008 |
| ChromPureヒトIgG、分子全体 | ジャクソンイムノ | 009-000-003 |
| ChromPureマウスIgG、分子全体 | ジャクソンイムノ | 015-000-003 |
| ChromPureマウスIgG、Fcフラグメント | ジャクソンイムノ | 015-000-008 |
| ChromPureウサギIgG、分子全体 | ジャクソンイムノ | 011-000-003 |
| ChromPureロバIgG抗体、分子全体 | ジャクソンイムノ | 017-000-003 |
| マイクロアレイスキャナ | テカン | LSリローデッド |
表2。リストこのプロトコルで使用する器具や試薬の。
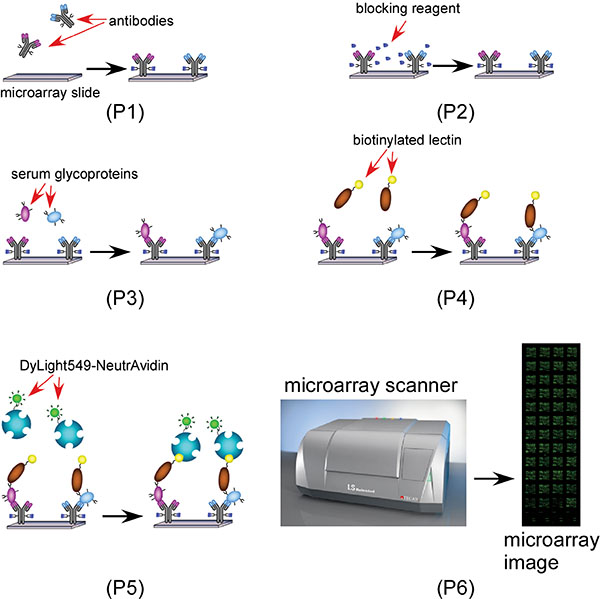
スキームレクチン抗体マイクロアレイベースの糖鎖バイオマーカー探索のプロセスを示す1スキーム1(ステップ2から4):ブロッカー(GLU-ヒドラジド)とBSAと抗体マイクロアレイをブロックする。2(ステップ5):血清サンプルを適用して、キャプチャ特異的な抗体を持つ特定の糖タンパク質で、3(ステップ6):;:プローブマイクロアレイイメージングのためのDylight 549標識されたニュートラビジンとビオチン化AAL 4(ステップ7)、ビオチン化レクチン(s)を適用します。
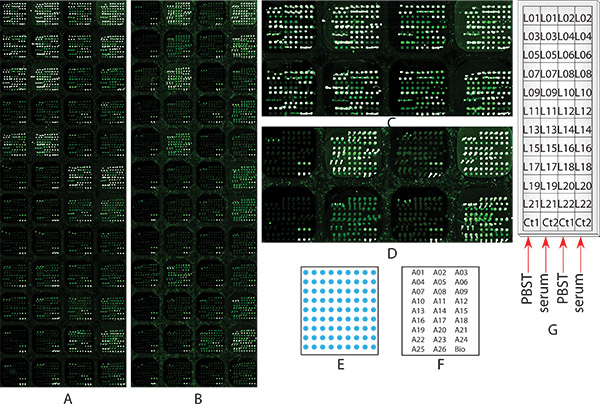
chemicによるHCC患者の血清サンプル中の複数の血清糖タンパク質のサンプル実験1グリコシル化プロファイリングの図1マイクロアレイ画像同盟国は、複数のレクチンの検出と抗体マイクロアレイをブロックされています。二つの同一マイクロアレイスライドは、(A)はいずれも化学的にブロックされない、または(B)化学的にブロックされたように、ステップ2で説明したように、両方のすべての糖鎖プロファイリングのための2から9までの手順と同様に、比較の目的を通り抜けた。 (A)と(B)マイクロアレイの画像は10ミクロンの分解能でステップ8でスキャンされます。 (C)なし、化学的にブロックされたマイクロアレイスライド()の最初の2行の画像のズーム、非化学的にブロックされたマイクロアレイスライド(B)の最初の2行のイメージで(D)ズーム)、(E)各サブアレイ内抗体配列の図、(F)配列マップ:サブ配列内の各抗体の位置、各抗体名は、3スポットを表します。(G)の血清サンプルおよびレクチン場所:各血清サンプルを部分配列図に示すとレクチンは、塗布した。

図2。マイクロアレイ画像肝硬変とHCC患者を識別することがバイオマーカーとしての特異的血清糖タンパク質の変化したフコシル化のためのサンプル実験2画面が表示されます。サンプル実験2セクションで説明したようにマイクロアレイアッセイを行った。 (A)ステップ8からマイクロアレイスライドのスライド全体のイメージは、各サブアレイ内抗体配列の(B)図(C)配列マップ:サブ配列内の各抗体の位置、各抗体名は、3スポットを表します。 (D)血清試料とインキュベートした部分配列のズームの画像、PBS対照とインキュベートした部分配列の(E)ズームの画像。
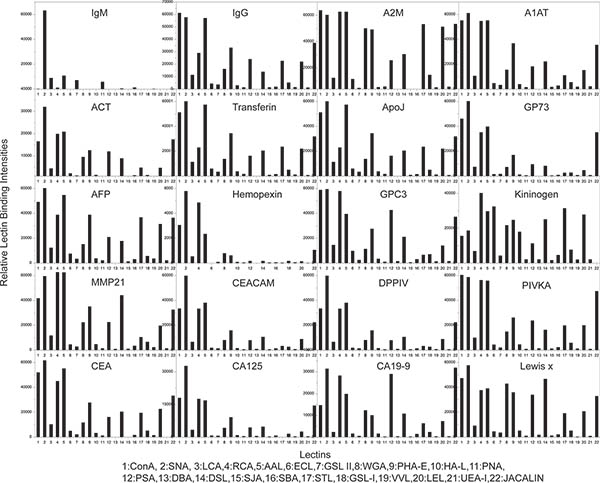
図3試料実験1からの糖鎖プロファイリングの結果。各棒グラフは、20テストされたタンパク質の1つのレクチン結合プロファイル(または糖鎖プロファイル)を表します。合計22種類のレクチンは目を分析するために使用されたそれぞれのタンパク質の電子グリカンのプロファイル。
ディスカッション
1。標的タンパク質と捕捉抗体の選択
抗体マイクロアレイアッセイに先立って、いくつかの試薬及び材料を考慮するために必要と用意されています。糖鎖プロファイリングや糖鎖バイオマーカーのスクリーニングのための抗体マイクロアレイを設計するには、糖タンパク質の候補に特異的な抗体のパネルは、文献に従って、または、以前の結果から応じて決定されるべきで?...
開示事項
著者らは、開示することは何もありません。
謝辞
この作品は、肝炎やウイルス研究所によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments | |
| ID | 試薬の名前 | 略語 | 会社 | カタログ# |
| L1 | ビオチン化コンカナバリン | ConAを | ベクターラボラトリーズ | BK-1000 |
| L2 | ビオチン化したニワトコニグラレクチン | SNA | ベクターラボラトリーズ | B-1305 |
| L3 | ビオチン化したレンズマメレクチン | LCA | ベクターラボラトリーズ | BK-2000 |
| L4 | ビオチンヒマ凝集素I | RCA | ベクターラボラトリーズ | BK-1000 |
| L5 | ビオチン化したヒイロチャワンタケレクチン | AAL | ベクターラボラトリーズ | B-1395 |
| L6 | ビオチン化エリスリナ属Cristagalliレクチン | ECL | ベクターラボラトリーズ | BK-3000 |
| L7 | ビオチン化Griffonia(Bandeiraea)SimplicifoliaレクチンII | GSL II | ベクターラボラトリーズ | BK-3000 |
| L8 | ビオチン化した小麦胚芽凝集素 | WGA | ベクターラボラトリーズ | BK-1000 |
| L9 | ビオチン化したインゲンマメのErythroagglutinin | PHA-E | ベクターラボラトリーズ | BK-2000 |
| L10 | ビオチン化したインゲンマメのLeucoagglutinin | PHA-L | ベクターラボラトリーズ | BK-2000 |
| L11 | ビオチン化ピーナッツ凝集素 | PNA | ベクターラボラトリーズ | BK-1000 |
| L12 | ビオチン化エンドウレクチン | PSA | ベクターラボラトリーズ | BK-2000 |
| L13 | ビオチン化Dolichos Biflorus凝集 | DBA | ベクターラボラトリーズ | BK-1000 |
| L14 | ビオチン化したチョウセン朝顔のレクチン | DSL | ベクターラボラトリーズ | BK-3000 |
| L15 | ビオチン化槐ジャポニカ凝集 | SJA | ベクターラボラトリーズ | BK-2000 |
| L16 | ビオチン化ダイズ凝集素 | SBA | ベクターラボラトリーズ | BK-1000 |
| L17 | ビオチン化したジャガイモ(ジャガイモ)レクチン | STL | ベクターラボラトリーズ | BK-3000 |
| L18 | ビオチン化Griffonia(バンドeiraea)SimplicifoliaレクチンI | GSL I | ベクターラボラトリーズ | BK-2000 |
| L19 | ビオチン化したソラマメVillosaレクチン | VVL | ベクターラボラトリーズ | BK-2000 |
| L20 | ビオチン標識トマトソバ(トマト)レクチン | LEL | ベクターラボラトリーズ | BK-3000 |
| L21 | ビオチン化Ulex Europaeus凝集素I | UEA I | ベクターラボラトリーズ | BK-1000 |
| L22 | ビオチン化ジャカリン | ジャカリン | ベクターラボラトリーズ | BK-3000 |
| A1 | ヤギF(ab ')2フラグメント抗ヒトIgM、Fc5μ抗体 | IgM抗体 | ジャクソンイムノリサーチ | 109-006-129 |
| A2 | ロバのF(ab ')2フラグメント抗ヒトIgG(H + L)tibody | AB1 | ジャクソンイムノリサーチ | 709-006-149 |
| A3 | マウス抗ヒトIgG F(ab ')2のモノクローナル抗体 | AB3 | ジャクソンイムノリサーチ | 209-005-097 |
| A4 | ヤギ抗ヒトα2マクログロブリンポリクローナル抗体 | A2M | GeneTex | GTX62924 |
| A5 | ウサギ抗ヒトα-1アンチトリプシンポリクローナル抗体 | A1AT | リーBiosiences | CA1T-80A |
| A6 | マウス抗ヒトα-1アンチトリプシンモノクローナル抗体 | A1AT | シグマアルドリッチ | SAB4200198 |
| A7 | ウサギ抗ヒトα-1アンチトリプシンポリクローナル抗体 | ACT | NeoMarkers | RB-367-A1 |
| A8 | ウサギ抗ヒトα-1-アンチキモトリプシンポリクローナル抗体 | ACT | フィッシャー·サイエンティフィック | RB9213R7 |
| A9 | マウス抗ヒトトランスフェリンモノクローナル抗体 | トランスフェリン | GeneTex | GTX101035 |
| A10 | ウサギ抗ヒトトランスフェリンポリクローナル抗体 | トランスフェリン | GeneTex | GTX77130 |
| A11 | ヤギ抗ヒトアポリポタンパク質Jポリクローナル抗体 | ApoJ | アブカム | ab7610 |
| A12 | マウス抗ヒトGP73モノクローナル抗体 | GP73 | アボット | 14H4-23 |
| A13 | マウス抗ヒトGP73モノクローナル抗体 | GP73 | SANTA CRUZ BIOTECHNOLOGY INC | SC-101275 |
| A14 | ウサギ抗ヒトα-1 fetoproteinポリクローナル抗体 | AFP | 建屋 | GWB-41C966 |
| A15 | マウス抗ヒトα-1フェトプロテインモノクローナル抗体 | AFP | フィッツジェラルド | 10-A05A |
| A16 | マウス抗ヒトヘモペキシンモノクローナル抗体 | ヘモペキシン | Assaypro | 60190から05011 |
| A17 | マウス抗ヒトグリピカン3(1G12)モノクローナル抗体 | GPL3 | サンタクルスバイオ | SC-65443 |
| A18 | マウス抗ヒトキニノゲン(LMW)モノクローナル抗体 | キニノゲン | Assaypro | 20333から05011 |
| A19 | ウサギ抗ヒトMMP-21モノクローナル抗体 | MMP21 | Epitomic | 1955から1 |
| A20 | マウス抗ヒトCEACAM-1モノクローナル不格好なやつY | CEACAM | R&Dシステムズ | MAB1180 |
| A21 | ラット抗ヒトDPPIV/CD26モノクローナル抗体 | DPPIV | R&Dシステムズ | MAB22441 |
| A22 | マウス抗ヒトPIVKA IIモノクローナル抗体 | PIVICA | 結晶化学 | 8040 |
| A23 | マウス抗癌胎児性抗原 | CEA | 米国の生物学 | C1300 |
| A24 | マウス抗CA125癌抗原 | CA125 | 米国の生物学 | C0050-01D |
| A25 | マウス抗CA19-9がん抗原 | CA19-9 | 米国の生物学 | C0075-18 |
| A26 | マウス抗ルイスxモノクローナル抗体 | ルイスX | カルビオケム | 434631 |
| バイオ | ビオチン化BSA(ポジティブコントロール) | バイオ | ホームメイド | N / A |
このプロトコルで使用されているレクチンと抗体の表1のリスト。
| 試薬/ sの機器の名前 | 会社 | カタログ番号 |
| 非接触マイクロアレイ | BioDot株式会社 | sciFLEXARRAYER |
| 384マイクロプレート | フィッシャー | 14-230-243 |
| FoodSaver | FoodSaver | V3835 |
| 極薄のニトロセルロースcoateマイクロアレイスライド | Gentel | パス |
| スライドインプリンタ(オプション) | ゲルカンパニー | WSP60-1 |
| シェーカー | フィッシャー | 15-453-211 |
| 遠心分離 | エッペンドルフ | 5804 000.013 |
| リムーバブルラックスライド洗面/スライド染色皿 | フィッシャー | 08から812 |
| スライドインキュベーションチャンバー/顕微鏡スライドボックス | フィッシャー | 03-448-5 |
| BRIJ 35、水に30 w / v%の溶液を | アクロスオーガニック | AC32958-0025 |
| Tween-20を | フィッシャー | P337-100 |
| 過ヨウ素酸ナトリウム(過ヨウ素4) | シグマ | 311448 |
| L-グルタミン酸γ-ヒドラジド | シグマ | G-7257 |
| 酢酸ナトリウム、無水(CH 3 COONa) | シグマ | S2889 |
| ウシ血清アルブミン(BSA) | Lampire生物学研究所 | 7500804 |
| リン酸緩衝生理食塩水(PBS)(10X) | デンヴィル科学 | CP4390-48 |
| Dylight 549コンジュゲートニュートラ | サーモ | 22837 |
| プロテアーゼインヒビターカクテル錠 | ロシュ社 | 4693159001 |
| ChromPureヒトIgG、Fcフラグメント | ジャクソンイムノ | 009-000-008 |
| ChromPureヒトIgG、分子全体 | ジャクソンイムノ | 009-000-003 |
| ChromPureマウスIgG、分子全体 | ジャクソンイムノ | 015-000-003 |
| ChromPureマウスIgG、Fcフラグメント | ジャクソンイムノ | 015-000-008 |
| ChromPureウサギIgG、分子全体 | ジャクソンイムノ | 011-000-003 |
| ChromPureロバIgG抗体、分子全体 | ジャクソンイムノ | 017-000-003 |
| マイクロアレイスキャナ | テカン | LSリローデッド |
このプロトコルで使用する器具や試薬の表2のリスト。
参考文献
- Fang, M. The ER UDPase ENTPD5 promotes protein N-glycosylation, the Warburg effect, and proliferation in the PTEN pathway. Cell. 143, 711-724 (2010).
- Marino, K., Bones, J., Kattla, J. J., Rudd, P. M. A systematic approach to protein glycosylation analysis: a path through the maze. Nat. Chem. Biol. 6, 713-723 (2010).
- Shental-Bechor, D., Levy, Y. Effect of glycosylation on protein folding: a close look at thermodynamic stabilization. Proc. Natl. Acad. Sci. U. S. A. 105, 8256-8261 (2008).
- Hossler, P., Khattak, S. F., Li, Z. J. Optimal and consistent protein glycosylation in mammalian cell culture. Glycobiology. 19, 936-949 (2009).
- Nothaft, H., Szymanski, C. M. Protein glycosylation in bacteria: sweeter than ever. Nat. Rev. Microbiol. 8, 765-778 (2011).
- Sola, R. J., Griebenow, K. Effects of glycosylation on the stability of protein pharmaceuticals. J. Pharm. Sci. 98, 1223-1245 (2009).
- Li, C., Lubman, D. M. Analysis of serum protein glycosylation with antibody-lectin microarray for high-throughput biomarker screening. Methods Mol. Biol. 723, 15-28 (2011).
- Dwek, M. V., Jenks, A., Leathem, A. J. A sensitive assay to measure biomarker glycosylation demonstrates increased fucosylation of prostate specific antigen (PSA) in patients with prostate cancer compared with benign prostatic hyperplasia. Clin. Chim. Acta. 411, 1935-1939 (2010).
- Drake, P. M. Sweetening the pot: adding glycosylation to the biomarker discovery equation. Clin. Chem. 56, 223-236 (2010).
- Kim, Y. -. P., Park, S., Oh, E., Oh, Y. -. H., Kim, H. -. S. On-chip detection of protein glycosylation based on energy transfer between nanoparticles. Biosensors & Bioelectronics. 24, 1189-1194 (2009).
- Boland, M., Rudd, P. M. Disease related glycosylation changes and biomarker discovery: challenges and possibilities in an emerging field. Editorial. Dis. Markers. 25, 189-192 (2008).
- Norton, P. A. N-linked glycosylation of the liver cancer biomarker GP73. J. Cell Biochem. 104, 136-149 (2008).
- Nakagawa, T. Glycomic analysis of alpha-fetoprotein L3 in hepatoma cell lines and hepatocellular carcinoma patients. J. Proteome Res. 7, 2222-2233 (2008).
- Durazo, F. A. Des-gamma-carboxyprothrombin, alpha-fetoprotein and AFP-L3 in patients with chronic hepatitis, cirrhosis and hepatocellular carcinoma. J. Gastroenterol Hepatol. 23, 1541-1548 (2008).
- Kobayashi, M. Fucosylated fraction of alpha-fetoprotein, L3, as a useful prognostic factor in patients with hepatocellular carcinoma with special reference to low concentrations of serum alpha-fetoprotein. Hepatol. Res. 37, 914-922 (2007).
- Maisey, N. R. CA19-9 as a prognostic factor in inoperable pancreatic cancer: the implication for clinical trials. Br. J. Cancer. 93, 740-743 (2005).
- Talar-Wojnarowska, R. Clinical value of serum neopterin, tissue polypeptide-specific antigen and CA19-9 levels in differential diagnosis between pancreatic cancer and chronic pancreatitis. Pancreatology. 10, 689-694 (2010).
- Chen, S. Multiplexed analysis of glycan variation on native proteins captured by antibody microarrays. Nat. Methods. 4, 437-444 (2007).
- Shao, C. Antibody microarray analysis of serum glycans in esophageal spuamous cell carcinoma cases and controls. Proteomics Clinical Applications. 3, 923-931 (2009).
- Chen, S., Haab, B. B. Analysis of glycans on serum proteins using antibody microarrays. Methods Mol. Biol. 520, 39-58 (2009).
- Yue, T. The Prevalence and Nature of Glycan Alterations on Specific Proteins in Pancreatic Cancer Patients Revealed Using Antibody-Lectin Sandwich Arrays. Molecular & Cellular Proteomics. 8, 1697-1707 (2009).
- Wolf-Yadlin, A., Sevecka, M., MacBeath, G. Dissecting protein function and signaling using protein microarrays. Current Opinion in Chemical Biology. 13, 398-405 (2009).
- Richard, E. Proteomics as Applied to Inherited Metabolic Diseases. Current Proteomics. 6, 140-153 (2009).
- Nolen, B., Winans, M., Marrangoni, A., Lokshin, A. Aberrant tumor-associated antigen autoantibody profiles in healthy controls detected by multiplex bead-based immunoassay. Journal of Immunological Methods. 344, 116-120 (2009).
- Kuno, A. Focused Differential Glycan Analysis with the Platform Antibody-assisted Lectin Profiling for Glycan-related Biomarker Verification. Molecular & Cellular Proteomics. 8, 99-108 (2009).
- Hsu, K. -. L., Mahal, L. K. Sweet tasting chips: microarray-based analysis of glycans. Current Opinion in Chemical Biology. 13, 427-432 (2009).
- Borrebaeck, C. A. K., Wingren, C. High-throughput proteomics using antibody microarrays: an update. Expert Review of Molecular Diagnostics. 7, 673-686 (2007).
- Sanchez-Carbayo, M. Antibody array-based technologies for cancer protein profiling and functional proteomic analyses using serum and tissue specimens. Tumor Biology. 31, 103-112 (2010).
- Porter, A. A motif-based analysis of glycan array data to determine the specificities of glycan-binding proteins. Glycobiology. 20, 369-380 (2010).
- Maupin, K. A. Glycogene Expression Alterations Associated with Pancreatic Cancer Epithelial-Mesenchymal Transition in Complementary Model Systems. Plos One. 5, (2010).
- Sevecka, M., Wolf-Yadlin, A., MacBeath, G. Lysate Microarrays Enable High-throughput, Quantitative Investigations of Cellular Signaling. Molecular & Cellular Proteomics. 10, (2011).
- Wang, M. Novel fucosylated biomarkers for the early detection of hepatocellular carcinoma. Cancer Epidemiol. Biomarkers Prev. 18, 1914-1921 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved