このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ASCの分化を制御するための二層ゲルをエンジニアリング
要約
このプロトコルは、その周囲の細胞外マトリックスからヒントを得るために、複数の表現型に分化するよう誘導される幹細胞の固有の能力を活用に焦点を当てています。このメソッドの原稿は、同時に脂肪由来幹細胞を共区別するために、PEG-フィブリンおよびコラーゲンから成る二層ハイドロゲルを利用したモデルでは、我々の説明とその特性を拡張する 1。
要約
年間の天然高分子ため、そのホストの生体適合性、in vitro および in vivo での細胞と相互作用する能力のより重要性を得ています。再生医療の約束を保持している研究分野は、新規の生体材料と幹細胞の組合せを使用することです。組織工学の分野における基本戦略は、細胞機能を指示するための三次元足場(例えば、細胞外マトリックス、ヒドロゲル、マイクロ/ナノ粒子を脱細胞)の使用です。この技術は、細胞は、彼らが付着し、増殖し、それらの分化した細胞の表現型と機能2-3を表現できる上に基板が必要であることを発見から進化してきました。最近では、それはまた、細胞が付着するため、これらの基質を使用していますが、また相互作用し、マトリクス基板(例えば、細胞外マトリクス、ECM)4から手がかりを取るだけでなく、ことが決定されている。したがって、細胞と足場は、その相互接続を使用している組織開発、組織、および究極の機能を制御するのに役立ちます。脂肪由来幹細胞(ASCS)マルチ系統分化を示し、細胞の容易に利用可能なソース(すなわち、プレ血管内皮および周皮細胞)として機能することができ、脂肪組織内に存在する間葉系、非造血幹細胞である。我々の仮説は、脂肪由来幹細胞は、二層のマトリックス1で単に共存培養することにより同時に表現型を異なる方向に向けることができるということです。私たちの研究室では、皮膚創傷治癒に焦点を当てています。この目的のために、我々は皮膚固有の創傷治癒ECM環境の特性や機能を模倣することができます自然の生体材料、フィブリン、コラーゲン、キトサンから単一の複合マトリックスを作成しました。
プロトコル
1。脂肪由来幹細胞(ASCS)1、5を分離する
注:特に断りのない限り、すべての手順は室温で行った。
- ラット腎周囲および副睾丸脂肪を分離し、前述の5のように1%ウシ胎児血清(FBS)を含む無菌ハンクス緩衝塩溶液(HBSS)で洗浄する。本研究では、動物福祉法を遵守して実施し、実装する動物福祉の規制と実験動物のケアと使用するためのガイドの原則に従ってされています。
- 組織をミンチし、室温で8分間500グラムで50 mLのチューブと遠心分離機に1%FBSを含むHBSS 25 mLに1〜2グラムを転送します。
- 浮遊脂肪組織層と125 mLの三角フラスコへの転送を収集し、37℃で45分間HBSSでコラゲナーゼII型(200 U / mL)を25 mLで扱う°オービタルシェーカー(125 rpm)でのC。
- 注意深くピペッティングにより液体留分を(油と脂肪層の下)を削除し、100を介して連続してそれをフィルタ - μmと70 - μmのナイロンメッシュフィルター。室温で10分間500gで濾液を遠心し、上清を吸引除去し、HBSS 25 mLで二回ペレットを洗浄する。
- MesenPRO RSの成長サプリメント、抗生物質抗真菌剤(ペニシリンG 100 U / mLの硫酸ストレプトマイシン100μg/ mLとし、アムホテリシン0.25μg/ mLとを添加した増殖培地50 mLの細胞ペレット(MesenPRO RS基礎培地)に懸濁しB)、および2つのT75フラスコ(25 / mLのフラスコ)にL-グルタミンおよびピペットの細胞を2mM。
- 文化37℃5%CO 2、加湿インキュベーター中ASC°C(通過2月4日ASCは、すべての実験に使用されています)。
2。キトサンマイクロスフェア(のCSM)を準備
注:特に断りのない限り、すべての手順は室温で行った。
- のCSMは、当社の以前のプロトコル5を使用してイオンコアセルベーション技術とともに油中水型乳化プロセスによって調製される。大豆油、n-オクタノール(1:2 v / v)で、5から成る油相混合液100 mLにキトサンの水溶液(酢酸の0.5 Mの3%(w / v)のキトサンの6 mL)を乳化%ソルビタンモノオレエート(スパン80)、乳化剤、反対方向に同時にオーバーヘッド(1700 rpm)と磁気攪拌(1000回転)を使用します。架橋が発生する前に早期に形成されるミセル溶液中に残ることができ、底に沈殿するためにないことを確実に混合し、この二重の方法。さらに、デ集約ミセル形成とrigidization中にキトサンをで磁気攪拌棒を支援します。
- 安定した油中水型エマルションが得られるまで連続して約1時間撹拌した混合物をかき混ぜる。 4時間(24 mLの合計)のn-オクタノール15分毎に1%(w / v)の水酸化カリウムを1.5 mLを加えて架橋イオンクロスを開始 すぐに架橋反応終了後、混合物を含むCSMのゆっくりデカント油相とアセトン100mlを追加した後、解決策は、石油残渣による曇りになります。 5分後、デカント、アセトン、さらに100 mLを加え、室温で一晩インキュベートする。次の日、5分間アセトンでビーズを再洗浄してください。これらのシリアルを実行した後、溶液は、洗浄を続行しない場合は、すべての油を除去し、アセトン溶液がクリアされるまで、明らかになっている必要があります洗い上げます。
- 真空デシケーターに回復球を乾燥させ、さらなる処理なしで分析します。あなたは、平均CSMの粒径、ミリグラム当たりの表面積、粒子サイズアナライザーを使用して、単位体積を決定することができます。
- その後の実験では、残留塩を除去し、無水エタノール5 mLで一晩洗浄することによって滅菌する滅菌水でCSM 3回洗浄します。
3。の決定のCSMでの遊離アミノ基の数
注:特に断りのない限り、すべての手順は室温で行った。
- トリニトロベンゼン(TNBS)BubnisとOfner 6の酸アッセイを使用してリンクイオンのクロスした後のCSMに存在する遊離アミノ基の数を決定します。 40℃で4時間、50 mLのガラス管に0.5%TNBS溶液1mLをマイクロスフェアの5mgをインキュベートし、60℃の6N HClを3mL℃で2時間Cを加えて加水分解する。
- 室温にサンプルを冷却し、脱イオン水5 mLとエチルエーテル10mLを加えることによって自由にTNBSを抽出します。
- ℃で15分間水浴中で室温まで冷却し、残留エーテルを蒸発させ、水15 mLで希釈して40に水相の5 mLのアリコートを温める。
- 空白とCSMのpのために使用キトサンとキトサンなく、TNBS溶液を用いた分光光度計で345 nmの吸光度を測定するアミノ基の合計数を決定するための賠償。キトサンへの相対的なCSMの遊離アミノ基の数を推定する。
4。 CSMの読み込みASC
注:特に断りのない限り、すべての手順は室温で行った。
- 一晩滅菌HBSSでセクション2.5から滅菌CSMの5mgを平衡化および8に追加 - μmの孔径の膜培養プレートインサート(24ウェルプレート)。
- CSMがメンブレン上に定住した後、慎重にHBSSを吸引し、挿入の外に増殖培地の挿入、700μLの内部に増殖培地300μLを追加します。
- 培養プレートのインサート内部CSM上の成長培地と種子の200μLの適切な濃度(1×10 4から4×10 4)でASCを再懸濁します。カルチャーインサート内の培地の最終量は、播種後、500μLです。
- Incub37℃5%CO 2の加湿インキュベーター内で24時間のCSM上でASCシード℃を食べました
5。のCSMでASCの読み込みと細胞生存率の割合を決定する
注:特に断りのない限り、すべての手順は室温で行った。
- インキュベーションの後、インサート膜に移行した細胞に影響を与えることなく、滅菌済み1.5 mLのマイクロ遠心チューブにピペットASCにロードされたCSMを。
- 残留培地を除去し、チューブに新鮮な増殖培地250μLを追加します。
- MTT [3 - (4,5 - dimethylthiozole -2 -イル)-2,5 -ジフェニルテトラゾリウムブロミド]の25μL加え、各チューブに溶液(5 mg / ml)を、2加湿5%COで4時間インキュベート37℃のインキュベーター
- インキュベーション後、培地を除去し、ジメチルスルホキシドの250μLを追加し、ホルマザンの複合体を可溶化するために2から5分間ボルテックス混合物を。
- 2700グラムでCSMを遠心のために5分、上清からピペットとMTTの製造元の仕様に従って、標準的なプレートリーダーを用いて570 nmと630 nmで、その波長の吸光度を決定します。
- 標準曲線を開発するために培養され定義されているASC番号から得られた値に対する相対のCSMに関連付けられている細胞数を決定します。
6。 PEG-フィブリンゲルに埋め込まれたASC-CSMの調製とキャラクタリゼーション
注:特に断りのない限り、すべての手順は室温で行った。
- ポリエチレングリコール(PEG)フィブリン(PEG-フィブリン)ハイドロゲルはSuggs らにより作製7スクシンイミジルグルタレート変更されたポリエチレングリコール(PEG、3400 Da)を溶解することによって。トリス緩衝生理食塩水(TBS、pHは7.8)とフィルターは滅菌の4 mLを用いてただの実験を開始する前に0.22μmのフィルターである。溶解PEGは、最初の3-4時間のために、このアプリケーションでのみ有効です。
- ミックス500&ムー、37℃5%CO 2の加湿インキュベーター内で20分間フィブリノゲン株式のL(TBS、pHは7.8で40 mg / mL)は、6ウェルプレートとインキュベートウェル培養におけるPEG株式の250μlの℃のフィブリノゲン:この混合物は、1:10、SG-PEG-SGのモル濃度比を構成しています。
- CSMの5 mgの濃度でASC-CSMの250μlを取り、(≈2×10 4細胞)とPEG化フィブリノゲン溶液と混合する。
- 直ちにトロンビン株式の1ミリリットル(25U/mL)を追加し、迅速にピペットで一度か二度ひいて粉にする。 10分を完全にゲル化を可能にするために37℃でPEG-フィブリノーゲンとトロンビンを混合した後、すぐに12ウェルプレートに細胞-ゲル混合物を配置し、5%CO 2の加湿インキュベーター中でインキュベートした。ゲル化時間が速いので、5秒以上ピペットチップ内にゲル溶液を試してみて、保持しません。 PEG化されたフィブリノゲンがトロンビンによって切断およびPEG化フィブリンゲルを形成する。など、目E最後のゲル製品は、PEG-フィブリンと呼ばれています。
- HBSSで二回PEG-フィブリンゲルを洗浄し、37℃5%CO 2の加湿インキュベーター中で10%FBSを添加したα最小必須培地(α-MEM)℃でインキュベート
- 標準の光学顕微鏡技術を用いた11日間にわたってゲルにCSMからの細胞の遊走を観察します。
7。コラーゲンゲルに埋め込まれたASC-CSMの調製とキャラクタリゼーション
注:特に断りのない限り、すべての手順は室温で行った。
- 2N NaOHを用いて6.8にpHを調整した後、Bornstein 8の方法とフィブリル化に従って、ラット尾の腱から抽出された1型コラーゲン(7.5 mg / ml)と混合ASC-CSM(≈2×10 4細胞を含む5 mg)を得た。
- 12ウェルプレートにフィブリル化コラーゲン-ASC-CSM混合物を追加し、5%CO 2加湿で30分間インキュベート37 fiedインキュベーター℃、
- 完全に心房細動の後、37℃で最大5%CO 2の加湿インキュベーター内で11日間までコラーゲン-ASC-CSMゲルをインキュベート
- 標準的な顕微鏡技術を用いた11日間にわたってゲルにCSMからの細胞の遊走を観察します。
8。二層PEG-フィブリン(ASC-CSM)コラーゲンゲルコンストラクトの開発
注:特に断りのない限り、すべての手順は室温で行った。
- 二重層は、構築する開発するために、若干の修正により、上記のようにコラーゲンとPEG-フィブリンゲルの両方を準備します。簡単に言うと、4段階のプロセスを使用して、コラーゲンとPEG-フィブリンの足場の間に "サンドイッチ" ASC-CSMを2 bioscaffoldsを使用して幹細胞の単一のソースの渡り鳥との共同誘導特性を研究するには:1)ロードASC CSM、2)にCOL上のフィブリル化コラーゲンゲル層ASC-CSMビーズをキャストラゲンゲル、3)キャストPEG-フィブリンゲルASC-CSM-コラーゲンゲル上およびゲルが固化することができ、4)のウェルに培地を追加し、in vitroで細胞を勉強したり( 図1を参照してくださいin vivoアプリケーション用インサートから削除するには、挿入。)
- 混合物にASC-CSMを追加せずに、7.1で上記のように1 mLの1型コラーゲン(7.5 mg / mL)を混合物を準備します。 6ウェル組織培養インサート(8μmの孔径)に混合物を置き、37℃5%CO 2の加湿インキュベーター内で30分間インキュベート
- コラーゲン表面を完全に細動した後、層培地(200μl)を中に懸濁させASC-CSM(10、000細胞/ mg)を5 mgの。ミクロスは、ゲル上の定住した後、セクション6.0で説明したように、混合物にASC-CSMを追加し、層ASC-CSM-コラーゲン層上にPEG化されたフィブリノゲン/トロンビン解決せず、PEG-フィブリンゲルを調製する。 PEG-フィブリンゲルを準備するとき、Tの代わりに細胞培養培地250μlを使用細胞を含む培地中の彼は250μlの。
- 完了すると、培地の構造を供給する前に完全にゲル化を達成するために、5%CO 2の加湿インキュベーター中で30分間構造をインキュベートします。
- 完全にゲル化した後、場所の上部構造物上室と下室の培地3 mLの培地を1 mL。
9。原液を作る
注:特に断りのない限り、すべての手順は室温で行った。
- 塩化カルシウムの在庫(40 mm)は:唯一のCaCl 2·2H 2 Oを使用します。脱イオン水100mlでのCaCl 2·2H 2 Oの588.4 mgを溶解する。 0.22μmのフィルターを使用して滅菌する。
- ポリエチレングリコール:PEGは、酸素との反応性が高いと室内の空気にさらされると酸化しになることができます。このように、PEGは、窒素(N 2)雰囲気下で保存する必要があります。 ACCurately使用直前まで-80℃で2 ml遠心チューブ(使用前にN 2でチューブをパージするようにしてください)とストア°Cで32 mgの重量を量る。使用前にTBS溶液4mlにPEGの32 mgを溶解する。
次のソリューションは、すべての実験の前に新鮮行わなければなりません。 - TBS溶液:(25 pHが7.75から7.77℃、25℃でのpHが非常に重要です)。 TBS溶液15mlを準備するには、慎重にフィルター滅菌脱イオン水で1つのバッファータブレットを溶解し、必要なpHに調整します。それは毎回新鮮なソリューションの準備の在庫を保管しないでください。
- フィブリノゲン溶液:(40 mg / ml)を。 40 mg / mlのフィブリノゲン濃度を作るためにTBSでフィブリノゲン粉末を溶解する。 4℃でマグネチックスターラーを使用して一晩、それを溶かす℃にそれはTBSの必要量と全体の1-Gの量を溶解しやすくなります。次の日、4°C(通常は曇り)からフィブリノゲンを除去し、それを許可する均質な溶液が得られるまでの水浴で温めています。最後に、0.45μmフィルターを使用して、フィブリノゲンを滅菌ろ過する。
- トロンビン溶液(25単位/ ml):トロンビン溶液を作るために、必要な量を量ると、準備を40mMのCaCl 2·2H 2 Oで溶解それは常にストックを作るためにトロンビンの全体のバイアルを使用することをお勧めします。例:-20℃〜200 mMのCaCl 2の0.2 H 2 O、アリコートと店舗で5区トロンビンのボトルを溶かし
10。代表的な結果
ここで紹介するテクニックの全体的な目標は、送達ビヒクルとしてCSMを使用して複数の表現型にASCの同時マトリクス駆動型の分化の可能性を実証することである。我々は、二層コラーゲン-PEG-フィブリン足場にCSMのから幹細胞を提供するためにin vitroでの戦略を示しています。この足場reveale内に埋め込まれたASCの特性評価同時に、差動では、新しい条件の下で繁栄するには、両方の細胞外環境からキューを取るコラーゲンとPEG-フィブリンの層の間にASCにロードされたのCSM "が挟まれた"ことができるD。まず、細胞の生存と渡り鳥の能力を維持するために、モデルシステムのための能力を特徴とする。コラーゲンは、彼らの"stemness"などSTRO-1の発現とその線維芽細胞様形態( 図2Dおよび2F)によって実証されたを維持するために、ASCの機能をサポートしていました。それらのチューブ状構造の形態、von Willebrand因子( 図2Eと2G)のそれらの内皮細胞特異的発現、および周皮細胞特異的発現によって実証されるとは対照的に、PEG-フィブリンは、血管の表現型に向かって区別するためにASCを誘導しNG2および血小板由来増殖因子受容体β(PDGFRβ)(データは示さず)。さらに、これらの観測された表現型は、培養の初期に起こるように思われ、11日間維持されたとして、DEMです。図3にonstrated。
表と図
二重層の利点は構築:
- 細胞を含まないだけでは足場は、生物活性足場として実行することができます。
- PEG-フィブリンは、成長因子を添加せずに区別するために幹細胞を誘導することができる。
- コラーゲンは、ASCの幹細胞の表現型を維持するために支援することができます。
- 二重層構造は、他の細胞型が移行し、(例えば、内皮細胞、線維芽細胞、ケラチノサイト、平滑筋細胞、周皮細胞)が増殖するためのアクティブ基板として使用することができます。
- これは、硬組織及び軟組織を再生するためにhydroxyaptiteまたは脱骨のような硬組織工学の足場を使用することができます。
- これは、多層、多様な組織工学コンストラクト(等、皮膚血管、血管上皮、真皮血管皮下など)を開発するために使用することができます。
- それは同時に開発するために、単一セルのソースを使用して多コンパートメント。
- それは自然起源のものであるため、宿主組織と統合する可能性を秘めています。
- ゲル構造内のCSMは、細胞から移行するためのプラットフォームを提供します。
- CSMを準備するために使用されるキトサンは、よく知られているアクティブな化学誘引です。
- "マトリックス駆動型の幹細胞の分化"のこのプロトコルに適用される全体的なコンセプトは、他の幹細胞の種類に適用されるかもしれません。しかし、さらなる調査がマトリックス駆動型の分化の可能性を決定するために保証されています。二層ゲル足場は持続的かつ制御された方法で細胞を提供するための貯水池として機能することができます。
- 再建後、ゲルはまだ個々の成分に分離することができます。
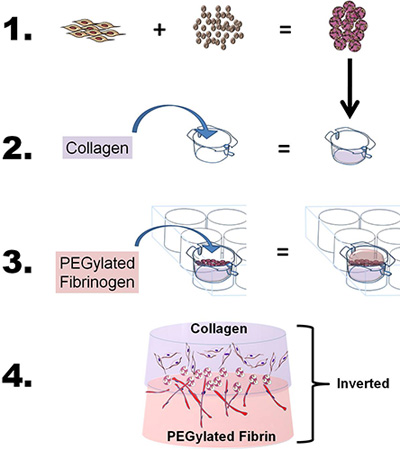
図1。回路図は、技術の全体的な目標及びプロセスを描いた。 1)脂肪由来幹細胞(ASCS)は、LOです。キトサンマイクロスフェアにaded。 2)コラーゲンは、その後6ウェルインサートは、コラーゲンをフィブリル化するためにpH調整し、6ウェルプレートチャンバーに入れ、挿入に注がれています。 ASCにロードされたCSMの球はその後コラーゲン上に積層されています。 3)PEG化フィブリノゲンは、その後コラーゲン(ASC-CSM)に注ぎ、トロンビンの添加によってゲル化されています。 4)最後の二重層構造は、その後の培養インサートから削除され、in vitroまたは in vivo分析で使用することができます。
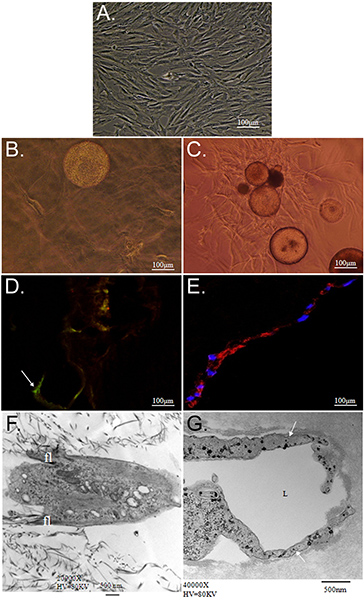
図2。ASCの特性は、コラーゲンとPEG-フィブリン3Dマトリックス内で培養した。隔離されたASCの)位相コントラスト顕微鏡写真は、継代し、ルーチンの2次元細胞培養技術を使用して維持しています。両方とも1日目C、E、および3次元PEG-フィブリンゲル内で培養しGのショーASC-CSM、一方、顕微鏡写真A、B、D、Fは3次元コラーゲンゲル内培養ASC-CSMを描く2。 BとC)では、ASCは、両方の足場タイプのCSM球からの移行を示しています。幹細胞のマーカーSTRO-1(;矢印D)のそれらの発現を維持しながら、ASCは、コラーゲンのフラット化、紡錘状の形態(B)を持っているように見えます。 PEG-フィブリンASCの中で培養したときには、よりチューブ状の構造を示し、von Willebrand因子(E)などの血管細胞マーカーを発現するように誘導されています。透過型電子顕微鏡は、それぞれの足場内のASCによって示され、典型的な形態を示しています。 (;矢印G)コラーゲンゲル内でのASCはASCのは、通常、内腔(Lラベルが付いている)構造を形成し、一方、セル(F)の本体から伸びる小さな糸状仮足(FL)を持っているように見えます。
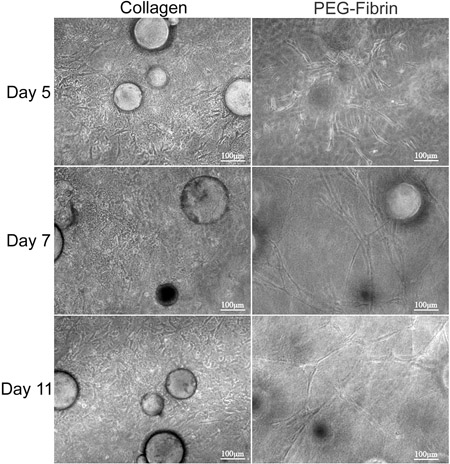
図3。コラーゲンとPEG-フィブリンゲルの二重層の間にASC-CSMの形態学的解析。 ASC-CSMはコラーゲンとPEG-フィブリンゲルの間に "挟まれた"と11日間培養で維持した。左columnは、コラーゲンマトリックス内に移行し、増殖してASCを表し、紡錘状の形態を取るように見えます。右の列には、PEG-フィブリンゲル全体のCSMと成形チューブ状の構造からの移行ASCを示しています。
ディスカッション
ASCはアイソレーションと、様々な種類の細胞に向かって分化する能力の容易さのためによく知られている。この原稿に記載された技術で、我々は、同時に複数のbiomatricesにこれらの細胞を曝すことによってASCの可塑性を悪用することができます。細胞は、CSMのベースから離れての移行とその周囲の細胞外環境を入力すると、細胞は足場からキューを取得し、いずれかの "stemness"(コラ?...
開示事項
なし競合する経済的利益は存在しません。
免責事項
ここに記載されている意見やアサーションは、作者の私的見解であり、公式、または国防省、または米国政府の部門の意見を反映して解釈されるべきではありません。著者らは、米国政府の従業員であり、この作品は、その職務の一部として作成されました。すべての作業は、米陸軍医学研究および資材コマンドでサポートされていました。本研究では、米陸軍医学研究および資材コマンド治験審査委員会によって、承認されたプロトコルに従って検討し、承認されたプロトコルの下で実施されました。
謝辞
SNは、ピッツバーグ·ティッシュエンジニアリング·イニシアティブからポストドクトラルフェローシップ·グラントによってサポートされていました。 DOZは、ジュネーブ財団から授与の助成金によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬/装置の名前 | 会社 | カタログ番号 | コメント |
| ハンクス平衡塩溶液(HBSS) | ギブコ | 14175 | 消耗品 |
| ウシ胎児血清 | ハイクローン | SH30071.03 | 消耗品 |
| コラゲナーゼタイプII | Sigma-Aldrich社 | C6685 | 消耗品 |
| 70μmのナイロンメッシュフィルター | BDバイオサイエンス | 352350 | 消耗品 |
| 100μmのナイロンメッシュフィルター | BDバイオサイエンス | 352360 | 消耗品 |
| MesenPRO増殖培地システム | インビトロジェン | 12746-012 | 消耗品 |
| L-グルタミン | ギブコ | 25030 | 消耗品 |
| のCaCl 2·2H 2 O | シグマ | C8106 | 消耗品 |
| T75組織培養フラスコ | BDバイオサイエンス | 137787 | 消耗品 |
| キトサン | Sigma-Aldrich社 | 448869 | 消耗品 |
| 酢酸 | Sigma-Aldrich社 | 320099 | 消耗品 |
| n-オクタノール | アクロスオーガニック | 150630025 | 消耗品 |
| ソルビタン、モノオレイン酸 | Sigma-Aldrich社 | S6760 | 消耗品 |
| 水酸化カリウム | Sigma-Aldrich社 | P1767 | 消耗品 |
| アセトン | フィッシャー·サイエンティフィック | L-4859 | 消耗品 |
| エタノール | Sigma-Aldrich社 | 270741 | 消耗品 |
| トリニトロベンゼンスルホン酸 | Sigma-Aldrich社 | P2297 | 消耗品 |
| 塩酸 | Sigma-Aldrich社 | 320331 | 消耗品 |
| エチルエーテル | Sigma-Aldrich社 | 472から484 | 消耗品 |
| 8μmの組織培養プレートインサート | BDバイオサイエンス | 353097 | 消耗品 |
| 1.5 mlのマイクロ遠心チューブ | フィッシャー | 05-408-129 | 消耗品 |
| MTT試薬 | インビトロジェン | M6494 | 消耗品 |
| ジメチルスルホキシド | Sigma-Aldrich社 | D8779 | 消耗品 |
| Qtracker細胞標識キット(Qトラッカー655) | 分子プローブ | Q2502PMP | 消耗品 |
| 1型コラーゲン | Travigen | 3447-020-01 | 消耗品 |
| 水酸化ナトリウム | Sigma-Aldrich社 | S8045 | 消耗品 |
| 12ウェル組織培養プレート | BDバイオサイエンス | 353043 | 消耗品 |
| フィブリノゲン | シグマ | F3879 | 消耗品 |
| トロンビン | シグマ | T6884 | 消耗品 |
| ポリエチレンのBenztriazoleデリバティブ | Sunbio | DE-034GS | 消耗品 |
| トリスバッファータブレット液(pH7.6) | シグマ | T5030 | 消耗品 |
| 遠心分離 | エッペンドルフ | 5417R | エクイpment |
| オービタルシェーカー | ニューブランズウィック州Scienctific | C24 | 機器 |
| 空気-5%CO 2の加湿インキュベータ | サーモフィッシャーサイエンティフィック | 370 | 機器 |
| オーバーヘッドスターラー | IKA | Visc6000 | 機器 |
| マグネチックスターラー | コーニング | PC-210 | 機器 |
| 減圧デシケーター | - | - | 機器 |
| 粒径分析器 | マルバーン | STP2000 Spraytec | 機器 |
| 水浴 | フィッシャー·サイエンティフィック | Isotemp210 | 機器 |
| 分光光度計 | ベックマン | ベックマン·コールターDU 800UV/Visible分光光度計 | 機器 |
| 渦 | Diagger | 3030a | 機器 |
| マイクロプレートリーダー | モレキュラーデバイス | SpectraMax M2 | 機器 |
| 光/蛍光顕微鏡 | オリンポス | IX71 | 機器 |
| 共焦点顕微鏡 | オリンポス | FV-500レーザー走査型共焦点顕微鏡 | 機器 |
| 走査型電子顕微鏡 | カールツァイスマイクロイメージング | レオ435 VP | 機器 |
| 透過型電子顕微鏡 | JEOL | JEOL 1230 | 機器 |
参考文献
- Natesan, S. A bilayer construct controls adipose-derived stem cell differentiation into endothelial cells and pericytes without growth factor stimulation. Tissue Eng. Part A. 17, 941-953 (2011).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J Biomed Mater Res A. 81, 259-268 (2007).
- Willerth, S. M., Sakiyama-Elbert, S. E. Combining stem cells and biomaterial scaffolds for constructing tissues and cell delivery. , (2008).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, M. C. The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Zhang, G. A PEGylated fibrin patch for mesenchymal stem cell delivery. Tissue Eng. 12, 9-19 (2006).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Zhang, G. Vascular differentiation of bone marrow stem cells is directed by a tunable three-dimensional matrix. Acta Biomater. 6, 3395-3403 (2010).
- Rochon, M. H. Normal human epithelial cells regulate the size and morphology of tissue-engineered capillaries. Tissue Eng. Part A. 16, 1457-1468 (2010).
- Liu, H., Collins, S. F., Suggs, L. J. Three-dimensional culture for expansion and differentiation of mouse embryonic stem cells. Biomaterials. 27, 6004-6014 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved