このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ラット胚神経細胞の分離と文化:クイックプロトコル
要約
我々は、齧歯類の胚から海馬および皮質ニューロンを分離、培養するための迅速な方法論を記述します。このプロトコルは、私たちはほぼ純粋な神経細胞の培養が必要とされる実験を行うことができます。
要約
我々は、E15-17ラットの胚から海馬または皮質ニューロンを分離し、培養するための簡単な方法を記述しています。手順は、マウスとヒトの一次ニューロンと神経前駆細胞の分離に正常に適用することができます。解離ニューロンは、数週間に、無血清培地に維持されます。これらの培養物は、ヌクレオ、免疫細胞化学、核酸の調製と同様に、電気生理学的に使用することができます。古いニューロンの培養物は、またリン酸カルシウムや、リポフェクトアミンなどの脂質ベースの方法で、効率は低下し、レンチウイルス形質導入により効率の良いレートでトランスフェクトすることができます。
プロトコル
1。ポリ-D-リジン(PDL):準備
- 1 mg / mlのストック溶液を得るためにPDLの5mgに無菌のddH 2 Oの5ミリリットルを追加します。
- 数回ピペッティングしてストック溶液を混ぜる。
- すぐに使用するか、または2-8ポリ-D-リジン溶液℃で保存してください。
2。ポリ-D-リジン(PDL):コーティングプラスチック細胞培養皿
- 滅菌のddH 2 Oで10μg/ mlの最終濃度にPDLストック溶液を希釈します。
- 培養面積(60 mmディッシュに3 ml)をカバーする60mmディッシュにピペット十分なソリューションを提供します。
- 文化面にもコーティングを確保するために静かに揺する。
- 一晩室温(RT)でコーティングしたプレートをインキュベートします。
- 通常翌日に、解剖の日に、吸引によってポリ-D-リジン溶液を除去し、無菌のddH 2 Oを3mlで簡単に洗うこの手順を繰り返します。回目の洗浄後、吸引で完全に水を削除します。
- プレートは、最大3週間までは4℃で保存することができます。
3。ポリ-D-リジン(PDL)およびラミニン:ガラスの作製とコーティング二チャンバースライド
- それぞれ10および5μg/ mlの最終濃度に無菌のddH 2 OのミックスPDL(1 mg / ml)とラミニン(1 mg / ml)のストック溶液を、。
- 培養面積(2よくガラス二チャンバースライドの各ウェルに1 ml)をカバーするガラス二チャンバースライドの各ウェルにピペット十分なソリューションを提供します。
- 文化面にもコーティングを確保するために静かに揺する。
- 室温で一晩コーティングしたプレートをインキュベートします。
- 次の日に、吸引を介してポリ-D-リジンラミニンコーティング溶液を除去し、無菌のddH 2 Oを1 mlで2回サッと洗う回目の洗浄後、吸引で完全に水を削除します。
- チャンバースライドは最大3週間までは4℃で保存することができます。
注:任意のガラスチャンバースライドは、コーティングされたfollowinすることができますグラムは、このプロトコル。各スライドは、コントロール·テスト実験の設定(例えば、未処理の対扱われ、非トランスフェクト対)を提供しますので、我々はしばしば二チャンバースライドを使用しています。
4。神経解剖と文化
- 37°Cの水浴中で以下の試薬を温める。
- 元の100ミリリットルボトルのTrypLEエクスプレス。
- Neurobasal/B27完全培地( 表Iを参照)。温めたボリュームは、(10 60ミリメートルメッキ皿例えば30ミリリットル)メッキになる料理の数によって異なります。
- 4 60 mmの培養皿と15ミリリットルBDファルコン高透明ポリプロピレンコニカルチューブに13 mlの冷HibernateのE溶液3mlを追加します。
- 3 100 mmの培養ディッシュのそれぞれに冷たい解剖培地( 表II、博士オリンピアメウッチ、個人的な通信を参照してください)の25〜30 mlを追加します。媒体の大容量を含むこれらのプレートは、すぐに彼らの後の胚を洗浄するために使用されます。羊水嚢(ステップ4.7および4.8)から除去。
- 実験動物の人道的なケアと使用に関する公衆衛生サービスのポリシーに従って、制度承認された動物のケアの下でCO 2でE17タイミング妊娠ラットを安楽死させるとプロトコルを使用しています。
- 70%EtOHで下腹部をスプレーし、子宮および胚を露出はさみのペアを持つ皮膚や筋肉を介して内側にカット。
- すべての胎児を取り出して、冷たい解剖媒体の過剰を含む滅菌100-mmディッシュに置いてください(25-30ミリリットル、ステップ4.3を参照)。
- 羊膜嚢からはさみの小さなペアを使用して胚を切断して冷たい解剖媒体を含む第二の100-mmディッシュに配置します。
- 5〜10秒間静かに傾けて、100 mmディッシュで室温で胚を洗浄します。その後、解剖媒体を含む第三100 mmディッシュにすすいだ胚を転送します。過剰培地で2回洗浄し、通常は血液の痕跡をすべて削除するのに十分である。ただし、NECessary、冷たい解剖培地の25〜30 mlを含有する新鮮な100-mmディッシュを使用して、1つより多くの時間を洗ってください。
- 実体顕微鏡と湾曲した鉗子を用いて、皮膚や頭蓋骨を引き出して、それぞれのラット胚の脳を抽出します。氷の上でこれらのプレートを維持冷たいHibernateのE. 60-mmディッシュ(典型的には、皿当たりません5つ以上の脳を含む)のいずれかで、脳全体に配置します。
- 一度に一皿を取ると、解剖顕微鏡下で、半球を分離し、中脳と髄膜を除去する大脳皮質を分離します。
- オプション:正中線に沿ってカットの脳は、海馬を抽出し、海馬ニューロンを分離するには、以下の手順に従ってください。
- すべての解剖が完了するまで氷上に大脳皮質を残す冷たいHibernateのE.の13ミリリットルを含む15 mlのコニカルチューブに明らかにあるすべての解剖皮質を収集します。その小さなサイズのために、解剖海馬ではなく、15 mlチューブに1.5 mlのエッペンドルフチューブに回収することができる。またはこのステップ野では、必要に応じて海馬は、2月4日皮質またはバイアルあたり2から4海馬の割合でHibernate E + 2%B27 +ゲンタマイシン(50μg/ ml)を+ファンギゾン(250 ng / ml)を1 mlを含むクライオチューブバイアルに配置することができます。脳組織は、最大一週間(後の時代はまだテストされていません)に、暗所で4℃で保存することができます。必要なときに、HibernateはEを含む15 mlチューブに脳組織を転送してから神経細胞を分離するには、以下のプロトコルに従うように微細な鉗子を使用しています。
- 組織培養フードにチューブを転送します。皮質は、チューブの底に沈殿して、慎重に上清を除去することができます。
- 15 mlのコニカルチューブに新鮮なHibernateのEの13ミリリットルを追加して、野にはチューブの底に沈殿し、上清を注意深く除去することができます。このステップ2回以上繰り返すと、最後に洗浄した後、慎重にすべてのメディアを削除します。
- 暖かいTrの、酵素1〜2ミリリットルを(海馬の分離のための以下を使用して野の数に応じて)を追加することによって大脳皮質を消化ypLEエクスプレス。パラフィルムでチューブのキャップを密封して10分間37℃の水浴中でチューブをフロートさせます。
- キャップを開ける前に、70%エタノールでチューブをスプレーし、Hibernate E. 10mlの皮質は、チューブの底に沈殿し、上澄みを除去するために許可を追加します。 TrypLE Expressを洗い流すには、この手順を3回繰り返します。最後のステップでは、慎重にすべてのメディアを削除します。
- 穏やかに(4-5回)ファイアーポリッシュガラスパスツールピペット(直径約1mm)を使用してNeurobasal/B27完全培地2ml中の皮質をひいて粉にする。気泡がないように注意してください。
- 直径の小さい滅菌ガラスパスツールピペット(すなわち直径1/2-3/4 mm程度ピペット)で別の4-5回を繰り返します。これより小さいパスツールピペットを使用していないか、それが細胞を破壊します。
- 解決するために(もしあれば、一般的には非常に少ない)は、組織の残りの部分ができます。
- 組織の定着部分を残して、新しい15 mlチューブに上部の単一細胞懸濁液を移す。毛皮Neurobasal/B27完全培地で10〜12ミリリットルに細胞懸濁液を希釈して配置する必要があります。
- よく混合し、1.5mlのエッペンドルフチューブ内で50倍カウント·ソリューション( 表IIIを参照)490μlに細胞懸濁液10μlを添加することによりカウントするための細胞を希釈します。
- 5.0×10 4 / cm 2の密度で、PDLコーティングプレート上に細胞をプレートし。ヌクレオが実行されるならば、我々はより高い濃度(8-10×10 4個/ cm 2)で細胞をプレーティングをお勧めします。
- 約13×10 6ニューロンがそれぞれE17胎児から導出されるように、通常、我々は、実験ごとに9月10日胎児を解剖。より多くの胚が必要な場合は、全体の手順は、2時間以上持続しないことを確認します。
- 24時間分離した後、必要に応じて、シトシン-β-D-アラビノフラノシド(AraCの)10μMのは、グリア細胞の増殖を防ぐために、それぞれの皿に追加することができます。 Neurobasal/B27媒体はグリア細胞の増殖を阻害するので、しかし、この手順は必須ではありません(Invitrogen社/ Gibco)を製造元の推奨に従って。
- 正確な時間が所望の分化段階に依存するものの、神経細胞は、 試験管内で 4-5日後に実験に使用することができます。我々は、生存率の有意な減少( 図1)を使用せずに最大4週間の培養神経細胞を持っています。
- 拡張された培養については、新たに調製しNeurobasal/B27完全培地で毎週培養培地を交換してください。
5。代表的な結果
ガラスチャンバースライド上で培養したニューロンは、免疫細胞化学に付すことができる。 図1は、培養中の5日後に固定されており、神経突起を表示するには、抗MAP-2抗体で免疫標識皮質ニューロンの典型的なイメージを示しています。
図2は、文化の中で3週間後のラット海馬ニューロンの代表的なイメージを示しています。完全に分化した細胞のニューロンの形態は、MAP-2で強調表示されているImmunolabeling(MAP-2神経マーカー、マウスモノクローナル抗体クローンAP-20、ジーンテックス、カリフォルニア州アーバイン)は、以前1を説明されている標準的な手順に従って、。画像は、EXiアクアカメラ(Qimaging)を搭載したニコンのEclipse E400直立蛍光顕微鏡で可視化した電動Z軸、SlideBook5取得/デコンボリューションソフトウェア(インテリジェントイメージングイノベーションズ社、デンバー、コロラド州)。個々の画像の3次元画像のシリーズは、1つの2次元の画像にデコンボリューションと分解能を高めるために近くに最大の強度に信号のカットオフを調整することによって解決されました。
図3は、ニューロン培養の純度を示しています。タンパク質溶解物をDIV7ラット神経細胞培養(CTX)からとヒト神経膠芽腫(GBM)のケースから得られた。予想通り、神経細胞ライセートはアストロサイトのマーカーGFAPのために強く神経タンパク質MAP-2の正と負であり、GBMタンパク質溶解物が負のfである間、またはMAP-2およびGFAP陽性の。
私たちのプロトコルで我々がメディアを解剖し、洗浄など、いくつかの年のためにHibernate Eを使用してきましたが、最近我々は、さらに使用するために脳組織を維持するためにそれの追加と非常に実用的な使用を検討しています。 図4 は 、in vitro 5(DIV5) の日数を示しています胚からの元の郭清をした後に休止状態E + B27に1週間4°Cで保管皮質から単離されたラット皮質ニューロンの文化。ニューロンは、前述のようにPDLとラミニンでコーティングされたガラス2チャンバースライド上に播種した。取得した画像( 図2)上記のようにSlideBook5取得/デコンボリューションソフトウェアを使用してデコンボリューションされました。

図1。pmaxGFP(Amaxa、ロンザ、ウォーカー、MD)でnucleofectedとMAPを免疫標識皮質ニューロンの代表画像-2抗体、赤インチオリジナルの倍率100倍。
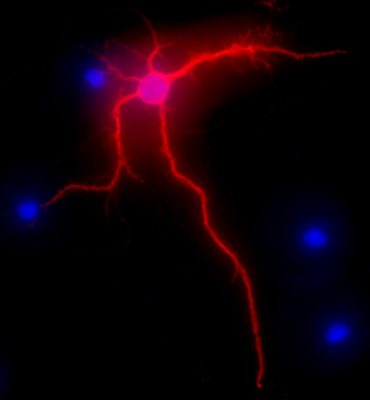
図2。文化の中で3週間後の海馬ニューロンの、赤で、MAP-2免疫標識を示す代表的なイメージ。 DAPI染色は、青色で、細胞の核を示しています。オリジナルの倍率40倍。

図3:神経細胞培養の純度を示すウエスタンブロット。ラットニューロンおよびヒトGBMのタンパク質溶解物30μgを電気泳動により分離し、標準的な手順1を以下のウェスタンブロット解析に供した。抗MAP-2は細胞シグナリング(ダンヴァーズ、マサチューセッツ州)、抗GFAP抗体由来のポリクローナルウサギはChemicon社からのマウスモノクローナル抗体(ミリポア、ビルリカ、MA)であった、マウスモノクローナル抗GRB2抗体BDトランスダクションラボラトリーズからの実施であった(火花、メリーランド州)。 GRB2は、ローディングコントロールとして用いた。

図4代表vitroで5日間の写真(DIV5)に残された皮質から得られたラット大脳皮質ニューロンのHibernate Eその郭清後の一週間、4℃+ B27。 A)ガラス二チャンバースライド上で培養した神経細胞の位相コントラストを。オリジナルの倍率20倍。 B)免疫蛍光は緑色で、神経突起のMAP-2の発現を示す。文化はアストロサイトのマーカーGFAPに対して陰性であった。 DAPI染色は、青色で、細胞の核を示しています。オリジナルの倍率40倍。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ここで説明したラット海馬および皮質ニューロンの解剖と文化の方法は化学的に定義された媒体( 図3)で成長し、ほぼ純粋な神経細胞の培養物を用いて実験を行うことができます。無血清培地で培養し、ほぼ純粋なニューロンのプロトコルは以前に2,3,4を説明してきたが、我々の方法で行われた重要な変更があります。従来のプロトコルから別の(すなわち、バンカー?...
Access restricted. Please log in or start a trial to view this content.
開示事項
利害の衝突が宣言されません。
謝辞
我々は編集支援のためにJonnaエリスに感謝します。国立精神衛生研究所から:説明プロジェクトが受賞番号R01MH079751(F.ペルッツィPI)によってサポートされていました。内容はもっぱら著者の責任であり、必ずしも国立精神衛生研究所や国立衛生研究所の公式見解を示すものではありません。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | 濃度 | ||
| Neurobasal | 98パーセント | ||
| B27 | 二パーセント | ||
| グルタミン | 0.5mMの |
表I. Neurobasal/B27完全培地 。
| 試薬 | 濃度 |
| グルコース | 16mMの |
| スクロース | 22 mmの |
| HEPES | 10mMの |
| NaClを | 160 mMの |
| 塩化カリウム | 5mMの |
| のNa 2 HPO 4 | 1mMの |
| KH 2 PO 2 | 0.22 mMの |
| ゲンタマイシン | 50μg/ mlの |
| ファンギゾン | 250 ng / mlの |
| pHは | 7.4 |
| オスモル濃度 | 320から330浸透圧 |
表II。解剖媒体 。
| 試薬 | 量(μL) |
| Neurobasal/B27完全培地 | 240 |
| トリパンブルーは0.4%の染色 | 250 |
| 合計 | 490 |
表III。ソリューションを数える50倍 。
表IV。特定の試薬 が含まれています 。
| 試薬 | 会社 | 猫。数 |
| HibernateはE | Brainbits | 767171 |
| Neurobasal | Gibco社、Invitrogen社 | 21103-049 |
| B27 | Gibco社、Invitrogen社 | 17504-044 |
| ファンギゾン | Gibco社、Invitrogen社 | 15290-018 |
| 硫酸ゲンタマイシン | シグマアルドリッチ | G1264 |
| グルタミン200mMの | Gibco社、Invitrogen社 | 35050 |
| TrypLE ExpressのW / Oフェノールレッド | Gibco社、Invitrogen社 | 12604 |
| シトシン-β-D-アラビノフラノシド塩酸塩 | シグマアルドリッチ | C6645 |
| ポリ-D-リジン | シグマアルドリッチ | P6407 |
| ラミニン1 mg / mlの | ミリポア | CC095 |
| HEPES | シグマアルドリッチ | H3375 |
| トリパンブルーは0.4%の染色 | Gibco社、Invitrogen社 | 15250 |
| 機器 | 会社 | 猫。数 |
| ステレオ顕微鏡 | オリンポス | SZ61 |
| 大鉗子 | FST | 11022から14 |
| 先の細いピンセット | モリア | MC40B |
| マイクロ先の細いピンセット | モリア | MC31 |
| 鋭いはさみ | Roboz | RS-6820 |
| ミクロ解剖はさみ | FST | 91460から11 |
| Microは、湾曲したハサミの解剖 | FST | 14067から11 |
| ガラス2 - チャンバースライド | ラボ·テック | 154461 |
| 60 mmの皿 | BDファルコン | 353002 |
| 100ミリメートル料理 | コーニング | 430167 |
| 15 mlチューブ | BDファルコン | 352099 |
| 1.5ミリリットルクライオチューブバイアル | ヌンク | 375353 |
表V.特定の機器 。
参考文献
- Aprea, S. Tubulin-mediated binding of human immunodeficiency virus-1 Tat to the cytoskeleton causes proteasomal-dependent degradation of microtubule-associated protein 2 and neuronal damage. J. Neurosci. 26, 4054-4062 (2006).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Serum-free culture of rat post-natal and fetal brainstem neurons. Brain Res. Dev. Brain Res. 120, 199-210 (2000).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Method for serum-free culture of late fetal and early postnatal rat brainstem neurons. Brain Res. Brain Res. Protoc. 6, 91-99 (2001).
- Brewer, G. J. Serum-free B27/neurobasal medium supports differentiated growth of neurons from the striatum, substantia nigra, septum, cerebral cortex, cerebellum, and dentate gyrus. J. Neurosci. Res. 42, 674-683 (1995).
- Banker, G., Goslin, K. Culturing nerve cells. , The MIT Press. Cambridge. (1998).
- Eletto, D. Inhibition of SNAP25 expression by HIV-1 Tat involves the activity of mir-128a. J. Cell Physiol. 216, 764-770 (2008).
- Gualco, E. IGF-IR-dependent expression of Survivin is required for T-antigen-mediated protection from apoptosis and proliferation of neural progenitors. Cell Death Differ. 17, 439-451 (2010).
- Gage, F. H. Survival and differentiation of adult neuronal progenitor cells transplanted to the adult brain. Proc. Natl. Acad. Sci. U.S.A. 92, 11879-11883 (1995).
- Keyser, D. O., Pellmar, T. C. Synaptic transmission in the hippocampus: critical role for glial cells. Glia. 10, 237-243 (1994).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 (1997).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved