このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
アゾキシメタン(AOM)とデキストラン硫酸ナトリウム(DSS)によるモデリング大腸炎関連癌
要約
私たちは迅速かつ一貫して人間の大腸炎に見られるものに形態学的および分子の類似点をもつマウスの大腸腫瘍を発生するプロ炎症剤デキストラン硫酸ナトリウム(DSS)の3つのサイクルが続く遺伝毒性物質のアゾキシメタン(AOM)の投与にプロトコルを実証関連癌。
要約
例えば、クローン病(CD)または潰瘍性大腸炎(UC)などの炎症性腸疾患を持つ個人(IBD)は、健常者の上に結腸直腸癌(CRC)を発症する危険にさらされている。このリスクは広範結腸関与との長年のUCを持つ個人では30%と高いの累積発生率は、病気の期間とその程度に比例している。IBDおよび大腸炎関連癌の1結腸異形成(CAC)は、結果として生じると考えられているこれらの細胞は慢性炎症性サイトカイン環境に浸っている間に2自発的と大腸炎関連癌がある腺の質を共有しながら上皮細胞傷害と修復の繰り返しサイクルで、根底にある分子の一連のイベントは、さまざまであると考えられている。3これは、区別は、CACの特定の動物モデルの必要性を主張している。
いくつかのマウスモデルは、現在、CACの研究のために存在します。デキストラン硫酸sodiUM(DSS)、結腸上皮に対する直接的な毒性作用を持つ薬剤は、慢性的な炎症状態を作成するために複数のサイクルでマウスに水を飲んで投与することができる。十分な期間では、これらのマウスのいくつかは、腫瘍を開発する。プロ発癌性の設定で投与された場合4腫瘍の開発は、このモデルで急いでされています。これらは、腫瘍形成経路の遺伝的変異を持つマウス(APC、p53が、MSH2)だけでなく、マウス遺伝毒性物質(アゾキシメタン[AOM]、1,2 -ジメチルヒドラジン[DMH])。5で前処理を含む
大腸炎関連癌のモデルとして、AOMとDSSの組み合わせは、その再現性、効力、低価格、使いやすさのために人気を得ています。彼らが共有メカニズムを持っているが、AOMはDMHより溶液中でより強力かつ安定していることが判明している。他のモデルで腫瘍の発達は、一般的に要求されますが、数ヶ月は、AOMを注入し、その後、DSSを投与したマウスは、十分に腫瘍を開発7月10日週最後に図6、図7のようにちょっと、AOMとDSSは特定の腫瘍形成株と交配することなく、任意の遺伝的背景のマウス(ノックアウト、トランスジェニックなど)に投与することができる。ここでは、10週間にわたってDSSの3 7日間のサイクルが続くAOMの単回注射を利用したマウスにおける炎症ドリブン結腸腫瘍形成のためのプロトコルを示しています。このモデルは密接に人間のCACで発生したものに似た組織学的および分子の変化を有する腫瘍を誘発し、この病気で発癌と化学予防の研究のための非常に貴重なモデルが用意されています8
プロトコル
1。大腸炎関連癌誘発
- セックスのケージと、実験群と対照群に使用される年齢をマッチさせた6-8週齢のマウスを脇に置きます。マウスは個別にテールマーキングや耳クリップで標識することができる。
- 当日は0、レコードベースラインの重みおよび10 mg / AOMワーキング溶液1kg(dH2O中に10 mg / mlの原液から希釈等張食塩水で1 mg / mlのは、-20℃で保管)で、それぞれのマウス腹腔内(IP)を注入。経験に基づいて、この線量は7から14 mg / kgおよび/または初期の実験では繰り返しの間で調節することができる。
注意:AOMは、揮発性の遺伝毒性物質であると添付のMSDSに従って慎重に扱われるべきである。希釈は、化学フードで準備氷上で維持しており、機関特有のプロトコルに従って捨てられるべきです。
- 0.22μmのセルロースアセテートFを介して蒸留水とパスで2.5%(2.5ミリリットル溶ける)DSS溶液を作る真空によってILTER。この用量は、マウス系統や環境に応じて1から3.5パーセントの間で調節することができる。最高1週間に一度準備し、DSS溶液は冷蔵保存することができます。
- 7日目、それらの飲料水としてマウスへの供給DSS溶液で。約250ミリリットル/ケージが新しいDSSを5匹/ケージの最大のために提供されてたびに必要となりますが、これらは推定値であり、あなたの動物施設で使用される水のボトルの種類によって異なります。
- 7日間のDSSの連続的な供給を提供するため、DSSソリューションは、この期間中にクリーンボトルで3回(2〜3日毎)を交換する必要があります。一部の研究者は、暴露の指標として新たな溶液と交換する前に消費された黄砂の量を測定する。
- 14日目に、2週間のために戻って標準の飲料水へのケージを切り替える。
- 手順を繰り返します(1.4) - (1.6)28日目と49は、DSSの2番目と3番目のサイクルを提供します。 DSSの "サイクル"は、飲料水中のDSSの一週間で構成されていますレギュラー(オートクレーブ)水を2週間続く。
2。臨床評価大腸炎と腫瘍の進行
- マウスは、週2-3回の重量を量った/観察されるべきである。ベースラインを基準にパーセント減量は大腸炎の重症度の代理指標として使用されています。直腸出血、下痢、または脱出の定期的な評価は、様々なスコアリングシステムによると実験目的に応じて行い、報告することができます9,10
- 下痢や直腸出血の2-3日と一緒に10%までの減量はDSSの完全なサイクル(毎日観察はこの直後のDSS期間中に役に立つかもしれません)次の週に期待することができる。
これは、いくつかのマウスが回復しない可能性もあり、彼らの体重の20%以上を失ったマウスは生き残る可能性が低くなりますと早期安楽死が必要な場合があります。 0.5単一のIP注射 - そのようなマウスでは1.0 mlの生理食塩水がfluiを訂正向かっ便利支え測定することができます D量が下痢のために失われた。
3。ネズミの内視鏡検査(オプション)
- DSSの2番目または3番目のサイクルの後に内視鏡検査は犠牲にする前に、in vivoで腫瘍の成長を確認するために実行することができます。 AOM / DSSモデルは、腫瘍の生産に非常に信頼性があるように、このステップは、一般的に必要ありません。それは、マウスの腫瘍を破壊する可能性を秘めているとしてほんの数マウスは、この方法を用いて評価する必要があります11
- 吸入または注射鎮静とマウスを麻酔。
- マウスを麻酔した後、尾と胸にテープで平らな板にマウスを固定します。
- 優しく腔内ビューを向上させ、糞便内容を削除するには、膨らませると灌漑に生理食塩水を用いて、マウスの直腸内にネズミの内視鏡を進める。 (腫瘍の改善されたビジュアライゼーションを提供するかもしれない内視鏡検査はまた、生理食塩水に代わる、この技術として、空気注入を使用して実行できることに注意してください。12)
- 70日目に、各AOM / DSS処理したマウスでは、複数の大腸腫瘍を抱くと評価のための準備ができているはずです。大きな腫瘍が望まれる場合、この日付は、数週間から数ヶ月遅れることがあります。 (ノートの、重度の直腸が脱出したマウスは、制度動物ケア委員会ごとなどの動物に過度の不快感を避けるために早期に安楽死させる必要があるかもしれません。)
- 剖検の前に、個別にイソフルラン及び頸椎脱臼(または他の施設内で承認された方法)でマウスを安楽死させる。最終的な重量と他の測定値は、現時点では行うことができます。
- まな板の上に露出し、その腹側にマウスを置きます。コロンの抽出の際に腹部の内容を汚染から毛を防ぐために、70%エタノールで腹部をカバーしています。
- 腹部の正中線を把握し、腹膜を露出させるために小切開を作るために鉗子を使用しています。
- 肋骨マルギに沿って腹部の両側にあるこの切開を延長nである。
- コロンは肛門直腸接合までに収穫できるように骨盤をカットするはさみを使用しています。のDSS大腸炎の傷害は、遠位直腸で最大であり、それに対応して、これが最大の腫瘍の開発の領域であるため、これは重要です。
- このような腸間膜リンパ節などの追加の組織も、この時点で収穫することができる。
5。巨視的分析のためにコロンを準備
- 5mlの注射器に取り付けられた強制経口18G針を用いて、生理的な方向に氷冷リン酸緩衝食塩水(PBS)など、流体出口とコロンをフラッシュします。結腸組織は、RNAまたはタンパク質ベースの分析のために使用される場合は、予冷作業トレーを採用することにより冷たい保つことができる。
- 冷たいトレイにその腸間膜や塗料に沿って長手方向に紅潮コロンを開きます。コロンは暗い表面上に配置されたときの腫瘍がより簡単に視覚化されます。別の方法として、1%アルシアンブルー色素がトンを強調するために適用することができますumors。定規やデジタルノギスを用いた腫瘍数と大きさを評価する。
- 腫瘍と隣接正常組織の小切片を組織学的評価のために、残りの大腸の一部を残して、RNA、タンパク質、または免疫組織化学(IHC)法によって将来の分析のために、この時点で切り出すことができる。
直ちにステップ5.2以下総結腸標本のデジタル写真は、上述したようにコロンの重要な部分を分析、他の形態のために切除している場合は特に、腫瘍量の正確な分析のために役立つことができます。腫瘍負荷(%)は、そのようなImageJのようなフリーソフトを用いて、腫瘍面積/全結腸領域として計算することができます。
6。組織学的評価のためにコロンを準備
- 注射器や指を介した冷たいトレイの残りのコロンに10%ホルマリンを適用します。組織は、このように、少なくとも30秒間固定できるようにすると、固定流域への転送を容易にします。残留ホルマリン仕掛品であることを確認してくださいedはオフ前に同じトレイに新規オープンしたコロンをペイントします。
- 10%ホルマリンで満たされた洗面器にコロンを転送し、エッジに突き止める。
- 固定の3時間後、70%エタノールにコロンを転送します。コロンは無期限に70%エタノール中で保存することができる。
- 大腸(直腸/遠、中、近位)の3つの長手方向のセクションが2%寒天で安定化され、パラフィン包埋を提示することができます。近位結腸と遠位結腸/直腸が各マウスについて均一に配向していることを保証する。
- 異形成、陰窩の損傷、炎症は以前に公開されたプロトコルに従って経験のある個人によって記述され、評価することができる。実験者が早期に形成異常のイベントを検出するに興味を持っている場合10は、13から15マウスは70日目の前に犠牲にすることができます。
7。代表的な結果
本明細書に記載されAOM / DSSモデルは、研究者が確実にマウスの大腸腫瘍を生成することができます。このモデルにおいて腫瘍増殖が直接関連付けられている炎症過程の影響を受けています。大腸炎の重症度は、下痢/血便の減量と存在します ( 図2)に従うことによって臨床的に監視する必要があります。疾患活動性のこれらの兆候は、DSSサイクルの5日目でとDSSが除去された後4日以上を開始する傾向がある。まれに、重要な直腸腫瘍の負担とマウスは直腸脱を開発することができません。後第二または第三のDSSサイクル下痢は、永続的になるかもしれません。一般的に腫瘍が存在し、前のDSSの第3サイクル( 図3)にマウス大腸内視鏡検査によって識別できます。追加の時間と収穫の時( 図4)で、大きな腫瘍でDSSの結果の3番目のコース。汚れ局所的に適用されるシアンブルーの使用は腫瘍( 図5)を強調するために用いることができる。大腸腫瘍の写真は、定量的に腫瘍生産と大きさを比較するために使用することができる腫瘍の測定値を生成するのに役立ちます実験群の間( 図6)。固定およびパラフィン包埋結腸標本はその後組織学のためにまたは免疫組織化学的染色を用いる( 図7、図8)を用いて評価することができます。
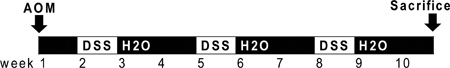
図1のAOMとDSS投与の概略図。 AOMは(10 mg / kg)を0日目に注入される。第二週(7日目)の先頭では、2.5%DSS溶液は、その飲料水のマウスに投与される。 DSSの七日間は、オートクレーブ滅菌水で2週間続いています。 DSSの追加の2つのサイクルが犠牲にする前に投与されています。

AOMとDSS投与中にベースラインを基準にして図2マウスの体重。週に各DSSサイクル、マウスロス続くことに注意してください E自分の体重の5-10%。この実験では体重減少が大腸炎の重症度のサロゲートマーカーである。
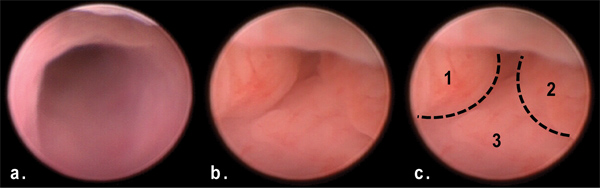
図3:AOM / DSS処理の50日に内視鏡を介してマウス遠位結腸に腫瘍の眺め。正常な大腸に比べて遠位結腸の内腔を閉塞する複数のポリープ状腫瘤(B、C)を()に注意してください。
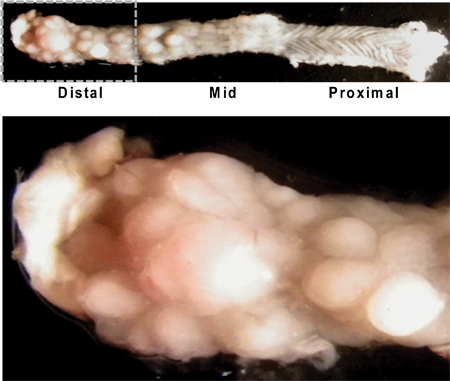
腫瘍の肉眼的形態を示す4。縦開きマウス結腸図 。遠位結腸/直腸(左上の画像)、そして少しの腫瘍の成長と近位結腸の特性rugatedテクスチャ(右上の画像)で高い腫瘍量を注意してください。遠位結腸の景色を間近では、さまざまなサイズ(下記)の多数の腫瘍を示しています。
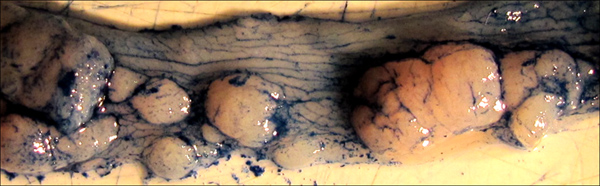
アルシアンブルーのアプリケーションによって強調図5腫瘍が染色。染料は結腸の正常質感だけでなく、個々の腫瘍の境界を強調する方法に注意してください。このような染色は、定規やデジタル測定による腫瘍領域を精密に測定するのに役立ちます。
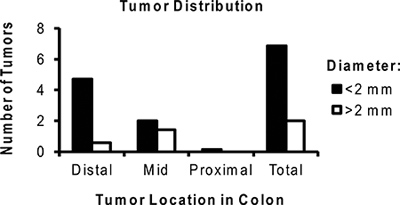
図6 AOM / DSSで処理したマウスあたりの腫瘍の平均数の代表的な分布。腫瘍の大部分は、遠位結腸に位置しています注意してください、サイズは<2 mmである。
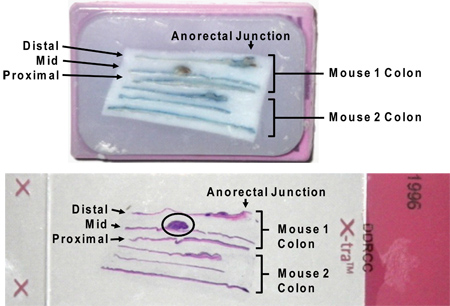
図7:カセットのコロンのパラフィン包埋縦断(上)H&E染色(下)次のスライドにd。シミブルー残留シアンはH&E染色と干渉しないことに注意してください。大きな腫瘍は、スライド画像(円内)に囲まれています。盲腸と肛門の間の3分の結腸全体を区画からの指定 "遠位"、 "中間"、および "近位"結果。

図8遠位結腸のAOM / DSS投与に起因する腫瘍の代表的な組織学。 H&E、BrdUを、と(トップパネル)50Xと400Xにおけるβ-カテニン染色スライド(下パネル)は、それぞれの人間の大腸腺癌と同様の異型性変化を示しています。
ディスカッション
AOMとDSSの迅速かつ効果的なモデルを用いたマウスの治療のヒト大腸炎関連癌。大腸炎関連癌に寄与する因子の遺伝に関する仮説は容易に遺伝子組み換えマウスに師事することができます13、あるいは16、大腸炎関連癌における薬理学的標的の効果は野生型マウスを使用することによって調べることができる。
このモデルは非常に炎症の設定における大腸?...
開示事項
特別な利害関係は宣言されません。
謝辞
この作品はDK089016とL30 RR030244(MAC)CA153036(AS)およびP30-DK52574(ワシントン大学消化器疾患メカニズムコアまで)によって部分的に資金を供給された。 AITは、ハワードヒューズ医学研究所医療研究研修フェローだった。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | 注釈 |
| C57BL/6Jマウス | ジャクソン研究所 | 000664 | |
| アゾキシメタン(AOM) | シグマアルドリッチ | A5486-100MG | 原液:0.5と-20℃に保たれるように蒸留水に希釈し10 mg / mlの- 1mlのアリコート。 実用的なソリューション:等張で1 mg / mlの(0.9%)食塩水に株式を希薄 |
| デキストラン硫酸ナトリウム(DSS) | TDBのコンサルティング | DB001 | MWの40 kDaの(他の情報源36から50 kDaの準備が許容され、同一のロットは、単一の実験に使用されるべきである)6 |
| Coloviewminiendoscopicシステム | カールストルツ | 複数 | Becker らを参照してください。機器とセットアップの詳細な説明については、図11 |
| TPPラピッドFILTERMAX 500ミリリットルのボトルフィルター、0.22μmのPES | 中西部科学 | TP99500 | 任意の標準的な組織培養フィルターは受諾可能である |
| エチルアルコール200プルーフのASC / USP | 薬理AAPER(またはその他の) | 11ACS200 | 蒸留水で70%に希釈 |
| イソフルランは、USP | バトラーアニマルヘルスサプライ | 4029405 | ガーゼや麻酔薬に浸した布で小さなガラスの瓶にマウスを置き、 |
| 18Gストレートニードル強制経口 | トリーサイエン | N-008 | |
| リン酸緩衝生理食塩水(PBS) | シグマアルドリッチ | P5493 | 蒸留水で1X(0.01M)に希釈 |
| コールドトレイ(ティッシュテックIIコールドプレート) | フィッシャー·サイエンティフィック | NC9491941 | -20℃で保存 |
| ImageJのソフトウェア | NIH(無料ダウンロード) | http://rsbweb.nih.gov/ij/ | |
| ホルムアルデヒド(37%) | フィッシャー·サイエンティフィック | F79-500 | PBS中10%に希釈 |
| BDのバクト寒天 | フィッシャー·サイエンティフィック | DF0140-01から0 | 蒸留水で2%溶液を作成するためにホットプレートを使用して、 |
| Miltex目のドレッシング鉗子 | MedPlus株式会社 | 18から780 | |
| Miltex瞳のはさみ | MedPlus株式会社 | 18から1430 | カーブドポイントが開いている間にコロンへの損傷を防ぐ。 |
| アルシアンブルー8GX(粉末) | シグマアルドリッチ | A5268 | 100ミリリットル3%酢酸(3 mlの氷酢酸+ 97 mlの蒸留水)に1グラムの粉末を追加 |
| 皮ベベル針の添付26 G×3/8と1 mLのツベルクリン注射器 | BD | 305946 | AOMの注射用 |
参考文献
- Ekbom, A. Ulcerative colitis and colorectal cancer. A population-based study. N. Engl. J. Med. 323, 1228-1233 (1990).
- Terzic, J. Inflammation and colon cancer. Gastroenterology. 138, 2101-2114 (2010).
- Ullman, T. A., Itzkowitz, S. H. Intestinal inflammation and cancer. Gastroenterology. 140, 1807-1816 (2011).
- Okayasu, I. Dysplasia and carcinoma development in a repeated dextran sulfate sodium-induced colitis model. J. Gastroenterol. Hepatol. 17, 1078-1083 (2002).
- Kanneganti, M., Mino-Kenudson, M., Mizoguchi, E. Animal models of colitis-associated carcinogenesis. J. Biomed. Biotechnol. 342637, (2011).
- Neufert, C., Becker, C., Neurath, M. F. An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression. Nat. Protoc. 2, 1998-2004 (2007).
- Tanaka, T. A novel inflammation-related mouse colon carcinogenesis model induced by azoxymethane and dextran sodium sulfate. Cancer Sci. 94, 965-973 (2003).
- De Robertis, M. The AOM/DSS murine model for the study of colon carcinogenesis: From pathways to diagnosis and therapy studies. J. Carcinog. 10, 9 (2011).
- Wirtz, S. Chemically induced mouse models of intestinal inflammation. Nat. Protoc. 2, 541-546 (2007).
- Cooper, H. S. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 69, 238-249 (1993).
- Becker, C., Fantini, M. C., Neurath, M. F. High resolution colonoscopy in live mice. Nat. Protoc. 1, 2900-2904 (2006).
- Becker, C., Fantini, M. C., Wirtz, S., Nikolaev, A., Kiesslich, R., Lehr, H. A., Galle, P. R., Neurath, M. F. In vivo imaging of colitis and colon cancer development in mice using high resolution chromoendoscopy. Gut. 54, 950-954 (2005).
- Shaker, A. Epimorphin deletion protects mice from inflammation-induced colon carcinogenesis and alters stem cell niche myofibroblast secretion. J. Clin. Invest. 120, 2081-2093 (2010).
- Boivin, G. P. Pathology of mouse models of intestinal cancer: consensus report and recommendations. Gastroenterology. 124, 762-777 (2003).
- Cooper, H. S. Dysplasia and cancer in the dextran sulfate sodium mouse colitis model. Relevance to colitis-associated neoplasia in the human: a study of histopathology, B-catenin and p53 expression and the role of inflammation. Carcinogenesis. 21, 757-768 (2000).
- Yoshida, Y. The forkhead box M1 transcription factor contributes to the development and growth of mouse colorectal cancer. Gastroenterology. 132, 1420-1431 (2007).
- Suzuki, R. Strain differences in the susceptibility to azoxymethane and dextran sodium sulfate-induced colon carcinogenesis in mice. Carcinogenesis. 27, 162-169 (2006).
- Mahler, M. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. Am. J. Physiol. 274, 544-551 (1998).
- Nambiar, P. R. Preliminary analysis of azoxymethane induced colon tumors in inbred mice commonly used as transgenic/knockout progenitors. Int. J. Oncol. 22, 145-150 (2003).
- Tanaka, T. Colorectal carcinogenesis: Review of human and experimental animal studies. J Carcinog. 8, (2009).
- Ciorba, M. A. Induction of IDO-1 by immunostimulatory DNA limits severity of experimental colitis. J. Immunol. 184, 3907-3916 (2010).
- Kerr, T. A. Dextran sodium sulfate inhibition of real-time polymerase chain reaction amplification: A poly-A purification solution. Inflamm. Bowel Dis. 18, 344-348 (2012).
- Tang, Y. is required for resection-induced changes in apoptosis, proliferation, and members of the extrinsic cell death pathways. Gastroenterology. 126, 220-230 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved