Method Article
マウスノロウイルスのプラークアッセイ
要約
ここでは、効率的に細胞培養で複製のみノロウイルスですマウスノロウイルス(MNV)の感染性粒子を定量化する方法を説明します。プラークアッセイは、マウスのマクロファージのためにMNVの向性を活用し、MNVを含む生物学的または環境試料での使用に適合させることができる。
要約
マウスノロウイルス(MNV)が効率的に組織培養1,2で育つノロウイルス属の唯一のメンバーです。細胞溶解および細胞変性効果(CPE)をマウス樹状細胞やマクロファージ1のMNV-1感染の間に観察される。 MNV-1のこのプロパティは、プラークアッセイ1を実行することによって、与えられた試料中の感染性粒子の数を定量化するために使用することができます。プラークアッセイは、細胞を溶解し、プラークと呼ばれる3コンフルエントな細胞単層に穴を形成するためにMNV-1の能力に依存しています。
複数の手法は、組織培養、採取された組織、臨床、環境試料中のウイルス感染を検出するために使用ではなく、すべてのメジャー感染性粒子の数( 例えば定量RT-PCR)。することができます感染性ウイルス粒子を定量化する1つの方法は、以下に詳細に説明するプラークアッセイ3を実行することです。 MNVのプラークアッセイのバリエーションは、蛍光であるMNVの抗原が細胞単層4で免疫染色され自己消費フォーカスアッセイ。ウイルス抗原の発現はプラーク形成に先行するので、このアッセイは、高速化することができます。また、プラークを形成することができませんウイルスを滴定するのに便利です。しかし、蛍光フォーカスアッセイは、そのような抗体およびフォーカス形成単位をカウントするための顕微鏡などのプラークアッセイのものを超えて追加のリソースが必要となります。 MNVの感染も50%組織培養感染量(TCID 50)3を決定することにより定量することができる。このアッセイは、エンドポイントの滴5によって接種組織培養細胞の50%のCPEを生成するために必要なウイルス量を測定します。しかし、検出限界は、プラークアッセイ4に比べて高くなっています。
この記事では、我々は効果的に、生物学的または環境試料1、4、6に存在する感染MNVの粒子の数を決定するために用いることができるプラークアッセイプロトコルを記述します。この方法は、BAです許容細胞(RAW 264.7マウスマクロファージ細胞)の単層を接種するために使用されているMNVの含有試料の10倍希釈系列の作成に関するSED。ウイルスは、特定の期間のために細胞単層に付着させた後、アガロースおよび細胞培養培地の混合物を用いて細胞を覆う前に吸引される。遠くにある細胞に広がりを制限しながら、寒天は、隣接する細胞にウイルス子孫の広がりを可能にします。その結果、感染した細胞を溶解し、プラークとして知られている単層の穴を形成している。ウイルスの十分普及すると、プラークはニュートラルレッド、メチレンブルー、またはクリスタルバイオレットのような染料を用いた細胞の可視次の染色になります。低希釈で、各プラークは隣接セルに広がる1感染性ウイルス粒子とその子孫に由来します。このように、斑の数をカウントすると、1つは、無希釈サンプル3に存在するプラーク形成単位(PFU)を計算することができます。
プロトコル
1。 RAW 264.7マクロファージ細胞株の培養
- 10%(v / v)の低エンドトキシンウシ胎児血清(<10 EU / ml)で高グルコースDMEMで構成されたDMEM-10メディアのRAW 264.7細胞(ATCC、カタログ番号TIB-71)、10mMのHEPESを維持、100 U / mlペニシリン、100μg/ mlのストレプトマイシン、1mMの非必須アミノ酸、2mM L-グルタミン。細胞は典型的に組織培養インキュベーター中℃、5%CO 2をフラスコあたりのメディアの35ミリリットルを含有し、37℃でインキュベート175cm 2の組織培養フラスコ内に保持されます。しかし、任意のサイズのフラスコをフラスコのサイズに適しているメディアのボリュームで使用することができます。
- セルを分割するには:、古いメディアを吸引細胞に新鮮なDMEM-10培地10mlを追加し、セルスクレーパーを用いてフラスコの底から細胞をこすり取る。次に、10mlのピペットに細胞を策定し、強制的にピペットチップPRを介して細胞を圧搾して均一な溶液に細胞を再懸濁フラスコの底にessed。少なくとも3回の細胞はもはや塊に、一緒にこの操作を繰り返します。単一細胞懸濁液が生成された光学顕微鏡で確認します。新しい175cm 2のフラスコに細胞懸濁液2ml(1:5希釈や〜2×10 7細胞)、およびメディアの最終容量を最大もたらす-その後1ミリリットル(1:10希釈や〜1×10 7個の細胞)を転送する35ミリリットル。
- 彼らはほぼコンフルエントに分割したセル(〜1×10 8個の細胞total/175 cm 2のフラスコ):3日ごとに1:5希釈で始まる場合1:10希釈、または2日ごとに始まる場合。セルの分割前に、細胞の形態を確認するために、光学顕微鏡を使用しています。細胞のほとんどはラウンドとアクティブになっていないはずです。活性化した細胞は、顆粒および/または付属した拡張、ひょろっとした形態を有する。これらの細胞は一般的にプラークを形成しないように細胞の過剰増殖を聞かせてはいけません。継代数を追跡し、頻繁に細胞の下通路アリコートを解凍して最初からやりなおす。 (我々は、カットオフとして通路30を使用します)。
2。 MNVの接種でRAW 264.7細胞に感染
- DMEM-10培地中で1×10 6生細胞/ mlの密度で6ウェルプレート(3.5 cmの直径)にシードRAW264.7細胞を、各ウェルに、この懸濁液2mlを加える。手で少なくとも10回プレートを揺動させたり〜10分間ロッキング装置を使用することによって、ウェル中に均等にセルを配信することが重要です。スワールプレートを、これは井戸の中心でクラスタに細胞の原因になりますのでしないでください。プレースプレート組織培養インキュベーター(37℃、5%CO 2)に変換します。細胞を37℃で一晩または少なくとも4時間アタッチすることを許可するプラークアッセイのために80%コンフルエントとうまく全体に均等に分布 - 細胞は60でなければなりません。
- 翌日、組織培養やMNVの感染マウスの均質化された組織あるいは糞便サンプルからMNVの感染細胞からできるウイルス接種物を準備します。組織サンプルを用いて、豆粒大のパイ組織のecesは組織ホモジナイザー(;ロシュ例えば MagnaLyser)を使用したDMEM-10を1mlの滅菌シリカビーズを含む2 mlのスクリューキャップ付き試験管中で均質化されています。糞便サンプルについては、3つ以下に糞を1mlの培地中で均質化されるべきである。すべてのサンプルは、次に凍結(-80℃)とプラークアッセイを実行する前に、一度解凍されています。
- DMEM /高グルコースから構成されて完全DMEM-5培地、5%(v / v)の低エンドトキシンウシ胎児血清(<10 EU / ml)を、10mMのHEPES、100にウイルス接種物の10倍希釈液を調製するU / mlペニシリン、100μg/ mlのストレプトマイシン、1mMの非必須アミノ酸、2mM L-グルタミン。
- 十倍の連続希釈物を、24ウェルプレートで調製される:リピーターピペットが複数のウェルに1.35ミリリットルメディアを分配するために使用され、10 -1希釈は、メディアの1.35ミリリットルとウイルス含有試料の0.15ミリリットルを混合することにより形成されており、その後10 -1希釈の0.15ミリリットルを10 -2 dilutioを作るために、メディアの1.35ミリリットルに追加されますnおよびように。ヒントあなたが新しい希釈を行うたびに変更することが重要です。マルチチャンネルピ ペットをウエル当たり0.15ミリリットルの総量を転送する24ウェルプレートの各ウェルに1フィッティングの2つのヒント( 図3Aを参照)で、一度に複数のサンプルの希釈液を作るために使用することができます。
- 組織ホモジネートおよび糞便内容の典型的な希釈範囲は10 -1〜10 -3である。しかし、これらのサンプルからのプラークは組織培養サンプルからのものに比べて小さくなる傾向があります。さらに、いくつかのケースでは糞便サンプルの1:100希釈液は、このようにプラークをカウントするための能力を妨げ、十分に細胞単層を混乱させる可能性があり糞の任意の毒性成分を希釈するために必要とされる。組織培養溶解物の希釈範囲は、ウイルスのライフサイクルの中で興味のある時点に依存します。 10 -9まで行く希釈は、感染のピーク時に必要となる場合があります。
- 連続希釈液を調製した後、6ウェルプレートにラベルを付けるsは、サンプル名とめっきさ希釈で、RAW264.7単層を(セクション2.1から)を含む。一度に一つのプレートには、それをフリックしたり、それを吸引することによりすべてのメディアを取り出してください。直後ウェルに希釈した試料0.5 mlを追加してから、次の希釈に進む前に、よく重複して繰り返します。すべての3つの希釈液を1プレートに添加されると、すべてのセルがカバーされていることを確認するために、手でプレートを前後に傾けます。細胞が乾燥しないよう保証するために、一度に一つのプレートを処理します。
- 各ウェルに希釈液の0.5mlを加えた後、直立板をスタックして、室温で1時間のためにそれらをインキュベートする。各ウェルに加え、ボリュームが完全に単分子層をカバーするのに十分ではないので、プレートは優しく15分間隔で、手で前後に傾けたり揺動装置(毎分〜18振動)に配置する必要があります。これは乾燥から細胞を防ぐことができます。
3。低融点アガロース(SeaPlaque)オーバーレイ準備
注:それは前もって準備オートクレーブしSeaPlaqueアガロースを持ついくつかのボトルを持っていることをお勧めします。アガロースは、使用前に電子レンジで再溶融させることができる。
- 1時間のインキュベーションが完了する前にプレートの全体積に必要なオーバーレイの量を計算します。必要なボリュームは2 ml /ウェルまたは12 ml/6-well板である。アガロース(3.2節参照)とは別にメディア(3.3項を参照)を用意します。
- アガロースを調製するために、ガラスの瓶の中に100mlの蒸留水(3%w / v)の総体積でSeaPlaqueアガロースの3グラムを中断します。 20〜30分間のオートクレーブ。 (アガロースはすでに、電子レンジで再溶融アガロース手の前に準備されていた場合。)それはアガロースが熱く℃の場合、使用前に水浴中で、それが細胞を殺すために42にSeaPlaqueアガロースを平衡化することが重要です。水位が望ましくない凝固を避けるためにアガロースのレベル以上であることを確認します。
- メディアを準備するには、次から構成されて2倍MEM培地、100mlを作る2倍MEM、10%(v / v)の低エンドトキシンウシ胎児血清(<10 EU / ml)を、10mMのHEPES、100 U / mlペニシリン、100μg/ mlのストレプトマイシン、4 mM L-グルタミン。 ℃の水浴中で37にメディアを平衡化します。
- 感染した細胞単層を重ねる直前に1:1の割合で無菌の瓶の中に一緒にSeaPlaqueアガロースおよび2x MEM培地の両方を混在させる。以上の200ミリリットルのオーバーレイが必要な場合は、複数のボトルに分割ボリュームと37℃の水槽に使用する準備ができるまで続ける。
- 1時間のインキュベーション(セクション2.7参照)の終わりには、各ウェルの接種を吸引。徐々に各ウェルの壁にピペットチップを配置することによって、各ウェルの端にオーバーレイの2 mlを加える。最大5つのプレートには、細胞が乾燥せずに同時に処理することができます。
- オーバーレイは組織培養インキュベーターに直立板を配置する前に、室温で約10分間凝固させる。 5%CO 2で37℃で48時間プレートをインキュベートする。
- 後に潜伏期間は、プラークは肉眼でかすかに見えているので、プラークの存在のために染色されていないプレートを確認してください。全くプラークが表示されていない場合は、追加の4時間インキュベートして、再度確認してください。しかし、最大のインキュベーション時間は72時間を超えてはいけません。
4。ニュートラルレッド染色によるプラークの可視化
- 、 - 1X PBS(組織培養グレード、Mg 2 +のすべての97ミリリットルに、プラークを可視化するために、ニュートラルレッド染色液は、ニュートラルレッドの3ミリリットル(Sigma社、カタログ番号N2889 DPBS中0.33パーセントw / v)を添加することにより調製されるのCa 2 + -自由; Gibco、カタログ#10010)。実験に必要なニュートラルレッド染色液の体積を計算:12ミリリットルニュートラルレッド染色液を各6ウェルプレートに必要です。その後、各ウェルに2ミリリットルを追加します。いくつかのプラークアッセイプロトコルはアガロースプラグをウェルから除去する必要があるが、このプロトコルでニュートラルレッド染色液は、オーバーレイに直接追加されます。
- で1時間後プラークがまだウェル内のニュートラルレッド染色液で表示されている場合は37℃でcubationは、チェックしてください。プラークは容易に明らかでない場合は、染色は別の時間継続することができます。プラークが見えるようになるまでインキュベートし続ける。 (注:以上で3時間染色が最適ではなく、全くのプラークは染色の3時間後に陽性対照試料中に表示されていない場合には、プラークアッセイが正しく動作しませんでした)染色が完了した後、ニュートラルレッド染色液を吸引、アガロースプラグを確保することが妨げられ、その後プラークをカウントに進んでいません。
- ライトボックスに逆さまに皿を置いて、重複カウントを避けるために数えプラークのドットをマークすることで、プラークをカウントします。 (一緒にプラーク定着の視覚的証拠、 すなわちん )プラークが明確に分離されてウェル内のプラークをカウントするための希釈を選択してください。可能であれば、2希釈でプラークをカウントします。そのプラークサイズがMNV株、ウイルス接種の間で異なるかもしれません注意することが重要である、とに依存プラークアッセイ中に、RAW264.7細胞の状態。
- 恥プラークは井の中の見えない、いずれかのサンプルには存在するウイルスやウイルスの量は、プラークアッセイの検出限界以下でありませんでした。このケースでは、井戸は他のプラーク含有井戸と同様の色で赤を染色。与えられた希釈に存在あまりにも多くのウイルス粒子が存在する場合あるいは、プラークの有無も観察されています。これは、全体の単層の溶解につながると井戸の色は黄色/オレンジ色に表示されます。
- ウイルス力価を計算します。シングル希釈でウェルの両方でプラーク数を追加し、希釈係数( すなわち 1ミリリットル2ウェルを0.5ミリリットルに感染している場合)を掛けます。これは、1ミリリットルのあなたの接種ボリューム内プラーク形成単位(PFU)の量が得られます。たとえば、10 -2希釈で、図4に、よく1(以下"II"のマーク)14プラークを持っており、他の井戸は( "V"のマーク)17プラークを持っています。したがって、ウイルス力価は14となりますX10 2 + 17x10 2 = 3100(3.1x10 3)PFU / mlであった。
5。代表的な結果
感染MNV-1粒子は、 図1に模式的に概説したようにプラークアッセイを用いて定量化することができる。 図2A、図2Bは、ローマ数字Ⅰ、Ⅱで示した3つの可視プラークを示しているが、単に感染の前に、RAW264.7細胞の単層でよく示し井の中のおよびIII。アッセイの個々のステップは、F. 図3A〜図3Aに示されているウイルスを含む検体の10倍希釈系列の調製を示す。 図3Bは、6ウェルプレートのウェルを複製するための希釈液の転送を示します。 図3Cは、1時間室温で接種でRAW264.7細胞を培養するために使用されるロッキング装置を示し、図3Dは、細胞がSeaPlaqueでオーバーレイされている例を示します。MEM図3Fは、48時間後に0.01パーセントニュートラルレッド溶液で染色された細胞を示している混合物。 図3Eは 、オーバーレイが固化するために室温でプレートを示します。 1から3時間、細胞を染色し、ニュートラルレッド染色液を吸引した後、プラークが表示されます( 図4)をカウントすることができます。
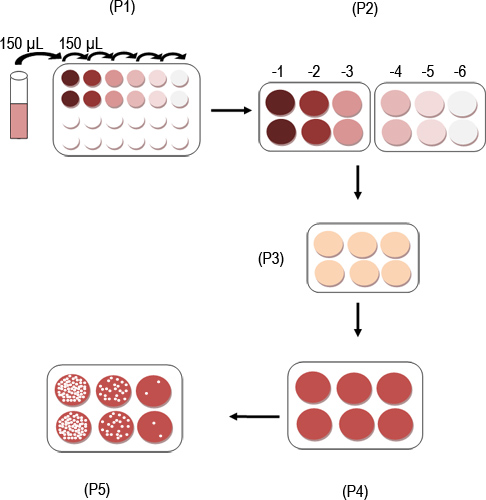
図1 MNVのプラークアッセイプロトコールの模式図。
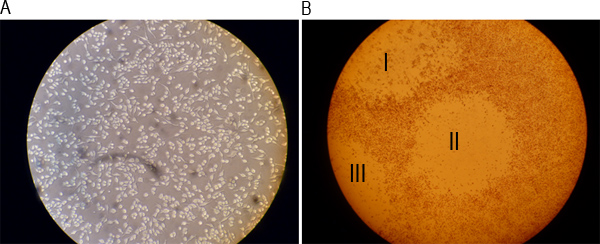
図2単層の井戸の代表的なイメージは、感染前とプラークの形成後。 )RAW264.7細胞は20倍の倍率で光学顕微鏡下で一晩培養し、画像化した。 b)細胞は48時間後に0.01パーセントニュートラルレッド溶液で染色した感染のRと4倍速倍率で光学顕微鏡下で可視化した。ローマ数字I、II、およびIIIは、3つの可視プラークを示す。
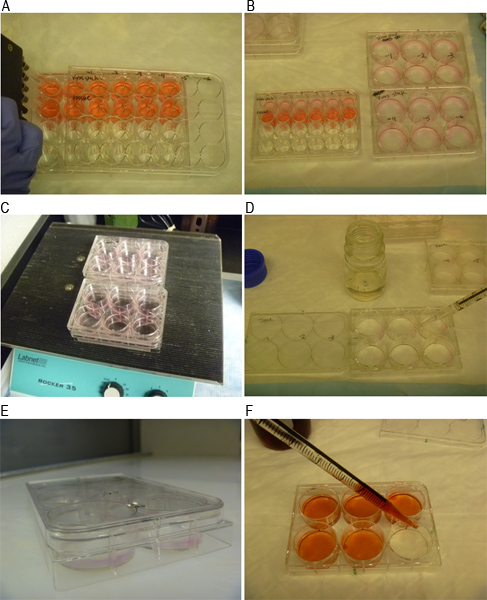
図3異なるプラークアッセイ手順の代表的な画像。 A)はMNV-1接種は、10倍希釈液で調製される。 B)の接種は、重複したウェル内の細胞単層に追加されます。 c)細胞および接種物を室温で1時間インキュベートすることにより揺動されています。 d)細胞はSeaPlaqueアガロースおよび2x MEM培地の1:1混合物でオーバーレイされます。 E)のプレートをオーバーレイが固化するために室温で10分間インキュベートする。ニュートラルレッド染色液を48時間後に感染した細胞のF)を染色。
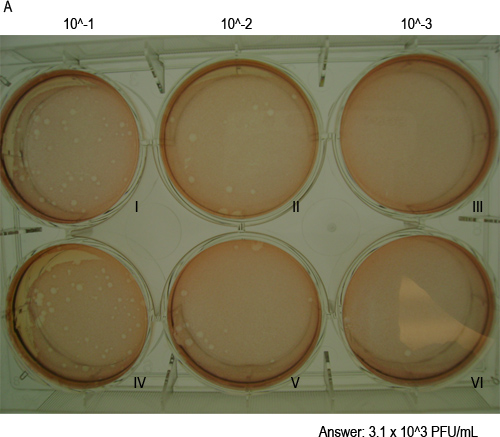
セルモノオールの図4。MNV-1フォームプラークエアーズ。ここに示されているインキュベーションの1時間後にニュートラルレッド染色液で染色したプラークを示す、代表的なプラークアッセイプレート48時間後に感染症である。プレートには、3つの10倍希釈のウェルを示しています。ローマ数字で標識されたウェルズは、IとIV 10-1希釈に対応し、IIおよびV 10-2希釈に対応し、IIIおよびVIは10-3希釈に対応しています。サンプルのウイルス力価は、(計算の詳細は、4.5項を参照してください)以下に示されます。
ディスカッション
ここに提示さMNV-1のためのプラークアッセイ法は、感染MNVの粒子を定量化する方法である。 図3に示されているアッセイの手順に従うことによって、1は、再現性のウイルス力価を得ることができます。アッセイの検出限界は使用する原料希釈に依存します。上記のようなサンプルの1:10希釈で始まる場合には、プラークアッセイの検出限界は10 PFU( すなわち、10 -1希釈で見える1プラーク)です。各プラークは、単一のウイルスを表すので、プラークアッセイはまた、単離されたプラークをピッキングし、それらを先に説明した1伝播することによってMNVのクローン集団を精製するために使用することができます。また、プラーク精製は、混合ウイルス集団から個々のウイルス集団を分離するために使用することができます。 MNVの感染を検出するためのプラークアッセイを使用しての制限ではなく、すべてのMNVの株がプラーク4を形成することである。しかし、それはinabiliを克服することが可能かもしれない直列組織培養7に、これらのウイルスを継代することによりプラークを形成するために、動物から単離されたいくつかのMNVの株のTY、。プラークアッセイの代替は、TCID 50のテクニック3、4を介して感染性粒子を測定することです。このアッセイは、エンドポイントの希釈後に接種し、組織培養細胞の50%のCPEを生成するために必要なウイルス量を定量化し、MNVの4のために完了するには、1週間かかります。プラークアッセイよりも遅いことに加えて、TCID 50アッセイはまた、小文字は区別されません(検出限界= 200 TCID 50 / ml)のRAW264.7細胞は4〜組織サンプルの毒性のために。
プロトコルの中の重要なステップは、プロトコル全体に記載されているが、次のセクションでは、トラブルシューティングを容易にするための概要を提供します。プロトコルの中で最も重要なステップは、RAW264.7細胞は、ウイルスの複製をサポートするためのアッセイを通じて生存し続けることを確実にすることです。これは、することができます光学顕微鏡を介して、アッセイの各段階で監視される。細胞生存率は2つの方法で確保されている。まず、注意がプレートを取り扱いながら、細胞が乾燥させないように注意するべきです。したがって、プレートは、一度に1つを接種し感染期間中に揺れ、それらが処理されていないときは閉じたままにしてくださいされています。細胞上に追加された2番目の、解決策は〜37℃に平衡化する必要がありますさらに、それは細胞の活性化を制限し、低エンドトキシン血清(<10 EU / ml)を含む培地中で、それらを維持するために、RAW264.7細胞の全体的な健康のために不可欠です。通路30以上から細胞を用いたときに加えて、我々はプラークアッセイの高い故障率を観察している。これはおそらくラボからラボごとに異なりますが、それはより高い通路RAW264.7細胞を使用する場合は特に、再現性の力価を確実にするために( 例えば、既知のウイルス力価を有するサンプル)をポジティブコントロールを含めることが重要です。高継代細胞の使用を制限するためには、早期のPASSAのバイアルを凍結することをお勧めしますGEは、RAW264.7細胞の受領細胞と頻繁に凍結バイアルから新しい文化を開始します。細胞は、付着する障害、細胞形態の変化(ひょろっとへのラウンドからなどと広がる)で使用する場合、またはマイコプラズマ汚染が検出されたとして、変更された特性を示すときに低継細胞培養でやり直すことも参考になります。に注意を払うためのもう一つの重要なポイントは、ピペットの先端がサンプル間及び希釈液中に変更されることを保証することである。これは、正確な希釈を確保し、サンプル間のクロスコンタミネーションを防止します。同じピペットチップを再び使用できるプロトコルの1つのステップは、同じサンプルの連続希釈液をウェルに添加されている場合があります。その場合、1が最も希釈接種から少なくともに起動し、新しい希釈を描画するときに激しくピペッティングしてください。
プラークアッセイプロトコルは、いくつかの修正に修正可能です。トン行うことができます一つの修正ここで二重に井戸を接種するための十分な細胞がないそれぞれの希釈のためにのみ単一ウェルに接種することです。接種量は0.5ミリリットルなのでしかし、プラークの数がPFU / mlになるように正規化するために2の係数を乗じなければならない。プラークアッセイはまた、MNVのレプリケーションをサポートすることができる任意の他の付着性の細胞株での使用に適合させることができ、これはマウスミクログリアBV-2細胞株8に記載されています。実装することができる他の修飾には、他のウイルスのために開発プラークアッセイプロトコルで説明されている適応されています。 MNVの場合には、以下の修正がすでに正常に実装されているのではなく海のプラークのメチルセルロースの使用アガロース9、代わりにニュートラルレッド10、11のクリスタルバイオレットまたはメチレンブルーを用いた細胞の染色を。
全体的に、このプロトコルは、簡単に他のプラーク形成ウイルスを定量化するために、必要に応じて適応またはOTHに使用することができますそれは一般的に感染性ウイルス粒子を定量化するための便利なツールとなって、RAW264.7細胞における溶解感染を引き起こす小胞体ウイルス。
開示事項
特別な利害関係は宣言されません。
謝辞
私たちは、批判的なコメントと提案についてWobus研究室のメンバーに感謝。 CEWの実験室での作業は、ミシガン大学、バイオ防衛のための優秀NIH / NIAIDの地域センターと新興感染症研究所(RCE)、プログラム、地域V "グレートからキャリア開発助成金から立ち上げ資金によって賄われていた湖 'RCE(NIH賞1-U54-AI-057153)およびNIH R01 AI080611。 MBG-H。ミシガン大学実験免疫学研究所(NIH T32 A1007413-16)病原微生物学における分子機構(NIH T32 A1007528)訓練助成金によって賄われていた。 JBCはブラジル、ブラジリア、CoordenaçãoデAperfeiçoamentoデPessoalデNívelスーペリア(CAPES)によって賄われていた。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | |
| DMEM /高グルコース | Hyclone社 | SH30243.02 | |
| 2倍、MEM | ギブコ | 11935 | |
| 100xのペニシリンおよびストレプトマイシン | Hyclone社 | SV30010 | |
| 10mMの非必須アミノ酸 | Hyclone社 | SH30238.01 | |
| 1M HEPES | Hyclone社 | SH30237.01 | |
| 200 MM(100倍)、L-グルタミン | Hyclone社 | SH30034.01 | |
| ウシ胎仔血清 | ギブコ、Hyclone社 | 10437、SH30070.02 | |
| 海プラークアガロース | ロンザ | 50100 | |
| ニュートラルレッド0.33パーセント | シグマ | N2889 | |
| 1X PBS | ギブコ | 10010 | |
| 1.0mmのジルコニア/シリカビーズ | BIOSPEC製品 | 11079110z | |
| モデル35スピードロッカー | Labnet | S2035 | |
| マグナライザー·インストゥルメント | ロッシュ | 03358968001 | |
| RAW 264.7細胞株 | ATCC | TIB-71 | |
| 組織培養インキュベーター | 三洋 | MCO-18AIC |
参考文献
- Wobus, C. E. Replication of Norovirus in cell culture reveals a tropism for dendritic cells and macrophages. PLoS Biol. 2, e432 (2004).
- Wobus, C. E., Thackray, L. B., Virgin, H. W. Murine norovirus: a model system to study norovirus biology and pathogenesis. Journal of virology. 80, 5104-5112 (2006).
- Condit, R. C., Knipe, D. M., Howley, P. M. Ch. 2. Fields Virology. 1, 25-58 (2007).
- Thackray, L. B. Murine noroviruses comprising a single genogroup exhibit biological diversity despite limited sequence divergence. Journal of virology. 81, 10460-10473 (2007).
- Reed, L. J., Muench, H. A simple method for estimating 50% endpoints. American Journal of Hygiene. 27, 493-497 (1932).
- Chachu, K. A. Antibody is critical for the clearance of murine norovirus infection. Journal of virology. 82, 6610-6617 (2008).
- Barron, E. L. Diversity of murine norovirus strains isolated from asymptomatic mice of different genetic backgrounds within a single U.S. research institute. PLoS ONE. 6, e21435 (2011).
- Cox, C., Cao, S., Lu, Y. Enhanced detection and study of murine norovirus-1 using a more efficient microglial cell line. Virology journal. 6, 196 (2009).
- Cooper, P. D. The plaque assay of animal viruses. Adv. Virus Res. 8, 319-378 (1961).
- Hyde, J. L. Mouse norovirus replication is associated with virus-induced vesicle clusters originating from membranes derived from the secretory pathway. Journal of virology. 83, 9709-9719 (2009).
- Simmonds, P. Bioinformatic and functional analysis of RNA secondary structure elements among different genera of human and animal caliciviruses. Nucleic acids research. 36, 2530-2546 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved