Method Article
ヘルパー依存型アデノウイルスベクターによる遺伝子導入による糖尿病マウスの肝臓におけるネオ·膵島形成
要約
我々は、ヘルパー依存性アデノウイルスベクター(HDAd)と高血糖の反転を用いた遺伝子Neurogenin3の転送(Ngn3)とベータセルリン(BTC)によりSTZにおける肝ネオ膵島形成(ストレプトゾトシン)誘発糖尿病マウスを記述します。我々の方法は、生体内伝達および長続きが遺伝子発現におけるそれらの高効率を持つヘルパー依存型アデノウイルスベクターの機能を活用できます。
要約
1型糖尿病は、膵臓のインスリン産生細胞のT細胞媒介性自己免疫破壊によって引き起こされます。膵島移植は、ドナーの可用性ごとおよび長期免疫抑制の必要性により制限されているので、今までインスリン補充は、依然として主要な治療法です。 Neuogenin3の遺伝子導入(Ngn3)によって誘導される膵島新生、膵島系譜定義する特定の転写因子とは、ベータセルリン(BTC)、膵島の成長因子は、1型糖尿病を治すために可能性を秘めています。
アデノウイルスベクター(広告)は、高効率遺伝子導入ベクターであるが、初期世代の広告は 、in vivoで使用中のため、いくつかの欠点を持っています。ヘルパー依存型広告(HDAds)は、広告の初期世代の安全性プロファイルを向上させ、導入遺伝子の発現1を延長するために開発された最も先進的な広告です。彼らはウイルスコード配列2-5を欠いているとだけ広告シス elを保持するので、彼らは慢性毒性を欠いているベクター複製とパッケージングに必要なements。これは、36キロバイトの遺伝子までのクローニングを可能にします。
このプロトコルでは、HDAd-Ngn3とHDAd-BTC生成するとSTZ誘発糖尿病マウスにこれらのベクターを提供する方法について説明します。我々の結果は、それがHDAd-Ngn3の同時注射と肝臓でHDAd-BTC誘発 'ネオ小島'示し、糖尿病マウスの高血糖を反転させます。
プロトコル
1。 HDAdシャトルベクターに治療用遺伝子をクローニング
- ユビキタス伸長因子-1プロモーター(BOS)とポリAシグナルが含まれていpLPBL1プラスミドベクターへのクローンマウスNgn3とBTCのcDNA。終了時には、配列分析によってベクトルを確認してから、6プラスミドpΔ28HDAdシャトルにこれらの発現カセットをサブクローニングする。
- プラスミドバックボーンを解放するためのPmeIによってダイジェストHDAdシャトルベクターは、トランスフェクショングレードの水とエタノール沈殿と再構成に続いてフェノール/クロロホルム/イソアミルアルコール抽出によってDNAを精製する。
2。ヘルパー依存型アデノウイルスベクター生産
HDAdベクトル生産は慎重に最適な結果を得るために従われる必要のある複数のステップが含まれます。
2.1トランスフェクション
- トランスフェクションの日に70〜80%コンフルエントに到達するために二日間6cmシャーレへのトランスフェクション、シード116細胞7時前。
- トランスフェクションの3時間前に、培地を除去し、新鮮な増殖培地5mlを追加[MEMは、Invitrogen社、10%FBSおよび1%PSG(ペニシリン、ストレプトマイシンおよびグルタミン)を補充した]。
- 製造元の指示に従って、PromegaからProFectionR哺乳類トランスフェクションキットを用いて、ステップ1.2)から10μgのDNAと116細胞にトランスフェクション、。
- 翌日、増殖培地を1mlで2回細胞を洗浄する。カルシウムとマグネシウムを含有するPBS 0.1 mlに500ベクター粒子(VP)/セルでヘルパーウイルス(HV)を追加(PBS + +)とセルにオーバーレイ。優しく均等にHVを10分毎に配布するために皿を揺する。
- 60分後、維持培地(MEM、5%FBS、1%PSG)の1.5 mlを加える。
- 翌日培地メンテナンスの別の1ミリリットルを追加します。
- CPEのための細胞( - 細胞が丸く、外れ細胞変性効果)を確認します。細胞の80%以上は2日、感染後にCPEを示すべきである。
- 粗細胞ライセート(CVL、細胞と培地)、収集-80℃で40%のスクロースおよびストアのDD 10%体積℃、 (CVL-P0) - CVLは通路0と表示されています。
2.2ベクトル増幅
- 凍結(-80℃、3〜5分)/解凍(37℃、1〜2分)3回。
- オーバーレイ0.5ミリリットルCVLは6cmディッシュでコンフルエント116細胞〜200 VP /セルでHVを補充し、ゆっくりと5分毎に皿を揺する。 30分後、1 mlの維持培地を追加します。
- 維持培地翌日の1ミリリットルを追加します。 2日後、細胞の大部分は、CPEを示すべきである。
- -80℃(CVL-P1)のステップ2.1.8で説明した)でCVLや店舗を収集します。
- CVL P2-P4を得るために3回の手順を繰り返します。
- HV-とHDAd特異的プライマーを( 表1)を用いて、P1〜P4で収集、およびqPCRによりベクター増幅を分析CVLの0.2ミリリットルからのDNA(DNeasyブラッド&ティッシュキット、Qiagen)を抽出します。指数関数的にsubsequenため( 図2のP3)がHVに相対増幅HDAdた通路を使用トン手順。
- 200 VP /セルで0.5ミリリットルCVLとHVと15センチメートル皿に90%コンフルエント116細胞を共感染させる。皿を優しく5分毎を揺する。 30分後、維持培地10mlを加える。
- 24時間後に維持培地5mlを追加します。
- 感染後48時間で正確に5分間1500 xgで遠心分離により細胞を回収する。
- -80℃でPBS + +を含む4%スクロース(P5)と凍結の1ミリリットル℃の再懸濁細胞
2.3大規模HDAd生産
- 懸濁細胞培養における感染の116細胞を調製するために、3Lのスピナーフラスコに8×15cmのディッシュでコンフルエント116細胞を転送して(Joklik改変MEM、5%FBS、0.1 mg / mlのハイグロマイシンおよび1%で補充サスペンション増殖培地を追加PSG)が最後の1リットル、60回転8でスピンしてCO 2インキュベーター中でインキュベートする。
- 新鮮な培地で2日間毎日(合計2リットル)の0.5 Lを追加します。
- 三日目に細胞をカウントする。トンに到達した場合の細胞は、使用する準備が整いました1×9のo総細胞数。
- 凍結/解凍P5は3回。
- 5分間、1,000×gで遠心分離することにより3 Lスピナーフラスコから細胞を収集します。再懸濁細胞上清100mlを保存します。
- 250mlのスピナーフラスコに細胞を移します。 37℃で1時間、200 VP /細胞に対する細胞とインキュベートし、60rpmでCでP5とHVを追加します。
- 転送細胞と培地に3 Lスピナーフラスコは、2Lのサスペンション増殖培地を追加します。 CPEのための細胞を観察するために、12ウェルプレートにウェルに1 mlの細胞懸濁液を移す。
- 60rpmでCO 2インキュベーターで2日間のスピナーフラスコ中で細胞をインキュベートします。
- 遠心分離により細胞を回収し、精製するまで-80℃(P6)で15ミリリットル100mMのトリス-HCl(pH8.0)及び店舗で再懸濁する。
2.4ベクトルの浄化
- P6に5%デオキシコール酸ナトリウム1.0mlを追加します。穏やかに混合し、室温で30分間インキュベートする。
- 2MのMgCl 2を 、300μの400μlを加えRNアーゼA(10 mg / ml)を、300のDNase I(10 mg / ml)を添加し、1時間37℃でインキュベートlの。
- 上清を回収し、室温で10分間6000 xgで遠心分離します。
- 組織培養フードで1時間の紫外線下でのNVT 65超遠心管(ベックマン)滅菌する。
- 首にチューブを埋めるために低密度のCsCl溶液(1.25グラム/ ml)を、高密度CsCl密度ソリューションの下敷き 2.8ミリリットル(1.41g/ml)して上清のオーバーレイ 5〜6ミリリットルの2.8ミリリットルを追加します。必要に応じて管を埋めるために100mMのトリス-HCl液(pH8.0)を使用します。
- 10時10遠心分離機で50,000 rpmで30分間°C、ベックマン、LE-80KがNVT-65ローターを用いたC。
- 針穿刺のた めの70%エタノールで拭き、サイド穿刺( 図3a)で22-Gの針を備えた3ミリリットル注射器を用いて低い乳白色のバンドを集めています。時には非常にかすかなヘルパーのバンドがより顕著ベクトルバンドの下に見ることができます。番目の限りを取得しようヘルパーバンドなしできるだけEベクターバンド。それは次以降の一夜遠心分離で分離されるように、ヘルパーバンドのいくつかは、吸引された場合でも、この手順では許容されます。
- 新しい滅菌遠心管に集めたバンドを置きます。 1.35グラム/ミリリットルのCsCl密度ソリューションを重ねて首にチューブを埋める。
- 10一晩5万rpmで℃で遠心分離します。乳白色のバンド( 図3b)を採取します 。
- 透析カセット(スライドインアナライザ、10,000 MWCO、サーモサイエンティフィック)にバンドを転送します。
- 4℃で一晩2mMのMgCl 2および4%スクロースを含むオートクレーブし、10mMのTIS-HClで、pHは7.2の3リットルに対して透析する。
- 透析カセットからHDAdベクトルを削除します。物理的な力価およびDNAの特性評価のために、50μlのアリコートを20μl。 (注:Ngn3ベクトルは、HDAd-Ngn3の収率はHDAd-BTCまたはHDAd、空に比べて貧弱であるため、十分なベクトルを得るために "P6"を3回繰り返します。)
HDAdベクトルの2.5キャラクタリゼーション
- 光学密度(OD)を使用して、物理力価(VP / ml)を決定します。 20分間56℃で0.1%SDS中でインキュベート°Cを含む380μlのTE緩衝液に20μlのベクトルまたは20μlの透析バッファーを追加します。 260 nmでのODを測定します。物理的な力価= OD260×1.1×10 12×20(VP / mlとなる)。
- 定量PCRによってHV汚染を分析します。 DNeasy組織/血液のDNA抽出キット(Qiagen)を用いてDNAを抽出するために50μlのアリコートを使用しています。 DNAを1000倍に希釈し、ヘルパーとベクター特異的プライマー( 表1)を用いて qPCR解析のための5μlを取る。ヘルパー汚染は、 図4(a)に示すように、1%未満でなければなりません。
- ベクトル構造を分析するためにサザンブロットを使用しています。逆方向末端反復配列(ITR)のプローブを用いてサザンブロット分析10を実行します 。代表的な結果を図4Bに示されている。
- in vitroでの有効性を判断します。既知の感染千四重におけるVp /セルでHDAdベクトルと12ウェルプレートに116細胞の数。 48時間後に細胞を回収し、定量RT-PCR( 表1)でNgn3とBTCのmRNAの発現を決定するためにRNAを抽出します。代表的な結果を図5に示す。
3。 HDAd-Ngn3と-BTCによる糖尿病マウスの治療
3.1マウスにおける糖尿病の誘発とHDAdベクターの注射
- STZの準備:0.1Mクエン酸緩衝液を用意し、4.3から4.5にpHを調整する。 0.22ミリメートルのシリンジフィルターを通してこれをフィルタリングします。滅菌水を使用すると、pHが4.2から4.5のクエン酸ナトリウム、0.01Mにこれを希釈します。 12.5 mg / mlの最終濃度を達成するために、このソリューションでは、STZ(Sigma)を、適切な量を溶かす。この濃度ではなく降水量がありません。 4でこのSTZソリューション°Cまで使用してください。注入直前に室温に注入液の温度を持参してください。 STZソリューションshoul毎日新たに調製し、溶解して5〜10分以内に注入することと思います。
- 5月7日午後(ライトはマウス施設でオフとマウスは積極的に供給開始される前)の間、夕方にこのソリューションのSTZを腹腔内(125μg/ gの体重の用量を達成するために、10μL/ gm)は、注入、 2日間連続で9。
HDAdベクトルの3.2監視マウスのグルコースと注射。
- 6時間とマウスまで毎週測定体重や血糖のための高速なマウスは、高血糖(≥250mg/dl)を持っています。尾スニップによって採取した血液のためのワンタッチグルコメーターを使用しています。一度血糖値は、永続的な高血糖と血糖値を確保するための高速6時間48時間後に再度≥250 mg / dlで、再検査血糖である治療のための目標範囲内である:250から500 mg / dlで。
- 尾静脈を介してHDAdベクトルの単回静脈内注射することによって、持続高血糖を持つマウスを扱う。合計ベクトル量は6×10 11 vpのです; Ngn3グループの5×10 11 vpのNgn3 + 1×10 11 VP;とBTCグループの1×10 11 vpのBTC + 5×10 11 vpの空のベクトルと組み合わせグループの5×10 11 vpのNgn3 1×10 11 vpのBTC:全ての投与群(0.25 mlで)のために対照群では6×10 11 vpの空のベクトル。
- 尾静脈注射。 Tailveiner制止(TV-150、ブレーンScientific社)にマウスを置くと、尾静脈を拡張するために暖かい水を使用し、70%アルコールで尻尾をきれいにしてください。親指と右手の人差し指で注射部位下記の尾を持ち、注射のための別の手を使用しています。注射前にシリンジ内の気泡が(30 1/2 G、針と1mlシリンジを使用して)がないことを確認してください。針を挿入して、ベクトルをゆっくりと注入します。針が静脈内にある場合は、血液のフラッシュが針のハブで見られ、また、注入時にも抵抗はありませんすることができる。針を除去した後、マウスにtを返す前に、出血を止めるためにガーゼで注射部位を保持するOケージ。
針が静脈に注入されていない場合、少し皮下膨疹が生じるに著しい抵抗がある。この時、針を取り外して、別のサイトで、再度実行してください。
HDAd-Ngn3 + HDAd-BTC治療の効果の分析3.3。
- モニタ6時間空腹時血糖値とベクトル処理後毎週体重。
- 市販のキットを用いてアッセイインスリン(マウスインスリンELISAキット、Mercodia)と肝酵素(ASTとALTインフィニティ試薬、サーモサイエンティフィック)に、2週間ごとに脚の伏在静脈または尾静脈から血液を採取します。
- 閉端で行われた穴にキャップされていない50mlのFalconチューブにマウスを置きます。
- マウスの頭は管の開放側のチューブと脚と尾の閉鎖端にある。左脚から血を収集するには、管の外に左脚を伸ばすと優しく足を固定するために親指と人差し指の間の太ももの皮膚をつまむ。
- 使用下肢の側面上に存在している伏在静脈を露出させるために、脛/下肢領域から毛を削除するシェーバー、。 70%アルコールで剃毛皮膚をきれいにし、それを乾燥させます。
- 穿刺25ゲージ針で伏在静脈を、Microvette CB300チューブ(ザルスタット)で血液を採取し、氷の上にチューブを入れます。
- ケージにマウスを返す前に、出血を止めるためにガーゼで穿刺部位を押してください。
- 5分間3000 xgで遠心する、さらなる分析のために-20℃で上清とストアを取る。
3.4は、治療後6週間でブドウ糖負荷試験(GTT)を行ってください。
- 15%ブドウ糖(15グラム/ 100ミリリットル)と滅菌フィルターグルコースを蒸留水にD-グルコース(Sigma社)を溶解した。
- 6時間ファストマウス。マウスを温め、血液(0分時点)を収集するために暖かいパッドを使用します。その後、D-グルコースのipの1.5グラム/キログラム(15%グルコースを10μl/ g)を注入します。
- 鞍部15分、30分、60分、120分で血液を言語変種。
- すべてのこれらの試料中のグルコースとインスリンを測定します。
3.5組織分析のベクターの発現を評価し、膵島新生の誘導を評価する。
これらすべての手順で確実に結果を解釈するために必要とされるコントロールが含まれます:(1)空のベクトルは、糖尿病マウスを治療した(2)非糖尿病マウス及び膵島の発現のための陽性対照として(3)非糖尿病膵臓特定のホルモンおよび転写因子。
- 治療後3〜6週間で収穫の肝臓と膵臓。 2個、免疫組織化学分析のために一晩10%ホルマリンで固定するRNAとタンパク質抽出のためのC言語-80℃で液体窒素やストレージのスナップ凍結のための第一、第二に分かれる。
- confirに標準プロトコルによりRNAを抽出し、膵島特定のホルモンおよび転写因子の発現を解析し、Ngn3と共に及びBTC特異的プライマー(9)(10)を用いて定量RT-PCRによる肝臓でのm個のベクトル式。
- 酸 - エタノール抽出法により肝臓からのインスリンとC-ペプチドを抽出し、市販のELISAキット(超高感度インスリンアッセイ、Mercodia、C-ペプチドELISAキット、和光)により定量化する。
- セクション9、10、パラフィン包埋の膵島特異的な転写因子と共に膵島特定のホルモン(インスリン、グルカゴン、PP、SST)に対する免疫染色を実行します。 Ngn3とBTCの発現はまた、免疫染色によって確認することができる。
4。代表的な結果
我々は、Ngn3、ユビキタスプロモーターeIF2a(BOS)によって駆動され、HDAd-Ngn3とHDAd-BTC生成pΔ28ベクターへのcDNAをクローニングしたBTC。 図2に示すように、相対的なHVの汚染は通路3で(もっとベクター増幅と少ないヘルパー増幅を意味する)有意に減少した。したがって、我々は、その後のベクトル生産のため、P3を使用していました。最初の後CsClの不連続勾配超遠心分離は、我々は最低のベクトルバンドを収集し、次に2番目の超遠心でHDAdベクトル( 図3)に対応した乳白色のバンドを集めた。精製HDAdベクトルは、定量PCRでHV汚染の1%未満である( 図4A)を持っていた( 図4B)ブロッティングマウスへのベクターの注入のために十分な品質を示す南部に見えないヘルパーの汚染がありませんでした。さらなる分析は、116細胞の感染により導入遺伝子の発現が含まれていた。 Ngn3とBTCのmRNA発現レベルは非感染細胞( 図5)のものと比較万倍以上によりベクター感染細胞で高かった。
HDAd-Ngn3と-BTCは、その後、空のベクター注入し、ネガティブコントロールとしてHDAd-BTC注入された糖尿病マウスの尾静脈注射を介しSTZ誘発糖尿病マウスに投与した。高血糖はインスリン分泌を覆し、グルコース刺激されました単一遺伝子ベクターまたはコントロール空ベクター( 図6)で処置したマウスにおけるHDAd-Ngn3とHDAd-BTCの両方ではなくで処置したマウスで復元されました。 HDAd-Ngn3-BTC治療誘発性膵島新生、これはコントロールとして非糖尿病、糖尿病、空のベクター投与したマウスで総インスリンとC-ペプチド含量( 図6E)をアッセイすることにより定量した。等モル比におけるc-ペプチドとインスリンの存在は、肝臓で検出されてインスリンが実際に肝臓で合成されていることを確認します。 RT-QPCRはHDAd-Ngn3-BTC処置したマウスの肝臓はすべての膵島特異的ホルモンや転写因子9を発現していることを確認した。免疫組織化学はHDAd-Ngn3とHDAd-BTCで処置したマウスの肝臓ではインスリン陽性細胞を認めたが、全くインスリン陽性細胞はコントロールベクター( 図7)で処置したマウスでは観察されなかった。我々はまた、Ngn3-BTC treateの膵臓における残存膵島がなかったことが確認され非糖尿病膵臓の多数の小島に比べてdマウス。膵島特定の系統の転写因子と一緒にベクトル(Ngn3とBTC)(PDX-1とNkx6.1)発現はまた、( 図7)は、肝臓の免疫染色により評価した。
ヘルパー依存性ウイルスシステムを用いた糖尿病マウスの遺伝子治療の図1のフローチャート。まず、Ngn3とBTCは、ユビキタスBOSのプロモーターによって駆動されるカセットに、HDAdシャトルバス(pΔ28)ベクターにクローニングされています。 HDAdは、トランスフェクション、増幅の連続継代し、ベクタ·精製を行い、大規模感染を含むいくつかのステップによって生成されます。質を特徴付ける後、HDAdsを尾静脈経由STZ誘発糖尿病マウスに静脈内注射する。治療の効果はグルコース、体重、GTTと遺伝子発現の解析によりを測定することにより評価される肝臓インチ
図2測定HDAdベクトル増幅。 DNAは、DNA抽出キット(Qiagen)を用いて、P4に通路P0から抽出されます。 DNAは1,000倍と5μlのDNAをリアルタイムPCR(定量PCR)のために使用され希釈される。ヘルパーとベクター特異的プライマーを使用しています。標準曲線をHDAdシャトルベクタープラスミドとHVプラスミド(上のパネル)の段階希釈(10 -5〜1 ng / ml)をすることによって生成される。ベクトルとヘルパーウイルスコピー数を標準曲線とCt値を使用してが計算され、HDAd / HVの比率は合計ウイルスの割合(ヘルパー+ HDAd)としてプロットされます。したがって、相対ベクトル増幅は次のように計算されます[ベクターのコピー数/(ベクター+ヘルパーウイルスのコピー数)]。相対HDAd / HVはP3で増加している間、P4で頭打ちHDAdベクター増幅(下のパネル)に示す例では。したがって、P3は、後続のステップのために選択されます。
図3代表HDAdベクトルバンド不連続CsCl密度遠心後。 HDAdベクトルはシーケンシャルCsCl密度勾配上3Lスピナー培養物から精製されています。 ()は、最初の密度勾配超遠心分離した後、シングル乳白色ベクトルバンドが不透明な細胞の破片(CD)の下(矢印)が表示されます。乳白色のバンド(矢印)が第二密度勾配遠心分離のために収集される。 (B)第二密度勾配超遠心分離した後に、乳白色のバンド(矢印)が透析のために収集されています。
図4ヘルパーウイルス汚染の分析。 DNAは50μlの精製されたウイルスから抽出され、ヘルパーの汚染がある図2のようにssessed。図はHDAd-Ngn3とHDAd-BTCのヘルパー汚染は1%未満であることを示している。
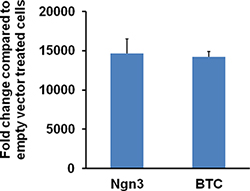
図5。 HDAdベクターの構造の分析。サザンブロット(岡K ら 。)前述したように実行されます。レーン1:ヘルパーウイルス由来のDNA、レーン2:P3からのDNA、レーン3:P4からDNA、レーン4:精製vectopr。オープン矢印はヘルパーウイルス由来のバンドを示し、矢印は満たさHDAdベクター由来のITRのバンドを示す。
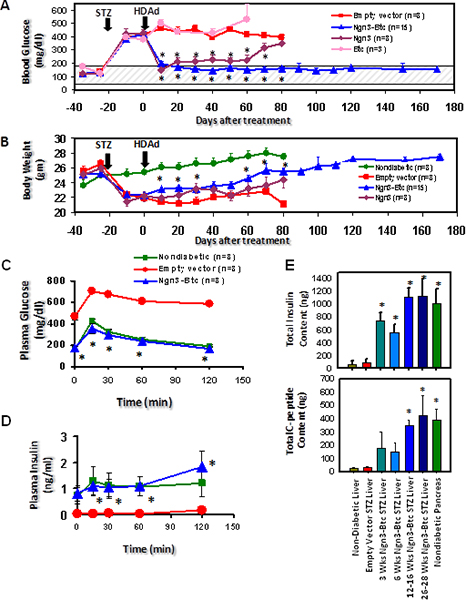
図6 HDAd-Ngn3またはHDAd-BTCベクターを感染116細胞におけるNgn3またはBTCの発現レベル。 12ウェルプレートの116細胞を、1000年2日間VP /セルでHDAd-Ngn3またはHDAd-BTCまたは空ベクターで感染させる。 CeのLLSを採取し、全RNAをTrizol試薬を使用して抽出されます。定量RT-PCRをNgn3またはBTC-特異的なプライマーを使用して実行されます。相対Ngn3またはBTCのmRNAの発現はHDAd-Ngn3またはHDAd-BTCに感染した細胞内の10,000倍以上の増加となりました。図はDev.Cell 2009年03月から転載され、16(3):358から73; Yechoorら。ら、エルゼビアの許可を得て。
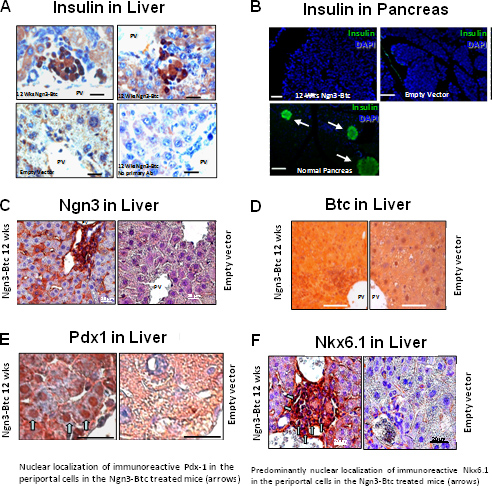
図7は、STZ誘発糖尿病マウスへのHDAd-Ngn3とHDAd-BTCの遺伝子導入は、肝臓での糖尿病および膵島新生の誘導の逆転につながる。 (A)は血漿グルコース及びHDAd-Ngn3とHDAd-BTCで処理したSTZ誘発糖尿病マウス(B)の体重。 (C)は、治療後6週間で、IP-GTT時の血漿グルコースとインスリン。 12週間の治療後の肝臓における(D)代表インスリン染色。 * P <0.05(対空のベクトルグループ)。図はdevから転載されています。セルリットル2009年03月、16(3):358から73; Yechoor ら 、エルゼビアの許可を得て。
| 名前 | フォワードプライマー | プライマーを逆 | |
| ヘルパー | GACCATCAATCTTGACGACC | ATGTCGCTTTCCAGAACCC | |
| ベクトル | TTGGGCGTAACCGAGTAAG | ACTTCCTACCCATAAGCTCC | |
| Ngn3 | AAGAGCGAGTTGGCACTCAG | TCTGAGTCAGTGCCCAGATG | |
| BTC | GCACAGGTACCACCCCTAGA | TGAACACCACCATGACCACT | |
表1プライマー配列。
ディスカッション
HDAdsは、初期世代の広告の弱点を克服するために、遺伝子治療アプリケーション用に活用するために開発されている。しかし、技術的な課題が残っている。たとえば、HDAdはHDAdの包装とベクトルを増幅するためのHVは初期世代の広告ほど効率的ではありませんが必要です。 HVは、第一世代の広告とHV妥協HDAdの有効性の汚染である。したがって、各継代のために非常に効率的なトランスフェクションし、最適な条件が重要である。ベクトルの生産のためのもう一つの重要なパラメータは、直接浮遊細胞用種菌として使用され、その後の通路5に使用されるべきである通路(P1〜P4)です。我々の経験に、最良の結果がHDAdベクトル割合が劇的に次の一節( 図2のP3)に増加していることで通路を使用することによって得られる。 HDAdベクターの収量は、導入遺伝子カセットに依存します。両方の遺伝子が下にあるので、ベクトル生産時には、両方の導入遺伝子が発現されるユビキタスプロモーター。 Ngn3は、転写因子とBTCは、そのことを表現成長ホルモンは、ベクトルの複製とパッケージングするのに役立ちますしながら細胞系統に影響を与える可能性の転写因子を発現HDAdベクターはベクター増幅を阻害を示唆している成長因子である。
糖尿病が大流行と想定すると、B細胞塊を復元するための新たなアプローチが必要とされている。本報告書では、膵島成長因子と共に膵島系譜定義する転写因子、Ngn3の遺伝子導入を行うためにHDAdベクトルの利点を活用する方法を記述し、ベータセルリンは、肝臓の門脈周囲の地域で膵島新生を誘導した。これの有効性を評価するためには、安定した高血糖を持つマウスを選択し、適切なコントロールが常に含まれていることを確認することが重要です。この遺伝子導入実験では、空のベクター治療糖尿病マウスは常に利用されるべきである。また、糖尿病のマイルは個別に扱わHDAd-Ngn3とHDAd-BTCを使用してceは膵島新生におけるこれら二つの遺伝子の個々の貢献をテストするために提供しています。我々のデータは、単独でNgn3、膵島新生を誘導するのに十分であることを示しているが、成長因子、BTCの添加は膵島新生の強力な誘導につながる応答を増大するのに役立つ。としてこれは、ベクトル表現が実際に標的組織、肝臓で達成され、また、処置されたマウスの血漿中でアッセイインスリンは膵臓の不在を証明することによって、膵臓の残留膵島から来ていないことを実証することをテストすることも重要である糖尿病マウスの膵島。
要約すると、遺伝子導入のためのHDAd - ベクター系の利点は、その高いクローニング能力、効率的な伝達と最小慢性毒性ならびに宿主へのベクターのゲノムの非統合のその性質を持つ肝臓で長期的な遺伝子発現にある染色体。主要な制限は、その世代とに関与する複雑な手順です。生体内のアプリケーションで主に最も人気のある広告の血清型5と肝臓に限られています。膵島新生は完全膵島成長因子、ベータセルリンと共に膵島系譜定義する転写因子、Ngn3の遺伝子導入することにより、肝臓での膵島新生を誘導することによって、糖尿病マウスにおける血漿インスリンと耐糖能を復元するように誘導することができる。本報告では、我々は高品質HDAd-Ngn3とHDAd-BTCを生成するために最適なプロトコルを示しており、高血糖症を逆に糖尿病マウスの肝臓において膵島新生を誘導し、評価するためのテクニックを紹介します。
脚注:ウイルスベクターおよびここで説明された細胞株は、ベクトルの生産コア研究所糖尿病研究センターは、ベイラー医科大学(から入手可能であるhttp://www.bcm.edu/mcb/index.cfm?pmid=7731 )。いくつかの市販のキットには、HDAdウイルス( 例えば Microbix biosyst生成するためにも利用できますEMS社)。
開示事項
特別な利害関係は宣言されません。
謝辞
この作品は、NIHからの補助金によって支えられて:R03 DK089061-01(VKY); NIH:K08 DK068391(VKY)、糖尿病·内分泌研究センター - (DERC - P30DK079638)ベイラー医科大学からパイロット&フィージビリティ助成DERC(VKY)、若年性糖尿病研究財団:JDRF賞#5-2006-134(VKY)。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | |
| ProFectionR哺乳類トランスフェクションキット | プロメガ | E1200 | |
| DNeasyブラッド&ティッシュキット(50) | キアゲン | 69504 | |
| パーフェクSYBR Green Supermixを、ROX | クアンタサイエンス | 95055-500 | |
| デオキシコール酸ナトリウム | シグマ | D6750-25G | |
| MEM粉末 | インビトロジェン | 61100087 | |
| ペニシリンストレプトマイシン | シグマ | 15140122 | |
| FBS | アトランタバイオ | S11150 | |
| L-グルタミン酸 | インビトロジェン | 25030-081 | |
| ハイグロマイシンB | シグマ | H0654-1G | |
| MEM EAGLE JOKLIK | シグマ | M0518-10L | |
| RNアーゼ | ロッシュ | 10109169001 | |
| DNase Iを、グレードII | ロッシュ | 10104159001 | |
| ストレプトゾシン | シグマ | s0130 | |
| ガラススピナーフラスコ | コーニング | 4500-3L | |
| ガラススピナーフラスコ | コーニング | 4500-250 | |
| -アナライザcassetをスライドさせて | ピアスCH | PI66380 | |
| チューブoptisealポリallomer、11.2ミリリットル | ベックマン·コールター | 362181 | |
| 塩化セシウム1キロ | JT4042-2 | VWR | |
| ベックマンLE-80K | ベックマン·コールター | 最適なLE-80K超遠心 | |
| フィルター | VWR | 28143-338 | |
| 管500メートルを遠心リットル | コーニング | 431123 | |
| tailveiner制止 | ブレーントリーの科学的、INC | TV-150 | |
| インスリン、マウスELISA | Mercodia | 10-1247-01 | |
| microvette CB300 | ザルスタット | 16.443.100 | |
| D-グルコース | シグマ | G8270 | |
| マウスC-ペプチドELISAキット | 和光純薬工業株式会社 | #631から07231 | |
| モルモット抗インスリン抗体 | アブカム | ab7842 | |
| ヤギ抗PDX1抗体 | 博士クリストファー·ライトからの贈り物 | ||
| マウス抗Ngn3抗体 | ベータ細胞生物学コンソーシアム、 東大。ペンシルベニア州の | AB2013 | |
| マウス抗Nkx6.1抗体 | ベータ細胞生物学コンソーシアム、 東大。 Pennsyのlvania | F64A6B4 | |
| 抗ベータセルリン抗体 | セルサイエンス | PAAQ1 | |
| ALT(SGPT)色試薬セット。 | テコ診断 | A526 - 120 | |
| AST /(SGOT)、カラーエンド試薬セット | テコ診断 | A561-120 |
表2に特異的な試薬および器具。
参考文献
- Parks, R. J. A helper-dependent adenovirus vector system: removal of helper virus by Cre-mediated excision of the viral packaging signal. Proc. Natl. Acad. Sci. U. S. A. 93, 13565-13570 (1996).
- Kim, I. H., Jozkowicz, A., Piedra, P. A., Oka, K., Chan, L. Lifetime correction of genetic deficiency in mice with a single injection of helper-dependent adenoviral vector. Proc. Natl. Acad. Sci. U.S.A. 98, 13282-13287 (2001).
- Belalcazar, L. M. Long-term stable expression of human apolipoprotein A-I mediated by helper-dependent adenovirus gene transfer inhibits atherosclerosis progression and remodels atherosclerotic plaques in a mouse model of familial hypercholesterolemia. Circulation. 107, 2726-2732 (2003).
- Oka, K. Long-term stable correction of low-density lipoprotein receptor-deficient mice with a helper-dependent adenoviral vector expressing the very low-density lipoprotein receptor. Circulation. 103, 1274-1281 (2001).
- Nomura, S. Low-density lipoprotein receptor gene therapy using helper-dependent adenovirus produces long-term protection against atherosclerosis in a mouse model of familial hypercholesterolemia. Gene Ther. 11, 1540-1548 (2004).
- Ng, P. A high-efficiency Cre/loxP-based system for construction of adenoviral vectors. Hum. Gene Ther. 10, 2667-2672 (1999).
- Palmer, D., Ng, P. Improved system for helper-dependent adenoviral vector production. Mol. Ther. 8, 846-852 (2003).
- Oka, K., Chan, L. Helper-Dependent Adenoviral Vectors. Current Protocols in Molecular Biology. , 16.24.1-16.24.23 (2005).
- Yechoor, V. Neurogenin3 is sufficient for transdetermination of hepatic progenitor cells into neo-islets in vivo but not transdifferentiation of hepatocytes. Dev. Cell. 16, 358-373 (2009).
- Yechoor, V. Gene Therapy with Neurogenin 3 and Betacellulin Reverses Major Metabolic Problems in Insulin-Deficient Diabetic Mice. Endocrinology. , (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved