Method Article
電気生理学基づき固体支持された膜の概要
要約
ここでは、起電膜輸送体の特性評価への応用を中心とした固体担持膜に基づいて電気生理学的手法を提案する。
要約
我々は提示電気生理学的方法は、金コーティングされたセンサーチップと上にホスファチジルコリン単層に化学吸着オクタ層からなる固体支持された膜(SSM)に基づいています。このアセンブリは、参照電極、塩化銀線を含むキュベットシステムに取り付けられている。
膜断片または目的の膜タンパク質を含有するプロテオリポソームの吸着した後、高速の液交換は、膜タンパク質の輸送活性を誘導するために使用される。単一ソリューション交換プロトコルでは、2つの溶液、一つの非活性化と1つの起動溶液を、必要とされる。流れはファラデーケージ内の加圧空気と弁と配管システムによって制御される。
起電輸送活性の動態は、SSM及びプロテオリポソームまたは膜断片との間の容量結合を介して得られる。この方法は、従って、得られるだけtransienT電流。ピーク電流は、固定輸送活性を表す。時間依存トランスポーター電流は回路解析により再構成することができる。
この方法は、特にパッチクランプや電圧クランプ法によって調査することができない細胞内膜、原核生物から真核生物またはトランスポータートランスポーターに適しています。
概要
ここでは、起電性膜タンパク質の特性評価のための固体支持された膜(SSM)に基づいて、新しい電気生理学的アプローチを示しています。
固体支持体は、ガラススライド、センサーチップ上に薄い金の層からなる。親水性の金表面はalcanethiol試薬のチオール基をバインドするために使用されます。その後、selfassemblyホスファチジルコリンmonolyerのは、SSMの形成が完了する。
膜タンパク質の起電反応を測定するために、プロテオリポソームまたは膜断片は、SSM( 図1)に吸着される。膜およびSSMを含むタンパク質は、その後容量結合膜系を形成する。したがって、タンパク質含有膜における電荷移動は、SSMを介して容量結合により検出することができる。このメソッドは、過渡電流が得られます。ピーク電流は、固定輸送活性を表す。時間依存性トランスポーターCUrrentsは、回路解析により再構成することができる。
センサチップは、キュベットシステム( 図2)に取り付けられている。キュベットはμlの17の円筒キュベット体積を有する(O-リング付きネットボリュームがマウントされた)。スプリングコンタクトピンはアンプへの連絡先を作成。出口コネクタは、本体部の頂部に螺と基準電極、塩化銀線を担持する。
キュベットは、ファラデーケージに取り付けられている。これは、高速溶液交 換機( 図3)に応答して、膜タンパク質の輸送活性を誘導するために使用される流体通路に接続されている。単一のソリューション交換プロトコルでは、2つの解決策、一つの非活性化と1活性化溶液は、必要とされる。フローは、インターフェイス·ボックス上のコンピュータまたは手動のスイッチでバルブ制御ソフトウェアを使用して加圧空気によって制御される。
プロトコル
1。 SSMベースの電気生理学のための装置のセットアップ
詳細はまた、当社のキュベットの概略図面や写真が含まれており、1、2を設定し、当社の技術的な出版物の2に示されている。別のソリューション交換構成とフロープロトコルも提案手法紙2で説明されています。
以下では、いくつかの最近の改善とビデオプレゼンテーションのための直接の関連がある技術的な詳細を追加します。
バルブ制御およびデータ収集
インターフェースボックスは、市販のUSBデジタル出力/アナログ入力インタフェース(NI USB 6009ナショナルインスツルメンツ)とバルブドライバが含まれています。これは、溶液の流れを制御し、データ収集を担当する。バルブは、通常12で駆動される。しかし、高速スイッチング用バルブは18までの電圧で駆動することができますV.ビデオでは、我々は12 Vの電源を使用してください。
弁駆動回路基板は、4つのバルブを操作することができる。それは、生物物理学のマックスプランク研究所の工房で製造されました。バルブはコンピュータによって制御するか、手動でフロントパネルのスイッチを経由してすることができます。後者は、クリーニング手順とをフラッシュするために便利です。測定中には、インターフェイス·ボックスは、バルブ制御およびデータ収集ソフトウェア(SURFE 2 Rソフトウェア、IonGate Biosciences)を使用して、コンピュータ制御される。
2。準備
このセクションでSSMベースの電気生理学実験の調製のための異なるプロトコルが挙げられる。
2.1 SSMを形成するための脂質溶液を作る
- 25μlのオクタデシル(クロロホルム中5 mg / ml)でとGLASバイアルで375μlのDiphytanoylphosphatidylcholineを(クロロホルム中20 mg / ml)で混ぜる。
- ロータリーエバポレーターおよび連続窒素気流を用い、クロロホルムを蒸発させるための約30分。
- n-デカン500μlの振とうすることによりガラスバイアルの壁から脂質を取り除きます。最終脂質濃度は、1:60(w / w)のオクタデシルアミン、15 mg / mlのである。
- ガラス貯蔵バイアルにソリューションを移す。 -20℃で脂質溶液を保存する
参照電極の2.2塩素
参照電極は、摩耗による定期的に塩素化されなければならない。
- 塩素化プロセスの前に目の細かいサンドペーパーを使用して、古いsilverchloride層の残りの部分を削除します。
- 0.5ミリアンペアで15分間1 M塩酸溶液と塩素系に白金電極と一緒に銀線を配置します。塩素化を完了した後、銀線は均質濃い灰色に変色します。
ポリアクリルアミドゲルブリッジの2.3調製
- でpH = 7、100 mMの塩化カリウムと6時の100mMのKPiを含む溶液を調製%がアクリルアミド。
- 0.3%APS(10%株式)とTEMED 0.6%を追加して、まもなくピペットでソリューションを混ぜる。
- 直ちに溶液を混合した後、空のゲルブリッジ容器に混合液30μlを注入するピペットを使用しています。注入時に気泡を避けることが重要である。
- 20分のインキュベーション時間の間にゲルが重合する。
- 重合後にゲルブリッジ溶液(100mMのpHが7のKPi、100mMの塩化カリウム)に格納されている。ゲル橋の寿命を延ばすために溶液を4℃で保存されます
計測ソリューションの2.4準備
異なる組成の溶液を交換するときにSSMと溶質の強い相互作用により、電気的アーティファクトが生成される。したがって、溶液の調製は重要なステップである。ソリューション交換アーチファクトを最小化するために溶液調製プロセス中に以下の点に注意してください。
- 1バッチからソリューションを非活性化し、活性化してください、pHとイオン強度を調整します。
- 高塩背景ソリューション交換アーチファクトを低減するのに役立ちます。
- 2ボリュームにバッチソリューションを分ける。
- 活性液に活性化化合物を追加します。可能な限り同様に両方のソリューションの浸透圧およびイオン強度を保つために、非活性化溶液中の代償化合物を使用してください。
- 溶液は4℃で保存されている場合、温度の小さな違いがアーティファクトを生成することができますので、すべてのソリューションは、測定を開始する前に室温に達していることを確認してください。
3。 SSMベースの電気生理学実験
ここでは、SSMベースの電気生理学的実験のための標準的なプロトコルを提示します。
SSMのセットアップを準備する3.1
SSMセットアップが使用していない状態で、チューブを30%エタノールで満たされている/水、ソリューション、細菌の増殖を防ぐために。
- キュベットを取り付ける前に、チューブからエタノールを除去し純水でシステムを洗浄します。水容器エタノール容器を交換してください。高圧(0.6から1.0バール)水20〜30 mlのシステムをクリーンを使用。
- pHを7.6または非活性化ソリューションでの100mMのKPIバッファを用いた洗浄手順を繰り返します。
- 気泡が流体システムに残っていないことを確認してください。
3.2キュベット取り付け
- 参照電極にO-リングを取り付け
- 貯蔵溶液からゲルブリッジを取ると基準電極に接続します。
- 予備充填非活性化緩衝液出口コネクター、Oリングを挿入し、基準電極組立体を完成させるゲルブリッジを接続する。気泡がゲルブリッジと出口溶液流路の交差点にしていないことを特に注意してください。
- 醸造おけの主要部をPreassembleばねコンタクトピン(アンプへの接続)を添加することによりって、入口管(端末バルブへの接続)、Oリング(SSMためのシーリング)とネジ。
- ピンセットを使用して、保存溶液(エタノール中の10mMオクタ)のセンサチップを取り出します。
- ピペットを用いて、約で残った溶液を洗い流してください。純粋なエタノール5ml。
- 窒素ガス下電極を乾燥させる。
- 入口キュベットの主要部のボアように、キュベットの底部に正確にセンサチップを配置するセンサの円形のアクティブ領域に向けられている。
- センサチップのアクティブ領域に脂質溶液を1μlを追加します。金の層が完全に脂質で覆われていることを、確認してください。
- すぐに脂質溶液を加えた後、組み立て済みの主要部分を追加することで、キュベットを閉じます。
- ファラデーケージにキュベットを取り付ける前に、すべての表面が完全に乾燥していることを確認してください。
- コンばねコンタクトピンと端子弁への入口管に増幅器を電気ショック療法。その後、ファラデーケージの内側のネジでキュベットを修正。
- キュベットの上部に出口コネクタをねじ込みます。最終的に出口コネクタと基準電極への電圧発生器に排出管を接続する。
- すぐに実装後キュベットは0.6バールでバッファを使用してシステムを洗う。これは、自発的SSMの形成をもたらす。
3.3測定膜パラメータ
SSMの品質をチェックするために、キャパシタンスとコンダクタンスは、関数発生器を用いて測定される。
- 関数発生器を使用して、コンダクタンスを測定するために100mVのDC電圧を印加する。
- コンダクタンスを計算電流減衰は膜コンデンサの充電を示しています。コンデンサの後、完全に測定された現在の利回りをオームの法則を用いた膜コンダクタンスが課金されます。簡潔にするために、我々はCuを用いるrrent 1秒、電圧後コンダクタンスG = I / Uを計算するために適用されます
- ピーク振幅と静電容量を測定する周波数0.5Hz〜50 mVのピークの三角波の交流電圧を印加する。
- 静電容量を計算し、得られた矩形波電流の振幅は、キャパシタの充電電流を表している。静電容量Cが転送された電荷に等しいQ =ΔU= 100 mVので割っIΔt。 (私は三角形の電圧の差が現在の正マイナス負の傾きであるため、ΔUは二度50 mVでの印加電圧である。)
- 約のために10分ごと繰り返して膜の電気的パラメータを監視します。定数値に到達するまで30〜40分間、。 1から0.6バールの範囲内の高圧でのKPI緩衝液との間に洗ってください。
- SSMの品質を推定:最適なパラメータは、0.1から0.2、NSと2から3.5 nFのの範囲である。 1 nFの下0.8、NSと低容量以上の高コンダクタンスを示しSSMが正しく形成されない。 4 nFの上記の高静電容量は、アクティブなゾーンがSSMによって完全に覆われていないことを意味するかもしれない。
- パラメータが最適な範囲にない場合、膜は廃棄されるべきであり、別のSSMは、新たに調製した電極チップを用いて、調製。
ソリューション交換アーティファクト3.4チェック
膜パラメータがチェックされた後に、測定バッファは、溶液交換のアーティファクトについて試験されるべきである。
- 流体系にそれぞれのソリューションコンテナを挿入します。
- 手動バルブを使用して、流体システムから気泡を除去する。
- データ収集ソフトを使用すると、あなたの実験で使用するフロープロトコルを選択しました。
- 0.6バールまでの圧力を調整し、測定を開始します。
- メカニカルバルブスイッチングアーティファクトとは別に、理想的には全くアーチファクト電流を測定するべきではありませんか、または彼らははるかSMAであるべき予想されるタンパク質輸送信号よりミュラー。ソリューション交換アーチファクトが認められた場合には、実験を続行する前に、バッファ組成物および/または準備手順を最適化しようとする。
3.5タンパク質サンプルを追加する
通常、プロテオリポソームまたは膜フラグメント-80℃で凍結保存されている℃、一回の測定のために約30μLのアリコートを必要とされている。
- 非活性化溶液とSSMをすすぐ。
- 氷の上でタンパク質試料を解凍。
- 3つの10秒の超音波処理サイクルは、氷の上で、10秒間隔で交互に冷却されています。プロテオリポソームを浴超音波処理を使用して超音波処理している。膜フラグメントのために先端超音波処理は(50W、30 kHzで、1ミリメートルのソノトロード径、強度20%、周期0.5)が使用されます。最後の超音波処理工程の後に氷の上に戻ってサンプルを入れていませんが、キュベットに、すぐにそれを注入する。
- ネジを外し、出口は、参照電極ASSE一緒コネクターmbly。
- ピペットを用いて、タンパク質試料の30μLを吸引し、穴コンセントにピペットチップをマウントします。
- 廃棄物容器への非活性化経路の手動弁を開き、キュベットボリュームにプロテオリポソームを注入。センサーでキュベット容積に空気を注入しないように注意してください。
- ピペットチップを取り外す前に、さらに溶液流を防止するための手動弁を閉じます。
- プロテオリポソームは、1〜2時間のインキュベーション時間のためにSSMに吸着することができます。それは一晩インキュベートすることも可能である。
SSMベースの実験の3.6一般的な手順
- 4℃で保存した場合、時間内に測定バッファを温めるすべての計測バッファはアーチファクトを回避するために測定を開始する前に室温でなければならない。
- ソリューションを変更する場合は、最初の非ファジング組織とソリューションコンテナ内部管をきれいにし、新しいボトルを挿入します。
- 測定を開始する前に、変更手続きから進化した可能性が気泡を除去するために手動バルブを使用しています。
- ただ、測定を開始する前に、圧力を調整します。私たちは、日常的に私たちの特定のバルブとチューブの構成で約1.0ミリリットル/秒の流量を得0.6バールの圧力を使用しています。
- 最初のいくつかの測定値は、別の後にまっすぐ1行うことができ、ピーク電流が一定になるまで拒否されるべきである。溶液はpHが異なる場合は、少なくとも3分のインキュベーション時間は、測定を開始する前に、プロテオリポソームの内側のpHを調節する必要がある。
- 今セットアップは測定のための準備ができている。ノイズを低減するには、少なくとも3の測定が行われ、平均化されるべきである。
3.7コントロール測定
一連の測定時の信号ランダウンは、タンパク質分解または吸着による損失が大きくなって発生する可能性があります。各SSM実験は、私すべきランダウン制御をNCLUDE。これは、同一のソリューションを繰り返し測定することによって行われます。最小限のランダウンコントロールは、同じ溶液を使用して、1つの初めに測定し、実験の終了少なくとも一つを意味する。
私たちはあなたの実験で最も高いピーク振幅を期待する条件の下でランダウン制御を行うことをお勧めします。これは、簡単に信号の要約を定量化することができる。
信号ランダウンは、2つのランダウンコントロールのピーク振幅を比較することにより定量化することができる。得られたパーセンテージ値はランダウンの線形時間依存性を仮定することによって測定された信号を補正するために使用することができる。
3.8アーティファクトコントロール
可能であれば、実験した後、目的の阻害タンパク質によってあなたの結果を検証してみてください。残りの信号はおそらくソリューション交換アーティファクトです。信号は次いで、測定されたアーティファクトを補正する必要がある。
3.9
- 純水20〜30 ml及び30%エタノール/水20〜30 mlでシステムを洗浄します。システムが使用されていないときエタノール溶液は、細菌の成長を回避する。
- この清掃した後は、システムからの圧力を解放し、すべての楽器をオフにします。
- ファラデーケージからキュベットを取り出して、それをマウント。キュベットの全ての部品は、浴超音波処理器を用いて、必要に応じて、水および純粋なエタノールで洗浄することができる。
- 純粋なエタノールでGLASビーカーにセンサーチップを置きます。風呂超音波処理を使用して約1〜2分間ビーカーを超音波処理。
- 窒素ガス下にセンサーチップを乾燥させる。
- 10mMのOctadecanthiolエタノール溶液中の光から離れたセンサチップを保管してください。約30分間のインキュベーション時間後に、センサチップは、再利用のために準備ができている。
結果
これまで、SSMベースの電気生理学はほとんど原核生物起源の20以上のトランスポーター、 例えば MELB 3、NhaA 4とPutP 5(6にまとめ)特徴付けるために使用されました。しかし、また、真核細胞、例えば細胞内膜輸送体から、ClC7 7と同様に、イオンチャンネル、 例えば、ニコチン性アセチルコリン受容体8が検討されている。
ここでは、5 9 LPR、10でレイシー指向のうち少なくとも85%右側にプロテオリポソームを用いた大腸菌からレイシー砂糖/ H +共輸送体の例の測定として存在する。私たちは、この輸送タンパク質の最小限の動力学モデルにつながる主要なステップに焦点を当てています。
1。レイシー野生型の電気生理学的特性評価
最初のステップは、異なるpH値を測定することにより起電反応の一般的性質である( >図4)、基質濃度( 図5)と基板。技術を検証するために、文献に与えられたK MとpK値が再現された。
レイシーショーのpH依存性二つの異なる起電反応。 pHが5およびpH 8.5の間だけでなく、容量結合電流が増加し、その形状を変更します。唯一の急速な起電反応が続く酸性のpH値の間にアルカリ条件下で定常状態の輸送は、観察される。我々は、トランスポーター電流( 図6)再構成する回路解析を使用し、高速起電反応から定常状態の信号を区別する。
pH7で単相信号が二相性になります。これは、2つの異なる起電反応が存在することを示している。転送された電荷(信号の積分)から推定した、2つの反応は、約6%と輸送サイクルの合計electrogenicityの94%を持っている。
起電反応のove_step "> 2。割り当てレイシーの反応サイクルにおける特定のステップには2つの起電反応を割り当てるには、E325Aレイシーバリアントが( 図7)を測定した。この亜種は乳糖交換を示しますが、なぜなら、プロトン放出の阻害のため、アクティブなすべての輸送モードのために欠損している。レイシーE325Aの信号が高速過渡を表し、すべての測定されたpH値のための定数である。信号の形状及び大きさは、酸性条件下でのレースの野生型の信号と同様である。また我々は容量結合システムで測定急速過渡電流の特徴で減少ピーク電流、後に小さな負の位相を観察します。乳糖バインディングとリリースが起電性ではないので、高速過渡は、ラクトースが結合後起電コンホメーション転移と相関している必要があります。
なお、プロトン放出速度limitiステップがあることが知られている乳糖濃度勾配駆動輸送モードでレイシーターンオーバーのためにNG。プロトンリリースが支持されているため、このケースでは、アルカリ性のpHを有する輸送速度の増加を期待していますこれは、定常状態の輸送レイシー野生の信号相関の場合です。さらに、それは唯一の内部pHがレイシーの定常状態トランスポート(未発表)影響を及ぼすことpH勾配測定によって示すことができた。したがって大きな起電反応がプロトン放出ステップに割り当てることができました。
3。動態解析のための測定
輸送速度のオンとオフを起電反応の同定後約4.5ミリ秒の高時間分解能でSSMのセットアップを使用して測定した。これは、1つの反応は信号を支配するとき、条件の下でのみ可能である。この場合、速度定数、反復最小二乗デを用いて信号の時間分解能を考慮した過渡電流から導出することができる畳み込みアルゴリズム( 図8)。決定速度定数と同様に提案された最小限の動力学モデル( 図9)、最終的にトランスポーター動態のシミュレーションのために使用された。シミュレートされた曲線は、さらに動力学モデルを証明するSSMデータを再現します。

図1。 SSMでのプロテオリポソームの吸着幾何。SSMは、センサチップ、構造化された金コーティングされたガラススライド上に形成されている。膜タンパク質の起電反応を測定するために、プロテオリポソームまたは膜断片は、SSMに吸着される。 2つの膜は、容量結合システムを形成する。唯一の過渡電流が検出された理由です。
tp_upload/50230/50230fig2highres.jpg "/>
図2。 SSMキュベットは、センサチップと基準電極を担持する。センサチップはキュベットベースとキュベットヘッドとの間に挟まれている。基準電極は、ポリアクリルアミドゲル塩橋によって流路から隔離されている。
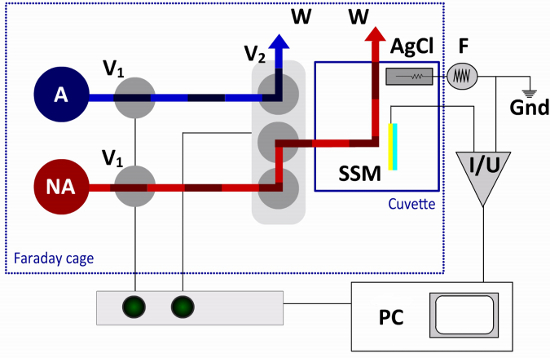
図3。 SSMのセットアップの流体経路と電気回路は。単一のソリューション交換プロトコルで唯一の非活性化(NA)と一つ活性化()ソリューションが必要です。流れは、2つの2ウェイバルブ(V1)及び片末端弁(V2)によって制御される。非活性化及び活性化ソリューション間の端子弁スイッチ、キュベット廃棄物容器(W)の溶液に他の解決策の一つを指示する。センサーチップ(SSM)は、増幅器(I / U)に接続されている参照電極(AgCl電極)は、外部電気回路にファンクションジェネレータ(F)に接続されている。コンピュータ(PC)およびインターフェイス·ボックスはバルブ操作およびデータ収集のために使用される。
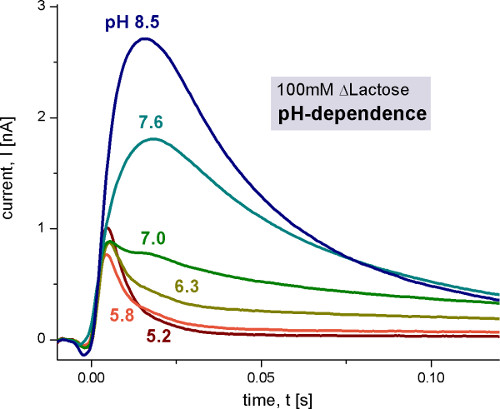
図4。活性化ソリューションは、100ミリメートル乳糖が含まれていた間に、異なるpH値で100mMの乳糖濃度ジャンプ後レイシープロテオリポソームを、野生型で測定過渡電流。非活性化ソリューションは、100 mMグルコースを含んでいた。すべての溶液を、1mMのDTTで表示されたpHで、100mMリン酸カリウム緩衝液中で調製した。この中に測定条件の詳細については、次の図は、 図9、図10を参照してください。
ftp_upload/50230/50230fig5highres.jpg "/>
図5。異なる濃度およびpH値でのラクトース濃度にジャンプした後、野生型プロテオレイシーで測定した正規化されたピーク電流を平均した K M値は双曲線近似から得られる。
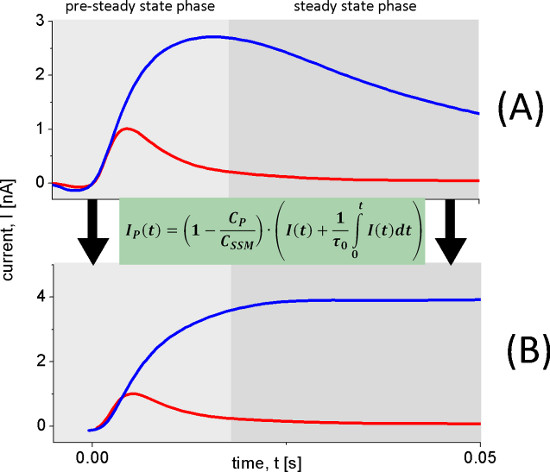
図6。トランス電流を再構成するために使用さ輸送電流の再建。過渡電流(A)は(B)pHが8.5(青のトレース)及びpH 5.2(赤トレース)、100 mMのラクトース濃度にジャンプした後、野生型レイシーテオリポソームを用いて測定した。速い起電反応が起こるpHを5.2ながらpHで8.5連続的な売上高が観察される。これは明らかに再構成された電流(B)において観察される。
files/ftp_upload/50230/50230fig7.jpg "ALT ="図7 "のfo:コンテンツ幅=" 4インチ "FO:SRC =" / files/ftp_upload/50230/50230fig7highres.jpg "/>
図7。過渡電流は、pH 5.2、100 mMのラクトース濃度ジャンプの後E325Aレイシープロテオリポソームを用いて測定し 、 このレースのバリアントは、輸送サイクルのプロトン放出の段階で阻害し、したがって、輸送欠損されています。観測された小さな負のコンポーネントは容量結合システムで測定急速過渡電流の特性であり、高速の起電反応後の膜容量の放電によって引き起こされる。その時定数π0は、システム( 図1)の静電容量とコンダクタンスによって決定されます。
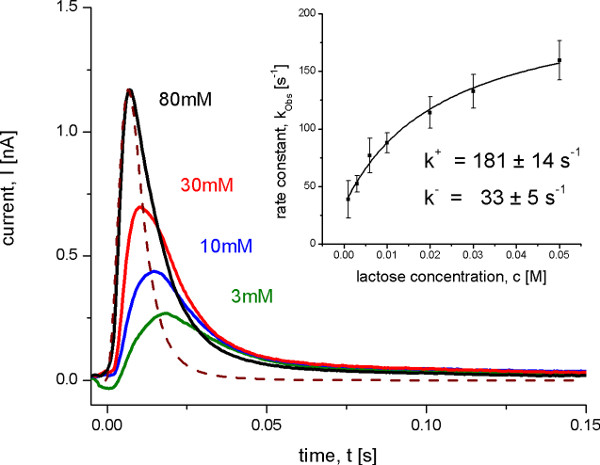
図8。野生型レイシープロテオのAFTEで測定する過渡電流pHは5.2でR異なる乳糖濃度にジャンプします。これらの条件下でない定常状態の輸送が認められたが、乳糖時起電コンホメーション転移結合されています。破線は、システムの時間分解能を表す伝達関数を示している。挿入図は、データへの双曲線フィットで観察された速度定数kobsからオンとオフの速度定数の決定を示しています。観測された速度定数を反復最小二乗デコンボリューションアルゴリズム10と過渡電流から決定した。
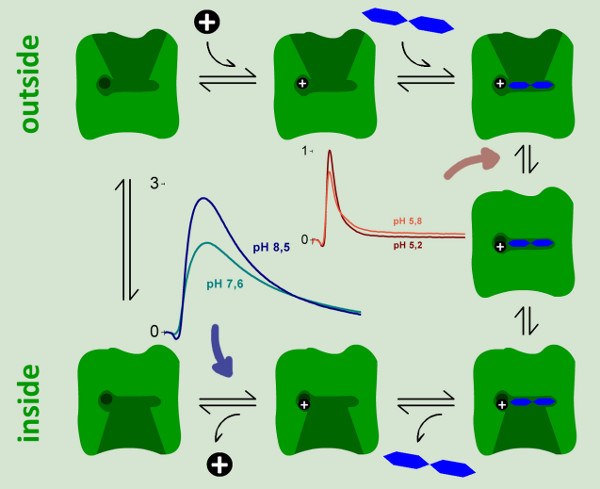
図9。レイシー。二つ起電ステップの反応サイクルのための運動モデルは SSM測定により同定し、特徴づけられる。反応に全電荷変位の〜94%に相当強く起電反応サイクルは、中性および塩基性pH値で観察される。それは、プロトン放出ステップ(青矢印)に割り当てることができる。野生型レイシーの連続的な代謝回転が阻害されると弱く電気発生工程は酸性のpHで観察される。私たちは、反応サイクルにおける全電荷の変位の6%を表し乳糖バインディング、時起電コンフォメーションへの移行この反応を割り当てられた。
ディスカッション
1。 SSMベースの電気生理学の利点は、従来の方法に比べ
SSMベースの電気生理学は、電気生理学的ツールボックスの貴重なツールとしての地位を証明しています。それはすなわちコンベンション電気生理学、パッチクランプと電圧クランプ方法は、適用することができない場合に特に有用です。別にいくつか珍しい例外から細菌のトランスポーターがあるため、細菌のサイズが小さいとため電圧クランプやパッチクランプ法を用いて調査することはできません彼らは、哺乳動物細胞または卵母細胞で発現することが困難である。しかし、また、生理学的に関連する哺乳類のトランスポーターを調査することができます。この場合、SSMベースの電気生理学は、細胞内膜からと、その堅牢性と自動化のための潜在的なの創薬におけるスクリーニングアプリケーション用のトランスポーターのために魅力的である。
TRANSPのSSM-basedUsing従来の電気生理学、時間分解特性評価ortersは困難である。トランスポーターの売上高は低いので '巨大パッチ'または '全セルの構成が必要になり、ソリューション交換実験では本質的に低い時間分解能を持っている。合併症は、光分解基板リリースを使用して克服することができる。しかし、基板の限られた数は、このアプローチに適している。ここSSMで迅速なソリューション交換は任意の基板を用いた高時間分解能で電気生理学的研究を実行するためのユニークな機会を提供しています。
2。制限事項および重要なステップ
パッチクランプと電圧クランプ法とは対照的に、SSMベースの電気生理学の電位を印加するために使用することができない。トランスポーターの特性は、したがって、膜電位に依存しないモードを輸送するために制限されている。
一般的には、SSMベースの電気生理学は(起電)トランスポーターの種類に関する制限はありません。しかし、電圧のcl結合タンパク質のような細胞成分は、タンパク質の機能に必要とされる場合、アンプやパッチクランプ法は、利点を有することができる。
ソリューション交換が大アーティファクト電流を作成する場合の制限は、発生する可能性があります。基板は親油性化合物の場合のようにSSMと強く相互作用する場合に起こります。アーティファクトコントロールが測定された信号を補正するために使用することができる。また、すべての測定バッファ内の高塩背景はアーティファクトを低減するために使用することができる。しかし、場合によっては、アーチファクトのサイズはタンパク質シグナルに匹敵する場合には、アーティファクトからのタンパク質に関連の信号を分離することはほとんど不可能である。幸いなことに、高いアーティファクトが最適化されたソリューションの交換では珍しいです。
SSMベースの電気生理学実験の成功を実現するために重要ないくつかのステップがあります。タンパク質試料の調製は、最も重要な部分である。プロテオリポソームを使用する場合は、必ずreconstitutionプロセスは十分LPRのクリーン、再現可能なサンプルが得られますし、トランスポーターは、正しい方法で配向されている。抗体が利用可能な場合には、LPR ELISA実験により凍結破砕電子顕微鏡および向きによって確認することができる。
唯一のタンパク質試料をインキュベートするための最適なパラメータを示しSSMを使用しています。タンパク質の注入は、別の重要なステップです。超音波処理は不可欠であり、気泡が注入時には避けるべきである。気泡がセンサチップから吸着タンパク質試料を除去するので、試料のインキュベーション後に測定値自体は、重要である。したがって、常に解決策を変更した後に気泡を除去。それにもかかわらず信号ランダウンが発生する可能性があります。可能な信号ランダウンを修正するには、それは実験中ランダウンコントロールを達成することが不可欠である。
3。特殊なシステム
SSMセットアップは、その用途に応じて変更することができる。またTここで利用可能な完全に異なる、高度に専門的なセットアップがされています。
pH勾配で例えば非対称な条件下でタンパク質信号を測定する可能性がある。プロテオリポソーム内外非対称バッファー組成を確立するために第3の解決策、安静時の解決策は、導入する必要があり、これは二重の交換設定が必要です。ここでは、非活性化と休息ソリューション切り替える追加三方弁が必要となります。
我々は、端末弁を欠くが、キュベットの異なるタイプを使用して、代替の流路を開発し、システムの時間分解能を増加させる。ここで活性化および非活性化ソリューションの接合はキュベット、SSMの前に3ミリメートルの内側に位置しています。このセットアップは、よく高速輸送過程の動態解析に適しています。それは2ミリ秒という低い時間分解能が可能であることを示すことができた。
商用ウェブたully自動化されたシステムは、薬物スクリーニングのための有意に高いスループットを目指してご利用いただけます。可動部は、溶液を集め、標準的なマイクロタイタープレートフォーマットの96ウェルプレート内のセンサ面上に噴射する。
開示事項
利害の衝突は宣言されていない。
謝辞
私たちは、サポートと有用な議論のためにレースの測定とE.バンベルクへの貢献のためにJ.ガルシアCelma、IスミルノワとR. Kabackに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Waterbath Sonicator | Bandelin | RK 52 H | |
| Tip Sonicator | Hielscher Ultrasonics GmbH | UP50H | |
| 2-way valve | NResearch, West Caldwell, USA | NR225T011 | |
| Terminal valve | NResearch, West Caldwell, USA | NR225T031 | |
| Manometer | Greisinger electronics | GDH 14 AN | |
| Faraday cage | Max Planck Institute of Biophysics | ||
| Cuvette | Max Planck Institute of Biophysics | ||
| 100 ml solution containers | Kartell | 1623 | |
| O-rings | Seal Science Inc. | ||
| Oscilloscope | Tektronix | TDS 1002 | |
| Reference electrode | Max Planck Institute of Biophysics | ||
| Function generator | Max Planck Institute of Biophysics | ||
| Tubings | SAINT-GOBAIN Performance Plastics | AAC00006 | |
| Sensor chip | Fraunhofer Institut für Schicht und Oberflächentechnik | ||
| Interface box | Max Planck Institute of Biophysics | ||
| Amplifier | Keithley | 427 | |
| Manual cog | Vygon GmbH | 876 | |
| USB analog-to-digital converter | National Instruments | 6009 | |
| Regeants | |||
| 1,2‑Diphytanoyl-sn-glycero-3-Phosphatidylcholine | Avanti Polar Lipids, Inc. | 850356 | |
| Acrylamide/Bis-acrylamide | Sigma Aldrich | A3574 | |
| Ammonium persulfate | Sigma Aldrich | A3678 | |
| D-(+)-Glucose | Sigma Aldrich | G8270 | |
| Dithiothreitol | Sigma Aldrich | 43819 | |
| Ethanol absolut | VWR AnalaR NORMAPUR | 603-002-00-5 | |
| Natural E. coli lipids polar extract | Avanti Polar Lipids, Inc. | 100600 | for LacY reconstitution |
| n-Decane | Sigma Aldrich | D901 | |
| Octadecanethiol | Sigma Aldrich | O1858 | |
| Octadecylamine | Sigma Aldrich | 74750 | |
| Potassium chloride | Merck | 1049360500 | |
| Potassium phosphate dibasic | Sigma Aldrich | P3786 | |
| Potassium phosphate monobasic | Sigma Aldrich | P9791 | |
| Tetramethylethylenediamine | BIO RAD | 1610801 | |
| α-Lactose monohydrate | Sigma Aldrich | L8783 | |
参考文献
- Seifert, K., Fendler, K., Bamberg, E. Charge transport by ion translocating membrane proteins on solid supported membranes. Biophys. J. 64, 384-391 (1993).
- Schulz, P., Garcia-Celma, J. J., Fendler, K. SSM-based electrophysiology. Methods. 46, 97-103 (2008).
- Garcia-Celma, J. J., et al. Rapid activation of the melibiose permease MelB immobilized on a solid-supported membrane. Langmuir. 24, 8119-8126 (2008).
- Mager, T., Rimon, A., Padan, E., Fendler, K. Transport mechanism and pH regulation of the Na+/H+ antiporter NhaA from Escherichia coli: an electrophysiological study. J. Biol. Chem. 286, 23570-23581 (2011).
- Zhou, A., et al. Charge translocation during cosubstrate binding in the Na+/proline transporter of E.coli. J. Mol. Biol. 343, 931-942 (2004).
- Ganea, C., Fendler, K. Bacterial transporters: charge translocation and mechanism. Biochim. Biophys. Acta. 1787, 706-713 (2009).
- Schulz, P., Werner, J., Stauber, T., Henriksen, K., Fendler, K. The G215R mutation in the Cl-/H+-antiporter ClC-7 found in ADO II osteopetrosis does not abolish function but causes a severe trafficking defect. PLoS ONE. 5, e12585 (2010).
- Schulz, P., Dueck, B., Mourot, A., Hatahet, L., Fendler, K. Measuring ion channels on solid supported membranes. Biophys. J. 97, 388-396 (2009).
- Garcia-Celma, J. J., Smirnova, I. N., Kaback, H. R., Fendler, K. Electrophysiological characterization of LacY. Proc. Natl. Acad. Sci. U.S.A. 106, 7373-7378 (2009).
- Garcia-Celma, J. J., Ploch, J., Smirnova, I., Kaback, H. R., Fendler, K. Delineating electrogenic reactions during lactose/H+ symport. Biochemistry. 49, 6115-6121 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved