Method Article
表面EBL作製したナノ構造基板を用いた生体分子のラマン分光検出の強化
要約
We describe the fabrication and characterization of nano-biological systems interfacing nanostructured substrates with immobilized proteins and aptamers. The relevant experimental steps involving lithographic fabrication of nanostructured substrates, bio-functionalization, and surface-enhanced Raman spectroscopy (SERS) characterization, are reported. SERS detection of surface-immobilized proteins, and probing of protein-ligand and aptamer-ligand binding is demonstrated.
要約
固定化生体分子と固体支持体上の金属ナノ構造をインターフェース共役ナノ生物学的システムの作製と特性評価が報告されている。関連する実験手順の全配列は、電子ビームリソグラフィー、基板上の生体分子の固定化、およびそれらの特徴付けを利用表面増強ラマン分光法(SERS)を使用して、ナノ構造の基材の製造を含む、記載されている。ナノ生物学的システムの三つの異なる設計は、プロテインA、グルコース結合タンパク質、およびドーパミン結合DNAアプタマーを含む、使用されている。後者の2つのケースでは、それぞれのリガンドの結合を、D-グルコースおよびドーパミンは、も含まれる。生体分子の3種類の異なる方法によってナノ構造の基板上に固定され、SERSイメージングの結果を報告する。 SERSの能力は、表面固定化されたタンパク質からの振動モードを検出するため、ならびにタンパク質 - リガンドのANをキャプチャするDアプタマー - リガンド結合が実証されている。結果はまた、表面ナノ構造の形状、生体分子固定化戦略、分子のラマン活性及び取得SERSスペクトルに結合するリガンドの存在または非存在の影響を示している。
概要
固体ナノ構造と生体高分子をインタフェース共役ナノ生物学的システムを開発し、特性化する能力は、次世代のバイオセンシング、バイオ作動技術の1,2のさらなる進歩にますます重要になってきている。これは、適切な固体素子(マイクロまたはナノ電極、ナノエンジニアリングコーティング、ナノワイヤー、またはナノ粒子)2,3,4の製作などの研究分野、数にわたる学際的研究を伴う。希望するバイオコンジュゲート5,6,7を作成するには、表面上の生体分子の固定化。ナノ生物学のインターフェイス1を監視する。ほとんどの場合、最適な製造、生体機能化、および特徴付け方法の選択は、強く相互に関連している。明らかに、ナノファブリケーション技術の選択は、システムの固相構成要素の要件によって駆動される検出方法に大きく依存しているtuの中rnは関連するバイオポリマーの性質およびインターフェースを監視する目的で決定される。
バイオコンジュゲートシステム1,3、表面増強ラマン分光法(SERS)特徴付けるために適用される技術は、幅広い種類の外表面8,9,10,11上に化学的及び生物学的種を検出するための非常に有望な方法として出現した。 SERSは、分子振動に対応する固有の署名の捕捉を可能にする表面固定化生体分子( 図1)による単色光の非弾性散乱を利用する。ラベル、錯体化学、または時間のかかるステップを伴うことなく、異なる分子を区別するために、この機能は、SERSバイオ検出の可能性が非常に効率的な方法になります。 SERSの別の重要な利点は、その高い感度である。貴金属ナノ構造体(SERS基板)と相互作用する光による局在表面プラズモンの励起が劇的整数を増加ラマン単層からの単一分子制限8,9,10,11まで、分子が非常に少量の検出を可能にする、検体によって散乱ensity。最後に、ほとんどの生体分子は、水溶液は安定であることが必要です。水は、多くの場合、制限されたラマン活性を有するので、水性サンプルからのバックグラウンド信号9を最小限に抑えられる。 SERSのアプリケーションは、最後の十年間10以上の指数関数的な増加を示している。しかしながら、SERSの多くの議論の課題は、ラマン散乱の電磁増強は、プラズモン波が11,12,13に誘導される金属ナノ構造のサイズ、形状、及び間隔に決定的に依存することである。効率的かつ再現可能なSERS測定を達成するために、基板形状の制御は、ナノスケール寸法で必要とされる。
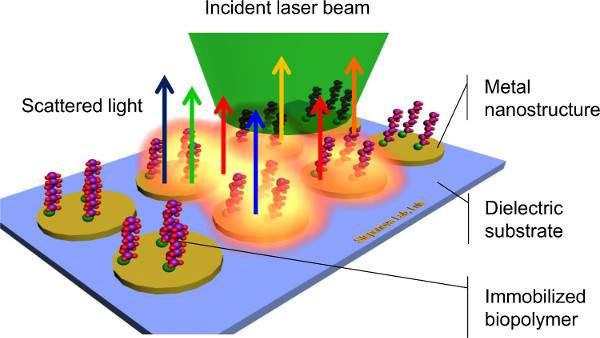
図1. Scは表面増強ラマン分光法のヘム。
SERS基板11,12,13を製造するために用いられる多くの方法は、大きくボトムアップおよびトップダウン方法に分類することができる。第一のタイプの方法は、自己組織化又はナノ構造を生成する指向性化学合成の様々なプロセスを採用する。多くの場合、例としては、固体支持体11,12,13、熱、スパッタ、または粗い金属膜11,12の電気化学堆積、および種々の化学合成法13に単分散ナノ粒子の固定化を含む宛て。このような技術は、比較的単純かつ安価である傾向があるが、それらのほとんどは、構造物の位置、および限定されたサンプル間の再現性の制御の欠如によってチャレンジする。
対照的に、トップダウン·リソグラフィ技術は、表面上に所望のパターンを作成するなどの粒子ビームとして操作可能な器具を使用する。最も頻繁に使用されるのひとつ固体支持体11,12上の異なる基板の設計を可能にするためにも、10 nmおよび以下柔軟性まで備えにわたってナノリソグラフィ法は、電子ビームリソグラフィ(EBL)は、優れた制御を提供する。 EBLは、電子のビームは、露光された領域において化学変化を引き起こす電子感応性材料(レジスト)の表面を横切って直径スキャン数ナノメートルのスポットまで焦点を当てた。ポジティブトーンポリメチルメタクリレート(PMMA)、適切な溶媒(現像液)に対する溶解性が増大につながる、レジストを構成するポリマー鎖の切断で電子ビーム露光の結果として抵抗する。電子ビームリソグラフィのプロセスは、基板上のレジストの均一な層のスピンコーティングを含む。電子ビームを真空チャンバ内のターゲットとレジスト材料の露光。可溶性領域を除去するためにサンプルの開発。
溶融シリカなどの金属ナノ構造の下に誘電体支持体は、bとがあるのeenは著しく、シリコン14,15のような他の材料に比べて、プラズモン波の局在によるSERSにおける強度を増加させることが示さ。しかしEBLパターニングは、誘電体基板上に、特にナノスケールで、露光中のビルドアップを充電するのに起因する重大な課題を伴う。以前、我々はこれらの困難は、レジスト上に導電性高分子層を配置することによって克服できること16,17を示している。 図2融合上の金属ナノ構造を生成するために金属蒸着及びリフトオフ続いEBL露光および現像を使用して、全体的な製造プロセスの概略図を示すシリカ担体。 この図の拡大版をご覧になるにはこちらをクリックしてください。
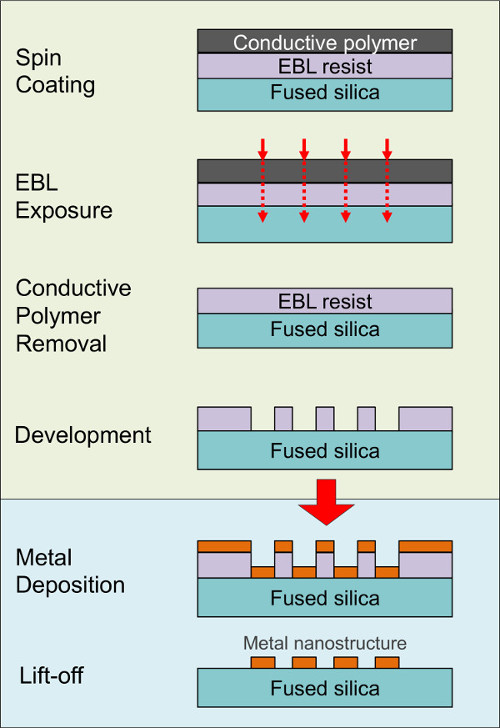
Eの図2.スキームlectronビームリソグラフィ、金属堆積、及び誘電体基板16〜19上に金属ナノ構造を作製するために用いるリフトオフ工程段階。この論文では、EBL、基質のバイオ機能化によるSERS基板の製造を含むプロセスステップのシーケンス全体を提示し、そしてラマンスペクトルのコレクション。我々の最近の研究18,19で検討つの設計は、(参照図3および図4、および表1)アドレス指定される。デザイン1において、組換えタンパク質Aは、溶融シリカ(FS)支持体18上の生体機能を有する金ナノ構造体上に固定化され、タンパク質のSERS検出を実証する。デザイン2では、リガンド(D-グルコース)の有無による組換えグルコース結合タンパク質21,26,27を Niで被覆されたFS上にAgナノ構造間の空間にヒスチジンタグにより、固定化され、タンパク質への糖の結合検出された。デザイン3では、ドーパミン結合DNをチオール化アプタマー19,23は、FS上のAuナノ構造体上に固定され、固定化されたアプタマーによってドーパミンの結合が実証される。 SERSの発展にSERSにより、ナノ生物学のインターフェイスを問い合わせる探査研究から、基板のラマンスペクトルの取得に準備し、固定化の異なる生体分子と戦略の代表から、関連するすべての実験工程を含めて、これらの例はさまざまなアプリケーションのために有用である認識方法として、結合タンパク質-またはアプタマーリガンドを利用する小分子のバイオセンサー。 この図の拡大版をご覧になるにはこちらをクリックしてください。
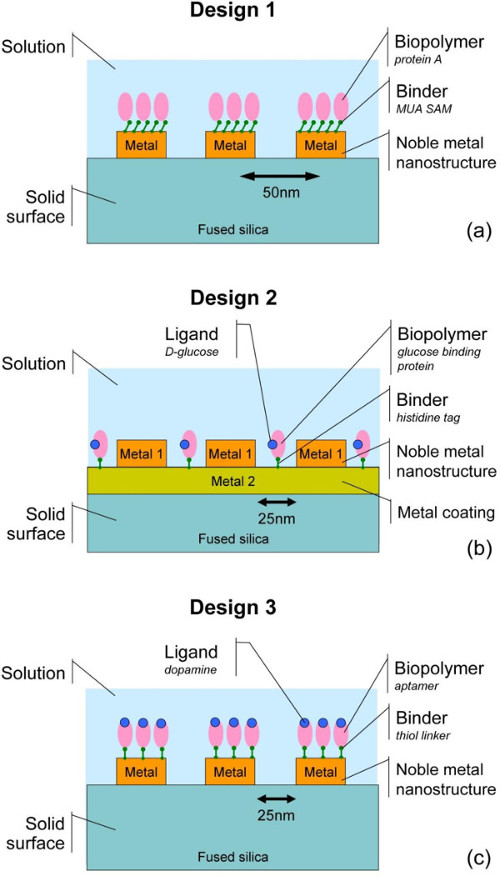
異なる生体分子を用いた3つの代表的なデザインの図3のスキーム、immobiliza方法ン、および基板材料:DI水中の11-メルカプトデカン酸(MUA)の自己組織化単分子膜(SAM)で官能化貴金属ナノドット上に固定化された(A)タンパク質A;貴金属ナノドット間の基板表面に固定化されたD-グルコースと複合体を形成し(B)、ヒスチジンタググルコース結合タンパク質(GBP)。貴金属ナノドットに固定化されたドーパミンで完了(C)チオール末端ドーパミン結合アプタマー(DBA)。 表1のさらに詳しい情報を見る。パネル(B)で示した設計2では、対応するリガンドを含まないサンプルも比較のために用意した。 この図の拡大版をご覧になるにはこちらをクリックしてください。
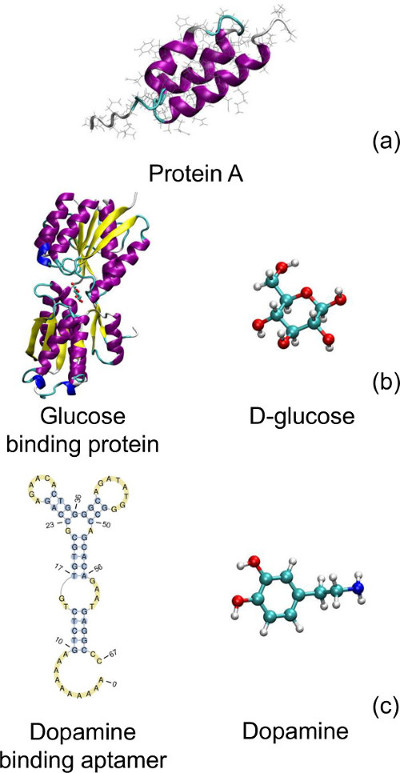
図4。3の設計に用いられる生体分子:(A)タンパク質A; (B)グルコース結合タンパク質およびD-グルコース。 (C)DNAアプタマーとドーパミンを結合ドーパミン。タンパク質立体構造(a)および(b)はそれぞれ、及びLINUXAMD64ためのVMDで描かプロテインデータバンク、PDB ID 1BDD 20と2HPH 21、バージョン1.9.1 22から取られる。 (c)において、アプタマーの二次構造はValFold 24ソフトウェアを用いて配列23から予測及びPseudoViewer 3.0 25で描かれている。それぞれの文字G、A、T、およびCグアニン、アデニン、チミン、およびシトシンヌクレオチドに対応し、。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| デザイン1 | デザイン2 | デザイン3 | |
| バイオポリマー | プロテインA | グルコース結合タンパク質(GBP) | ドーパミン結合アプタマー(DBA) |
| バインダー | 11-メルカプトウンデカン酸(MUA)自己組織化単分子膜(SAM) | ヒスチジンタグ | チオールリンカー |
| リガンド | なし | D-グルコース | ドーパミン |
| ソリューション | 脱イオン(DI)水 | リン酸カリウム緩衝液 | トリス(ヒドロキシメチル)アミノメタン(TRIS)及びエチレンジアミン四酢酸(EDTA)緩衝液;リン酸緩衝生理食塩水(PBS) |
| 基板 | FS上のAu構造 | ニッケルコーティングされたFS上のAgの構造 | FS上のAu構造 |
| パターン化されたAREA | 4ミクロン×10ミクロン | 4ミクロン×8ミクロン | 4ミクロン×10ミクロン |
| パターン | 金ドット、50nmのピッチ | 銀ドット、40 nmのピッチ | 金六角形、200nmのピッチ |
| 銀六角形、200nmのピッチ | Auの構造化されていないパッド | ||
| Agの構造化されていないパッド | |||
| EBL被ばく線量 | ドット: | ドット:105μC/ cm 2程度 | 六角形:180μC/ cm 2程度 |
| アレイのI 120μC/ cm 2程度 | 六角形:170μC/ cm 2程度 | ||
| 配列II 96μC/ cm 2程度 | |||
| 配列III 72μC/ cm 2程度 | |||
| レーザー励起波長 | 532 nmの | 532 nmの | 780 nmの |
表1.ナノ生物系の三つのデザインを。
プロトコル
1。基板の準備
- 1センチメートル×1cmに以下サイコロを溶融シリカ(FS)ウエハーを切断するために、半導体ダイシングソーを使用してください。
- ピラニア溶液で清浄な試料(H 2 SO 4:H 2 O 2、3:1;注意:強力な酸化剤)で15分間バス28は 、脱イオン水でサイコロをすすぎ、窒素で乾燥した。
- ホットプレート上のサンプルは15分間180℃で表向きに置きます。 RTにホットプレートから取り外した後のサンプルを冷却する。
- デザイン1と3の場合は、手順2に進みます。
- 設計2は、Niを10nmの層を電子ビーム蒸着チャンバコートサンプルを置く。
電子ビームリソグラフィを用いてナノパターン化されたPMMAマスクの2の作製(EBL)
- スピンコートPMMAレジストと基板上の導電層。
- チャック上の中央に個別に真空チャックと場所サンプルを用いたウエハスピナーを使用してください。場所ポリメチルメタクリレート(PMMA)の1滴は、2秒のランプ時間60秒間3,500rpmでガラスピペットおよびスピンを用いた試料の中心上のレジスト。
- 3-5分間、180℃で基板を焼く。基板を焼成した後、RTにサンプルを冷却する。
- 基板を冷却し、スピナーチャックに戻って、基板上の導電性ポリマーの滴を広げた。 2秒のランプ時間と3000 rpmで40秒間基板をスピン。 1分間、80℃でベークサンプル。
- 標準的な手順の16,17,18,29に従ってEBL露光を行う。
- 製造業者の取扱説明書を使用して、最小の可能なビームのステップサイズで、表1から特徴用量を用いた露光デザインを準備。
- 電子ビームリソグラフィーチャンバ内にサンプルをロードする。 EBLシステムがオートフォーカスを持っていない場合は、フォーカスのためのビーズの縁から離れたパターンが露出される場所から離れ小キズを使用ING。
- 製造業者の取扱説明書を使用し、必要に応じて必要なフォーカス及び非点収差補正、並びに、ライトフィールドの位置合わせを行い、サンプルを露出する。適正露出プロファイルと最高のパターンの品質を可能にするために、露光のために30 keVの電子ビームエネルギーと7.5μmの開口部を使用しています。
- 導電性ポリマーを除去し、露光した試料を開発しています。
- 現像剤混合物と、導電性ポリマーと第二のビーカーを除去するための脱イオン(DI)水を用いてビーカーを準備し(IPA:H 2 O、7:3)を、室温で5分間撹拌した。リンス剤として第3のビーカーにイソプロパノール(高純度)を準備します。
- ピンセットを使用し、その後、導電性高分子膜を除去する現像液に試料を置き、ゆっくり上下に20秒間ピンセットを移動させるために3秒間水にサンプルを置く。直ちにイソプロパノールに基板を搬送し、さらに10秒間すすぎ、次いで、窒素でサンプルを乾燥させる。
3.貴金属ナノ構造体の作製
- 試料の表面上に堆積される金属蒸着を可能にするために、逆さまに、電子ビーム蒸着システムにサンプルをロードする。約0.1nm /秒の速度で設計1および図3に示すように、デザイン2は、厚さ10nmのAg層のための試料の上に厚さ10nmのAu層を堆積させる。
- 水で推奨される高さに超音波処理システムを記入し、アセトンで別のビーカーを埋める。ビーカーの底にサンプル顔を置き、試料を10分間浸漬することを可能にする。ビーカーを保持し、水浴に置き、アセトンの高さは、水の高さに一致し、超音波処理システムをオンにすることを可能にする。超音波処理は、最大60秒間に発生することを許可する。
- 工程3.1で詳述したのと同じ手順を用いて、FS上に膜厚10nmの金属膜を堆積することによって均一にAuとAgパッド基板を準備する(デザイン1及び3)及びNiコーティングされたFS(デザイン2)のsubstrステップ2をスキップしてのATE。
基板の4。バイオ機能化
- デザイン1のサンプルを準備します。
- RTでエタノール中11 - メルカプトデカン酸(MUA)の1 mM溶液を準備します。 10分間の超音波処理。
- 48時間MUAの溶液に適切なナノ構造の基板を浸す。エタノールで3回サンプルをすすぎ、室温で5分間乾燥した。
- DI水中の(3-(ジメチルアミノ)プロピル)カルボジイミド(EDC) - N -エチル- Nの75 mM溶液」を調製する。 DI水中のNヒドロキシスクシンイミド(NHS)の15 mM溶液を準備します。
- 基板上のAu上NHSのマイクロピペット預金100μLを使用して、すぐに同じ領域にEDCの100μlを添加する。 MUAの自己組織化単分子膜(SAM)を活性化するために1分間インキュベートする。
- 基板の同じ領域上のタンパク質を100μlのドロップ溶液(47μM)を配置し、多区画ペトリ(d)に5℃で24時間のサンプルを保存する別の区画で、密閉カバーをDI水1 mlのっぽい。
- 連続して各ビーカーに20秒間別個のビーカー内のサンプルを攪拌することにより脱イオン水で3回サンプルをすすぐ。サンプルは、すすぎ後、またはすすぎの際に乾燥させないでください。
- ステップ5に進みます。
- デザイン2サンプルを準備します。
- リン酸カリウム緩衝液中のグルコース結合タンパク質(GBP)の0.9 mM溶液(K 2 HPO 4、25mMの、pH7.5)に調製する。バッファ内のD-グルコースの100 mM溶液を準備します。
- 100mMのD-グルコース溶液および1ミリリットルプラスチック製マイクロチューブ容器及びマイクロピペットを用いて0.9 mMのGBP液30μlを30μlのを混ぜる。 30分間インキュベートする。
- デポジットマイクロピペットを用いて調製された基材上のリガンドフリーGBP溶液とリガンド結合GBP溶液20μlそれぞれ。密封されたカバー付きペトリ皿中で24時間、5℃でサンプルを保管してください。
- 内のサンプルを3回すすぎRTでのリン酸カリウム緩衝液。
- ステップ5に進みます。
- デザイン3つのサンプルを準備します。
- 7.4の最終pHとTRIS EDTA緩衝液を用いて、1μMの濃度にドーパミンアプタマーを結合(DBA)溶液を希釈。
- 化学天秤でドーパミン粉末を測定し、5分間攪拌ビーズをリン酸緩衝生理食塩水(PBS)中で混合することにより、5μM濃度のドーパミン溶液を調製する。
- 各基板の表面上に、DBA溶液20μl降下を堆積し、サンプルがペトリ皿の上カバーを室温で1時間放置します。
- リン酸カリウム緩衝液(K 2 HPO 4、25mMの、pH7.5)中で試料を3回すすぐ。
- 直立クリーンルーム等級の上にサンプルを配置し、基板の表面側に膜を維持しつつ、裏面を乾燥させるために拭く。コントロールとして脇にサンプルを設定します。
- ドーパミン溶液oの5μlのドロップを置きますnは、所望のドーパミン濃度が残りの試料にPBS緩衝溶液の既存の液滴の表面。 10分間サンプルをインキュベートする。
- アプタマーなしでのAuパッド表面上のドーパミン溶液の液滴を配置します。 10分間インキュベートする。
- リン酸カリウム緩衝液中で3回の試料をすすぐ。
5.ラマン分光
- レーザー露光により蒸発を避けるために、防水チャンバ内の各サンプルを置きます。
- ガラススライド上の化学的に不活性な高真空グリース、場所サンプルとプラスチックシリンジに充填し、試料に触れることなく、サンプルを周囲グリースの数ミリメートルを分配する。
- 基板の上に、顕微鏡カバースリップを置き、静かにバッファが真空グリースに接触することなく基板とカバーガラスの間に薄い液体界面を作成する、シールを形成するように押し下げる。
- 使い方光学ラマン顕微鏡システムは、レーザーをオンにすることなくサンプリングされる金属ナノパターン化された領域の表面上に焦点を得る。
- 倍率10倍を目的とした試料の損傷を防ぐために、20未満の秒の合計時間で2.4から3.1 mWの間のレーザ強度でラマンサンプリング18,19を実行します。 表1に示すように、励起波長を用いて設計1,2、および3からのサンプルについてのラマンスペクトルを取得また、プロテインA、GBP、D-グルコース、およびドーパミン粉末用の金属ずにガラススライドを用いたソリューションの制御ラマンスペクトルを取得するとしてのナノ構造は、比較のためにサポートしています。
結果
溶液中の遊離タンパク質と金属含有基材を使用せずに、溶液中または粉末形態のフリーのリガンドを含む、主要な構成要素のための制御ラマンスペクトルを収集し、解釈のために、ならびに適切な比較を可能にすることが重要である。 図5Aは、典型的なラマン提示ナノ構造の基材なしのガラススライド上にDI水の中の遊離プロテインAのスペクトル。最高ラマン強度を持つ2つのバンドが、2931センチメートルのバンドは-1と1091センチメートル-1、それぞれ、CHとCS結合を含む振動に対応しています。 563センチメートル-1 1450 -1、1653センチメートル-1及び2426センチメートル-1のような低いラマン強度を有する他のバンドは、振動モード18,32,33,34の重畳に起因し得る。三つの異なる濃度、0.3、0.9及び1.3mMの有する緩衝溶液中のリガンドフリーGPBの制御ラマンスペクトルは、 図5Bに示されている。 T IN彼は3400センチメートルまわり、広い帯域を把握-1 2935センチメートルのバンドのに対し、溶剤35に対応して-1タンパク質32,33のCH結合を含む振動を表す。 図5Cは、中にD-グルコースのための高い波長のラマンスペクトルを示す異なる濃度のために緩衝液:1、6、100、200、及び400 mMの。グルコースの濃度が増加すると、C-H結合の振動帯は2890センチメートル-1及び2960センチメートル-1で生じる。 532 nmおよび780 nmの励起波長の両方で得られた結晶形でのドーパミンの制御ラマンスペクトルを図5Dに示されている。ラマンスペクトルの多くは、ベンゼン環曲げ及び分子19,36のCH結合のストレッチから来ている。約3,000 -1におけるバンドのいくつかは、-1だけ532nmではなく、780 nmの励起波長で観察される。
PLOAD / 52712 / 52712fig5.jpg "/>
DI水中のプロテインAの図5の制御ラマンスペクトルは532nmの励起波長18(A)で得られた。緩衝溶液中のリガンド遊離グルコース結合タンパク質のラマンスペクトルは、532 nmの励起波長(B)で得られた。緩衝溶液中のD-グルコースのラマンスペクトルは、532 nmの励起波長(C)で得られた。ドーパミン粉末のスペクトルは、532 nmおよび780 nmの励起波長19(D)で得られた。全てのスペクトルは、ナノ構造の基材なしでガラススライド上に溶液のラマンスペクトル(a、b、c)を、粉体(d)は規則的である。 (D)においては、様々な分子振動のラマンシフトレジームの割り当ては、他の場所19に詳述するように一般的な原子分子の電子構造システム(GAMESS)30とMacMolPlt 31ソフトウェアを用いて行った。 18 AMERICから許可を得て転載パネル(A)真空協会。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ステップ1-3で説明したように、表面固定化生体分子のためのSERSスペクトルを得るためには、溶融シリカ担体上に金属ナノ構造を含む基板が製造される。作製した基板の品質は、走査型電子顕微鏡(SEM)を使用して監視される。標準的なSEM手順は他の場所16,17,18、19ず、本プロトコールに含ま記載されている。 図6に示す代表的なSEM構造(パネル広告)等のAuおよびAgナノドット、ナノ六角形の画像、ならびに非図 -structured AuとAgのパッド(それぞれ、パネルeおよびf)。次のステップは、 表1に記載されている3つのデザインを採用したナノ構造化基板上の生体物質の固定化、およびそれらのSERSスペクトルの収集を伴う。 O中ラマンイメージング中に水性環境を維持するRDER、各サンプルは、対応する溶液中に配置され、図7に示すように、薄いガラスカバーで蓋をし 、密封し、( 表1参照)。

図6の走査型電子顕微鏡(SEM)SERS基板として用い、厚さ10nmのAuとAg表面のナノ構造の画像(A、B)ナノドットのアレイ。 (C、D)ナノ六角形のアレイ。 (E、F)構造化されていないパッド。 Agの構造(右)との基板はFS上の厚さ10nmのNiコーティングを使用するのに対し、Auの構造(左)と基材は、FSのサポートを採用。他の箇所16,17,18に記載されるような画像が得られた。PG "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
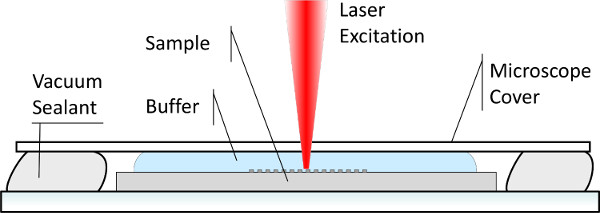
溶液中の生体機能を有するサンプルのラマンイメージング用防水室の図7.スキーム。
デザイン1において、組換えタンパク質Aは、脱イオン水18で11-メルカプトデカン酸(MUA)の自己組織化単分子層で官能基材上に固定される。この設計では基板は( 図6Aおよび図8参照)が50nmピッチでのAuドットの3つの配列を含み、溶融シリカ上のドット間の距離を変化させる。タンパク質の固定化のプロセスは、基板上のSAMの形成で始まる。 SAMとタンパク質との間の共有結合を得るために、SAMのカルボン酸基は、Nの混合物で処理することにより、アミン反応性NHSエステルに変換されるの-エチル- N ' - (3-(ジメチルアミノ)プロピル)カルボジイミド(EDC)溶液およびDI水中のNヒドロキシスクシンイミド(NHS)溶液。プロテインAの固定化は、タンパク質37のリジン残基によりNHS基の置換により起こる。 Auのナノ構造体上に固定化プロテインAを使用したデザイン1用撮像サンプルの例を図9に示されている。( 図9(a)は、別のドット間の隙間と、生体機能を有する金ナノドットの3つの配列を含むサンプルの光学顕微鏡像を示すまた、 部3Aaと8)を図 、および図9Bは 、これらのアレイ上のラマンスペクトルマッピングを示しています。それは、最高のラマン強度の低い強度が最も広いドット間のギャップを有する配列IIIについて得られるのに対して、Iは、ドット間の隙間が狭くている配列のために発見されたことが分かる。これは、より高い電気情けないによって生成強いプラズモンカップリング効果によって説明することができるドット18の間の狭いスペースでのLDS。 図9Cは、配列IおよびIIに対して得られた最強のSERSスペクトルを示す。スペクトルは、 図5Aに見られる溶液中の遊離プロテインAのラマンモードの近くにいくつかのバンド(1630センチメートル-1、1964センチメートル-1、2280センチメートル-1、2577センチメートル-1、および2916センチメートル-1)を示す。タンパク質中に見られる様々な債券の振動に起因する、これらのバンドは、両方の固定されたタンパク質で、その溶液中で同様の場所に表示され、または固定化された時、わずかにやや高い波数にシフトしているのどちらか。これとは対照的に、タンパク質なしにMUA SAMによって官能類似のナノ構造基板のSERSスペクトルは、 図9は、表面固定化プロテインAのSERSマッピングを表していることを確認した、全く異なるパターン18を示 して見るにはこちらをクリックしてくださいこの図の拡大版。

図デザイン1 18で使用されるFS基板上のAuナノドットの3つの配列の8 SEM像。配列は、ドット間のギャップの幅が異なる結果として、同じ50nmのピッチと若干異なるドット半径を持っている。これは、3つのアレイのためのPMMAマスクを生成するために異なるEBL露光量を適用することによって達成される( 表1参照)。より高い被ばく線量はメタライゼーションとリフトオフ後に、より大きな金のドットサイズを可能に、PMMAマスクより広い穴になる。 18米国真空学会から許可を得て転載。 この図の拡大版をご覧になるにはこちらをクリックしてください。
レ/ ftp_upload / 52712 / 52712fig9.jpg "/>
デザイン1 18における基板固定プロテインAの図9 SERSイメージング。溶融石英基板上に50nmのピッチと異なるドット間の隙間のAuナノドットの3つの配列を含む(A)試料の光学顕微鏡像、(参照図6)は 、生体機能を有する、図3Aに示すように(B)サンプルのラマンマッピング。ドットアレイIおよびIIから(C)SERSスペクトル。パネル(B)において、縦軸は、基板を横断する距離を表し、横軸はラマンシフトを示し、凡例バーはラマン強度を示している。垂直パネル内のパネルのライン(B)及び(C)溶液中で遊離プロテインAのベンチマークラマンバンドを表す(*)は、破線(C)は 、アレイI.ラマンスペクトルからのSERSバンドを示し、532nmの励起を得た。波長。 18米国真空学会から許可を得て転載。 この図の拡大版をご覧になるにはこちらをクリックしてください。
デザイン2で、D-グルコース(リガンド)と複合体を組換え糖結合タンパク質(GBP)21は、リン酸カリウム緩衝液中で、適切な基質上に固定化される。固定化リガンドを含まないGBPを有する試料も比較のために用意されている。この設計では、グルコース結合タンパク質は、貴金属6にはNiによく結合ではなくヒスチジンタグを用いて表面に取り付けられている。基板は、Agナノドット、ナノ六角形、及びNiコーティングされたFSに構造化されていない銀のパッド(それぞれ、 図6B、6D、および6F)のアレイを含むので、一方が固定化されたタンパク質分子の大部分の間の隙間に配置されることを期待することができニッケルコーティングがavがあるAgのナノ構造ailable。ラマンスペクトルは、固定化された無グルコース及びグルコース結合GBPについて得られた、それぞれ、 図10Aおよび10Bに示されている。すべてのこれらのスペクトルは、約緩衝液35に対応する3300センチメートル-1、広い帯域を示す。構造化されていない銀パッドで得られたスペクトルは、この単一のバンドを含み、そして予想通り、固定化タンパク質は、Ag表面上に見出されていないことを確認し、任意のタンパク質の振動モードを示していない。これとは対照的に、スペクトルは、Agナノドットと1550センチメートル-1と2900センチメートル周りにナノ六角形の展示バンド-1、分析対象物32,33を表すの配列を用いて得られる。具体的には、広帯域の周り1550センチメートル-1、アミドIIバンドとして知られている、タンパク質33,34で結合が振動ペプチドすることによるものである。と考えた場合に、このバンドは、Agの特徴との間のNi表面上に固定化されたGBPの振動モードの重畳を表すナノドット又はナノ六角形を含有する基質を使用した場合の、とは、貴金属ナノ構造体の近傍のこれらのモードのSERS増強を示す。このバンドは、結合タンパク質のために利用可能なNi表面なし銀パッド上SERS増強( 図5B)及び不在の不在下で溶液中のタンパク質のための非常に弱いが、それは、タンパク質のためのアクセス可能ないくつかのNi表面を有するナノ構造の基材のために顕著であるバインドします。しかし、さらに重要な本研究のためには、他の、狭いバンドの周りに約2900センチメートル-1 CH結合wibrations 32,33に起因することができます。グルコースを含まないGBPのスペクトルは2933センチメートル-1ナノ六角形基板( 図10A)と類似した波長のナノドット基板、および、弱いが識別可能なバンドでの顕著なバンドを示す。グルコース自由なタンパク質の場合とは異なる、グルコース結合GBPのSERSスペクトルは、 ふぃぎゅに示す 2850センチメートル-1と2910センチメートル-1に、債券の振動体制をCHに対応する図10(b)の展示再二つのバンド。バンドはよくナノ六角形基板上のグルコース結合GBPのスペクトルに顕著である、と彼らはまた、ナノドット基板上のGBPのスペクトルで見ることができる。 2850センチメートルのバンドは他のバンド-1に対し(2910センチメートルで、2890センチメートルに適度に近い-1つのソリューションのD-グルコースからの制御ラマンスペクトルであるため、それがタンパク質に結合したグルコースに起因することができる-1)タンパク質及びグルコースの両方のCH結合の振動に起因している。一つは、グルコースを含まないとグルコース結合基質固定化GBPからSERSシグネチャの違いを結論付けることができ、この領域で観測可能で、タンパク質結合グルコースのCH結合の振動が説明した設計を採用した検出可能である。
10.JPG "/>
リガンドフリー(A)の図10. SERSスペクトルとデザイン2で3異なる基板上に固定化されたリガンド結合(B)グルコース結合タンパク質 。スペクトル。780 nmの励起波長を用いて得られた拡大版を表示するには、こちらをクリックしてくださいこの図の。
設計3は、チオール終端23と、カスタマイズのドーパミン結合アプタマー(DBA)は、トリス、基板(ヒドロキシメチル)アミノメタン(TRIS)、エチレンジアミン四酢酸(EDTA)緩衝液で固定し、ドーパミンは、その後、固定化アプタマー19に結合されている。この設計のための基質は、FS( 図6C)上のAuナノ六角形の配列を含む。構造化されていない金パッド( 図6E)は 、制御目的のために使用される。 DNAは本質的に蛍光性であることから38、780 nmの励起waveleng thは、この要因を減少させるために設計3で使用されている。この設計では、認識要素(アプタマー)は、ドーパミン、この領域における重要なラマン活性を示し、一方、 図11において考慮ラマンシフトの領域の活性ラマンない。固定化されたアプタマーなしドーパミンのみに曝露した試料からのシグナルが19ない結果ドーパミンバンドを示さないので、観測されたSERSバンドがアプタマーに結合したドーパミン由来すると予想される。 図11は、添加前と後の金ナノ構造体上の固定化されたアプタマーのSERSスペクトルを比較するドーパミン。予想されたように、固定化されたドーパミンのないアプタマーは、ラマンバンドを示さない。対照的に、顕著なラマンバンドの数は、ドーパミン結合固定化アプタマーについて観察される。 図11の中で最もバンドの位置は、振幅の違いはあるものの、結晶質のドーパミンのものに近い。
igure 11 "SRC =" /ファイル/ ftp_upload / 52712 / 52712fig11.jpg "/>
リガンドフリー(パープルライン)の図11. SERSスペクトルとデザイン3 19中のAuナノ六角基板上に固定化されたリガンド結合(青線)ドーパミン結合アプタマー。赤い線は、ドーパミン粉末の制御SERSスペクトルを示す。 してくださいこの図の拡大版を表示するには、こちらをクリックしてください。
ディスカッション
SERSは、多くのユニークな利点を提供バイオ検出の非常に強力な手法として認知を得ている。極めて高感度の分析物9,10,11,35の非常に少量を検出することが可能となり、一方、分子振動との関係は、選択的にSERSスペクトルから特定 の検体の「フィンガープリント」を同定することが可能である。さらに、SERSは、水に比較的鈍感で非破壊的技術であり、それによって、それらの天然の水性環境9に生物学的物質を探索するために非常に適している。提示された結果は、これらの利点を強調ならびにさらなるバイオ検出の非常に柔軟なラベルフリー技術としてSERSの強力な可能性を示す。異なる基板固定生体分子の単層を用いた3の設計では、ラマンモードは、自信を持って、特定の分析物に起因する可能性があることが検出されている。 O、これらの生体分子の検出ことRそれぞれのリガンドは、SERS基板の支持体として溶融シリカの平坦な表面を採用することが実証されている、電子の表面に生物学的材料をインタフェース新興バイオ電子アーキテクチャとの関係で多数のアプリケーションを約束し、現在のエレクトロニクス、マイクロフルイディクスの設定を使用したデザインの互換性が高まりますそして電気化学デバイス2,3。重要なことには、2〜3の設計においてSERS検出を認識要素として、それぞれ、表面固定タンパク質およびアプタマーの単層を用いた、グルコースおよびドーパミンなどの小分子の特異的結合のために実証されている。
しかし、いくつかの側面は、「オンチップ」設定における効率的なSERSバイオ検出を達成するために、世話をする必要がある。まず、ほとんどの生体分子に共通でよく知られている課題は、ドライENVIのような非自然条件にさらされる場合は特に、分解するそれらの傾向である境や強烈なレーザー光。プロトコルを通じて、我々は常にラマンスペクトルの取得試料の調製から、全体の実験中に適切なソリューションに浸漬し、生体機能を有するサンプルを維持することの重要性を強調してきた。後者については、カスタム防水チャンバは、レーザー露光中の液体の蒸発を避けるために( 図7)が設計されている。プロトコールのステップ5.3に記載のように露光及びレーザ強度の持続時間はまた、サンプルの損傷を避けるために制限されるべきである。
SERS検出の結果は、使用基板、及び金属ナノ構造、特に、フィーチャー間の分離の形状に敏感で見出される。それは図8および図9から次のように、設計1の試料のSERS強度は、溶融シリカ上のAuナノドット間の隙間の幅に強く依存する。私はテストされたAuナノドットの3つの配列のうち、nは、この設計( 図8)は 、最も高いラマン強度は金フィーチャ間の狭い隙間を有し、したがって、より効率的な電磁場増強を提供する配列Iによって達成される。 図9に示すように、10〜20ナノメートル以下のレベルで、フィーチャー間の分離の制御が必要である。 SERS基板を製造するためのEBLを採用し、ここで示されたように、フィーチャー間のギャップの幅を制御するために特別に効率的な解像度を提供しています。ポジ型EBLとPMMAなどのレジストPMMAマスクの孔のサイズは、単に、露光量を変化させることによって変えることができる。リフトオフ後に、これは金属加工ドットの異なるサイズになり、適切なEBL露出18用量を選択することによって所望のようにドット間の隙間の幅を調整することができる。
他の課題は、特定の生物の検出アプリケーションのためのSERS基板の幾何学的形状の最適化である。増強効果のIもののフィーチャー間のギャップの減少にncreasesは、生体分子の比較的大きなサイズは、ギャップがいかに狭い上の制限を課す。これは、固定化方法は、タンパク質を効率的に( 図3B参照 )は、貴金属点の間の表面にではなく、ドット自体に結合するようなものである場合に、デザイン2の結果から明らかである。それは、図10から次のように、構造化されていない銀パッド用のSERSスペクトルは、分析物からのバンドを示していない。パッドは非常に薄いアイランド間のギャップと、ナノ結晶構造を示すが、これらのギャップは、タンパク質分子を収容するのには狭すぎる( 図6F参照 )。まだ複雑さの別の次元は、タンパク質 - リガンド結合を検出する必要があるときに添加される。 図10に、SERS CH帯域が仮にGBPのコンホメーションの変化によって説明することができるリガンドを含まないか1つに比べてリガンド結合GBPからのスペクトルにおいてより顕著である増加したラマン活性を有する、より剛性構造が得られる、D-グルコース2 7,27の結合に依存する。一つは2ナノ構造の基板を比較した場合、リガンド結合タンパク質からのタンパク質およびグルコースCHバンドの両方がナノ六角形でより顕著であるのに対し、リガンドを含まないタンパク質からのCHバンドは、ナノドットの基質を用いて得られたSERSスペクトルにおいて強いこと基板。二つの要因がこれらの違いをもたらすことが期待されて、Agの間のスペースの可用性は、GBPは、Niと結合することができる場合があります、そして「ホットスポット」のラマン散乱電磁増強へのリガンド結合およびリガンド遊離タンパク質の感受性これらの機能の間。一方では、ナノドットパターンは、Niコーティングは、Agナノドット基板上のグルコースを含まGBPについて観測より顕著CHバンドを説明する可能性がある、と結合するタンパク質のために利用可能である比較的大きな特徴間のエリアを提供しています。一方、それらの不均一なSTRUCによるトゥーレ( 図6Dを参照)、銀ナノ六角形は、ナノ六角形基板上のグルコース結合GBPから強いCH振動帯で生じたナノ六角形の中のAgの島の間の狭い隙間に強い電磁強化を表示するために生じる可能性があります。この相互作用のいくつかの項目は、さらなる検証が必要であり、そのようなポンドなどの大きなタンパク質が関与する複雑な分析物のためのSERS基板の最適化は、パイプラインのままです。
他の構成要素ではないのに対し、唯一のリガンドは、選択された領域内のラマン活性がある場合、明らかに、認識要素として固定化された生体分子を用いたリガンド結合のSERS検出が容易になる。これは、アプタマーに結合したドーパミンの顕著なSERSバンドが得られ、設計3( 図11)の場合である。アプタマードーパミンペアは、優れた特異性を示すとSERSスペクトルは、有意なバックグラウンドシグナルなしで顕著なバンドを含む。
ラベル·手数料SERS技術の将来の進歩は、異なる表面ナノ構造の設計の広い範囲を持つ生体分子」のSERS信号増強の広範なテストを伴うだろう。サイズ、形状、およびここに提示試料調製プロトコルと組み合わせフィーチャー間の分離、制御の素晴らしいレベルの様々なナノ構造を製造する直接描画電子ビームリソグラフィの使用は、比較した結果の相互検証を容易にする異なる研究グループによる。 SERS基板は、メソッド11,12,13「ボトムアップ」の代替を採用して作製されたとき、これは広範な種類のに最適な基板設計の信頼性の高い識別に向かって金属ナノ構造のサイズと位置のよりよい制御を可能にする、再現性の主要な課題に対処するアプリケーション。これらの技術の拡張性は、続いて、ナノ相補ナノリソグラフィー法とEBLとを組み合わせることによって改善することができる調整可能なEBL技術を採用する最適化されたナノスケールのデザインの将来の量産に向けたインプリントリソグラフィ19。
開示事項
The authors have nothing to disclose.
謝辞
The authors would like to thank: David Wishart, Valentyna Semenchenko, Mark McDermott, Michael Woodside, and Albert Cao for their help in developing and preparing the protein conjugates as well as the DNA aptamer; T. M. Fahim Amin, Mosa Sharmin Aktar, and Trevor Olsen for their assistance in the sample preparation, Jonathan Mane for his assistance in generating images of the molecular structures; and the funding sources including the National Research Council of Canada – National Institute for Nanotechnology (NRC-NINT), Natural Sciences and Engineering Research Council of Canada (NSERC), and the University of Alberta for supporting the work.
資料
| Name | Company | Catalog Number | Comments |
| 11-Mercaptoundecanoic acid (MUA) |  Sigma Aldrich Sigma Aldrich | 450561 ALDRICH | Used for surface functionalization in Design 1 |
| Conductive polymer |  Mitsubishi Rayon Mitsubishi Rayon | aquaSAVE-57xs | A 70 nm thick layer is used as anti-charging coating for EBL exposures |
| D-glucose | Collaborator Lab. | Ligand in Design 2 | |
| Dopamine | Collaborator Lab. | Ligand in Design 3 | |
| Dopamine binding aptamer (DBA) |  Integrated DNA Technologies Inc. Integrated DNA Technologies Inc. | 5'- /Thiol Modifier C6 S-S/ AAAAAAAAAA GTCTCTGTGT GCGCCAGAGA ACACTGGGGC AGATATGGGC CAGCACAGAA TGAGGCCC-3' | Biopolymer in Design 3 |
| Fused silica wafers |  Mark Optics Mark Optics | ||
| Glucose binding protein (GBP) |  Collaborator Lab. Collaborator Lab. | PDB ID 2HPH | Biopolymer in Design 2 |
| High vacuum grease |  Dow Corning Dow Corning | Used to seal water-proof chamber | |
| Hydrogen Peroxide 30%, H2O2 | J.T. Baker | Used for pirahna solution | |
| N-ethyl-N'-(3-(dimethylamino) propyl) carbodiimide (EDC) |  Sigma Aldrich Sigma Aldrich | 03450 FLUKA | Used for immobilization of biopolymer in Design 1 |
| N-Hydroxysuccinimide (NHS) |  Sigma Aldrich Sigma Aldrich | 130672 ALDRICH | Used for immobilization of biopolymer in Design 1 |
| Potassium phosphate buffer | Collaborator Lab. | Buffer used in Raman sampling | |
| Phosphate buffered saline (PBS) | Collaborator Lab. | Solvent in Design 3 | |
| Polymethylmethacrylate (PMMA) 950 A2 |  MicroChem MicroChem | A 90 nm thick layer is used as EBL positive tone resist | |
| Recombinant protein A |  Protein Mods Inc Protein Mods Inc | PDB ID 1BDD | Biopolymer in Design 1 |
| Sulfuric acid 96%, H2SO4 | J.T. Baker | Used for pirahna solution | |
| Tris(hydroxymethyl)aminomethane (TRIS) and ethylenediaminetetraacetic acid (EDTA) buffer |  Sigma Aldrich Sigma Aldrich | T9285 SIGMA | Buffer in Design 3
|
| | |||
| Equipment | |||
| Name | Company | Catalog Number | Comments |
| Dicing saw | Diamond Touch Technology Inc. (17301 W Colfax Ave # 152, Golden, CO) | Used to cut FS wafer | |
| Electron beam evaporator |  Kurt J. Lesker Kurt J. Lesker | Used for Au and Ag evaporation | |
| Electron beam evaporator |  Johnsen Ultravac (JUV) Johnsen Ultravac (JUV) | JuV E-gun | Used for Ni evaporation |
| Microscope cover slips (25 mm) |  Fisher Scientific Fisher Scientific | 12-545-102 | Used in water-proof chamber |
| Microscope slides (3×1 in.) |  Fisher Scientific Fisher Scientific | Used in water-proof chamber | |
| Raith 150TWO EBL exposure system |  Raith Inc. Raith Inc. | Raith 150TWO system | Used for EBL exposures |
| Raman microscope |  Thermo Scientific Thermo Scientific | Nicolet Almega XR | Used for Raman spectroscopy |
| Sonicator system |  Branson Branson | Used for liftoff and solutions mixing | |
| Spinner |  Brewer Spinner and Hotplate Brewer Spinner and Hotplate | Cee 200X and Cee 1300X | Used to spin-coat PMMA and conductive polymer |
参考文献
- Sapsford, K. E., Tyner, K. M., Dair, B. J., Deschamps, J. R., Medlintz, I. L. Analyzing Nanomaterial Bioconjugates: A Review of Current and Emerging Purification and Characterization Techniques. Anal. Chem. 83, 4453-4488 (2011).
- Walcarius, A., Minteer, S. hD., Wang, J., Yu, L., Merkoçi, A. Nanomaterials for Bio-Functionalized Electrodes: Recent Trends. J. Mater. Chem. B. 1, 4878-4908 (2013).
- Kim, J., et al. Applications, Techniques, and Microfluidic Interfacing for Nanoscale Biosensing. Microfluid. Nanofluid. 7, 149-167 (2009).
- Rassaei, L., Singh, P. S., Lemay, S. G. Lithography-Based Nanoelectrochemistry. Anal. Chem. 83, 3974-3980 (2011).
- Wong, L. S., Khan, F., Micklefield, J. Selective Covalent Protein Immobilization: Strategies and Applications. Chem. Rev. 109, 4025-4053 (2009).
- Ley, C., Holtmann, D., Mangold, K. -M., Schrader, J. Immobilization of Histidine-Tagged Proteins on Electrodes. Colloids and Surfaces B: Biointerfaces. 88, 539-551 (2011).
- Kim, D., Herr, A. E. Protein Immobilization Techniques for Microfluidic Assays. Biomicrofluidics. 7, 041501(2013).
- Anker, J. N., Hall, W. P., Lyandres, O., Shah, N. C., Xhao, J., Van Duyne, R. P. Biosensing with Plasmonic Nanosensors. Nature Materials. 7, 442-453 (2008).
- Bantz, K. C., et al. Recent Progress in SERS Biosensing. Phys.Chem. 13, 11551-11567 (2011).
- Sharma, B., Frontiera, R. R., Henry, A. -I., Ringe, E., Van Duyne, R. P. SERS: Materials, Applications, and the Future. Mater. Today. 15, 16-25 (2012).
- Kleinman, S. L., Frontiera, R. R., Henry, A. -I., Dieringer, J. A., Van Duyne, R. P. Creating, Characterizing, and Controlling Chemistry with SERS Hot Spots. Phys.Chem.Chem.Phys. 15, 21-36 (2013).
- Fan, M., Andrade, F. S., Brolo, A. G. A Review on the Fabrication of Substrates for Surface Enhanced Raman Spectroscopy and their Applications in Analytical Chemistry. Anal. Chim. Acta. 693, 7-25 (2011).
- Cao, Y., Li, D., Jiang, F., Yang, Y., Zh, H. Engineering Metal Nanostructure for SERS Application. J. Nanomater. 123812, 1-12 (2013).
- Glembocki, O., Rendell, R., Alexson, D., Prokes, S., Fu, A., Mastro, M. Dielectric-Substrate-Induced Surface-Enhanced Raman Scattering. Phys. Rev. B. 80, 085416(2009).
- Merlen, A., et al. Surface Enhanced Spectroscopy with Gold Nanostructures on Silicon and Glass Substrates. Surf. Sci. 605, 1214-1218 (2011).
- Muhammad, M., Buswell, S. C., Dew, S. K., Stepanova, M. Nanopatterning of PMMA on Insulating Surfaces with Various Anticharging Schemes Using 30 keV Electron Beam Lithography. J. Vac. Sci. Technol. B. 29, 06F304(2011).
- Peters, R., Fito, T., Gutierrez-Rivera, L., Dew, S. K., Stepanova, M. Study of Multilayer Systems in Electron Beam Lithography. J. Vac. Sci. Technol. B. 31, 06F407(2013).
- Gutierrez-Rivera, L., Peters, R., Dew, S., Stepanova, M. Application of EBL Fabricated Nanostrucutred Substrates for SERS Detection of Protein A in Aqueous Solution. J. Vac. Sci. Technol.B. 31, (2013).
- Gutierrez-Rivera, L., Peters, R., Dew, S., Stepanova, M. Surface-Enhanced Raman Spectroscopy Detection of Protein-Ligand Binding Using D-glucose and Glucose Binding Protein on Nanostructured Plasmonic Substrates. , (2014).
- Peters, R. Fabrication and Testing of Surface-Enhanced Raman Spectroscopy Substrates for the Detection of Biomolecules [MSc Thesis]. , University of Alberta. (2014).
- Gouda, H., Torigoe, H., Saito, A., Sato, M., Arata, Y., Shimada, I. Three-Dmensional Solution Structure of the B Domain of Staphylococcal Protein A: Comparisons of the Solution and Crystal Structures. Biochemistry. 31, 9665-9672 (1992).
- Cuneo, M. J., Johnson, S. J., Beese, L. S., Hellinga, H. W. High Resolution Structure of E. Coli Glucose/Galactose Binding Protein Bound with Glucose. Research Collaboratory for Structural Bioinformatics (RCSB) Protein Data Bank. , (2009).
- Humphrey, W., Dalke, A., Schulten, K. VMD - Visual Molecular Dynamics. J. Molec. Graphics. 14, 33-38 (1996).
- Walsh, R., DeRosa, M. C. Retention of Function in the DNA Homolog of the RNA Dopamine Aptamer. Biochem. Biophys. Res. Comm. 388, 732-735 (2009).
- Akitomi, J., Kato, S., Yoshida, Y., Horii, K., Furuich, M., Waga, I. ValFold: Program for the Aptamer Truncation Process. Biomed. Inf. 7, 38-40 (2011).
- Han, K., Lee, Y., Kim, W. PseudoViewer: Automatic Visualization of RNA Pseudoknots. Bioinformatics. 18, S321-S327 (2002).
- Dwyer, M. A., Hellinga, H. W. Periplasmic Binding Proteins: a Versatile Superfamily for Protein Engineering. Curr. Opin. Struct. Biol. 14, 495-504 (2004).
- Benson, D. E., Conrad, D. W. Design of Bioelectronic Interfaces by Exploiting Hinge-Bending Motions in Proteins. Science. 293, 1641-1644 (2001).
- Bozic, S., Chorzempa, J. Pirahna Cleaning. , University of Alberta. (2011).
- Mohammad, M. A. Raith 150TWO SOP. , University of Alberta. (2011).
- Schmidt, M. W., et al. General Atomic and Molecular Electronic Structure System. J. Comput. Chem. 14, 1347-1363 (1993).
- Bode, B. M., Gordon, M. S. MacMolPlt: a Graphical User Interface for GAMESS. J. of Mol. Graph. Mod. 16, 133-138 (1998).
- Bright, A., Devi, T. S. R., Gunasekaran, S. Spectroscopical Vibrational Band Assignment and Qualitative Analysis of Biomedical Compounds with Cardiovascular Activity. Int. J. Chem. Tech. Res. 2, 379-388 (2010).
- Bandekar, J. Amide Modes and Protein Conformation. Biochim. Biophys. Acta. 1120, 123-243 (1992).
- Barth, A., Zscherp, C. What Vibrations Tell About Proteins. Quarterly Reviews of Biophysics. 35, 369-340 (2002).
- Chrimes, A. F., Khoshmanesh, K. h, Stoddart, P. R. M. itchellA., Kalantar-Zadeh, K. Microfluidics and Raman Microscopy: Current Applications and Future Challenges. Chem. Soc. Rev. 42, 5880-5906 (2013).
- Park, S. -K., Lee, N. -S., Lee, S. -H. Vibrational Analysis of Dopamine Neutral Base based on Density Functional Force Field. Bull.-Korean Chem. Soc. 21, 959-968 (2000).
- Briand, E., Salmain, M., Compère, C., Pradier, C. M. Immobilization of Protein A on SAMs for the elaboration of immunosensors. Coll. Surf. B: Biointerfaces. 53, 215-224 (2006).
- Lakowicz, L. R., et al. Radiative decay engineering: 2. Effects of Silver Island Films on Fluorescence Intensity, Lifetimes, and Resonance Energy Transfer. Analytical biochemistry. 301, 261-277 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved