このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
治療用途のためのツールとしてのRGD官能ヒドロゲルの合成
要約
We present a protocol for the synthesis of RGD-functionalized hydrogels as devices for cell and drug delivery. The procedure involves copper catalyzed alkyne-azide cycloaddition (CuAAC) between alkyne-modified polyacrylic acid (PAA) and a RGD-azide derivative. The hydrogels are formed using microwave-assisted polycondensation and their physicochemical properties are investigated.
要約
The use of polymers as biomaterials has provided significant advantages in therapeutic applications. In particular, the possibility to modify and functionalize polymer chains with compounds that are able to improve biocompatibility, mechanical properties, or cell viability allows the design of novel materials to meet new challenges in the biomedical field. With the polymer functionalization strategies, click chemistry is a powerful tool to improve cell-compatibility and drug delivery properties of polymeric devices. Similarly, the fundamental need of biomedicine to use sterile tools to avoid potential adverse-side effects, such as toxicity or contamination of the biological environment, gives rise to increasing interest in the microwave-assisted strategy.
The combination of click chemistry and the microwave-assisted method is suitable to produce biocompatible hydrogels with desired functionalities and improved performances in biomedical applications. This work aims to synthesize RGD-functionalized hydrogels. RGD (arginylglycylaspartic acid) is a tripeptide that can mimic cell adhesion proteins and bind to cell-surface receptors, creating a hospitable microenvironment for cells within the 3D polymeric network of the hydrogels. RGD functionalization occurs through Huisgen 1,3-dipolar cycloaddition. Some PAA carboxyl groups are modified with an alkyne moiety, whereas RGD is functionalized with azido acid as the terminal residue of the peptide sequence. Finally, both products are used in a copper catalyzed click reaction to permanently link the peptide to PAA. This modified polymer is used with carbomer, agarose and polyethylene glycol (PEG) to synthesize a hydrogel matrix. The 3D structure is formed due to an esterification reaction involving carboxyl groups from PAA and carbomer and hydroxyl groups from agarose and PEG through microwave-assisted polycondensation. The efficiency of the gelation mechanism ensures a high degree of RGD functionalization. In addition, the procedure to load therapeutic compounds or biological tools within this functionalized network is very simple and reproducible.
概要
ヒドロゲルは天然または合成された親水性架橋ポリマーで形成された三次元ネットワークであり、独特の三次元構造によって特徴付けられます。これらのデバイスは、薬物送達、組織工学、遺伝子キャリアとスマート・センサ1,2の生物医学分野でますます魅力的です。実際、その高い水含有量、ならびにそれらのレオロジーおよび機械的性質は、それらの適切な候補が軟組織微小環境を模倣し、水溶性のサイトカインまたは増殖因子の送達のためにそれらの効果的なツールにするために行います。最も有望な使用の一つは、細胞および生物活性化合物を運ぶ注射用生体材料としてです。 インビトロおよびインビボ実験3,4で観察されたようなヒドロゲルは、保持して正確な生理学的関連性の様式で幹細胞の調節シグナルを送達することによって、細胞の生存および制御幹細胞の運命を改善することができます。このの主要な利点は、可能性であります体の上にすべてを移行し、目標の目標5を失って 、循環急流にエリアとextravasatesを離れる細胞の量を最小限に抑え、( その場で )接種のゾーン内注入した細胞を維持します。三次元ハイドロゲルネットワークの安定性は、ポリマー鎖の6間の共有結合または凝集力によって形成され、その架橋部位です。
このフレームワークでは、直交選択的化学は、ポリマー鎖に適用されるが、ヒドロゲル公演7を向上させることができる汎用性の高いツールです。実際、適切な化学基を有するポリマーの修飾は、細胞生存率および組織形成におけるそれらの使用を強化するために適切な化学的、物理的および機械的特性を提供するのに役立つ可能性があります。同様に、ゲルマトリックス内の細胞または成長因子をロードするための技術のうち、RGDペプチドの使用は、細胞接着及び生存の改善を可能にします。 RGDは構成されるトリペプチドでありますアルギニン、グリシン、およびはるかに複数の細胞接着受容体と細胞アンカー、行動および生存8,9にその生物学的影響に対処する能力のために最も効果的でしばしば用いられるトリペプチドであるアスパラギン酸の。この作業では、RGD官能ヒドロゲルの合成は、もてなしの細胞微小環境のために十分な生化学的特性によって特徴付けネットワークを設計することを目的として検討されています。
ヒドロゲルの合成におけるマイクロ波照射の使用は、副反応を最小限に抑え、従来の熱プロセス10に比べて短時間でより高い反応速度と収率を得るための簡単な手順を提供します。この方法は、ポリマーとの相互作用及び反応システム11中の有機溶媒の非存在に起因する精製工程及び収率滅菌ヒドロゲルを必要としません。したがって、それは、MODためのポリマーネットワークに結合されたRGDの高い割合を確保しますificationsは、ゲル形成に関与するポリマーの化学基に必要とされます。カルボキシル基は、PAAおよびカルボマー、ならびにヒドロキシル基、PEGから、アガロースから、重縮合反応によりヒドロゲルの三次元構造を生じます。言及されたポリマーは、脊髄損傷の修復処理12におけるヒドロゲルの合成のために使用されます。以前に報告されているようにこれらのデバイスは、高い生体適合性だけでなく、多くの生体組織のとチキソトロピー性のものと似ている機械的および物理化学的特性を示し、13,14を動作します。さらに、それらは、注射ゾーンで、 その場に局在したままです。
この研究では、PAAのカルボキシル基は、アルキン部分( 図1)を用いて修飾され、及びRGD -アジド化合物は、構造を用いて調製化合物とトリペプチドの末端基-NH 2(CH 2)の反応性を利用するn個合成されます- N 3(<強い>図2)。その後、変更されたPAAはCuAACのクリック反応15-17( 図3)を介してRGD-アジド誘導体と反応します。銅(I)触媒の使用は、反応速度及び位置選択性の両方の主要な改善につながります。 CuAAC反応は広く、有機合成およびポリマー科学において使用されます。これは、官能基を高効率、高耐性を兼ね備え、かつ、有機溶剤を使用することによって影響を受けません。高選択性、速い反応時間および簡単な精製手順は、所望の部分18を移植する星型ポリマー、ブロックコポリマーまたは鎖の取得を可能にします。このクリック戦略は、最終的な生化学的用途に応じて物理化学的性質をカスタマイズするために重合後のポリマーを修正することが可能となります。 CuAAC実験条件は簡単に(銅の酸化を最小限に発生する可能性があるのに対し、反応は、水の影響を受けない)、再現性、および自然のです形成されたトリアゾールは、製品の安定性を確保します。銅金属の使用は、細胞に対する潜在的な毒性効果および生物学的微小環境において、臨界点と考えることができるが、透析は、触媒残留物の完全な除去を可能にするための精製方法として使用されます。最後に、PAAは、RGD細胞または薬物担体としてのこれらのシステムの潜在的な機能を確認するために、検討されているヒドロゲルの合成( 図4)、得られたネットワークの物理化学的特性で使用される修飾しました。
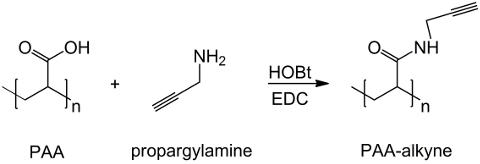
図1:PAAは、アルキンの合成を修正アルキン基とPAAの官能化のスキームを;。 「n」はプロパルギルアミンと反応するカルボキシル基を有するモノマーを示しています。 ご覧になるにはこちらをクリックしてください。この図の拡大版。

図2:RGD- アジド合成 RGD-アジド誘導体の合成この図の拡大版をご覧になるにはこちらをクリックしてください。

図3:RGD-アジド誘導体とアルキン-PAA間のクリック反応の反応スキームをクリックしてください 。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図4:ハイドロゲルSYNThesis。RGD官能ヒドロゲルの合成手順。 この図の拡大版をご覧になるにはこちらをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
プロトコル
注:受信のような化学物質が使用されています。線形RGDを購入し、それは標準的なFmoc固相ペプチド合成16,19によって調製することができます。溶媒は分析グレードのものです。透析はカットオフに等しい3500にダワット Mを有する膜を使用する必要があります。合成された化合物は、溶媒、化学シフトとしてクロロホルム(CDCl 3中)または重水(D 2 O)を使用して400 MHzの分光計で記録された1 H NMRスペクトルにより特徴づけられる百万分率でδ値として報告されます。さらに、ヒドロゲルは、KBrペレット技術を使用してFT-IR分析に供し、その物理的特徴付けは、37℃で反転試験管を用いて評価し、ゲル化の研究を含むています。
4-Azidobutanoyl塩化物1の1の合成
- ジクロロメタン10ml及びジメチルホルムアミド0.5ml中の4- azidobutanoic酸(3.90ミリモル)の500ミリグラムを溶解します。
- 0°Cで溶液を冷却氷浴を使用して。
- 攪拌しながら、反応系に滴下して加えるゆっくりジクロロメタン5mlに塩化オキサリル(5.85ミリモル)の505μLを加え、。
- 氷浴を用いて0℃で1時間後、室温に戻します。
- ロータリーエバポレーターを用いて減圧下で溶媒を除去します。
- CDCl 3中16試料を溶解し、1 H-NMR分光法により得られた生成物を特徴付けます。
RGD-アジド誘導体2の2の合成
- 1MのNaOH 1mlにRGDを50mg(0.145ミリモル)を溶解させます。
- テトラヒドロフラン2ml中の1(0.16ミリモル)の24ミリグラムを溶解します。
- 氷浴を用いて0℃で溶液1を滴下してRGDソリューションのすべてを追加します。
- 室温に戻し、一晩攪拌。
- 1MのHClの1ミリリットルを追加します。
- ロータリーエバポレーターを用いて減圧下で溶媒を除去します。
- OBTを特徴づけますained 1 H-NMR分光法による製品、D 2 O 16でサンプルを溶解させます。
3. PAAアルキン変形例3
- 蒸留水15ml中のPAA溶液(2.8ミリモル)のw / wの35%の200 mgの溶解。
- プロパルギルアミン塩酸塩(0.20ミリモル)の15.4 mgの追加。
- 1(v / v)のアセトニトリル:50°Cに加熱することにより、蒸留水溶液1 14mlの中の1-ヒドロキシベンゾトリアゾール水和物(HOBT、0.28ミリモル)の42.8 mgの溶解。
- 室温でのPAA溶液にHOBtをソリューションのすべてを追加します。
- 反応混合物にethyldimethylaminopropylcarbodiimideの53.6 mgの(EDC、0.28ミリモル)を追加します。
- pHを5.5に調整し、室温で一晩反応系を撹拌し、1MのHClを使用してください。
- ソリューションを透析。蒸留水2リットルに塩化ナトリウムの11.2グラムを溶解し、その後、塩酸ワット/ wの37%の0.2ミリリットルを追加します。 3.5キロダルトンのM wのカットオフを有する膜を用いて溶液を透析。
- Perfo3日間のrm透析。塩酸w / wの37%の0.2ミリリットルを含む新たに調製した蒸留水2Lで毎日透析液を変更します。
- -80℃での最終溶液を保管してください。製造業者のプロトコルに従って凍結乾燥機でそれを凍結乾燥。
- D 2 O 16のサンプルを溶解し、1 H-NMR分光法によって官能化ポリマーを特徴付けます。
PAA-RGDポリマー4の4の合成
- PAAの78 mgを蒸留水10mlにアルキン3(1.083ミリモル)を改変溶かします。
- テトラヒドロフラン5mlにRGDアジド誘導体2(0.0722ミリモル)25mgを溶解させます。
- 高分子溶液にRGDソリューションのすべてを追加します。
- ヨウ化銅(0.0116ミリモル)およびアスコルビン酸ナトリウムの2.2ミリグラム(0.0111ミリモル)の2.2 mgの追加。
- 攪拌しながら、60℃で一晩、得られた混合物を還流。
- 25℃に混合物を冷却。
- Dialyzソリューションを電子。蒸留水2リットルに塩化ナトリウムの11.2グラムを溶解し、その後、塩酸ワット/ wの37%の0.2ミリリットルを追加します。 3.5キロダルトンのM wのカットオフを有する膜を用いて溶液を透析。
- 3日間透析を行います。塩酸w / wの37%の0.2ミリリットルを含む新たに調製した蒸留水2Lで毎日透析液を変更します。
- -80℃での最終溶液を保管してください。製造業者のプロトコルに従って凍結乾燥機でそれを凍結乾燥。
- D 2 O 16のサンプルを溶解し、1 H-NMR分光法により得られた生成物を特徴付けます。
5. RGD官能ヒドロゲルの合成
- PBSを準備します。蒸留水50mlにPBS塩645 mgの溶解。
- カルボマーの40 mgであり、官能基化PAA 4の10 mgを完全に溶解(30分)まで、室温で、PBSの9ミリリットル(ステップ5.1)でブレンド。
- 溶液に、PEGの400ミリグラムを加え、45分間攪拌し続けます。
- 攪拌を停止し、システムが30分間沈降することを可能にします。
- pHを7.4に調整するために1NのNaOHを使用してください。
- 得られた混合物の5ミリリットルに、アガロース粉末25mgを追加します。
- 通常は30秒と1分の間の時間のために、沸騰するまで、500 Wのマイクロ波放射を使用してシステムを照射し、電磁的に80℃まで加熱します。
- その温度が50℃になるまで室温にさらされ、混合物のままにして、1の溶液を得るためには、PBS(ステップ5.1)の5ミリリットルを追加:1の体積比を。
- 1.1センチメートルの直径を有する鋼製シリンダーを含む12マルチウェルプレートを準備します。
- 溶液から500μlのアリコートを取り出し、各鋼シリンダに配置します。
- システムを完全にゲル化するまで45分間安静にしておきます。
- ヒドロゲルを得るために、ステンレス製のピンセットを用いてシリンダーを削除します。
治療ツール(薬物または細胞)の6.のロード
- 目を繰り返しEPS 5.1から5.7まで。
- 1の体積比(既にゾル状態で)、混合物を37°Cに達すると、1で最終的なシステムを得るために、所望の薬物溶液または細胞培養物を含む溶液5mlを加えます。
- 繰り返しは、物理的にゲル内に捕捉biocompoundsを有するポリマーネットワークを得るために5.9から5.12を繰り返します。
7.ヒドロゲルキャラクタリゼーション
- FT-IR分析
- ゲル形成後、24時間蒸留水2.5 ml中に合成さヒドロゲルのいずれかを浸します。
- ヒドロゲルが沈んでいる水性媒体を取り出して、凍結乾燥した液体N 2で。
- KBrペレット法に従ってヒドロゲルサンプルをラミネート。
- 瑪瑙乳鉢にKBrを完全へらを追加します。ヒドロゲル少量のサンプルを取り、のKBr粉末と混合(臭化カリウム量、またはスパチュラの先端をカバーするのに十分なだけの約0.1から2パーセント)。
- 粉末が微細かつ均一になるまで混合物を粉砕します。
- IRペレットを形成するために、KBrペレットキットを使用してください。手動の実験用プレスを使用した粉末を押す:5トンに等しい圧力容量で3分間、その後3分間10トンの圧力容量で。
- 外観のように均質かつ透明な最終ペレットを得るために圧力を解放します。 IRサンプルホルダーにペレットを挿入し、スペクトル16を実行します。
- ゲル化研究
- PBSの900μlの2ミリリットルのマイクロチューブを記入し、37℃に平衡化。
- ヒドロゲルを形成し、37℃でインキュベートし製造された高分子溶液100μlを加えます。
- 管を反転し、ゲルを1、2、5、10及び20分で流れる場合に観察。ゲルは、ゲル化時間として流れていない時刻を記録します。
Access restricted. Please log in or start a trial to view this content.
結果
nは、カルボキシル基のアミンと反応するモノマーラベル図1に示したようにPAAのアルキン誘導体を効率的に、ポリアクリル酸、およびプロパルギルアミンから合成されます。生成物の同定は、1 H-NMR分光法によって確認される。 図5は、三重結合で変性されたPAAの1 H-NMRスペクトルを示す図 。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
The PAA post-polymerization modification with alkyne moieties and the RGD functionalization with the azide group guarantee the formation of a stable bond between the polymer and the peptide. Indeed, triazole serves as a rigid linking unit among the carbon atoms, attached to the 1,4 positions of the 1,2,3-triazole ring and it cannot be cleaved hydrolytically or otherwise. In addition, triazole is extremely difficult to oxidize and reduce, unlike other cyclic structures such as benzenoids and related aromatic heterocycles<...
Access restricted. Please log in or start a trial to view this content.
開示事項
The authors state no conflict of interest and they have not received any payment in preparation of this manuscript.
謝辞
著者は、言語の編集のために実りある議論のための教授マウリツィオ瑪斯とミスキアラAllegrettiに感謝したいと思います。本研究は、坂東GIOVANI Ricercatori 2010(MinisteroデッラサルーテGR-2010- 2312573)によってサポートされています。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Poly(acrylic acid) solution average Mw ~100,000, 35 wt% in H2O | Sigma Aldrich | 523925 | CAS 9003-01-4 |
| Poly(ethylene glycol) 2,000 | Sigma Aldrich | 84797 | CAS 25322-68-3 |
| Carbomeer 974P | Fagron | 1387083 | |
| Agarose | Invitrogen Corp. | 16500-500 | UltraPure Agarose |
| RGD peptide | abcam | ab142698 | |
| 4-azidobutanoic acid | Aurum Pharmatech | Z-2421 | CAS 54447-68-6 |
| Oxalyl chloride | Sigma Aldrich | O8801 | CAS 79-37-8 |
| Propargylamine hydrochloride 95% | Sigma Aldrich | P50919 | CAS 15430-52-1 |
| Copper(I) iodide | Sigma Aldrich | 3140 | CAS 7681-65-4 |
| Sodium ascorbate | Sigma Aldrich | Y0000039 | CAS 134-03-2 |
| Phosphate buffered saline | Sigma Aldrich | P4417 | |
| Dialysis Membrane | Spectrum Laboratories, Inc. | 132725 | Spectra/Por 3 Dialysis Membrane Standard RC Tubing MWCO: 3.5 kD |
参考文献
- Slaughter, B. V., Khurshid, S. S., Fisher, O. Z., Khademhosseini, A., Peppas, N. A. Hydrogels in Regenerative Medicine. Adv. Mater. 21 (32-33), 3307-3329 (2009).
- Rossi, F., Perale, G., Papa, S., Forloni, G., Veglianese, P. Current options for drug delivery to the spinal cord. Expert Opin. Drug Deliv. 10 (3), 385-396 (2013).
- Huebsch, N., et al. Harnessing traction-mediated manipulation of the cell/matrix interface to control stem-cell fate. Nat. Mater. 9 (6), 518-526 (2010).
- Mothe, A. J., Tam, R. Y., Zahir, T., Tator, C. H., Shoichet, M. S. Repair of the injured spinal cord by transplantation of neural stem cells in a hyaluronan-based hydrogel. Biomaterials. 34 (15), 3775-3783 (2013).
- Khetan, S., et al. Degradation-mediated cellular traction directs stem cell fate in covalently crosslinked three-dimensional hydrogels. Nat. Mater. 12 (5), 458-465 (2013).
- Ashley, G. W., Henise, J., Reid, R., Santi, D. V. Hydrogel drug delivery system with predictable and tunable drug release and degradation rates. Proc. Natl. Acad. Sci. U S A. 110 (6), 2318-2323 (2013).
- Rossi, F., van Griensven, M. Polymer Functionalization as a Powerful Tool to Improve Scaffold Performances. Tissue Eng. Part A. 20 (15-16), 2043-2051 (2014).
- Gould, S. T., Darling, N. J., Anseth, K. S. Small peptide functionalized thiol-ene hydrogels as culture substrates for understanding valvular interstitial cell activation and de novo tissue deposition. Acta Biomater. 8 (9), 3201-3209 (2012).
- Azagarsamy, M. A., Anseth, K. S. Wavelength-Controlled Photocleavage for the Orthogonal and Sequential Release of Multiple Proteins. Angew. Chem. Int. Edit. 52 (51), 13803-13807 (2013).
- Larrañeta, E., et al. Microwave-Assisted Preparation of Hydrogel-Forming Microneedle Arrays for Transdermal Drug Delivery Applications. Macromol. Mater. Eng. 300 (6), 586-595 (2015).
- Cook, J. P., Goodall, G. W., Khutoryanskaya, O. V., Khutoryanskiy, V. V. Microwave-Assisted Hydrogel Synthesis: A New Method for Crosslinking Polymers in Aqueous Solutions. Macromol. Rapid Comm. 33 (4), 332-336 (2012).
- Perale, G., et al. Multiple drug delivery hydrogel system for spinal cord injury repair strategies. J. Control. Release. 159 (2), 271-280 (2012).
- Rossi, F., Perale, G., Storti, G., Masi, M. A Library of Tunable Agarose Carbomer-Based Hydrogels for Tissue Engineering Applications: The Role of Cross-Linkers. J. Appl. Polym. Sci. 123 (4), 2211-2221 (2012).
- Frith, J. E., et al. An injectable hydrogel incorporating mesenchymal precursor cells and pentosan polysulphate for intervertebral disc regeneration. Biomaterials. 34 (37), 9430-9440 (2013).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click chemistry: Diverse chemical function from a few good reactions. Angew. Chem. Int. Edit. 40 (11), (2001).
- Sacchetti, A., Mauri, E., Sani, M., Masi, M., Rossi, F. Microwave-assisted synthesis and click chemistry as simple and efficient strategy for RGD functionalized hydrogels. Tetrahedron Lett. 55 (50), 6817-6820 (2014).
- Ossipov, D. A., Hilborn, J. Poly(vinyl alcohol)-based hydrogels formed by "click chemistry". Macromolecules. 39 (5), 1709-1718 (2006).
- Truong, V., Blakey, I., Whittaker, A. K. Hydrophilic and Amphiphilic Polyethylene Glycol-Based Hydrogels with Tunable Degradability Prepared by "Click" Chemistry. Biomacromolecules. 13 (12), 4012-4021 (2012).
- Hou, R. Z., et al. New synthetic route for RGD tripeptide. Prep. Biochem. Biotechnol. 36 (3), 243-252 (2006).
- Rossi, F., Chatzistavrou, X., Perale, G., Boccaccini, A. R. Synthesis and Degradation of Agar-Carbomer Based Hydrogels for Tissue Engineering Applications. J. Appl. Polym. Sci. 123 (1), 398-408 (2012).
- Mauri, E., Rossi, F., Sacchetti, A. Tunable drug delivery using chemoselective functionalization of hydrogels. Mater. Sci. Eng. C. 61, 851-857 (2016).
- Joaquin, A., Peppas, N. A., Zoldan, J. Hydrogel Polymer Library for Developing Induced Pluripotent Stem Cell Derived Cardiac Patches. Tissue Eng. Part A. 20, S55-S55 (2014).
- Rossi, F., et al. Tunable hydrogel-Nanoparticles release system for sustained combination therapies in the spinal cord. Colloids Surf. B Biointerfaces. 108, 169-177 (2013).
- Kolb, H. C., Sharpless, K. B. The growing impact of click chemistry on drug discovery. Drug Discov. Today. 8 (24), 1128-1137 (2003).
- Ossipov, D. A., Yang, X., Varghese, O., Kootala, S., Hilborn, J. Modular approach to functional hyaluronic acid hydrogels using orthogonal chemical reactions. Chem. Commun. 46 (44), 8368-8370 (2010).
- Anderson, S. B., Lin, C. C., Kuntzler, D. V., Anseth, K. S. The performance of human mesenchymal stem cells encapsulated in cell-degradable polymer-peptide hydrogels. Biomaterials. 32 (14), 3564-3574 (2011).
- Caron, I., et al. A new three dimensional biomimetic hydrogel to deliver factors secreted by human mesenchymal stem cells in spinal cord injury. Biomaterials. 75, 135-147 (2016).
- Lee, J. W., Kim, H., Lee, K. Y. Effect of spacer arm length between adhesion ligand and alginate hydrogel on stem cell differentiation. Carbohyd. Polym. 139, 82-89 (2016).
- Liu, Y., Fan, Z., Wang, Y., Yu, L. Controlled Release of Low Molecular Protein Insulin-like Growth Factor-1 through Self-Assembling Peptide Hydrogel with Biotin Sandwich Approach. J.Biomed. Eng. 32 (2), 387-392 (2015).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved