このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
アン
要約
ここでは、肺結核病変および腔からのカゼムとの薬物結合を測定するための迅速な平衡透析(RED)法を説明する。このプロトコールはまた、発泡マクロファージ由来のマトリックスと共に使用され、これは、カゼムの有効な代用物である。
要約
結核病の根絶には、複雑な肺病変の複数の層に浸透することができる薬物レジメンが必要である。窩洞および病変の大部分のコアにおける薬物分布は、一般に害虫とも呼ばれる薬物耐性細菌の亜集団を収容するため、特に重要である。結核病変における薬剤浸透の測定のための既存の方法は、 生体分析または画像化技術に結合された経費のかかる時間のかかる生体内薬物動態研究を必要とする。この結合は、カゼムを介する薬物分子の受動的拡散を妨げるので、カゼイン高分子への薬物結合のインビトロ測定は、そのような技術の代替として提案されている。迅速な平衡透析は、血漿タンパク質および組織結合研究を行うための迅速かつ信頼性の高いシステムである。このプロトコールでは、excisであるカゼウムのホモジネートへの薬物結合を測定するために、高速平衡透析(RED)装置を使用した結核に感染したウサギの病変および腔から滲出した。このプロトコールはまた、カゼムの代わりに使用する脂質負荷THP-1マクロファージから代理マトリックスを生成する方法も記載している。このカゼウム/サロゲート結合アッセイは、結核薬の発見において重要なツールであり、他の疾患によって引き起こされる病変または膿瘍の薬物分布を研究するのに役立つことができる。
概要
肺結核疾患の治療には、様々なタイプの病変への薬物の効果的な分配が必要である。壊死病巣および腔は、薬剤耐性または「持続性」細菌の亜集団を有する大腸菌センターを含む。 1、2空洞病は、劣悪な治癒率と不良な予後と関連している。以前の研究では、定量的および画像技術を用いて、カゼムを浸透させる能力が薬物クラスごとに著しく異なることが示されている。しかし、これらの方法は、遅く退屈な動物感染モデルの使用を必要とする。 ex vivoカゼウムへの薬物結合を測定するインビトロアッセイを設計した。この結合は、肉芽腫の薬物浸透と逆相関することが判明し、したがって、予測ツールとして使用。 7
平衡透析は、血漿蛋白質結合研究に金標準的なアプローチとみなされています。迅速平衡透析(RED)デバイスは、そのようなアッセイを実施するための、迅速で使いやすいと信頼性の高いシステムを提供します。 8デバイスは、2つのコンポーネントで構成され:使い捨て、半透膜の垂直シリンダによって分離された2室からなる使い捨てインサート。一度に48個のインサートまで保持することができ、再使用可能なベース板。透析膜は、8 kDaの分子量カットオフ(MWCO)を有する薬物 - 高分子結合研究のために理想的です。膜区画の高い表面積対体積比は、急速透析および平衡化を可能にします。インサートとベースプレートの両方は、最小の非特異的結合のために検証されてきました。生体分析技術とRED素子の組み合わせは、Pにおける薬物の非結合画分の正確な推定を提供しますラスマ8,9
当初は血漿タンパク質結合を測定するように設計されていたが、RED装置はホモジネートを用いたいくつかの組織結合研究に用いられてきた。このプロトコールでは、壊死病変および結核感染ウサギの腔から摘出された壊死屑であるカゼムに対する薬物結合を測定する。ケース状材料の無細胞性および非血管性は、アッセイと適合する均一な懸濁液にホモジナイズすることを容易にする。
カゼウムが生産するのが面倒で、来るのが難しいことを考えると、プロトコールはまた、泡沫状マクロファージから調製された代理母材と共に使用するために検証されている。 THP-1単球由来マクロファージはオレイン酸で誘導され、それらに「泡沫」外観を与える複数の脂質体を蓄積する。これらの脂質負荷細胞を採取し、我々はcaseumへの代理として使用マトリックスを生成するために処理。この研究では、この代用マトリックスに結合するその薬剤を示した効果肉芽腫及び空洞の乾酪性コア中の薬物の浸透を妨げるインビボのプロセスを模倣、caseumに結合するとよく相関します。
プロトコル
すべての動物研究は、NIAID(NIH)、Bethesda、MDの機関動物管理および使用委員会の承認を得て、国立衛生研究所の実験動物の管理および使用のガイドに従って実施した。 結核菌を含むすべての研究は、生物安全性封じ込めレベル3(BSL-3)の実験室で実施された。
1.ウサギ感染モデルとカゼムコレクション
- 以前に記載されたような鼻のみのエアロゾル曝露システムを使用して、 結核菌でニュージーランドの白色ウサギに感染させる。 12、13感染が12〜16週間進行するようにします。ウサギを35mg / kgのケタミンおよび5mg / kgのキシラジンで筋肉内に静置し、ウサギに0.22mL / kgのペントバルビタールナトリウムおよびフェニトインナトリウムを静脈内に安楽死させ、剖検を続ける。
- ピンセットとメスを使用して、胸部から肺を取り除く。vity。各肺葉から、個々の空洞および大きな壊死肉芽腫をメスを用いて切開する。空洞と肉芽腫の壁からカゼムを慎重にこすり落とす。使用準備が整うまで-20℃で2 mLスクリューキャップチューブに試料を計量し、記録し、保存する。
- 3メガラドのドライアイスで感染性のカゼウムサンプルをガンマ線照射して、BSL-2ラボでの使用に不快で安全なものにします。
2.THP-1細胞からのCaseum Surrogateのインビトロ発生
- T175細胞培養フラスコ(80mL /フラスコ)中のRPMI1640培地(2mM L-グルタミンおよび10%ウシ胎仔血清)中のTHP-1単球を増殖させる。フラスコを5%CO 2雰囲気下、37℃で3〜4日間インキュベートする。
- T175フラスコから2本の50mLコニカルチューブで培養液を150 xgで5分間遠心します。上清を捨て、ペレットを10mLのRPMI 1640培地に懸濁する。
- この培養物5μLを45μLのtを含む1.5mLチューブにピペットライパンブルー。ピペッティングにより完全に混合する。 10μLを血球計算盤に移し、光学顕微鏡(倍率10倍)を用いて生存可能なTHP-1単球の数を数えた(染色していない)。培養液1mLあたりの生存細胞数を計算する。 RPMI培地で希釈して1.25 x 10 6 cells / mLの最終密度にします。
- 大きな細胞培養プレート(50×10 6細胞/プレート)上に培養物40mLをロードする。 40μLの100μMPMA(エタノール中で調製したホルボール12-ミリステート13-アセテート)を加え、細胞をインキュベーター内で一晩付着させる。
注:PMAの最終濃度は100nMである。 - エタノール中の純粋なオレイン酸(OA)(0.89g / mL)を0.1Mの濃度( すなわち、エタノール968.3μL中の31.7μLのOA)に希釈する。新鮮な予熱したRMPI培地でこの溶液を10 mMの濃度に希釈する。 37℃に予熱したRPMI培地中でこのOA懸濁液を0.4mM(最終使用濃度)に希釈する。
- 既存のメディアと非メディアを削除する-adhered細胞を細胞培養プレートから、穏やかにはTHP-1マクロファージ(THP-M)を0.4 mMのOAの40ミリリットルを加えます。一晩インキュベーター中で37°Cでインキュベートします。
- 視覚各THP-Mにおける多数の脂質体の介在物の存在を確認するために40倍の倍率で光学顕微鏡を使用しています。細胞培養プレートからすべてのRPMI培地を除去し、穏やかに50 mLの血清学的ピペットを使用して、リン酸緩衝生理食塩水(PBS)で2回接着細胞を洗浄します。
注:脂質体はTHP-Mの細胞質のように、小さい透明な球状構造で表示されます。 - 各プレートに、PBS中の5mMのエチレンジアミン四酢酸(EDTA)の40ミリリットルを加えます。 37°Cで15分間インキュベートします。
- 繰り返しピペッティング全体板の表面上に10-mLの血清学的ピペットを使用して、泡沫状マクロファージ(FM)を取り外します。 50 mLコニカルチューブに細胞懸濁液を移し、5分間、150×gでスピンダウン。
- 10 mlのPBS(第三のPBS洗浄)Aで細胞ペレットを再懸濁予め計量した15mLコニカルチューブに移す。 150xgで5分間再びスピンダウンする。血清学的ピペットを使用して上清を慎重に吸引し、廃棄する。
- FMペレットを3回凍結融解して細胞を溶解し、75℃で20〜30分間インキュベートしてマトリックス中のタンパク質を変性させます。使用準備が整うまでペレットを-20℃で保存する。
迅速な平衡透析(RED)アッセイ
- ジメチルスルホキシド(DMSO)中のすべての試験化合物の10 mMストック溶液を調製する。各アッセイの前にDMSO中で500μMの作業溶液に希釈する。
- カゼインサロゲートペレットを入れたチューブを秤量する。空のチューブの重量を引いて、ペレットのみの重量を導出する。チューブ当たり2〜3個の金属ビーズを添加し、組織ホモジナイザーを用いて1,200ストローク/分で1分間、各マトリックスの10倍希釈懸濁液を達成するために、カセムまたは代理マトリックスをPBS(1:9w / v)
- スパイク6.5μLの500μL5μM(≦1%DMSO)およびボルテックスの最終濃度を達成するために、643.5μLのホモジネートに試験化合物のμM溶液を添加する。
- REDインサートをベースプレートに挿入します。各REDインサートのドナーチャンバー(赤いリング)と各レシーバーチャンバーへの350μLのPBSに200μLの薬物添加マトリックスを加えます。各試験化合物について3つのインサートを調製する(3つのサンプル)。プレートを接着プレートシールでシールし、サーモミキサー上で37℃、200 rpm(1 xg)で4時間インキュベートする。
- インキュベーション後、ドナーおよびレシーバーチャンバーの内容物を2〜3回上下にピペッティングすることにより穏やかに混合する。ドナーチャンバーからホモジネートのアリコート20μLをピペットで出し、1.5mLチューブ(1:1)中の20μLのきれいなPBSに加える。同様に、レシーバーチャンバーからのPBSサンプルのアリコート20μLをピペットで取り出し、クリーンホモジネート(マトリックスマッチング)20μLを加えます。 8
注:マトリックスマッチングは、定量分析のために2つの別々の較正曲線(ホモジネートおよびPBS中)を作成した。ドナーチャンバーの内容物は時間の経過とともに沈降することがある。アリコートを除去する前にピペットで内容物を穏やかに混合する。
4.LC-MS定量およびデータ解析
- 500ng / mLのジクロフェナクまたは10ng / mLのベラパミル(内部標準)を含む160μLの1:1メタノール:アセトニトリルを各チューブに加え、ボルテックスしてタンパク質を沈殿させる。 10,000×gで5分間遠心分離して沈殿物を沈降させ、液体クロマトグラフィー - 質量分析(LCMS)分析のために上清を96ウェルディープウェルプレートに移す。 7
- 上記のサンプルと同じマトリックス組成を維持しながら、各試験化合物について1〜1,000nMの較正曲線を構築する。 LC-MS法を用いて、ドナーおよびレシーバーチャンバーからのサンプル中の試験化合物の濃度を定量する。
- 非結合部分( f u )を計算する式1を用いて希釈マトリックス中の薬物を計算する。式2を用いて希釈されていないマトリックス中のf uを計算する( D =希釈係数10)。 14
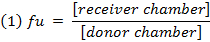
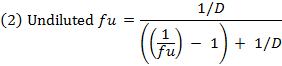
- 式3を用いて各化合物の回収(質量バランス)を調べ、安定性/代謝/非特異的結合の問題を有する化合物を同定する。
注:回復率は通常70〜130%です。 15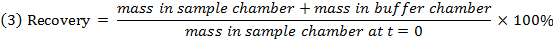
結果
このプロトコルを使用して、我々は浸透カゼムでの予測された効率のために何百もの結核薬開発化合物を試験した。 図1は、REDアッセイの基本概念を視覚化しています。 REDインサートの透析膜は、未結合の小分子がドナーウェルからレシーバウェルに拡散し、最終的に両方のコンパートメント間の平衡を達成することを可能にする。タンパク質または脂?...
ディスカッション
結核に感染した患者の肺壊死病変および空洞には、薬物治療に対して反抗的な細菌の亜集団が含まれる。これらの構造の大部分のコアは、細胞外環境においてこれらの胞子を保持することに特に関与する。これらの離れた場所への抗菌剤の好都合な分布は、結核薬効の重要な決定要因であると考えられている。このプロトコールのバリデーションの前に、大腸病変における創薬化合物の分布?...
開示事項
競合する金銭的利益はない。
謝辞
私たちは、それぞれ、PA-824(pretomanid)、AZD5847、radezolidとtedizolid bedaquilineを提供するためのジョンソン・エンド・ジョンソン、TBアライアンス、アストラゼネカ、リブ-XとTrius治療に感謝したいです。ブレンダンプリドー、マシュー・ツィンマーマン、ステファン・ジャズウィン、エマ・レイ・フラド、ナンシールーエル、レヤン・リおよびダニエル・ウェイナー MALDI分析、生物分析方法、caseumサロゲートの調製、化学合成、およびウサギcaseumの単離と支持を提供しました。この作品は、センターオブエクセレンスのためにビル・アンド・メリンダ・ゲイツ財団とウェルカム・トラストからビル・アンド・メリンダ・ゲイツ財団、賞#OPP1044966とOPP1024050からV・ダートイス、NIH共有計装グラントS10OD018072だけでなく、共同資金に資金調達を行いましたP・ワイヤットに発展途上国の疾患のためのリード最適化のために。
資料
| Name | Company | Catalog Number | Comments |
| New Zealand White Rabbits | Covance | - | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| THP-1 monocytic cell line | ATCC | ATCC TIB-202 | |
| 175 cm² TC-Treated Flask (T175) | Fisher Scientific | T-3400-175 | |
| RPMI 1640 media w/o glutamine | Fisher Scientific | MT-15-040-CV | |
| Hyclone Fetal Bovine Serum, Gamma irradiated | Fisher Scientific | SH3091003IR | |
| Hyclone L-glutamine, 200 mM | Fisher Scientific | SH3003401 | |
| Cellstar TC dish, 145 mm x 20 mm, vented | Fisher Scientific | T-2881-1 | |
| Phorbol 12-myristate 13-acetate (PMA) | Fisher Scientific | BP685-1 | |
| Ethylenediaminetetraacetic acid | Sigma | E6758 | |
| Oleic acid | Fisher Scientific | ICN15178101 | |
| Pierce RED Device Reusable Base Plate | Fisher Scientific | PI-89811 | |
| Pierce RED Device Inserts, 50/box | Fisher Scientific | PI-89809 | |
| Pierce RED insert removal tool | Fisher Scientific | 89812 | |
| Adhesive plate seal | Fisher Scientific | 08-408-240 | |
| PBS, pH 7.4, 10x 500 mL (Gibco) | Life Technologies | 10010-049 | |
| DMSO | Sigma | 472301 | |
| Acetonitrile | Sigma | 34998 | |
| Methanol | Sigma | 34860 | |
| Verapamil hydrochloride | Sigma | V4629 | |
| Diclofenac sodium salt | Sigma | 93484 | |
| Trypan Blue Solution, 0.4% | Fisher Scientific | 15-250-061 | |
| Ethanol, 200 proof | Fisher Scientific | 04-355-451 | |
| 2010 Geno/Grinder | SPEX SamplePrep | 2010 | |
| Bead Mill Homogenizer Accessory, Metal Bulk Beads | Fisher Scientific | 15-340-158 | |
| 484R Cobalt 60 Irradiator | JL Shepard | 7810-484-1 | |
| INCYTO C-Chip Disposable Hemacytometers | Fisher Scientific | 22-600-100 | |
| Upright Light Microscope | Leica | DM1000 | |
| Binary Liquid Chromatography system | Agilent | 1260 | Multi-compenent |
| Mass spectrometer | AB Sciex | 4000 |
参考文献
- Sacchettini, J. C., Rubin, E. J., Freundlich, J. S. Drugs versus bugs: in pursuit of the persistent predator Mycobacterium tuberculosis. Nat Rev Microbiol. 6 (1), 41-52 (2008).
- Zhang, Y. Persistent and dormant tubercle bacilli and latent tuberculosis. Front Biosci. 1 (9), 1136-1156 (2004).
- Aber, V. R., Nunn, A. J. Short term chemotherapy of tuberculosis. Factors affecting relapse following short term chemotherapy. Bull Int Union Tuberc. 53 (4), 276-280 (1978).
- Chang, K. C., Leung, C. C., Yew, W. W., Ho, S. C., Tam, C. M. A nested case-control study on treatment-related risk factors for early relapse of tuberculosis. Am J Respir Crit Care Med. 170 (10), 1124-1130 (2004).
- Dartois, V. The path of anti-tuberculosis drugs: from blood to lesions to mycobacterial cells. Nature Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Sarathy, J. P., et al. Prediction of Drug Penetration in Tuberculosis Lesions. ACS Infect Dis. 2 (8), 552-563 (2016).
- Waters, N. J., Jones, R., Williams, G., Sohal, B. Validation of a rapid equilibrium dialysis approach for the measurement of plasma protein binding. J Pharm Sci. 97 (10), 4586-4595 (2008).
- Singh, J. K., Solanki, A., Maniyar, R. C., Banerjee, D., Shirsath, V. S. Rapid Equilibrium Dialysis (RED): an In-vitro High-Throughput Screening Technique for Plasma Protein Binding using Human and Rat Plasma. J Bioequiv Availab. 14, 1-4 (2012).
- Liu, X., et al. Unbound drug concentration in brain homogenate and cerebral spinal fluid at steady state as a surrogate for unbound concentration in brain interstitial fluid. Drug Metab Dispos. 37 (4), 787-793 (2009).
- Able, S. L., et al. Receptor localization, native tissue binding and ex vivo occupancy for centrally penetrant P2X7 antagonists in the rat. Br J Pharmacol. 162 (2), 405-414 (2011).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: a failed host immune response. Open Biol. 1 (4), 1-14 (2011).
- Via, L. E., et al. Tuberculous Granulomas are Hypoxic in Guinea pigs, Rabbits, and Non-Human Primates. Infect Immun. 76 (6), 2333-2340 (2008).
- Kalvass, J. C., Maurer, T. S. Influence of nonspecific brain and plasma binding on CNS exposure: implications for rational drug discovery. Biopharm Drug Dispos. 23 (8), 327-338 (2002).
- Di, L., Umland, J. P., Trapa, P. E., Maurer, T. S. Impact of recovery on fraction unbound using equilibrium dialysis. J Pharm Sci. 101 (3), 1327-1335 (2012).
- Lenaerts, A. J., et al. Location of persisting mycobacteria in a Guinea pig model of tuberculosis revealed by r207910. Antimicrob Agents Chemother. 51 (9), 3338-3345 (2007).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved