Method Article
マイクロ Rna の齧歯動物の神経筋疾患を治療する遺伝子組換えアデノ随伴ウイルス血清型 9 を使用しての全身配信
要約
ここで我々 はマイクロ Rna 組換えアデノ随伴ウイルス血清型 9 を使用して神経筋疾患のマウスモデルでの配信をについて説明します。単一の末梢投与マウスにおける筋と運動ニューロン、miRNA の機能を検討し、治療の潜在的なin vivoする機会を提供することで持続的な miRNA 発現となりました。
要約
内因性マイクロ Rna 経路を介した RNA 干渉は、転写後の遺伝子サイレンシングによってタンパク質合成を制御することにより遺伝子発現を調節します。近年、マイクロ Rna を介した遺伝子発現制御有毒な利得関数メカニズムによって引き起こされる神経学的疾患の治療の可能性を示しました。ただし、標的組織への効率的な配信は、そのアプリケーションを制限されています。ここでは、脊髄や延髄筋萎縮症 (SBMA) のトランスジェニック マウス モデルを使用、神経筋疾患ポリグルタミンの膨張によるアンドロゲン受容体 (AR) による遺伝子サイレンシングをテストするために新たな識別された AR ターゲット miRNA、ミール 298。我々 はミール 298 組換えアデノ随伴ウイルス (下さい rAAV) 血清型 9 ベクトルを使用して、非分裂細胞の情報伝達を容易に過剰発現。SBMA マウスの尾静脈注射は骨格筋と運動ニューロンのミール-298 の持続的かつ広範な発現を誘導し、マウスの神経の表現型の改善で起因しました。
概要
Mirna が非コード Rna が、遺伝子発現制御、多様な細胞と代謝経路の調節に重要な役割を果たしている、長さ 21 23 ヌクレオチド。1遺伝子発現は転写後の遺伝子サイレンシングまたは mRNA の分解を誘導することによって調整される主に。2 MiRNAs は通常、3' 非翻訳領域 (UTR) 連結 5' UTR の遺伝子のコーディングおよびコーディングの mRNA も記載されているターゲットの領域を補完するものです。3
ひと疾患の病態におけるマイクロ Rna の役割の現在の理解の拡大、個々 の miRNAs の miRNA 家族薬理学的変調には有効な治療選択肢、ますます。MiRNAs その他の RNA 阻害戦略と比較して、多くの利点があります: miRNAs は毒性が少ないと低い免疫原性とサイズが小さいセルに簡単に配信することができます。4,5,6 MiRNAs 通常ある携帯電話ネットワーク内に多くのターゲットしたがって潜在的なターゲットに効果と安全性の懸念を標的組織への効率的な配信を指定のアカウントに入れる必要があります。
神経筋疾患は、集録または筋肉と運動ニューロンに影響を与える条件を継承します。骨格筋への薬物の対象と研究、主な課題は、治療ウィンドウ内の広範な分布を達成するためにはどこの新興エリアです。7運動ニューロンは、血液脳関門によって薬へのアクセスを妨げないために主に対象とするより困難。
脊髄と延髄筋萎縮症 (SBMA) の細胞培養とねずみのモデルは、この研究で使用されました。SBMA は有毒な利得筋と運動ニューロンの両方が影響を受ける関数メカニズムによって引き起こされる神経筋疾患です。8,9 SBMA (ケネディの病気;OMIM #313200) は X リンク疾患、筋肉の脱力が特徴と萎縮、エンコードAR蛋白質拡張 2p018 AR 遺伝子 CAG リピート拡大によって引き起こされます。10この無秩序のため現在入手可能な病気変更の処置はありません。本研究で用いたトランスジェニック マウス モデルを繰り返す男女の特異性、運動ニューロンの病理、進行性筋萎縮症など、病気の特徴。11
本研究で我々 の努力は miRNA を識別するのに焦点を当てて直接下方制御式変異 AR 遺伝子と脊髄に miRNA の配信と私たちの病気のマウスモデルの骨格筋の安全かつ効率的なモードを設計します。
ここで我々 は比較的メタボライト miRNA、miRNA-298 (加入番号 MIMAT0004901)、SBMA モデルにおける変異 AR 表現を直接抑える12特定。ミール 298 の標的組織への配信を達成するために、組換えアデノ随伴ウイルス血清型 9 (rAAV9) ウイルス戦略を使いました。rAAV9 は、血液脳関門を通過し、非分裂細胞、ニューロンを含む長期の遺伝子発現を仲介することが可能です。13 AAV9-ミール-298 の単一の全身投与は miRNA、筋肉と運動ニューロンの効率的な伝達、AR 発現のダウンレギュレーション、SBMA のマウスの病気の表現型の改善の持続的な表現になった14 miRNA antagomirs 過剰発現または生体内で提供するためにこの手法を使用できます。
プロトコル
すべてのプロシージャは、ケアと実験動物の使用のため国立の機関健康ガイドに従って行われた 8 編、国民アカデミーの出版物、改訂 2011、NINDS 動物ケア委員会によって承認されていると。
1. AAV9-マイクロ Rna のデザイン戦略と miRNA 選択
- MiRWalk 予測データベースを使用して、候補 Mirna ターゲット遺伝子 mRNA 3' UTR 地域と対話するを選択します。15
注: は、少なくとも 7 ヌクレオチドへマイクロ Rna シーケンスの最小種の長さを制限します。比較分析のため他設立ミルナ予測プログラム (ミランダ、miRDB、Targetscan) を選択します。これらの選択基準に基づいて、ここでは、ミール-185、ミール 298、ミール-873、ミール 877 に選ばれたさらなる評価。 - MiRBase (http://www.mirbase.org/) から選択した miRNA のシーケンスを取得します。
- Pri ・ ミールのクローンを作成 (60-70 国税庁) と cis 適切な AAV に 250-300 nts が並ぶ、両側のゲノム シーケンスまたはモック シーケンスその、ベクトルします。
注: 並ぶシーケンスが正しい pri ミール表現と成熟したマイクロ Rna の処理のため必要です。たとえば選択した miRNA やモックのシーケンスに続くひと伸長因子 1 α (EIF1α) プロモーターと cDNA のエンコードに続いて人間サイトメガロ ウイルス (CMV) プロモーターから成る式カセットとデュアル プロモーター下さい rAAV cis ベクトルを選択します。GFP 蛍光タグ。EIFα プロモーターは、サイレンシングの最小限のリスクで、安定且つ均一な表現を保証するために選ばれました。特定のアプリケーションによって、組織の特定のまたは条件付きのプロモーターを使用できます。 - 準備、浄化、AAV、次の公開プロトコルを滴定しなさい。16
注: ここでは、AAV に pri ・ ミールのクローニング ベクトルとウイルスの生産によって行われた外部メーカー。
2 AAV miRNA プラスミドの尾静脈注射
注: この手順には、ターゲット遺伝子と年齢とマウスの体重に合わせて調整が必要があります。公共機関、動物のケアおよび使用委員会 (IACUC) ガイドラインを使用すると、ドーズ量の範囲、ボリュームおよび年齢とマウスの体重に基づく管理の最適なルートを決定します。ターゲット組織における GFP 蛍光信号および miRNA 発現レベルは、ピーク開始 2 週間投与後と予想されます。次のプロトコルは早い成年期の雄マウスを指します。AAV は、バイオ セーフティ レベル 1 のガイドラインの下でバイオハザードとして処理する必要があります。
- 滅菌リン酸緩衝生理食塩水 (PBS) を使用して (英領バージン諸島/mL) あたり 1010-1011ウイルス ゲノムのウイルス負荷を含む 100-200 μ L 因数で AAV miRNA プラスミド ストックを分割します。バイオハザード個人保護装置は AAV ソリューションを処理するために使わなければなりません。
注: 一度、因数を解凍格納できます 4 ° C で 2 週間。ウイルス株は、-80 ° C のフリーザーで保存できます。 - 適切なサイズのプラスチックまたはテーパー状のプラスチック フィルム チューブなど市販の restrainers でマウスを抑制します。
- 70% アルコール綿の尾の表面をきれいにします。
- 30 の血管拡張を増やすに尾の下で暖かいパッド (28-30 ° C) を保持する s の別の方法として、(2-3 フィートの距離) で赤い熱ランプを使用して動物を暖かい、暖かい水に尾を浸漬します。
-
尾の遠位部から始まって、挿入針 (27-30 G) ウイルスの因数を搭載、ベベル、静脈に、尾から 15 °。注射の前に針が正しく挿入されてを確認します。
- 注入時に抵抗が感じられる場合、腫れは皮膚の下が表示されます、手順を停止します。針を除去し、前回の注射部位の上針を再挿入します。
注: また、可能となる針を軽く吸引して血液を観察すること。ハードの吸引は、尾静脈を折りたたむことができます。射出時に静脈が青白くなる、針が正しく挿入されています。
- 注入時に抵抗が感じられる場合、腫れは皮膚の下が表示されます、手順を停止します。針を除去し、前回の注射部位の上針を再挿入します。
- 注入が完了した後、針を上げる前に数秒を待ってから。
- 出血の部位を確認します。サイトに出血の停止まで 2 本の指を使用して適度な圧力を適用します。
- 動物を檻に戻ります。
3. 行動実験
注: すべての実験は、一意にコード化されたバイアルによる治療の隠蔽と第三者によって盲目的に実施されました。治療の順序はランダムに。後述のテストを実行すると、実験条件 (部屋のタイプ) と、一日の時間は変動を抑える制御必要があります。このテストより信頼性の高い結果を達成するために 4 週古いマウスで実行する必要があります。マウスは、通常のパフォーマンスのベースラインを取得する年齢の 5 週間でウイルス注入前に一度行動評価を施行した.ウイルス投与後マウスは 40 週齢まで注入後、48 h を開始週に一度を評価しました。
- テストを開始する前にノイズやその他の障害、少なくとも 30 分は静かな、暗い部屋に AAV を注入したマウスをもたらします。順化のこの期間中に動物が不可でした。
- 30 分のための新しい部屋にマウスを慣らす、次行動アッセイ (3.3 と 3.4 の手順) を開始します。各行動の分析の間に 10 分間のギャップを保ちます。
-
吊りワイヤー テスト
注: このテストは、筋力と運動機能障害を監視します。- パディングのシートを使用して、クッションとして。尻尾でマウスをピックアップし、ワイヤー グリッド ラックの中央に配置します。15 〜 20 センチ、表面上ラックを上げ、ゆっくりと画面上のグリップを調整する動物を許可するのには、画面を反転します。
- ラックが完全に反転して、一度タイマーを起動し、落ちる時間を記録します。
注: マウスは、グリッドに 4 つの手足とハングアップします。ワイヤーが低すぎる設定されている場合、マウス可能性がありますにハングしません。マウスが 60 前にグリッドから落ちる場合 s、グリッド上に戻る場所、タイマーをリセットして、2 つのより多くの試行までこの手順を繰り返します。最高のパフォーマンスを登録します。 - ときの時間制限 60 の s に達すると、動物がケージに戻します。
-
フット プリント分析
注: 長いと 5 cm 幅 5 cm 高い壁を持つ吸水性シートは狭い滑走路約 70 cm にする必要があります。- マウスを片手で優しく、赤インクを前足と後足は前足をブラシに青インクに適用します。
- 狭い滑走路の床に吸収性シートを配置します。
- マウスを徒歩または他に端から端まで滑走路の直線で吸収シート上で実行を許可します。
- 新鮮な吸収性のシートを使用してマウスを使ってプロセス 2 回を繰り返します。
- 前方への動きの 2 つの連続したステップ間の距離を測定します。最初にインクルードしないし、最後の動物のちょうどの開始とその実行を終了いくつかの足跡。
4. 安楽死と組織の収穫
- 安楽死室またはベルの jar ファイルを使用します。ガラスベル ジャーを使用している場合は、ヒューム フードの下での手順を実行します。
- イソフルランに綿を浸すし、ベルの jar ファイルにそれを置きます。麻酔材料とのスキンシップから動物を維持するのにには、物理的な区切りを使用します。この手順の直後に瓶の中の動物を配置します。
注: ベルジャーはプリチャージとイソフルレン動物に低酸素血症の可能性を避けるためにしないでください。 - 30 までのイソフルラン暴露を続ける呼吸停止後 s。
- 削除した直後に、瓶からマウスは頚部転位によって安楽死させます。
注: この手順行われるべき組織の劣化を避けるために可能な限りすばやく. -
脊髄が最初の収穫と、大腿四頭筋。
- 脊髄を収穫するには、マウスの裏面を公開し、郭清基板側に 4 つの手足を修正します。
- 70% のエタノールの解離のサイトを洗います。
- 頚部転位の鋭いはさみを使用してを実行します。
- 中央線で皮膚の切開を行います。切断または注意ペルトを引き上げて、頭の上に続いて、横断面の皮膚の断裂によるペルトを削除します。(頭蓋底に隣接して見つけられる) 列の C1 2 地域の肩甲骨の下にはさみで切断することによって頭を削除します。
- 腹側腹壁筋をカットし、横方向に, 脊髄列に到達するまで、一度に 1 つの方向を続行します。
- 頸髄から鋭いはさみ削除脊椎を使用します。両側に椎体のアーチの間で切断することによって脊椎の横の部分を削除します。
- 全体の椎骨を削除した後に、脊髄をリリースします。
-
スナップインは、次のメソッドを使用してあらかじめ冷やした 2 methylbutane で収穫された組織を凍結します。
- 半分は 2 methylbutane とステンレス ボウルを記入し、液体窒素を入れた容器でボウルの下四分の一が水没します。
- 事前に 1-2 分液体窒素で 2 methylbutane を冷やします。
- それが白くなるまで 2 methylbutane の鉗子で骨格筋を配置します。ドライアイス、-80 ° C で保存し組織をすぐに転送します。
- 脊髄の免疫染色、スナップのように凍結する前に室温でパラフィン ブロックで組織を埋め込みます。17
- 生化学的解析とマイクロ Rna 定量、1収穫された組織内クリオバイアル置き、液体窒素で凍結します。-80 ° C で試料を保存します。
結果
AAV9 ミール 298 の 10 の11の vg のウイルス負荷は、SBMA の 5 週齢マウスに尾静脈注射によって注入されました。これらのマウスは、AR (AR97Q) の異常ポリグルタミン管と人間の AR 遺伝子を運ぶし、10 週齢 (減量、背を丸めて背部および筋萎縮) による神経筋疾患の徴候を開発します。11腰椎脊髄と大腿四頭筋は、miRNA の定量化、生化学アッセイおよび免疫組織化学 (図 1) の投与後 2、4、8、12 週間で収穫されました。治療とその後の分析の管理は、盲目の調査官によって行われました。
それぞれ、骨格筋と脊髄 (図 2 投与後 12 週間 8 週間でピークの発現レベルと骨格筋と脊髄 2 週間と 4 週間の治療後でミール 298 式を示した qRT PCR 解析).顕微鏡 (Axiovert 100 M) を使用して、緑の蛍光性信号によって検出された筋肉ティッシュおよび脊髄運動ニューロンで GFP と運動ニューロンのマーカー コリン アセチルトランスフェラーゼ (チャット) 治療、マウスを開始後 10 週目の共局在疾患の症状 (図 2)。
同じ用量レジメンを使用すると、SBMA マウスのコホートどちらのミール-298 を受け取ったり、尾静脈注射による生化学的解析と機能解析のための年齢の 7 週間でモックに無作為に割り付けされました。注入 40 週齢まで、毎週の体重と行動評価によって続いた。qRT PCR 解析を示した、ミール 298 治療変異 AR (図 3)、影響を受ける組織のレベルを減少させる強化体重や運動パフォーマンス (図 4) 注入後 10 週間始まります。
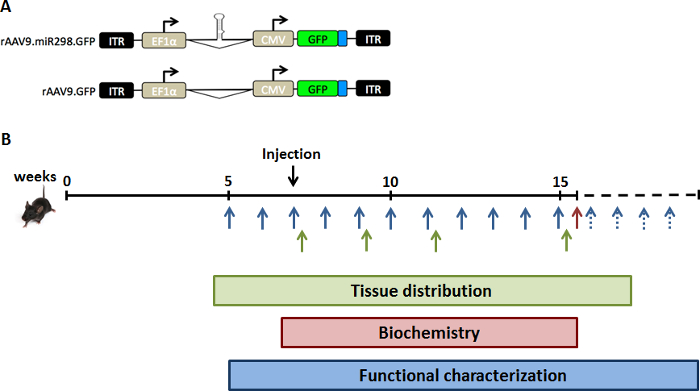
図 1: 研究デザインのスケマティック。ミール 298生体内での発現レベルを増加するには、GFP とミール 298 またはモックアップを発現 (A) デュアル プロモーター AAV ベクター プラスミドを SBMA マウスを注入しました。(B) マウスは 7 週齢 (事前症状ステージ) で尻尾無駄注射によって注入されました。脊髄と大腿四頭筋は、SBMA マウスの組織分布解析 (緑) の異なる時点でのコホートから集められました。SBMA マウスのコホートが扱われ、生化学的解析 (赤) のための年齢の 16 週で犠牲にしました。重量と行動アッセイは機能解析 (青) のための年齢の 40 週まで毎週行われました。この図の拡大版を表示するのにはここをクリックしてください。

図 2: マウスの AAV9 ミール 298 配信。ここで説明した方法を使用して、マウスは、静脈注射を AAV9-ミール-298-GFP または AAV9 モック GFP を受信しました。合計 miRNA は腰椎の脊髄および 2,4,8 および投与後 12 週で大腿四頭筋から採取しました。ミール-298 (A) の大腿四頭筋の表現レベルを推定する qRT PCR を行った (n = 5) (B) 腰椎脊髄 (n 5、P = < 0.01)。すべてのデータは、平均値 ± 標準誤差を手段として報告されます。(C) 大腿四頭筋 (画像の倍率は 10 倍 GFP の局在化によって確認された治療後 10 週で収穫された組織における AAV ベクターの広範な伝達。スケールバー = 100 μ m) と (D) 運動ニューロン腰椎脊髄 (画像の倍率は 40 倍。スケール バー = 10 μ m. GFP (緑)、チャット (赤) と DAPI (青)。土井からの図が変更されている: 10.1038/mt.2016.13。14この図の拡大版を表示するのにはここをクリックしてください。

図 3: MiRNA 298 過剰発現より, 変異 AR 脊髄と大腿四頭筋のマウスします。(A) 腰椎脊髄と AAV9-ミール-298-GFP や AAV9 モック GFP で治療 (B) 大腿四頭筋における AR の mRNA の発現量を推定する qRT PCR を行った。SnoRNA202 に正規化されたトラン スクリプト レベル (n = 治療あたり 5)。* P < 0.05 * * P < 0.01。すべてのデータは、± 標準誤差を手段として報告されます。土井からの図が変更されている: 10.1038/mt.2016.13。14

図 4: ミール 298 過剰発現運動機能を改善し、体重減少を低減します。行動評価は週に一度 (w)、週 5 に 40 の間に行った。本体重量 (左) とマウスのワイヤー (右) パフォーマンスをぶら下げ (n = グループあたり 15)。すべてのデータは、± 標準誤差を手段として報告されます。土井からの図が変更されている: 10.1038/mt.2016.13。14
ディスカッション
ここで選択して配送尾注入を介してウイルスのベクトルとして rAAV9 を使用して、骨格筋およびマウスの運動ニューロンを対象に miRNA の非常に効率的かつアクセス可能な方法論を示します。14に比べて他の RNAi の戦略、Mirna、毒性が少ないと少ない免疫原性。18また、サイズが小さいウイルスのベクトルの限られた包装の容量に適したそれらを作る。2計算アルゴリズムと予測ツールと推定されるマイクロ Rna mRNA ターゲットの同定ができます。識別されると、miRNA のターゲット遺伝子発現に及ぼす影響を確認する必要があります。一般的なアプローチは、与えられた miRNAの in vitroノザン西部分析を用いたターゲット バイオマーカ発現量を検出しです。14,19
様々 な研究は、Mirna を提供するため、ウイルス ・非ウイルスベクターの戦略を使用しています。13ここでは、遺伝子の配信ツールとしてアデノ随伴ウイルス (AAV) を使用しました。分割で親和性の広範なスペクトルで、長期的な遺伝子導入により、他のウイルスのベクトルと比較して、AAV を引き出す低免疫原性、および非分裂細胞。18この配信方法も機能性と RNA 分子の特異性に影響を与える可能性があります化学修飾の必要性を回避できます。AAV のキャプシド蛋白質の組成によってほとんど決定されているいくつかの血清型があります。これらの血清型の親和性が異なるし、異なる種類の細胞を変換します。標的組織を考慮したときに正しい型を選択する必要があります。我々 は中枢神経系、骨格筋周辺管理19、20次にその高い伝達効率のための rAAV9 を選択します。このアプローチは、大人動物、細胞外マトリックスの組成、ニューロン-グリア比、血液脳関門の成熟度の違いによる可能性が高いと比較して新生児の動物の伝達効果を示しています。21,22
このプロトコルの重要なステップは、発現ベクターのデザインです。低いプロモーターの横にある最初の遺伝子と比較して 2 番目の遺伝子発現が妨げになって、bicistronic のベクトルと比較してデュアル プロモーター ベクトルにより従って miRNA、EGFP の発現を降伏バックツー バック構成蛍光抗体法によるマウス組織における miRNA の局在化を許可します。
AAV9 の静脈内注射は、高効率と標的組織、骨格筋運動ニューロンで均質な伝達で起因しました。インジェクションのこのルートでは、全身循環に到達し、中枢神経系治療に重要な脳血液関門を横断する投与量をことができます。さらに、中枢神経系への配信のための非侵襲的な方法です。ミール 298 式は 5 週齢で単一の末梢注入で 2-4 週間後脊髄、筋肉増加。とき遅延伝達を説明するかもしれない単一座礁させたゲノム AAV のベクトルを 2 番目の DNA 鎖のデノボ合成を使用しています。23
人間のミール-298 のレベル検出されなかった投与で慢性疾患の複数の注射が治療効果に到達するために必要なことを示唆して、単回投与後 20 週。ただし、経時劣化も miRNA を制限して、生涯の反復投与が必要な場合があります。さらに、AAV のベクトルへの適応免疫は、巧妙な遺伝子配達に別の障壁を形成できます。24免疫不活性 AAV ベクターのように世代は反復投与とこの有望な配信システムで長期的な効果を達成するために重要です。25
治療戦略として miRNA の使用に関する制限は、オフターゲット効果のリスクです。MiRNAs は可能性がありますこのアプローチで安全上のリスクをもたらす、incomplementary 他の遺伝子の転写を基礎に組み合わせるを通じてやり取りします。マイクロ プロセッサ複合体をバイパスする、広範な長期的な安全性と忍容性の研究は、この戦略を安全に変換する前に重要、mirtrons など、非正規の miRNAs の使用を含む、RNAi シーケンスの設計を改善し、有効な治療法です。26,27,28
MiRNA の発現として開発されたここで説明した方法が、miRNA 阻害療法 antagomirs を使用して活用することができますではも。
開示事項
著者が明らかに何もありません。
謝辞
著者は利益相反を宣言しません。AAV9 ウイルス産生ありがとう SignaGen 研究所 (Rockvile、MD、米国)。この研究は、NINDS、NIH の学内研究プログラムによって支えられました。フィリップ r. リーは、NICHD 学内研究部門からの資金によって支えられました。カルロ ・ リナルディは、協会フランセーズ contre レ Myopathies (AFM) から奨学金によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| QIAzol Lysis Reagent | Qiagen | 79306 | Lysis of fatty and standard tissues before RNA isolation |
| miRNeasy Mini Kit | Qiagen | 217004 | Purification of miRNA and total RNA |
| TaqMan MicroRNA Reverse Transcription kit | ThermoFisher Scientific | 4366596 | A highly specific kit that quantitates only mature miRNAs |
| snoRNA202 Primer | ThermoFisher Scientific | 1232 | Taqman miRNA control assay in mouse |
| miR-298 Primer | ThermoFisher Scientific | 2190 | Taqman miRNA-298 assay in mouse |
| Anti-GFP antibody | abcam | ab290 | Rabbit polyclonal to GFP - ChIP Grade |
| Red ink pad | Dovecraft Essentials | ||
| Blue ink pad | Dovecraft Essentials | ||
| AAV9-GFP vector | SignaGen Laboratories | SL100840 | Large scale AAV plasmid construction, packaging and purification |
| mmu-miR-298-5p | ThermoFisher Scientific | MC12525 | mirVana miRNA mimic |
| AAV9-EF1a-has-mir-298-GFP | Vector Biosystems Inc |
参考文献
- Broderick, J. A., Zamore, P. D. miRNA therapeutics. Gene Therapy. 18, 1104-1110 (2011).
- Esteller, M. Non-coding RNAs in human disease. Nat Rev Genet. 12, 861-874 (2011).
- Pickering, B. M., Willis, A. E. The implications of structured 5' untranslated regions on translation and disease. Semin Cell Dev Biol. 16, 39-47 (2005).
- Bilen, J., Liu, N., Burnett, B. G., Pittman, R. N., Bonini, N. M. MicroRNA pathways modulate polyglutamine-induced neurodegeneration. Mol Cell. 24, 157-163 (2006).
- Lee, Y., Samaco, R. C., Gatchel, J. R., Thaller, C., Orr, H. T., Zoghbi, H. Y. miR-19, miR-101 and miR-130 co-regulate ATXN1 levels to potentially modulate SCA1 pathogenesis. Nat Neurosci. 11, 1137-1139 (2008).
- Liu, N., et al. The microRNA miR-34 modulates ageing and neurodegeneration in Drosophila. Nature. 482, 519-523 (2012).
- Ebner, D. C., et al. Strategies for skeletal muscle targeting in drug discovery. Curr Pharm Des. 10, 1327-1336 (2015).
- Giorgetti, E., Lieberman, A. P. Polyglutamine androgen receptor-mediated neuromuscular disease. Cell Mol Life Sci. 73, 3991-3999 (2016).
- Grunseich, C., Rinaldi, C., Fischbeck, K. H. Spinal and bulbar muscular atrophy: pathogenesis and clinical management. Oral Dis. 20, 6-9 (2014).
- La Spada, A. R., Wilson, E. M., Lubahn, D. B., Harding, A. E., Fischbeck, K. H. Androgen receptor gene mutations in X-linked spinal and bulbar muscular atrophy. Nature. 352, 77-79 (1991).
- Katsuno, M., Adachi, H., Kume, A., Li, M., Nakagomi, Y., Niwa, H., Sang, C., Kobayashi, Y., Doyu, M., Sobue, G. Testosterone reduction prevents phenotypic expression in a transgenic mouse model of spinal and bulbar muscular atrophy. Neuron. 35, 843-854 (2002).
- Boissonneault, V., Plante, I., Rivest, S., Provost, P. MicroRNA-298 and microRNA-328 regulate expression of mouse beta-amyloid precursor protein-converting enzyme 1. J Biol Chem. 284, 1971-1981 (2009).
- Choudhury, S. R., et al. Widespread central nervous system gene transfer and silencing after systemic delivery of novel AAV-AS vector. Mol Ther. 24, 726-735 (2016).
- Pourshafie, N., et al. MiR-298 counteracts mutant androgen receptor toxicity in spinal and bulbar muscular atrophy. Mol Ther. 24, 937-945 (2016).
- Dweep, H., Sticht, C., Pandey, P., Gretz, N. miRWalk--database: prediction of possible miRNA binding sites by "walking" the genes of three genomes. J Biomed Inform. 44, 839-847 (2011).
- McClure, C., Cole, K. L., Wulff, P., Klugmann, M., Murray, A. J. Production and titering of recombinant adeno-associated viral vectors. J Vis Exp. (57), e3348(2011).
- Stuard, D. A., Oorschot, D. E. Embedding, sectioning, immunocytochemical and stereological methods that optimise research on the lesioned adult rat spinal cord. J Neurosci Methods. 61, 5-14 (1995).
- Huang, F., et al. miR-25 alleviates polyQ-mediated cytotoxicity by silencing ATXN3. FEBS Lett. 588, 4791-4798 (2014).
- Kuhn, D. E., Martin, M. M., Feldman, D. S., Terry, A. V., Nuovo, G. J., Elton, T. S. Experimental validation of miRNA targets. Methods. 44, 47-54 (2008).
- Yang, N. An overview of viral and nonviral delivery systems for microRNA. Int J Pharm Investig. 5, 179-181 (2015).
- Bourdenx, M., Dutheil, N., Bezard, E., Dehay, B. Systemic gene delivery to the central nervous system using Adeno-associated virus. Front Mol Neurosci. 7, 50(2014).
- Foust, K. D., Nurre, E., Montgomery, C. L., Hernandez, A., Chan, C. M., Kaspar, B. K. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat Biotechnol. 27, 59-65 (2009).
- Wang, Z., Ma, H. -I., Li, J., Sun, L., Zhang, J., Xiao, X. Rapid and highly efficient transduction by double-stranded adeno-associated virus vectors in vitro and in vivo. Gene Therapy. 10, 2105-2111 (2003).
- Saunders, N. R., Joakim Ek, C., Dziegielewska, K. M. The neonatal blood-brain barrier is functionally effective, and immaturity does not explain differential targeting of AAV9. Nat Biotechnol. 27, 804-805 (2009).
- Boudreau, R. L., Spengler, R. M., Davidson, B. L. Rational design of therapeutic siRNAs: minimizing off-targeting potential to improve the safety of RNAi therapy for Huntington’s disease. Mol Ther. 19, 2169-2177 (2011).
- Duque, S., Joussemet, B., Riviere, C., Marais, T., Dubreil, L., Douar, A. M., et al. Intravenous administration of self-complementary AAV9 enables transgene delivery to adult motor neurons. Mol Ther. 17, 1187-1196 (2009).
- Lowenstein, P. R. Crossing the rubicon. Nat Biotechnol. 27, 42-44 (2009).
- Sibley, C. R., Seow, Y., Curtis, H., Weinberg, M. S., Wood, M. J. Silencing of Parkinson's disease-associated genes with artificial mirtron mimics of miR-1224. Nucleic Acids Res. 40, 9863-9875 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved