このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
インスリン刺激に対するグルコース取り込み測定と応答
要約
この方法では、ヒト初代筋細胞をin vitroで培養して分化した筋管を得、グルコース取り込み速度を測定する。我々は、放射性標識[ 3 H] 2 - デオキシ-D-グルコースを用いて、基礎およびインスリン刺激状態における速度を定量化するための詳細なプロトコルを提供する。
要約
骨格筋は哺乳類の最大のグルコース沈着物であり、グルコースの恒常性に大きく寄与する。筋肉細胞のインスリン感受性の評価は、筋肉のグルコース代謝を調査し、代謝変化を特徴づけることに専念した全ての研究において重要な関連性を有する。筋肉細胞では、グルコーストランスポーター4型(GLUT4)タンパク質がインスリンに応答して原形質膜に移行し、細胞内にグルコースが大量に入る。グルコース取り込み速度を増加させることによって筋肉細胞がインスリンに応答する能力は、インスリンに対する筋細胞感受性を定量化するための標準的な指標の1つである。ヒト初代筋管は、細胞がインスリン感受性を含むドナー表現型の多くの特徴を維持するので、適切なインビトロモデルである。このin vitroモデルは、インスリン反応性に影響を与える可能性のある化合物の試験にも適しています。分化した筋管におけるグルコース取り込み速度の測定は、インスリン感受性。
この方法では、ヒト初代筋肉細胞をインビトロで培養して分化した筋管を得、インスリン刺激ありおよびなしでのグルコース取り込み速度を測定する。我々は、放射性標識[ 3 H] 2 - デオキシ-D-グルコース([ 3 H] 2dG)を用いて、受動的および能動的グルコース輸送速度を定量化するための詳細なプロトコルを提供する。活動的な基礎およびインスリン刺激速度ならびに刺激の倍を定量するための計算方法が提供される。
概要
骨格筋は哺乳類の最大のグルコース沈着物であり、グルコースの恒常性に大きく寄与する。このインスリン応答性組織は、インスリン刺激によって誘発されるグルコース取り込みの主要部位である1 。
2型糖尿病では、インスリン抵抗性が骨格筋を含むいくつかの組織で観察され、正常な血糖濃度を上回る。したがって、対象が対象における欠陥を特徴付けることであるか、対象を改善しようとする治療の効率を評価することであろうと、この組織およびその細胞のインスリン感受性のレベルを決定することが重要である。ヒトまたは動物の被験者において、インスリン感受性を評価するための金標準的技法は高インスリン血糖上昇クランプである。 DeFronzoによって1979年2月に導入され、 3 、 4年以降に変更されたこの方法は、全身を正常な血中グルコース濃度を維持するためにインスリン刺激下で灌流されるグルコースの速度として測定される組織のインスリン応答性。
インスリン感受性の探索は、インビトロ筋肉モデルを用いて細胞レベルで行うこともでき、インスリン刺激に対する細胞の生物学的応答を定量化するための有効かつ信頼できるツールである(5,6,7)。実際に、グルコース取り込み測定は、インスリン刺激に対する細胞の生物学的応答、インスリンの受容体への結合、GLUT4に富む小胞の転座、細胞内シグナル伝達およびリン酸化カスケードを定量化します8 。
これは、分化した筋管が代謝特性を含むドナー表現型の多くの特徴を維持するので、ヒトの試料では大きな関心事である患者に観察された障害および障害9,10,11,12。筋管は、グルコーストランスポーター15および細胞インスリンシグナル伝達機構16の発現を含む、骨格筋13,14と構造的、代謝的および表現型の類似性を示す。したがって、一次筋管におけるグルコース取り込みの測定は、ドナーの筋表現型を特徴付けること、または介入(薬物、栄養、または身体活動)が筋細胞におけるインスリン感受性に及ぼす影響を調査することと関連がある。
培養筋管におけるグルコース取り込みの測定はまた、インスリン感受性を改変する実験を行う際の信頼できるツールである 17,18 。 インビトロ
ここでは、ヒトの筋管を培養し、分化させ、細胞のグルコース取り込み速度を測定するための詳細なプロトコールを記載する。この方法は、実験室での準備、共同作業、または市販の供給業者に由来するものであれ、ヒト筋前駆細胞の任意の供給源に適用可能である。マウスおよびラット由来のC2C12およびL6のような不死化筋肉細胞株もまた、このプロトコール7によるグルコース取り込み測定に使用することができる7 。
我々は、放射性標識された[ 3 H] 2dGを用いて、基礎およびインスリン刺激状態の速度を定量化するための詳細なプロトコルを提供する。 T彼は標識されたグルコースアナログを使用することにより、出発物質が減少したグルコースの侵入を正確に測定することができ、これは一次細胞を扱う際の共通条件である。修飾されたグルコース分子は、代謝経路に入ることができず、したがって、細胞内に蓄積し、全細胞放射能による信頼できる定量を可能にする。実験条件には、グルコース輸送阻害剤(サイトカラシンB)の使用が含まれ、インスリンの有無にかかわらず測定が行われる。この組み合わせにより、グルコース活性侵入速度の決定、ならびにインスリン応答指数の倍数変化の計算が可能になる。この方法は、1回のインキュベーション時間中に1回のインスリン投与量で示されるが、プロトコールは、用量反応または時間経過実験のために容易に改変することができる12 。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1.細胞培養培地および溶液の調製
- 培地の調製
- グルタミン(2mM)、ペニシリン/ストレプトマイシン(最終5μg/ mL)、2%ウシ胎児血清(FCS)および2%血清代替物を含むHam's F-10培地を補充することによって、増殖培地(PM)を調製する。
- グルタミン(2mM)、ペニシリン/ストレプトマイシン(最終5μg/ mL)、および2%FCSを添加したダルベッコ改変イーグル培地(DMEM)を補充することによって分化培地(DM)を調製する。
- グルコース取り込み溶液の調製
注意:放射性物質の取り扱いは、許可された要員が制限された管理区域内でのみ許可されています。材料および廃棄物は、適切な手順、ガイドラインおよび現地法に従って処理する必要があります。- X-ダルベッコのリン酸緩衝生理食塩水(X-DPBS)を調製するために、0.2%(w / v)(最終濃度)のウシ血清アルブを含むDPBS(BSA)を含む。溶液を0.2μmフィルターで濾過する。 4℃で保存する。
- 冷たい2-デオキシ-D-グルコース(2dG)溶液を調製するために、16.4mgの2dGを秤量し、10mLの蒸留水に可溶化して10mMの溶液を得る。 4℃で保存する。
- 放射標識した2dG(2dG *)溶液を得るために、600μLの冷2dGおよび6μLの放射性標識[ 3 H] 2dGを5400μLのX-DPBSに加える。
注:最終濃度は1 mM 2dGで、標識は1μCi/ mLです。- 放射標識した2dG *溶液の20μLアリコート(TC20)を脇に置いてください。
- インキュベーション混合物の調製
- サイトカラシンB混合物については、2μLの20mMサイトカラシンBを2mLの放射性標識2dG *溶液に加える。
注:サイトカラシンBのストック溶液はジメチルスルホキシド(DMSO)中10mg / mLである。 - DMSO混合物については、残りの4mLの放射性標識2dG *溶液に4μLのDMSOを加える。
- サイトカラシンB混合物については、2μLの20mMサイトカラシンBを2mLの放射性標識2dG *溶液に加える。
2.ヒト一次筋細胞の培養
- ヒト筋肉衛星細胞による6ウェルプレートの播種
注:凍結バイアル(250,000個の細胞を含む)から社内(詳細は、参考文献24を参照)または市販のヒト筋肉衛星細胞を使用してください。単一条件下でのグルコース取り込みの測定に必要な1つの6ウェルプレートを得るために、以下の手順を250,000個の細胞について行う。- 事前に加温した水(37℃)中の自家製24凍結バイアルまたはヒト筋肉衛星細胞の商業用調製物を急速に解凍し、バイアル内に小さな氷塊が残るまで急速に解凍する。
- あらかじめ温めた(37℃)PM10mLを入れた50mLプラスチックチューブに直接注ぎます。
- 500×gで5分間遠心分離し、上清を捨てる。
- 18mLの予熱したPMで細胞ペレットを静かに再懸濁する(42,000個の細胞を得るために3mLの培地)。 6ウェルプレート(9.6cm 2 )の各ウェルに3mLを分配する。
注:プレートの6つの個々のウェルは、受動輸送阻害(ウェル1および2)、基底速度(ウェル3および4)およびインスリン刺激速度(ウェル5および6)についてグルコース取り込みの重複測定を実施する必要がある。 6)。異なる治療法が必要な場合は、6ウェルプレートを繰り返します。 - 細胞が90%コンフルエンスに達するまで標準培養条件(37℃、5%CO 2 )でインキュベートする。
注:このステップは、細胞バッチによって48〜72時間かかります。このステップでは媒体を交換しないでください。
- 筋細胞の分化
- PMを除去し(48-72時間後)、予熱したDM(ウェル当たり3mL)と交換する。 37℃、5%CO 2でインキュベートする。
注:分化は、細胞が整列し、多核化された安定した状態に達するまでに5日間かかります。通常、プライマリ筋管を1g / Lのグルコース培地で培養する。したがって、培養中のグルコース枯渇を避けるために、3mLの培地でプレートを満たして、常に十分なグルコース基質が細胞に利用可能であることを確認してください。 - 2日ごとにDM培地を交換する。
注:この時点から、筋管は最大7日間安定であり、有意な変化はなく、グルコース取り込み測定はいつでも実施できる。
- PMを除去し(48-72時間後)、予熱したDM(ウェル当たり3mL)と交換する。 37℃、5%CO 2でインキュベートする。
- 筋細胞治療(オプション)
注:一次筋管は、インスリン刺激およびグルコース取り込み測定前に、修飾(薬剤試験、シグナル伝達経路の阻害剤/活性化剤など )を誘導するために数日間治療することができる。筋肉細胞は、インスリン感受性に影響を与える可能性のある治療に提出することができ、グルコース取り込み測定は、この影響を定量化する。例えば、筋肉細胞と飽和脂肪酸パルミテートとのインキュベーションはインスリン抵抗性を促進し、細胞はinsulinはグルコース摂取を刺激した。- 10%BSA(脂肪酸を含まない)および0.5mLのパルミテート(PALM)を添加したDM 12mLを調製する。 10%BSA(脂肪酸を含まない)のみを補充した12mLのDMを調製する。
- ヒト初代筋管を有する2つの6ウェルプレートを調製し、セクション2.1および2.2(分化の5日間)で記載されているようにそれらを培養する。
- 5日目に、2mLのPBSで各ウェルを洗浄する。 1枚のプレートに、PALMを含むDM 2mLを加える。他のプレートに、DMのみを含有する2mLのBSAを加える。
- 37℃、5%CO 2で48時間インキュベートする。
3.インスリン刺激
- 2mLのPBSで分化した筋肉細胞を2回洗浄する。
- 注意深くPBSを除去し、血清がなくなるまで3時間(37℃、5%CO 2 )FCSを含まないDM3mLと共にインキュベートする。
- すべてのウェルの培地をFCSなしで3 mLのDMに交換する。ウェル5および6に100nMインスリンを加える。
- ヒト筋管培養をインキュベートする1時間(37℃、5%CO 2 )。
4.グルコース取り込み
- インスリン刺激の1時間後、ウェルをX-DPBSで2回洗浄する(1回の洗浄につき1mL)。
- サイトカラシンB混合物1 mLをウェル1と2に加え、1 mLのDMSO混合物をウェル3〜6に加える。15分間インキュベートする(37℃、5%CO 2 )。インキュベーションの終わりに、すぐにプレートを氷上に置く。
5.細胞溶解
- 氷冷PBS 1mLで細胞を2回洗浄する。
- 600mMの50mM NaOHで各ウェルの細胞を溶解する。氷上で5分間インキュベートし、緩やかな軌道回転で穏やかに混合する。
注:ライセートの粘性が高すぎる場合は、NaOH 1.5 mLまで希釈してください。 - ピペットを使用して、細胞ライセートを再懸濁して回収する。
放射性標識グルコースの測定
- 400μLの各細胞溶解物を液体シンチレーション計数バイアルに入れる。ネガティブコントロールバイアルに400を準備する50mM NaOH、50μLの50mM NaOH、およびTC2020μLを含む陽性コントロールバイアル(ステップ1.2.3.1から)。
- 4mLの液体シンチレーション溶液を各バイアルに加える。キャップを閉じ、各バイアルを完全に混和させます(1-2秒)。
- 各バイアルを液体シンチレーションカウンターに入れ、製造元の指示に従って放射能を測定する。各シンチレーションバイアルの分当たりのカウント数(CPM)を10分間記録する。
注:CPM = "分崩壊"× "カウント効率"。
7.グルコース取り込み速度
- 残りのライセート(ステップ5.2の200μL)を使用して、タンパク質濃度を測定します。 Bradford 25または同等の方法を用いて、各細胞溶解物のタンパク質濃度を決定する。各ウェルの総タンパク質量(Q)をmgで計算する。
- TC1(放射標識2dG *1μLの値)を得るには、TC20のCPM値を20で割ります。
- 各バイアルについて、tグルコース取り込み速度は以下の通りである:
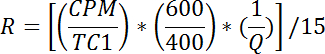
注:Rはpmol / mg / minで測定されます。井戸1〜2に対するRの平均は、受動輸送速度R pを与える。井戸3-4のRの平均は基礎総輸送率R btを与える。ウェル5-6のRの平均は、インスリン刺激総輸送速度R itを与える。- 以下のように、基礎アクティブ輸送速度(R ba )を計算する:
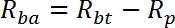
- インスリン刺激された活性輸送速度(R ia )を以下のように計算する:
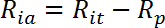
注:筋管のようなインスリン応答細胞では、グルコース取り込み速度は、通常、R ba 、R ia 、およびR ia / R baのような倍率のインシュリン刺激の3つの値によって表される。
- 以下のように、基礎アクティブ輸送速度(R ba )を計算する:
Access restricted. Please log in or start a trial to view this content.
結果
3日目に、筋芽細胞はコンフルエントに達する( 図1A )。この段階の筋芽細胞は、典型的には単核細胞である。培地を交換し、8日目に分化を完了させた( 図1B )(プロトコールセクション2)。分化の5日後、筋管は整列され、典型的には多核体形成される。グルコース取り込み速度測定の前に、ヒト初代筋管にパルミテー...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
グルコース取り込みは、細胞培養およびそれらがグルコースの使用にどのように影響するか、および細胞がインスリンに応答する能力に対する活性化剤または阻害剤を試験するための重要な生物学的測定値である。本明細書に記載の方法は、迅速かつ信頼性が高いことが示されており、健康な被験者および/または代謝亢進の患者6,7,10,12,21,26,27,36,37からの初代筋管を用いた多くの研究で広く使...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は何も開示することはない。
謝辞
著者らは、財政支援のために、ラジオバイオロジーサービス(Lyon-Sud病院)およびFond National Suisse(FNS)のAnneCharriéを認める。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Human primary muscle cell | In house preparation from human skeletal muscle biopsies | In house preparation from human skeletal muscle biopsies | If not available, use commercial source |
| Human primary muscle cell | Promocell | C-12530 | Should be cultured with associated media C23060 and C23061 |
| 6-well plate | Corning | 356400 | BioCoat Collagen I Multiwell Plates |
| Ham's F10 | Dutscher | L0145-500 | 1 g/L glucose |
| Glutamine | Dutscher | X0551-100 | |
| penicilin/streptomycin 100x | Thermo fisher scientific | 15140122 | |
| Serum substitute UltroserG | Pall France | 15950.017 | serum substitute in text |
| DMEM low glucose | Dutscher | L0064-500 | 1 g/L glucose |
| Fetal Calf Serum | Eurobio | CVFSVF00-01 | |
| Dulbecco's Phosphate-Buffered Saline | Dutscher | L0625-500 | Contains Mg2+ (0.5 mM) and Ca2+ (0.9 mM) |
| Insulin solution human | Sigma-Aldrich | I9278 | |
| 2-deoxy-D-glucose | Sigma-Aldrich | D6134 | |
| Albumin bovine | euromedex | 04-100-812-E | |
| fatty acid-free BSA | Roche | 10,775,835,001 | |
| palmitate | Sigma-Aldrich | P0500 | |
| Deoxy-D-glucose, 2-[1,2-3H (N)] | PerkinElmer | NET328A001MC | Specific Activity: 5 - 10 Ci (185-370GBq)/mmol, 1 mCi (37MBq |
| Cytochalasin B | Sigma-Aldrich | c2743 | |
| PICO PRIAS VIAL 6 mL | PerkinElmer | 6000192 | |
| ultima gold MW CA | PerkinElmer | 6013159 | scintillation liquid |
| bêta counter | PerkinElmer | 2900TR |
参考文献
- Stump, C. S., Henriksen, E. J., Wei, Y., Sowers, J. R. The metabolic syndrome: role of skeletal muscle metabolism. Ann Med. 38 (6), 389-402 (2006).
- DeFronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Fossum, E., Hoieggen, A., Moan, A., Nordby, G., Kjeldsen, S. E. Insulin sensitivity relates to other cardiovascular risk factors in young men: validation of some modifications of the hyperinsulinaemic, isoglycaemic glucose clamp technique. Blood Press Suppl. 2, 113-119 (1997).
- Heise, T., et al. Euglycaemic glucose clamp: what it can and cannot do, and how to do it. Diabetes Obes Metab. 18 (10), 962-972 (2016).
- Sell, H., Jensen, J., Eckel, J. Measurement of insulin sensitivity in skeletal muscle in vitro. Methods Mol Biol. 933, 255-263 (2012).
- Sarabia, V., Lam, L., Burdett, E., Leiter, L. A., Klip, A. Glucose transport in human skeletal muscle cells in culture. Stimulation by insulin and metformin. J Clin Invest. 90 (4), 1386-1395 (1992).
- Sarabia, V., Ramlal, T., Klip, A. Glucose uptake in human and animal muscle cells in culture. Biochem Cell Biol. 68 (2), 536-542 (1990).
- Richter, E. A., Hargreaves, M. Exercise, GLUT4, and skeletal muscle glucose uptake. Physiol Rev. 93 (3), 993-1017 (2013).
- Gaster, M., Kristensen, S. R., Beck-Nielsen, H., Schroder, H. D. A cellular model system of differentiated human myotubes. Apmis. 109 (11), 735-744 (2001).
- Bouzakri, K., et al. Reduced activation of phosphatidylinositol-3 kinase and increased serine 636 phosphorylation of insulin receptor substrate-1 in primary culture of skeletal muscle cells from patients with type 2 diabetes. Diabetes. 52 (6), 1319-1325 (2003).
- Scheele, C., et al. Satellite cells derived from obese humans with type 2 diabetes and differentiated into myocytes in vitro exhibit abnormal response to IL-6. PLoS One. 7 (6), e39657(2012).
- Jackson, S., et al. Decreased insulin responsiveness of glucose uptake in cultured human skeletal muscle cells from insulin-resistant nondiabetic relatives of type 2 diabetic families. Diabetes. 49 (7), 1169-1177 (2000).
- Aas, V., et al. Are cultured human myotubes far from home? Cell Tissue Res. 354 (3), 671-682 (2013).
- Bakke, S. S., et al. Myotubes from severely obese type 2 diabetic subjects accumulate less lipids and show higher lipolytic rate than myotubes from severely obese non-diabetic subjects. PLoS One. 10 (3), e0119556(2015).
- Stuart, C. A., et al. Hexose transporter mRNAs for GLUT4, GLUT5, and GLUT12 predominate in human muscle. Am J Physiol Endocrinol Metab. 291 (5), E1067-E1073 (2006).
- Al-Khalili, L., et al. Insulin action in cultured human skeletal muscle cells during differentiation: assessment of cell surface GLUT4 and GLUT1 content. Cell Mol Life Sci. 60 (5), 991-998 (2003).
- Tsuka, S., et al. Promotion of insulin-induced glucose uptake in C2C12 myotubes by osteocalcin. Biochem Biophys Res Commun. 459 (3), 437-442 (2015).
- Gorbunov, E. A., Nicoll, J., Myslivets, A. A., Kachaeva, E. V., Tarasov, S. A. Subetta Enhances Sensitivity of Human Muscle Cells to Insulin. Bull Exp Biol Med. 159 (4), 463-465 (2015).
- Breen, D. M., Sanli, T., Giacca, A., Tsiani, E. Stimulation of muscle cell glucose uptake by resveratrol through sirtuins and AMPK. Biochem Biophys Res Commun. 374 (1), 117-122 (2008).
- Pinnamaneni, S. K., Southgate, R. J., Febbraio, M. A., Watt, M. J. Stearoyl CoA desaturase 1 is elevated in obesity but protects against fatty acid-induced skeletal muscle insulin resistance in vitro. Diabetologia. 49 (12), 3027-3037 (2006).
- Gastebois, C., et al. Transition from physical activity to inactivity increases skeletal muscle miR-148b content and triggers insulin resistance. Physiol Rep. 4 (17), (2016).
- Naimi, M., Tsakiridis, T., Stamatatos, T. C., Alexandropoulos, D. I., Tsiani, E. Increased skeletal muscle glucose uptake by rosemary extract through AMPK activation. Appl Physiol Nutr Metab. 40 (4), 407-413 (2015).
- Feng, Y. Z., et al. PPARdelta activation in human myotubes increases mitochondrial fatty acid oxidative capacity and reduces glucose utilization by a switch in substrate preference. Arch Physiol Biochem. 120 (1), 12-21 (2014).
- Perrin, L., et al. Human skeletal myotubes display a cell-autonomous circadian clock implicated in basal myokine secretion. Mol Metab. 4 (11), 834-845 (2015).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Bouzakri, K., et al. Malonyl CoenzymeA decarboxylase regulates lipid and glucose metabolism in human skeletal muscle. Diabetes. 57 (6), 1508-1516 (2008).
- Shemyakin, A., et al. Endothelin-1 reduces glucose uptake in human skeletal muscle in vivo and in vitro. Diabetes. 60 (8), 2061-2067 (2011).
- Alkhateeb, H., Chabowski, A., Glatz, J. F., Luiken, J. F., Bonen, A. Two phases of palmitate-induced insulin resistance in skeletal muscle: impaired GLUT4 translocation is followed by a reduced GLUT4 intrinsic activity. Am J Physiol Endocrinol Metab. 293 (3), E783-E793 (2007).
- Coll, T., et al. Oleate reverses palmitate-induced insulin resistance and inflammation in skeletal muscle cells. J Biol Chem. 283 (17), 11107-11116 (2008).
- Gaster, M., Rustan, A. C., Beck-Nielsen, H. Differential utilization of saturated palmitate and unsaturated oleate: evidence from cultured myotubes. Diabetes. 54 (3), 648-656 (2005).
- Hage Hassan, R., et al. Endoplasmic reticulum stress does not mediate palmitate-induced insulin resistance in mouse and human muscle cells. Diabetologia. 55 (1), 204-214 (2012).
- Haghani, K., Pashaei, S., Vakili, S., Taheripak, G., Bakhtiyari, S. TNF-alpha knockdown alleviates palmitate-induced insulin resistance in C2C12 skeletal muscle cells. Biochem Biophys Res Commun. 460 (4), 977-982 (2015).
- Hommelberg, P. P., et al. Palmitate-induced skeletal muscle insulin resistance does not require NF-kappaB activation. Cell Mol Life Sci. 68 (7), 1215-1225 (2011).
- Yang, M., et al. Saturated fatty acid palmitate-induced insulin resistance is accompanied with myotube loss and the impaired expression of health benefit myokine genes in C2C12 myotubes. Lipids Health Dis. 12, 104(2013).
- Peng, G., et al. Oleate blocks palmitate-induced abnormal lipid distribution, endoplasmic reticulum expansion and stress, and insulin resistance in skeletal muscle. Endocrinology. 152 (6), 2206-2218 (2011).
- Lambernd, S., et al. Contractile activity of human skeletal muscle cells prevents insulin resistance by inhibiting pro-inflammatory signalling pathways. Diabetologia. 55 (4), 1128-1139 (2012).
- Nikolic, N., et al. Electrical pulse stimulation of cultured human skeletal muscle cells as an in vitro model of exercise. PLoS One. 7 (3), e33203(2012).
- Hsu, F. L., et al. Antidiabetic effects of pterosin A, a small-molecular-weight natural product, on diabetic mouse models. Diabetes. 62 (2), 628-638 (2013).
- Zou, C., Wang, Y., Shen, Z. 2-NBDG as a fluorescent indicator for direct glucose uptake measurement. J Biochem Biophys Methods. 64 (3), 207-215 (2005).
- Catalano, K. J., et al. Insulin resistance induced by hyperinsulinemia coincides with a persistent alteration at the insulin receptor tyrosine kinase domain. PLoS One. 9 (9), e108693(2014).
- Liu, H. Y., et al. Insulin is a stronger inducer of insulin resistance than hyperglycemia in mice with type 1 diabetes mellitus (T1DM). J Biol Chem. 284 (40), 27090-27100 (2009).
- Renstrom, F., Buren, J., Svensson, M., Eriksson, J. W. Insulin resistance induced by high glucose and high insulin precedes insulin receptor substrate 1 protein depletion in human adipocytes. Metabolism. 56 (2), 190-198 (2007).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved