Method Article
アミロイド組織イメージング ステンド グラス ハイパー スペクトルで発光共役オリゴチオフェンと共焦点顕微鏡と蛍光寿命イメージング
要約
アミロイドの沈着は、さまざまな病気の最大の特徴し、多くの異なった器官を苦しめます。本稿では、発光性共役オリゴチオフェン蛍光蛍光顕微鏡技術との組み合わせで染色の応用について説明します。この染色法は、検出と臨床的および科学的設定でタンパク質凝集体の探査のための強力なツールを表します。
要約
全身組織のアミロイドとして沈殿物蛋白質は、原因や病気の多数の結果をすることができます。これらの中で我々 は血清アミロイド A、トランスサイレチンと igg 抗体軽鎖が肝臓、手根でアミロイドとして預金主に中枢神経系や全身性アミロイドーシスを悩ませているアルツハイマー病やパーキンソン病などの神経変性疾患を見つけるトンネル、脾臓、腎臓、心臓やその他の末梢の組織。アミロイドは、知られているし、しばしばコンゴ赤 Thioflavin T (ThT) や Thioflavin (ThS) などアミロイドの特定の染料を使用してより多くの世紀のため研究されています。発光性共役オリゴチオフェン (LCOs) と呼ばれるこれらの染料に最近開発された補完の例として heptamer ホルミル チオフェン酢酸 (hFTAA) を提案する.hFTAA は使いやすい、蛍光抗体で染色または他の細胞のマーカーとの互換性です。広範な研究は、その hFTAA 検出従来アミロイド染料より疾患タンパク質凝集体のより広い範囲を証明しています。さらに、hFTAA は、アミロイド線維多型の研究を許可するように異なる集計から光学割り当ての適用もできます。イメージング手法の適用は任意ですが、ここではハイパー スペクトル イメージング (HIS) を示す、レーザー走査型共焦点顕微鏡と蛍光寿命イメージング (FLIM)。これらの例は、LCOs に形成の詳細な知識とアミロイドの構造特性を得るためのツールとして使用できますイメージング技術のいくつかを示します。技術に重要な制限事項はすべて従来の光学顕微鏡検査の技術、検出を許可する骨材の顕微鏡サイズの要件。さらに、集計では、hFTAA をバインドできるようにする反復的な β-シート構造を含むべきであります。凝集構造または構造を変更する固定および/またはエピトープの過剰な暴露は、貧しい hFTAA バインドをレンダリングし、したがって正確なイメージングへの制限を提起できます。
概要
組織におけるアミロイドの沈着は、アルツハイマー病、パーキンソン病、全身性アミロイド症、プリオン病等の番号疾患病理学的特徴です。アミロイド病とまで 40 の異なった蛋白質に近い人間1でアミロイドの前駆物質として分類されているという事実の有病率、にもかかわらずアミロイドの沈着と病気の表現型との関係について少し知られています。人間の患者からサンプルの組織はずっと診断および科学的な目的のための両方を使用します。アミロイドと動作、寿命、および他の表現型の読み取り数との相関を調査するため多数の動物モデルが確立されている病気の進行2,3アウト。大きな努力は、創薬といくつかの私たちの最も恐れられている広範な病気と戦うための設計で行われています。しかし、遺伝子型、表現型、アミロイド斑の負荷、および薬剤管理の間の接続の評価はなくまっすぐ進むです。染色および組織のアミロイド イメージング用のツールは無愛想が多いし、アミロイド線維形成と構造の低解像度情報を提供します。
コンゴ赤の複屈折、ThT、ThS 蛍光検出およびアミロイド病4の動物モデルとポスト mortem サンプル患者の生検から組織サンプルを分析するための古典的な方法の例を示します。これらの技術は数十年 (1920 年代以来コンゴ赤と ThT と 1960 年代からの微分) に使用されているおよびインストルメンテーションが洗練されている、詳細な分析では、染色の手順と分析が実行されています。ほぼ世紀前と同様。
高感度の新規アミロイド染料、hFTAA5、成熟したアミロイドの検出と同様に、高精度で小型の未熟なタンパク質付着物の検出ができるの利用について述べる。従来の染料と比較して、hFTAA、タンパク質凝集体5,6,7を関連付けられた病気の広い範囲を検出する証明されました。さらに、hFTAA は、異なる集計型8の光学割り当ての適用もできます。ここで、hFTAA 染色とプリオン病とアミロイド β 前駆体タンパク質 (APP) トランスジェニック マウス プラークにおけるアルツハイマー病9,10 を模倣するように設計の確立された動物モデルから組織の解析について述べる.全身性アミロイドーシス患者から診断の解析とポストの mortem サンプルも表示します。LCOs; 1 つのプラーク内の立体配座の違いを報告することができます組み込みのプロパティがあります。そして、バインディングおよび蛍光に関するさまざまなプロパティと 2 つの LCOs を組み合わせて違いは11に顕著さら。落射蛍光顕微鏡のロングパス フィルターを装備、ハイパー スペクトル カメラ ヘッドを使用してスペクトル特性の客観的分類とスペクトル解析のための顕微鏡写真の記録を有効にします。励起ソースとして波長可変レーザ共焦点レーザー蛍光顕微鏡を使用して、詳しくアミロイド斑の 3 次元プロパティを評価します。波長可変レーザ励起スペクトルのコレクションを有効にし顕微鏡で発光波長の選択以下の手順により、LCO 蛍光、蛍光抗体法によりターゲット蛋白質のアミロイドの共局在を決定するための共同のイメージング。FLIM は、LCOs に課せられた立体配座の違いに前例のない感度を提供し、蛍光発光スペクトルでは検出されない可能性がありますの違いを明らかにします。
記載されている染色法と主な目標は、小さな amyloid 沈殿物の高感度検出を容易にして内アミロイド構造多型を特徴付けるため。この知識は、タンパク質凝集疾患の基本的な理解のために重要です。
プロトコル
注: LCO 合成ラボ以上にわたり行われてきました。本質的に適用する求電子芳香族置換、パラジウム触媒によるクロス カップリング、アミド結合、エステルの加水分解のためのプロトコルと、我々 は総合的他用 5 , 用プローブをカスタマイズします。 12. 合成、キャラクタリゼーション、および浄化後、LCO の製品は凍結乾燥、常温保存します。プローブのいくつか (うち hFTAA) が今市販 (材料の表 を参照).
1 LCO の染色液
注: 商用ベンダーから hFTAA を購入すると、場合、ベンダーに従ってください ' のセクション 1 ではなく指示。
。- 、凍結乾燥再懸濁します
- hFTAA 2 mm 水酸化ナトリウム 1 mg/mL のストック溶液を調製します。4 ° C で、ガラス瓶の在庫を維持します。株式は 1 年間保存することができます 。
- 染色の日、リン酸緩衝生理食塩水 (PBS) でストック 1: 10,000 を希釈して実用的なソリューションを準備します 。
2。組織試料作製法
注: アミロイド マーカーとして hFTAA を使用して多くの組織型をイメージすることができます。例については、 図 1 を参照してください。hFTAA 集計構造に敏感です。染色したがって好ましくで実行されるエピトープの露出無しで上の集計。ティッシュの固定を最小限に抑える場合、スペクトルの最適な品質を実現します。したがって染色の時にエタノールで軽く固定、新鮮な冷凍物が好ましいです。しかし、例えば ホルマリンで固定された組織のアミロイド沈着も検出することが可能です。hFTAA は一般にティッシュをよく突き通します。イメージングのものと互換性がある厚を選択
。- ホルマリン固定、parafinembedded セクションを使用して、一晩キシレン deparafinize 場合。連続お風呂でのセクション 99% エタノール、70% エタノール、dH 2 O、および PBS、各 10 分を浸しなさい。周囲条件下で乾燥するティッシュ セクションを許可します
。 注意: キシレンは化学の発煙のフードで常に処理されます。キシレン、有機溶剤は有害です。- 部屋の温度で融解凍結切片。一晩 10% ホルマリンでティッシュ セクションを修正し、99% のエタノール、70% エタノール、dH 2 O、および PBS、各 10 分の連続した浴場でそれらを浸すことによって水分補給。周囲条件下で乾燥するティッシュ セクションを許可します 。
- HFTAA 作業ソリューション (約 200 μ L) の滴を加えるそれをカバーするティッシュ セクション。ドロップレットは、表面張力によって場所に滞在する必要があります。汚損のため室温で 30 分間インキュベートします 。
- リンス ピペットを使用して 500 μ L の PBS を染色液とに没頭する PBS お風呂で 10 分間許可する周囲条件下で乾燥するセクションのスライドです 。
- は、メディアをマウントする蛍光を使用してマウントします。一晩解決するメディアをマウントできるようにします
。 注: 蛍光抗体法により、特定の細胞または細胞小器官のマーカーなど 他の染色法との組み合わせで実行できます hFTAA 染色します。染色するには、選択肢の完全な汚損のプロトコルを実行し、hFTAA 2.2 の段階から始まって、最後に染色を追加します。例については、 図 2 を参照してください。蛍光抗体法、640 に興奮した二次抗体を選択できれば nm 以上。この波長範囲で hFTAA は吸収しないとそれ故に興奮することはできず、ない蛍光を発する。こうと写りが見られることがない hFTAA と抗体間 。
3。顕微鏡
注: ロングパス フィルターを搭載した蛍光顕微鏡を使用します。以下のすべての設定は、 図 4 の画像の生成に使用されました。調整は、アミロイド型や組織サンプルの種類に応じて行われる必要があります。HFTAA 行きのアミロイドは漂白に向かって安定したが、それは、供試体が検討、イメージ、光源をオフにすることをお勧めします
。- HIS
注: (参照 材料表) のロングパス放出フィルターとカメラ頭落射蛍光顕微鏡を用いた実験を行った。 ロングパス フィルターおよびハイパー スペクトル カメラ搭載、標準的な蛍光顕微鏡を- 使用。スペクトル カメラをキャリブレーションすることを確認してください 。
- ソフトウェアで、プロジェクトの名前、選択 " 分光画像 " 集録を開始と 。
- 436 nm の励起フィルターを用いた眼を通じて関心のオブジェクトを選択し、カメラに光路をシフトします 。
- 、ケース データ マネージャー (CDM) のスペクトル、ラベル サンプルでは、サンプルの種類を選択し、プレスを取得します。アクイジション ・ ウィンドウが開きます 。
- アクイジション ・ ウィンドウで " 分光イメージング "、設定メニューを開き、取得プロパティを選択、460-700、ガス/レーザー/狭いフィルターで最大速度で速度品質と測定型分光範囲を設定します。ダイアログ ボックスを閉じます 。
- 画像のメニュー選択は完全ライブします。アイコン バーで縞をオフにします。選択またはピーク メモリー値が 800 MB 以下の画像に領域のサイズします。露出時間を 1,000 と 3,000 の合計画像の明るさを示す値に設定します。アイコン バーの色付きのカメラを押します。集録が開始されます。画像の取得が完了したらを押して保存先で、" 取得スペクトル画像 " ダイアログ ボックスと " 新しいセル " ケース データ マネージャー] ダイアログ ボックス 。
- CDM からは、分析の開始] ボタンを使用して収集した画像を開きます。データ解析のウィンドウが開きます 。 スペクトル表示] ダイアログ ボックスを使用して Roi を選択して、イメージの各ピクセルから
- スペクトル情報を収集できます。選択 " 定義 " イメージの関連分野から Roi を選択します 。
- は、Lib] ボタンを使用してテキスト ファイルとしてスペクトル データを保存します。保存された .txt ファイルは、選択した任意の解析ソフトウェアにインポートできます。.Slb ファイルは、データ解析ソフトウェア内で分析のため使用できます。として、全体のイメージからハイパー キューブ データの raw ファイルとしてエクスポートすることも " tif の層 "、または " テキスト形式でレイヤー " 外部ソフトウェアを使用してデータおよびイメージの解析アプリケーションのため 。
- 共焦点顕微鏡
注: 共焦点の顕微鏡は励起源として波長可変レーザ搭載します。すべて蛍光発光実験、レーザー強度を 0.2% (3 μ の平均パワーに対応する) に設定 1 風通しの良いユニットにピンホール、フレームのサイズ 1,024 px x 1,024 px、7、16 以上のスキャンとビット深度 8 ビットとして平均としてスキャン速度 (を参照してください < strong > テーブルの材料)。これらの設定は、個々 の共焦点システム、レーザー ソースとサンプルの種類に合わせて調整する必要があります。- 発光スペクトルを収集ラムダ モードとアルゴンを使用して励起を使用してデータ レーザー 488 にセット nm。32 チャンネルの息をのむ検出器の 22 チャンネルを使用して 503 と 687 の nm 間排出量を収集します。ゲインを 755 に設定します 。 シングル チャンネルの画像を達成するために
- は、スマート オプションを設定を使用します。FITC (緑フィルター)、750 にゲインを設定および Alexa 535 (赤いフィルター) 845 にゲインを設定します 。 波長可変レーザの励起スペクトルを収集する
- は、1 nm のステップで 551 と 586 nm の発光を収集しながら 490 545 nm の間で励起を使用します。2% (30 μ の平均パワーに相当) し、774 に利得レーザー強度を設定します 。 スペクトル モードで z を収集する
- は、0.96 μ m のステップでの深さをスキャンできます。3.2.1 のステップと同じ刺激および放出設定を使用が 730 にゲインを設定できます 。
- FLIM
注: 共焦点の顕微鏡が FLIM ユニット装備 (材料の表 を参照してください)。- は、共焦点顕微鏡の次のパラメーターを設定: ピンホール、20; 励起波長 490 nm; レーザー強度、0.5% (7.5 μ の平均パワーに対応する)。40 MHz でパルス レーザーを使用します 。
- 、FLIM でソフトウェア設定フォトンカウンティング以上 550 nm。表示パラメーター] ウィンドウで次の最大数は約 4,000 の光子数までのフォトンカウンティング 。
- ファイルを保存し、SPC のイメージとしてエクスポートします 。
- は、FLIM ソフトウェアの 2 成分の指数関数的減衰にデータをフィットしました。Χ 2 を与えるフィット < 2 が良いです。Y 軸の値は、指定された有効期間のカウント数です 。
- は、例えば、100 カウントのしきい値を選択します。T1 でカラーコード、有効期間の範囲を選択します。崩壊はアミロイド構造に依存して、hFTAA がバインドされています。300 および 1,000 ps 間の蛍光寿命が観察されています。ファイルを保存します 。
- のエクスポート オプションを使用して、生データをエクスポートし、新しいフォルダーに目的のデータを保存します 。
結果
高感度人間の患者や実験動物から多くの異なる組織タイプの蛋白質の多数からアミロイド染色は、科学的な研究のように臨床診断同様に不可欠です。この稿では、どのようにこれがすることができますを示す染色と組織の種類の選択からアミロイドのマルチ モーダル イメージングのための hFTAA に代表される LCOs を使用して達成。10 年以上前、チオフェン ベース アミロイド配位子の最初の出版以来13LCOs6,7,11を使用してイメージを持って組織の様々 な蛋白質の広い範囲から成る堆積物アミロイド 14,15,16 (図 1)。抗体や他の組織学的マーカーと組み合わせて、LCOs は (図 1 a図 2) の診断、科学的目的のため優れたツールを提供します。蛍光マーカーの適切な選択と同じセクション (図 1 ahFTAA、DAPI 蛍光セットアップで図 2 a hFTAA) をいくつか fluorophores が付いてをイメージすることができます。また、明視野と蛍光 (図 2 b、hFTAA、軽打抗体染色) を使用しての汚損のための連続部分を使用することが可能です。最近では、hFTAA は、コンゴ赤染色臨床診断7,15 (図 3) に非常に有望な補完するために実証されています。
最後の十年にわたるイメージング技術の開発は、定量的な方法でアミロイド沈着の深遠な違いが同じ時間、分、間を識別できるアミロイドの染料の必要性を増加しています。LCO 内共役系バインド モードで変化を報告するユニークな機能を提供します。分子のねじれは共役系の結合角の歪みにつながるし、電子 (図 4 a) の輸送を阻害できます。これは順番 LCO 励起と放射の波長と放射寿命の両方の蛍光特性に反映します。我々 は放出のロングパス フィルターを搭載した直立した蛍光顕微鏡で彼を使用します。共焦点の顕微鏡検査および FLIM の発光スペクトルの励起、パルス レーザーと、LSM780 を使用します。1 つのオブジェクト (APP トランスジェニック マウスにおける β アミロイド (a β) プラーク) イメージを描き、さまざまなテクニックを例示する (図 4 b-e)。ハイパー蛍光スペクトル (図 4 b) スペクトル シフトと別のリージョン内のプラークの輝度評価が可能です。共焦点顕微鏡 (図 4 c) における励起スペクトルは、下流の実験、例えば、いくつか fluorophores が付いている染色の組み合わせの最適な励起波長を決定する使用できます。このメソッドも LCO のバインディング モードの構造相違の発見に有用証明できます。共焦点モードで発光スペクトルは蛍光発光特性 hFTAA またはいくつかの LCOs または LCO と蛍光の組み合わせ実験での共存を評価するいくつかの蛍光物質の組み合わせを決定する使用ことができます。組み合わせ。HFTAA の蛍光寿命は小さい hFTAA のバインディング モードの変化に強く影響されました。したがって FLIM はバインディング ターゲット (図 4 d) が hFTAA に課せられた違いの判別には強力なツールです。これ、たとえば異なるプリオン系統8鑑別に使用できます。共焦点画像と 3次元画像への Z スタックの処理です (図 4e) アミロイド集合体の全体的な形状を探索するための便利なツールです。再度、追加 fluorophores の使用は沈殿物の構成を理解に役立ちます。
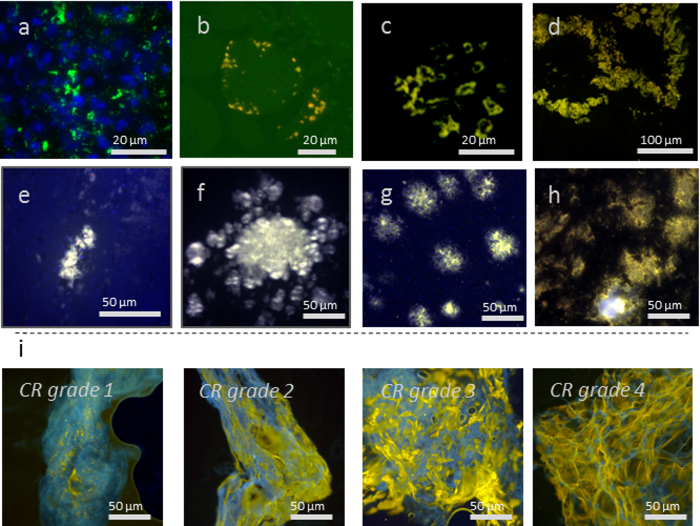
図 1: 様々 な組織型とタンパク質凝集体 h FTAA の染色を示す: ケラチン集計 (DAPI で counterstained)、肝臓で散発的に (b) p62 陽性 r 介在物から成る (、) マロリー Denk 体封入体筋炎 (s-IBM) の筋肉組織、(c) アミロイド (f、(d) (e) 羊スクレイピー (プリオン) マウスひと腸管内アミロイドの免疫グロブリン軽鎖脳人間の膵臓の膵島アミロイドポリペプチド) 慢性消耗性疾患 (プリオン) APP23 マウス脳内 a β (g) プラク マウス脳内 a β (h) アプリ/PS1 マウスの脳、および (私) 脂肪生検病理細胞診トランスサイレチンのアミロイドの人間の患者の診断のサンプル1-4 標準コンゴーレッド (CR) の得点によると等級別になります。黄色の領域は、hFTAA amyloid 沈殿物を染色し、青は脂肪組織から蛍光を示します。スケール バーの長さは、各パネルで指定されます。この図の拡大版を表示するのにはここをクリックしてください。
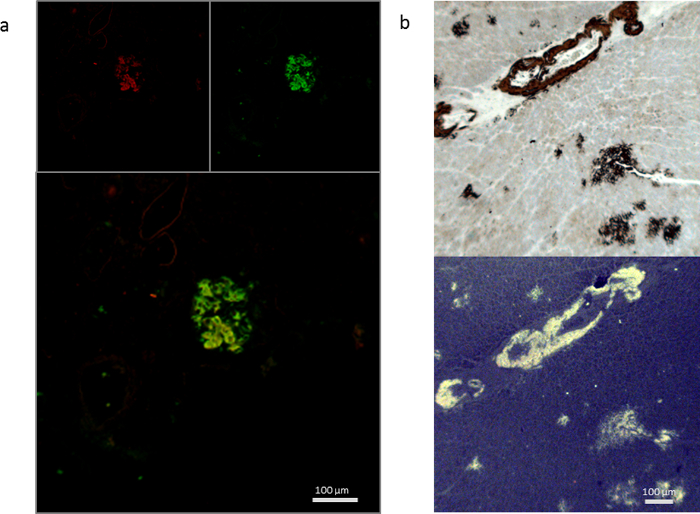
図 2: 抗体染色の例。抗血清アミロイド A (AA) 蛍光と同じセクションを人間の AA アミロイドの hFTAA は共同染色は (、)。左上: AA 抗体排出 640 nm;488 で上右 hFTAA nm;下のパネルは、黄色でイメージ表示の共存をオーバーレイします。連続切片 (b) 抗体染色と hFTAA 蛍光。上部パネル: AA 抗体 DAB 染色、下部パネル: hFTAA longpass 排出フィルターとイメージします。スケール バー: 100 μ m.この図の拡大版を表示するのにはここをクリックしてください。
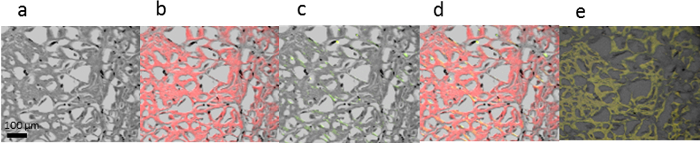
図 3:トランスサイレチンのアミロイド染色・ マイヤーのヘマトキシリン/コンゴ赤 (、-d) とマイヤーのヘマトキシリン/hFTAA (e) 人間の心でショートパス フィルターと蛍光を比較します。(、) 明視野イメージ明視野 (b) + (c) 明視野蛍光交差偏光板、(d) 明視野蛍光 + 405 (e) hFTAA 蛍光交差偏光板nm + 480 nm 励起 ( 、-のdに連続セクション)。スケール バー: 100 μ m.この図の拡大版を表示するのにはここをクリックしてください。
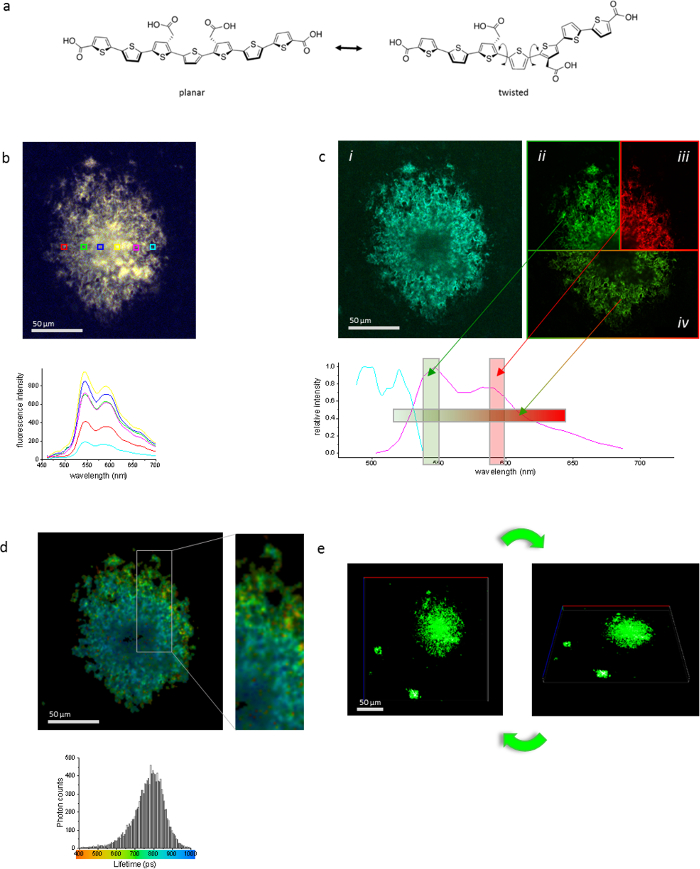
図 4: 高齢者 APP23 マウスの 1 つの a β プラークを使用して同じオブジェクト hFTAA で染色し、いくつかの技術とイメージを示した。hFTAA (、)、蛍光性は、その構造の状態によって決まります。平面とツイスト状態で hFTAA の構造が表示されます。連続的な発光スペクトルの評価 (b) ハイパー スペクトル イメージング。下のパネルでスペクトルは、画像内のボックス化された地域によって色分けをされて。(i) 共焦点 (c) 励起イメージング (ii、iii) のスペクトル撮像とフィルター モードまたは (iv) スペクトル モードで発光イメージング。(d) 蛍光寿命イメージング、短い有効期間が a β プラークの周辺で発見され、プラークの中心部での生活時間が長くなるほど、アミロイドの立体配座の違いの検出のため。下のパネルのヒストグラムは、全体のプラークの寿命回数の分布を示しています。イメージは、ヒストグラムの下の規模に応じて色です。(e) 共焦点 Z スタック オブジェクトの立体構造を表示するフィルター モードで収集されます。スケール バーの長さは、各パネルで指定されます。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
異常に折られた蛋白質のアミロイドへの堆積は、多くの病気プロセスのキー イベントです。細胞外のアミロイド a β ペプチドの構成、過リン酸化タウによって形成される細胞内の蛋白のもつれはアルツハイマー病患者の脳で発見されます。異なった蛋白質、例えばトランスサイレチン (TTR)、血清アミロイド A タンパク質 (SAA)、igg 抗体軽鎖ミスフォールドタンパクと中枢神経系の外組織のアミロイド沈着としてマニフェストの範囲。アミロイド堆積物が知られており、我々 はまだ以上の世紀の勉強不足かアミロイドの詳細な知識が、分子レベルでこのプロセスを防ぐために何を行うことができます堆積が開始されます。アルツハイマー病、アミロイドーシスのプロセスがどのように神経変性に関連付けられてであるかを裏付ける必要です。アミロイドーシスの治療法のミッションで 1 つのキーのクエストは小説を開発するアミロイドの発生、進行、および回帰; 監視のためのツールを微調整したがって対象となるアミロイド検出は鍵です。長い目で見れば、臨床診断感度および選択性アミロイド染色方法7,15の増加からお越しの。この点で現在の課題は途方もなく、非常に活発な研究領域です。臨床開発、臨床試験の 1 つの主な問題は、予後診断です。これらの病気の可能性があります開始も症状が現れるが、そこの治療が病気の識別をする必要がありますを開始する前にします。ここで、感度は新規方法論の重要な側面です。さらに、いくつかのタンパク質の凝集体、有毒である、いくつかが、保護およびいくつか、中立的なために、この問題はさらに複雑です。したがって神経変性タンパク質の凝集疾患の多様性を報告した異種表現型を説明する集計別種の存在が示唆されているので、特定の集約型を監視する機能は不可欠です。例えば、プリオン蛋白質は、アミノ酸の同一の一次シーケンスことができます特定のプリオン株に上昇を与える個別の集計型に折り畳ま方法の典型的な例です。同様な多型は、a β ペプチド、α-シヌクレイン、タウに報告されています。この点で、LCOs は、異なる集計から光学割り当ての卓越したツールであると示されています。プリオン系統特異蛋白質を集約、いくつかの種類の全身性アミロイドーシスとして多型の a β は、たんぱく質とタウ凝集体は、LCOs のコンホメーション誘導光学現象により区別されています。
アミロイドの沈着は、分子の精密の生化学や生物物理学的方法と浸透しにくい組織で行われるイベントです。プローブ イベント前のヴィヴォ体内および体外同じ LCO 分子を使用する可能性体内で前のヴィヴォまたはを適用することは技術を使用して発生する解明のイベントのステージを設定します体外11,17のサンプルします。最近報告された高分解能構造モデルを示して LCO 型米州自由貿易地域 (pFTAA) 結合すること 6 レジスタで平行 β ストランド18にわたる線維の軸と平行に整列側鎖によって形成された空洞であることを示す原子分解能 LCO ターゲットのエンティティに関する知識を得ることが可能です。本質的には pFTAA の結合共振器と結合モードはコンゴ赤19、反復的な正荷電 Lys 側鎖と並ぶ溝によって決まりますに似ています。LCOs の親和性は、コンゴ赤チェーンの柔軟性と疎水性空洞に向かってチオフェン環の硫黄原子の強いファンデルワールス相互作用による可能性が高いとより良い比較する表示されます。Prefibrillar 種 (ThT 応答) の前に5,20の検出が表示されます繰り返し β シート、レジスタで並列-β ストランド、なる pFTAA よりも長い 2 つのチオフェンをされている hFTAA の構成に依存最大 8 β 鎖の交差に します。
汚損のプロトコルは、次の手順で撮影トラブルに注意を支払う必要があります: (i) 固定: 組織サンプルの豊富な固定できるアミロイド構造を混乱させるし、誘起蛍光スペクトルの変化を検出する可能性を制限hFTAA 分子の立体構造の歪み。新鮮凍結材料から凍結切片の軽度の固定は最適なスペクトル分解能を達成するために好まれる。ただし、hFTAA は染色し、アミロイドが減少効果とスペクトル変化少ない固定ティッシュの蛍光を発する。(ii) エピトープ露出: 抗体の結合のためにバインドする hFTAA のための能力を減らすかもしれない時折のエピトープの露出を達成するために組織の前処理は、アミロイド構造を中断します。これは問題、エピトープ露出は抗体の汚損のプロトコル、抗体の hFTAA の連続部分を使用して重要なステップ、それぞれ考えられます。(iii) overstaining: hFTAA は非常に敏感。作業ソリューションは、nM の低濃度に保つ必要があります。問題の背景を汚す場合 hFTAA の濃度が低下します。組織でスパース hFTAA をバインド要素では、hFTAA の過剰は集計でき、取り付け中に蓄積されます。これは、組織自体の焦点面ではない蛍光として認識されます。これが表示された場合は、カバー スリップ セクションのスライドすることができます、PBS で洗浄し、新鮮な取り付け中、新しいカバー スリップ マウントまで PBS でマウントされたスライドを浸します。(iv) フィルター ベース イメージング: ロングパス フィルターまたは複数検出チャンネルを使用してスペクトル大抵解決蛍光について述べる。hFTAA は、短いパス フィルターを使用しても監視できます。コントラストを削減し、複数の色を検出する可能性を廃止することを認識ください。
過去年にわたって明らかと研究ツール、蛍光 LCOs、hFTAA が非常に有望なプロパティを表示する、特になっています。結果は、様々 なタンパク質と病気の状態、血清アミロイド A、トランスサイレチン、免疫グロブリン軽鎖の全身性アミロイド (タウ、封入体筋炎) 細胞内凝集体の hFTAA 検出に至る実証されている (カッパとラムダ) seminogelin 1、プリオン蛋白質 (臨床サンプルを含む)21膵島アミロイドポリペプチド インスリン7,15診断ツールとして hFTAA の実装の制限要因は、ルーチンのアミロイドの病理学研究所でその蛍光顕微鏡は広く使用されませんです。さらに、診療所で彼は容易に利用できません。ただし、hFTAA のアミロイド染色し、蛍光顕微鏡フィルター ベースの蛍光顕微鏡で臨床検査室で使用されているし、する必要があります。無料診断法として考慮されます。これは最近トランスサイレチン アミロイドーシス自動ファッション22で蛍光性のための基本的な設定を使用して手根管生検で実証されました。
さらに、に加えて、各種のタンパク質 hFTAA 蛍光認識様々 な線維の種類と事前維アミロイド凝集体、例えば経路維種が検出され、特徴付けられます。この文書に 3 つの顕微鏡検査の技術を使用してさまざまなサンプルに 1 つ LCO を説明してきました。生体分子ターゲットの多彩な検出など、表面プラズモン共鳴 (SPR)23で相互作用の記録と陽電子放出のカイネティックスの LCOs の開発に関する合成における構造制御の使用を許可しても断層レントゲン写真撮影 (ペット)24。
これまでに 25 以上の異なる LCOs が公開されています。アミロイド イメージングの LCOs の使用の増加が増加するは、知識とこれら疾患に関連する集計の組み立て、分解、および臓器・存在している個人に干渉について理解します。
開示事項
PH PN MB SN は Ebba バイオ テクノロジー商品ブランド名 Amytracker545 の下の hFTAA の少数株主です。
謝辞
著者らは、蛍光顕微鏡と阻害される、ヨハン ・ Bijzet、Bouke Hazenberg、フランク ヘップナー、マティアス Jucker、テレーズ Klingstedt、カリン magnusson 氏、クリスティーナ ・ Sigurdson、ダニエル ・ Sjölander、上のアドバイスをミカエル ・ リンドグレンやチャナン Sluzny を感謝したいです。クリストフ ・ Röcken、グニラ Westermark、Westermark あたり、貢献するティッシュ セクションまたはこの文書に表示されます顕微鏡のクルト ・ Zatloukal。記載表示されているデータのコレクションはスウェーデンの脳財団 (Hjärnfonden)、スウェーデンのアルツハイマー協会 (Alzheimerfonden)、スウェーデンの研究議会 (VR)、ヨーラン ・ グスタフソン協会ゲオルクから拠出金によって賄わされている &アストリッド オルソンと EU FP7 健康プロジェクト LUPAS、リンショーピン大学。
資料
| Name | Company | Catalog Number | Comments |
| hFTAA/Amytracker545 | Ebba Biotech | ||
| Dako fluorescene mounting medium | Agilent technologies | GM304 | |
| LeicaDM6000 | Leica | ||
| Lumen 200 | Prior | ||
| Spectraview system | ASI spectral imaging | ||
| Spectraview software | ASI spectral imaging | ||
| LSM780 | Zeiss | ||
| Zen 2010b v6.0 software | Zeiss | ||
| FLIM system | Becker & Hickl | ||
| Ar/ML 458/488/514 | Zeiss | ||
| Tunable Laser In Tune | Zeiss |
参考文献
- Sipe, J. D., et al. Amyloid fibril proteins and amyloidosis: chemical identification and clinical classification International Society of Amyloidosis 2016 Nomenclature Guidelines. Amyloid. 23, 209-213 (2016).
- Buxbaum, J. N. Animal models of human amyloidoses: are transgenic mice worth the time and trouble?. FEBS letters. 583, 2663-2673 (2009).
- Hall, A. M., Roberson, E. D. Mouse models of Alzheimer's disease. Brain Res Bull. 88, 3-12 (2012).
- Westermark, G. T., Johnson, K. H., Westermark, P. Staining methods for identification of amyloid in tissue. Methods in enzymology. , 3-25 (1999).
- Klingstedt, T., et al. Synthesis of a library of oligothiophenes and their utilization as fluorescent ligands for spectral assignment of protein aggregates. Org Biomol Chem. 9, 8356-8370 (2011).
- Klingstedt, T., et al. Luminescent conjugated oligothiophenes for sensitive fluorescent assignment of protein inclusion bodies. Chembiochem. 14, 607-616 (2013).
- Sjolander, D., et al. Establishing the fluorescent amyloid ligand h-FTAA for studying human tissues with systemic and localized amyloid. Amyloid. 23, 98-108 (2016).
- Magnusson, K., et al. Multimodal fluorescence microscopy of prion strain specific PrP deposits stained by thiophene-based amyloid ligands. Prion. 8, 319-329 (2014).
- Radde, R., et al. Abeta42-driven cerebral amyloidosis in transgenic mice reveals early and robust pathology. EMBO Rep. 7, 940-946 (2006).
- Sturchler-Pierrat, C., et al. Two amyloid precursor protein transgenic mouse models with Alzheimer disease-like pathology. Proceedings of the National Academy of Sciences of the United States of America. 94, 13287-13292 (1997).
- Nystrom, S., et al. Evidence for age-dependent in vivo conformational rearrangement within Abeta amyloid deposits. ACS chemical biology. 8, 1128-1133 (2013).
- Aslund, A., et al. Novel pentameric thiophene derivatives for in vitro and in vivo optical imaging of a plethora of protein aggregates in cerebral amyloidoses. ACS chemical biology. 4, 673-684 (2009).
- Nilsson, K. P., Herland, A., Hammarstrom, P., Inganas, O. Conjugated polyelectrolytes: conformation-sensitive optical probes for detection of amyloid fibril formation. Biochemistry. 44, 3718-3724 (2005).
- Mahajan, V., et al. Cross beta-sheet conformation of keratin 8 is a specific feature of Mallory-Denk bodies compared with other hepatocyte inclusions. Gastroenterology. 141, 1080-1090 (2011).
- Sjolander, D., Bijzet, J., Hazenberg, B. P., Nilsson, K. P., Hammarstrom, P. Sensitive and rapid assessment of amyloid by oligothiophene fluorescence in subcutaneous fat tissue. Amyloid. 22, 19-25 (2015).
- Arja, K., et al. Enhanced fluorescent assignment of protein aggregates by an oligothiophene-porphyrin-based amyloid ligand. Macromol Rapid Commun. 34, 723-730 (2013).
- Psonka-Antonczyk, K. M., et al. Nanoscale Structure and Spectroscopic Probing of Abeta1-40 Fibril Bundle Formation. Front Chem. 4, 44 (2016).
- Herrmann, U. S., et al. Structure-based drug design identifies polythiophenes as antiprion compounds. Sci Transl Med. 7, 299ra123 (2015).
- Schutz, A. K., et al. The amyloid-Congo red interface at atomic resolution. Angewandte Chemie (International ed). 50 (26), 5956-5960 (2011).
- Hammarstrom, P., et al. A fluorescent pentameric thiophene derivative detects in vitro-formed prefibrillar protein aggregates. Biochemistry. 49, 6838-6845 (2010).
- CORDIS. . Final Report Summary - LUPAS (Luminescent polymers for in vivo imaging of amyloid signatures). , (2013).
- Hahn, K., et al. Establishing and validating the fluorescent amyloid ligand h-FTAA (heptamer formyl thiophene acetic acid) to identify transthyretin amyloid deposits in carpal tunnel syndrome. Amyloid. , 1-9 (2017).
- Johansson, L. B., et al. An azide functionalized oligothiophene ligand--a versatile tool for multimodal detection of disease associated protein aggregates. Biosens Bioelectron. 63, 204-211 (2015).
- Nordeman, P., et al. (11)C and (18)F Radiolabeling of Tetra- and Pentathiophenes as PET-Ligands for Amyloid Protein Aggregates. ACS Med Chem Lett. 7, 368-373 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved