Method Article
エレクトロマップを用いた光マッピングデータのハイスループット解析
要約
このプロトコルでは、心臓光学マッピングデータを分析するためのMATLABベースのオープンソースソフトウェアプラットフォームであるElectroMapのセットアップと使用について説明します。ElectroMapは、心臓実験モデルの広い範囲にわたって光学マッピング電圧とカルシウムデータセットの分析のための汎用性の高いスループットツールを提供します。
要約
光学マッピングは、多細胞製剤における心臓電気生理学の高い時時間分解能研究のための確立された技術である。ここでは、光学マッピングによって取得された高解像度電圧およびカルシウムデータセットの解析、定量化、マッピングのためのElectroMapの使用をステップバイステップガイドで紹介します。ElectroMap解析オプションは、主要な電気生理学的パラメータの多種多様をカバーし、グラフィカルユーザーインターフェイスは、前処理とパラメータ定義の簡単な変更を可能にし、ElectroMapを幅広い範囲に適用可能にします。実験モデル。組み込みのペーシング周波数検出と信号セグメンテーションにより、実験記録全体のハイスループット解析、急性応答、単一ビート対ビート変動性を示します。さらに、ElectroMap には、ノイズの多いデータセットの信号品質を向上させるために自動マルチビート平均化が組み込まれ、この機能が単一のデータセットを使用する際に検出されない可能性のある電気生理学的変化を解明する方法を示します。ビート分析。カスタムモジュールは、ここで示すように、伝導、単一ファイル分析、および代替の詳細な調査のためにソフトウェア内に含まれています。このソフトウェアプラットフォームは、複雑な心臓電気生理学の処理、解析、マッピングを可能にし、加速するために使用することができます。
概要
光学マッピングは、電圧および/またはカルシウム濃度の蛍光レポーターを利用して、従来のものよりも大きな空間分解能で心臓電気生理学(EP)およびカルシウム処理を多細胞製剤で調製します。テクニック1,2,3.したがって、光学マッピングは、心臓3、4、5における生理的および病因的電気的挙動に関する重要な洞察を提供する、重要かつますます利用される技術として出現した。,6,7,8.光学マッピング実験から得られたデータの効果的な処理と分析は、いくつかの要因によって複雑です。光マッピングデータセットの高い時空間分解能の性質は、数千の画像フレームで構成される生のビデオファイルで、それぞれが多数の個々のピクセルで構成され、高スループットと自動化を必要とする大きなデータファイルを生み出します。処理9.画素サイズが小さく、色素の負荷が悪く、蛍光の小さな小さな変化が、信号対雑音比(SNR)の低い光信号をもたらし、効果的な解析が達成可能である前処理を必要とする10。処理および分析は、光を利用して活性化を開始する光遺伝学的ペーシングプロトコルを使用することによってさらに複雑になり、蛍光センサ11、12からの記録された信号を歪める可能性がある。さらに、データが処理されると、いくつかの一貫性のない技術と定義を適用して目的のパラメータを測定することができ、最も適用可能な技術は実験のセットアップ、モデルおよび質問2によって異なる。 10、13.これらの制限は、技術のさらなる取り込みを妨げ、真に客観的な分析を妨げます。
これらの制限を克服するために、いくつかの研究グループは、実験モデル、質問、ハードウェア7、14、15、16に合わせたカスタム処理パイプラインを設計しました。その他は、基礎となるアルゴリズムが4、17にアクセスするのが難しいかもしれない商用プロプライエタリなソフトウェアを使用しています。その結果、光マッピングデータの処理と分析のために、自由に利用可能なオープンソースソフトウェアプラットフォームが明らかに必要です。このソフトウェアは、オープンソース、使いやすく、柔軟なパラメータ調整、明確なEP特性を持つ実験モデルの範囲に適用可能であり、心臓の範囲の簡単で調整可能な定量化を可能にすることが重要です。光学マッピングを使用して研究できるパラメータ。
我々は最近、心臓光学マッピングデータセット13の高い、半自動化された処理、分析およびマッピングのための包括的なソフトウェアプラットフォームElectroMapを公開し、リリースしました。ここでは、ElectroMap の利用に関するビデオ マニュアルを紹介し、複数の光マッピング データセットの処理、解析、およびマッピングに使用する方法を示します。私たちは、標準的なEPおよびカルシウム処理変数を定量化し、スタンドアロンの伝導速度、単一ファイル解析およびオルタナナンモジュールの使用を実証するためにElectroMapの使用に焦点を当てています。
プロトコル
1. 光マッピングデータ収集
- 無傷で孤立した全心臓6、18、隔離されたアトリア14、19、心室ウェッジ20、心臓スライスを含む実験モデルの広い範囲のいずれかを使用して心臓光学マッピングを実行します21歳,22、および細胞単層23.これらの調製物から生の光学マッピングデータを収集するための実験計画に関する関連資料を参照してください。取得したデータを tiff スタックに変換したり、 に保存したりできる場合。MATファイルは、エレクトロマップを使用して分析可能である必要があります。これには、さまざまな寸法 (正方形/長方形) と解像度 (現在テストされている最大 2048 ピクセル x 2048 ピクセル) のデータが含まれます。
2. ソフトウェアのインストールと起動
注: ElectroMap をインストールして実行する方法の詳細は、ソース (.m) コードから MATLAB で実行されるか、スタンドアロンの実行可能ファイル (windows 用の.exe) として実行されます。最終的なソフトウェアとその機能は、2 つのセットアップ オプションの間で不変です (ディレクトリ ナビゲーションのいくつかの違いを除く)。したがって、インストールするバージョンを選択する際の主な考慮事項は、MATLAB および必要なツールボックスへのアクセスと、ソース コードへのアクセスが必要かどうかです。可能な場合は、MATLAB バージョンを使用して、起動時間の短縮、処理時間の短縮、エラー報告の容易化を行うことをお勧めします。
-
セットアップ 1: MATLAB 内でのエレクトロマップの実行
- MATLAB をインストールします。エレクトロマップはMATLAB 2017aで設計されましたが、ソフトウェアはMATLABのすべての以降のリリースで使用するためにテストされています(執筆時点では2018bまで)。画像処理、信号処理、統計と機械学習、カーブフィッティングのツールボックスが必要です。
- GitHub リポジトリ (https://github.com/CXO531/ElectroMap) から ElectroMap の最新の 「ソース コード」リリースからすべてのファイルをダウンロード/クローンします。ダウンロードしたコンテンツを目的の場所に解凍します。
- MATLAB を開き、ElectroMap ソース コードをホストするフォルダの場所に移動します。次に、ファイルElectroMap.mを開き、エディターで実行を押すか、コマンド ウィンドウにElectroMapと入力してRETURNを押します。これにより、ElectroMap ユーザー インターフェイス 、図 1Aが起動します。
-
セットアップ 2: スタンドアロン .exe ファイル
- インストーラ ファイルをダウンロード: https://drive.google.com/open?id=1nJyI07w9WIt5zWcit0aEyIbtg31tANxI。
- インストーラの指示に従って、ElectroMap ソフトウェアと共に Web から MATLAB ランタイムをダウンロードする必要があります。
- エレクトロマップ.exeを実行します。
注: スタンドアロン バージョンの起動時間は数分です。
3. 画像の読み込みと前処理
- [フォルダを選択]を押し、分析するデータ ファイルの場所に移動します。これにより、左側のリストボックスに、そのディレクトリ内のすべてのファイルが正しいファイルタイプ (.tif または .マット)。.MAT ファイルには、イメージ スタック変数のみを含める必要があります。
注: ディレクトリ セレクタ内を移動すると、フォルダのみが表示され、個々のファイルは表示されません。 - インターフェイス内から読み込むファイルを選択し、[イメージの読み込み]を押します。
- 読み込まれると、最初のフレームが表示され、赤いアウトラインはイメージの自動しきい値を示します。必要に応じて、[ROIの保存/ロード]を選択して、以前に使用した ROI を再読み込みします。この場合、手順 3.3 をスキップします。
- 既定では、しきい値は最初のフレームのピクセル強度に基づいています。必要に応じて、[しきい値のイメージ] ドロップダウン メニューのオプションを変更して、信号時間コースの振幅に基づくしきい値に変更します。しきい値を選択すると、イメージ スタック全体に適用されます。
- 必要に応じて、しきい値オプションを手動に変更し、スライダをアクティブにしてイメージしきい値を手動で調整します。さらに、画像のトリミング (トリミングイメージ)や、しきい値オプションの下に適切なチェックボックス(es)を選択して分析のために目的のカスタム領域(カスタムROI)を描画します。領域の数など、対象領域選択の高度なオプションは、上部メニューのROI 選択から使用できます。
- 適切なしきい値が適用されたら、[プロセスイメージ] を押して処理を適用します。処理の設定については、以下に詳しく説明します (手順 3.4.1-3.4.5)。この時点で、正しいカメラ設定が入力されていることを確認します。これらは、μm のピクセル サイズ(重要: これはイメージ ピクセル サイズであり、イメージング デバイスのチップまたは同等のハードウェアを構成するピクセルのサイズではありません) とフレームレート(kHz 単位)です。
- 信号反転の場合は、[データの反転] チェックボックスをオンにして有効にします。報告された蛍光シグナルが目的のパラメータに反比例している場合(一般的に使用されるポテンショメトリック染料と同様に)信号を反転させることができる。
- 空間フィルタリングの場合は、カーネルメニューからガウスまたは平均を選択します。空間平均領域のサイズは、カーネルドロップダウンメニューに隣接するサイズ入力によって制御されます(つまり、3ピクセルx3ピクセルフィルタカーネルが表示されます)。ガウスフィルタを適用する場合、シグマ入力から標準偏差を設定することもできます。
- ベースライン補正の場合は、[ベースライン] メニューから[トップハット24]または[4度または 11度]補正25を選択します。補正は、各ピクセルに個別に適用することも(処理時間が長い)、または画像全体の平均として適用できます(ただし、同種のベースライン変更を想定しています)。トップハットの補正は、ベースライン選択ドロップダウンメニューに隣接する[トップ-ハットの長さ]をミリ秒単位で設定することで変更することもできます。Top-Hat カーネルの長さは、個々のアクションポテンシャル/カルシウム過渡のタイムスケールよりも大きくする必要があります。
- 時間フィルタリングの場合は、[フィルタリング]メニューから[サビツキー-ゴール]または「無限インパルス(IIR)フィルタリング」を選択します。
注:左下に現れる組織平均信号を除き、アンサンブル平均画像範囲からのパラメータ定量時に各ピクセルに個別に時間フィルタリングが適用されます。これは、ファイル全体ではなく、必要に応じてデータの小さなセクションをフィルタリングすることで、処理時間を短縮するために実装されています。 - フレームの削除では、[フレームの削除]オプションを選択すると、振幅が対象信号より大きい大きなピークをイメージ セットから削除できます。これは、チャネロドプシン211、12などのオプシンの光活性化によって脱分極が開始される光遺伝学的ペーシングなどの光学的ペースのデータセットに有用でありうる。
注: フレームの削除によって画像信号に生理的なステップの変更が生じる可能性があるため、時間フィルタリングによってデータにアーティファクトが導入される可能性があるため、ここではお勧めしません。
- [セグメンテーション]オプションのオプションに従ってプロセスイメージが選択されると、シグナルはセグメント化されますが、データセット全体を再処理することなく迅速に変更できます(セクション4参照)。
4. データセグメンテーションとアンサンブル平均化
注:ファイルが処理されると、組織平均信号(右下トレース、図1A)のピークが検出され、赤い円でラベル付けされます。設定されたしきい値を超えるピーク (ピークしきい値によって設定されたトレース上の青い線) のみがカウントされます。さらに、ピークは、[ピーク距離]入力で設定された前のピークと比較して十分に遅延している場合にのみカウントされます。その後、検出されたピークに基づいて信号がセグメント化されます。まず、各ピークの有効サイクル長(CL)は、次のピークとの間の時間を測定することによって算出される。ピーク数 (最小ピーク数入力数で設定) に類似した CL (最小境界入力によって設定されるしきい値) がある場合は、グループ化され、それらのピークの平均 CL が計算されます。
- データをさらにセグメンテーションするには、[セグメント信号]を押します。サブセグメンテーション オプションは次のとおりです:なし– 同じ CL を持つすべてのピークがグループ化されます。[すべて]一定の CL 時間内の nピークのセグメント (nピークはセグメント サイズ入力によって設定されます) が識別されます。最後– CL 変更の前の最終 n ピークが識別され、グループ化され、他のすべてのピークは分析されません。およびシングル ビート– これは nピーク= 1 のAllセグメンテーションを適用することと同じで、グループ化またはアンサンブル平均化は適用されません (4.5 を参照)。これは、シングルビートボタンを選択して適用することができます。
- 対象の時間を拡大し、セグメント信号を選択することにより、信号のカスタムセグメンテーションを適用します。これにより、選択した時間ポイントに対応する[セクション]ボックスに「[セクションをズーム]」という追加オプションが追加されます。
- セグメンテーションの結果は、組織平均信号に隣接するリストボックスに表示され、セクション番号と推定CLが表示されます。セグメント化されたすべての時間セクションは、異なる色で示されます。リスト ボックスからセグメントを選択すると、そのセクションが赤で強調表示されます。また、[マップの作成] ボタンが選択されているかのように、このセクションの解析が自動的にトリガーされます (セクション 5 を参照)。
- グループ化されたピークの分析は、「アンサンブル平均」データに対して実行されます。これにはセグメント内のピークを一緒に平均化し、参照時間はステップ 4.2 で識別されたピークになります。入力の前後を変更し、セグメント信号を押すことで、時間枠を平均に更新します。
5. 作用電位/カルシウム過渡時間および伝導速度分析
- 画像が処理されると、[マップの作成] ボタンがアクティブになります。[マップを生成]を押して、アクションの潜在的な持続時間(APD)、アクティブ化時間、伝導速度、SNR 解析を適用します。デフォルトでは、解析は最初の信号セグメントに適用されます。リスト ボックスから他のセグメントを選択すると、選択したセグメントに解析が適用されます。
注:分析結果は、平均、標準偏差、標準誤差、分散、5~95パーセンタイル分析を含む結果テーブルに表示されます。デュレーションマップは「APD」マップと呼ばれますが、同じ設定で処理されたカルシウム信号はカルシウム過渡時間を測定します。 - [ピクセル情報を取得] を選択すると、画像内の任意のピクセルからの信号の詳細な表示が表示され、[ピクセルを比較] を選択して、最大 6 つの場所からの信号を同時にプロットします。
- 信号処理パネルを使用して、期間解析の設定を調整します。これらは次のとおりです:持続時間– ピークから測定するパーセンテージ再偏光/減衰の時間;'APD' ベースライン– 振幅測定の基準ベースラインとして定義されている信号の期間。と'APD' 開始時刻– 継続時間の測定の開始時刻。これらは、アイソクロナルマップ(以下で説明)の活性化時間を決定するための同じオプションであり、呼び出されます:スタート(d2F/dt2max)、アップストローク(dF/dt max)、脱極性中間点(振幅の50%の時間)、ピーク(最大振幅の時間)。マウスおよびモルモットのアクションポテンシャルに適用されるこれらの定義を図 2Aに示します。
注: これらのオプションのいずれかを変更すると、期間マップと結果テーブルが自動的に更新されます。マップ縮尺と外れ値の削除オプションも使用できます。
- 信号処理パネルを使用して、期間解析の設定を調整します。これらは次のとおりです:持続時間– ピークから測定するパーセンテージ再偏光/減衰の時間;'APD' ベースライン– 振幅測定の基準ベースラインとして定義されている信号の期間。と'APD' 開始時刻– 継続時間の測定の開始時刻。これらは、アイソクロナルマップ(以下で説明)の活性化時間を決定するための同じオプションであり、呼び出されます:スタート(d2F/dt2max)、アップストローク(dF/dt max)、脱極性中間点(振幅の50%の時間)、ピーク(最大振幅の時間)。マウスおよびモルモットのアクションポテンシャルに適用されるこれらの定義を図 2Aに示します。
- 伝導速度は、メインソフトウェアインターフェイス内でも自動的に測定されます。これは、選択された活性化尺度によって定義されたアイソクロナルマップからBayly et al26のマルチベクトル法を用いて達成される(ステップ5.4で説明)。アクティベーションポイントを押して、アクティベーションマップの3D表現をレンダリングします。
- マルチベクトル伝導速度測定法は、アイソクロナルマップをn x nピクセルの領域に空間的にセグメント化します。ローカル ウィンドウ サイズ入力を使用してnの値を設定し、[フィッティング アクティベーション時間入力] を使用して分析を適用するアクティブ化時間の範囲を設定します。
注: 各ローカル領域に対して、多項式サーフェスfは、活性化時間と空間位置 (x ,y)との関係を最もよく表す適合値です。このサーフェスのグラデーション ベクトルCVローカルは、次のように計算されます。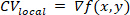 (1)
(1)
ここで、2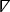 次元デカルト空間差演算子26を示す。
次元デカルト空間差演算子26を示す。 - アイソクロナル マップ内の各ピクセルについて、速度と伝導方向を表すローカル ベクトルが計算されます。この解析を表示するには、表示ドロップダウン メニューからベクトルを含むアイソクロナル マップを選択します。
- SNRは、ベースラインにおける信号の標準偏差と比較した最大振幅の比率として計算されます。この分析は、すべての処理ステップの後に実行されます。トップメニューのSNR計算を押して、ベースラインとして定義された信号の期間の設定を編集します。
6. 伝導解析モジュール
- 伝導速度のより詳細な分析にアクセスするには、伝導を押します。これにより、メインインターフェイス、単一ベクトル法、およびアクティベーション曲線のように、Baylyマルチベクトル法を使用して伝導を定量できる別のモジュールが開きます。
- 単一ベクトルを押すと、単一ベクトル法を使用して伝導が解析され、CVは2点間の活性化時間の遅延から計算されます。これは、単一ベクトルボタンの下で選択可能な自動または手動の方法を使用して行うことができます。
- 自動単一ベクトル法の場合は、伝導を測定する距離と開始点を選択します。ソフトウェアは、選択したポイントから360度のスイープを実行し、時間遅延を測定し、1度ずつすべての方向に沿って関連する伝導速度を計算します。この解析の結果は、マップに隣接するグラフに表示され、最も遅い伝導の方向は赤で表示されます。
- 手動単一ベクトル法の場合は、アイソクロナル マップから始点と終点の両方を選択して、伝導速度を計算します。新しい開始点を選択するには、[開始点をクリア]を押します。
- ローカルベクトルを押してマルチベクトル方式を適用し、メインインターフェイスの設定と一致します。伝導モジュール内では、伝導速度の分布、計算されたベクトルの角度分布、および伝導速度の角度依存性を表示することができます。
- 活性化曲線を押して、時間の関数として活性化された組織のパーセンテージをプロットします。100% までのアクティブ化までの時間が自動的に表示され、最小値 (青) と最大 (赤) のアクティブ化率のカスタム値も選択できます。
7. その他の分析とモジュール
- 自動的に実行される持続時間と伝導速度の解析とは別に、ElectroMap を使用して他のいくつかのパラメータを定量化できます。これらの解析は、表示マップの上のドロップダウン メニューから選択できます。分析を実行するには、これらのオプションのいずれかを選択すると、結果は結果テーブルの 4行目に表示されます: 1)拡張期間隔– 次のアクションポテンシャルの活性化時間に 90% の再分極までの時間。2)ドミナント周波数– 各ピクセルの周波数スペクトルは、高速フーリエ変換を使用して計算され、最も電力を持つ周波数が支配的な周波数として定義されます。主要な周波数解析のための高度な範囲とウィンドウの設定は、周波数マッピングを選択して使用できます。3)ピークまでの時間– 2 人のユーザーが選択したパーセンテージ間の立ち上がり時間 (既定値は 10 ~ 90%)作用電位またはカルシウムの放出の脱分極段階の。パーセンテージの値は、TTP設定を選択して変更することができます。そして4)リラクゼーション定数(τ) – リラクゼーション定数は、フォームの単一指数減衰を合わせて計算されます。
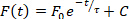 (2)
(2)
ここで、時間tの蛍光レベルは、ピーク蛍光、F0、およびその後の減衰(Cは定数である)27に依存する。 方程式 2 に適合する値は、メインの ElectroMap ユーザー インターフェイス内で選択可能であり、r2値に基づく適合除外基準の良好性も選択できます。 - シングルファイル分析を押して、ファイル内の各セグメントのハイスループット期間と伝導分析のための専用モジュールを開きます。解析は、画像全体(持続時間、伝導時間、活性化時間)または選択した地域または対象ポイント(現在の期間のみ)で実行できます。結果は .csv ファイルに出力されます。
注: イメージ全体の APD 値の場合、.csv ファイルの最初の列は平均で、2 番目の列は標準偏差です。 - Alternansを押して、ビート間変動の専用分析とマッピング用のスタンドアロン モジュールを開始します。オルタナティブ処理および分析オプションの詳細については、O'Shea et al. 201913を参照してください。具体的には、このモジュールは、オルタナティブと呼ばれる2つの周期振動を識別するように設計されています。継続時間と振幅の両方が計算され、出力されます。
注: デュレーションオルタナナンは、あるピークから次のピークまでの持続時間測定を比較することによって測定されます。すなわち、ピーク1と2とAPD1とAPD2がそれぞれある場合、持続時間はオルタナティブナン(ΔAPD)として計算されます。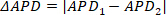 (3)
(3)
継続時間の測定は、メインインターフェイスの設定を使用して実行されます。一方、振幅オルタナナンは、絶対変化として多細胞製剤間で定量化およびマッピングすることができます(0% = 1つのビートと次のビートの間の同じ振幅のパーセンテージとして定義されます)。さらに、カルシウム負荷などの現象の影響は、以前に報告されているように、負荷と放出のオルタナンを測定および比較することによってさらに調べることができる28。Lが大きなビートのピーク振幅(つまり、振幅が前のビートよりも大きい場合)、S 小さなビートの振幅、および D 小さなビートの拡張荷重として定義されている場合、リリースオルタナナン (
D 小さなビートの拡張荷重として定義されている場合、リリースオルタナナン (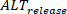 ) は次のように定義されます。
) は次のように定義されます。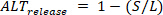 (4)
(4)
逆に、ロード オルタナナン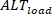 ( ) は次のように定義されます。
( ) は次のように定義されます。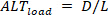 (5)
(5)
オルタナナンの測定は組織全体で行うことができ、分析の結果はモジュールの右下に表示される。モジュールを最初に使用すると、実験ファイル全体で解析が実行され、表示される結果はファイル全体の平均ビート差です。ただし、[ズームを保持]を選択解除し、特定の期間を拡大表示し、[ズームされたセクションを分析]を選択すると、ファイル内の特定の時間に分析を制限できます。これにより、選択した期間の分析が表示される結果パネルが更新されます。- オルタナティブ分析のビートツービートビデオを表示するには、再生を選択します。また、[平均マップの作成]を選択すると、この機能を使用する場合にポップアップ メニューで設定されている選択時点から平均されたオルタナティブ動作のマップが書き出されます。
- フェーズ マップを押して、フェーズ マッピング モジュールを開始します。ヒルバート変換は、各タイムポイントで信号の瞬間位相(-πと+πの間)を計算するために実行されます。再生またはドラッグ スライダを押して、時間の経過に伴う位相の動作を視覚化し、ピクセルをクリックして位相図をレンダリングします。
8. データのエクスポート
- データは、さまざまな形式で ElectroMap からエクスポートされます。[エクスポート値]を押して、現在表示されているマップの値をメインの使用インターフェイスに保存します。測定値は、マップ (ピクセルの位置を保持する) として保存することも、単一のリストに凝縮して保存することも、.csv、.txt または として保存することもできます。MAT ファイル。
- [マップをエクスポート] を押すと、現在表示されているマップを含むポップアップが表示され、さまざまな画像形式で保存できます。マップの表示オプションは、[マップ設定]を選択して制御されますが、[マップのエクスポート] を選択すると編集することもできます。たとえば、トップメニューからこのアイコンを選択してカラーバーを追加し、[編集>カラーマップ]を選択してスケールを設定できます。
- アクティベーションビデオを押すと、アクティブ化シーケンスのアニメーションがレンダリングされ、アニメーションの .gif ファイルとして保存できます。
- セグメントビデオを押して、識別された各セグメントの現在表示されているパラメータの.aviビデオファイルを保存します。
結果
この研究の一環として行われたすべての作業は、科学的目的のために使用される動物の保護に関する英国動物法(科学的手続き)法1986および指令2010/63/EUによって定められている倫理的ガイドラインに従って行われました。実験は、ホームオフィス(マウス:PPL 30/2967およびPFDAAF77F、モルモット:PPL PF75E5F7F)とバーミンガム大学(マウス)とキングスカレッジロンドン(モルモット)の機関レビューボードによって承認されました。ここで分析された生データの収集の詳細な方法は、以前の出版物5、6、14、19で見つけることができます。
ElectroMap を制御するメイン インターフェイスを図1Aに示します。データセットを分析するために必要な手順は、主に[イメージの読み込み]、[プロセスイメージ]、および[マップの作成] ボタンによって制御され、図 1Aではそれぞれ緑、青、赤で強調表示されています。図 1B-Dは、これらの各ボタンの選択時に発生する操作を示しています。ロード イメージは、ユーザーが選択したイメージしきい値オプション (図 1B)を適用し、プロセス イメージ(図 1C)はフィルタリングとベースライン補正を適用します。最後に、マップを作成すると、まず時間枠とセグメンテーションの設定に従ってデータを平均化し(単一のビートセグメンテーションを選択しない限り)、上述の解析を実行します。
ElectroMap の重要な側面は、カメラの種類と実験モデルに関する柔軟性です。これは、広く使用されているモデル間に存在する明確な心臓EPと解剖学的特性のために光学マッピングソフトウェアの有用性のために重要です。図2Aは、例えばモルモット心室と比較した場合のマウス心房の作用電位形態を示し、以前に報告した6,14として電圧感受性染料を用いて記録した。アクションポテンシャルの明確な形状と、異なるフレームレートとピクセルサイズを持つ2つの別々の光学マッピングカメラを使用しているにもかかわらず、ElectroMapを使用して両方のデータセットを正常に分析することができます。ただし、これにはユーザー インターフェイス内の一部のパラメーターを変更する必要があります (図 2B)。長引くモルモットアクションの可能性は、より大きな時間枠を必要とすることを注意してください。さらに、トップハットベースライン補正が光学的に記録された信号を生理学的に変更するのを防ぐために、その時間長は、それが作用電位の時間経過よりも大きくなるように増加する必要があります。
ElectroMapは、EPパラメータを効果的に回復するために必要とされるかもしれない光学的に記録された信号のSNRを改善するのに役立つ多数の処理オプションを提供しています。たとえば、データ セグメンテーションに続くピークの自動アンサンブル平均です。図3A-Cは、アンサンブル平均の適用が、他の方法の代わりに、孤立したマウス左アトリア(n=13)からSNRを改善する方法を示す。これにより、測定の不均一性と解析失敗の可能性が減少します (図 3D)。例えば、3 Hz から 10 Hz へのペーシング周波数の変更は APD50を変更しませんでしたが、アンサンブル平均化が行われていない場合、10 Hz ペーシングで APD50の予想29の減少が観測されました(図3E)。
図 4は、ElectroMap が提供する自動ペーシング周波数検出およびセグメンテーションの有効性と有用性を示しています。ここでは、マウス左のアトリア(n=5)を120ミリ秒のサイクル長でペースアップし、サイクル長は50ミリ秒に達するまで徐々に10ミリ秒短縮した。).これは、すべてのデータセットで高い精度で実現されました (図 4B)。データの自動セグメンテーションにより、ペーシング周波数/サイクル長の短縮に伴う伝導速度の減速の簡単かつ高スループット解析が可能となりました(図4C,D)。同時に、APD50(図4E)および拡張間隔(図4F)が短くなった。光学的に測定されたピークの振幅は減少し、ピークまでの時間は増加しました(図4G,H)。これらは再び心臓組織29、30における期待される返還応答であり、ElectroMapの使用は、薬理学的薬剤の存在下でのペーシング頻度に応答して変化を解明するのに役立ち、遺伝子改変、または病気の状態。
ElectroMap などのソフトウェアを使用する場合の重要な考慮事項は、基になるデータにアーティファクトが存在することです。図5は、例えば、運動アーティファクト(組織運動による光学的に記録された信号の歪み)がElectroMap内の活性化および特に再偏光の正確な測定を妨げることができることを示している。詳細については、「ディスカッション」を参照してください。
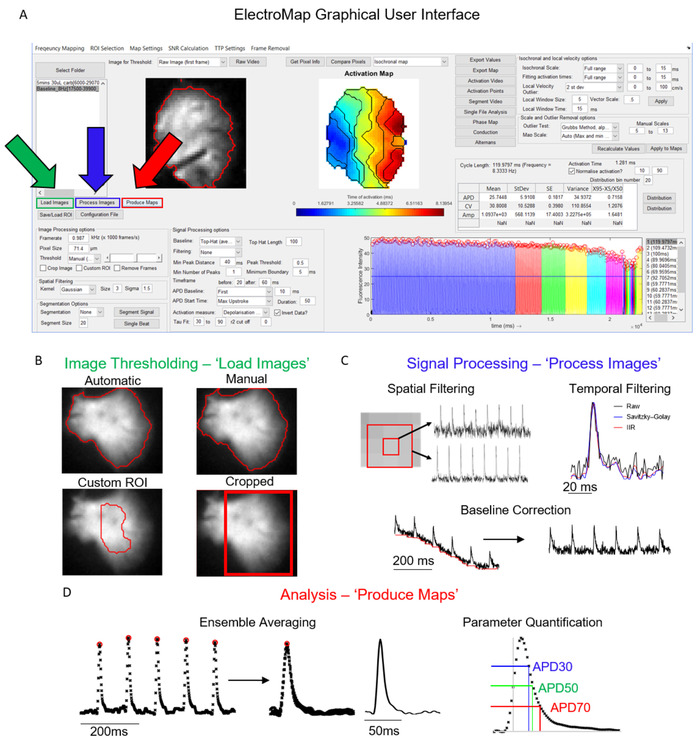
図1:エレクトロマップの主な処理ステップ。(A) エレクトロマップのグラフィカルユーザーインターフェイスで、ロードイメージ(緑)、プロセスイメージ(青)、およびマップの生成(赤)ボタンが強調表示されます。(B)イメージの読み込みオプションの選択に適用できるイメージしきい値オプション。(C) ユーザーが利用できる信号処理オプションには、空間的および時間的なフィルタリングとベースライン補正が含まれており、プロセスイメージを押すことでイメージスタックに適用できます。(D) [マップの作成] を選択してアクティブ化される平均化とパラメータ定量 (APD 測定値を示す) をアンサンブルします。オシェイらから適応フィギュア, 201913.この図のより大きなバージョンを表示するには、ここをクリックしてください。
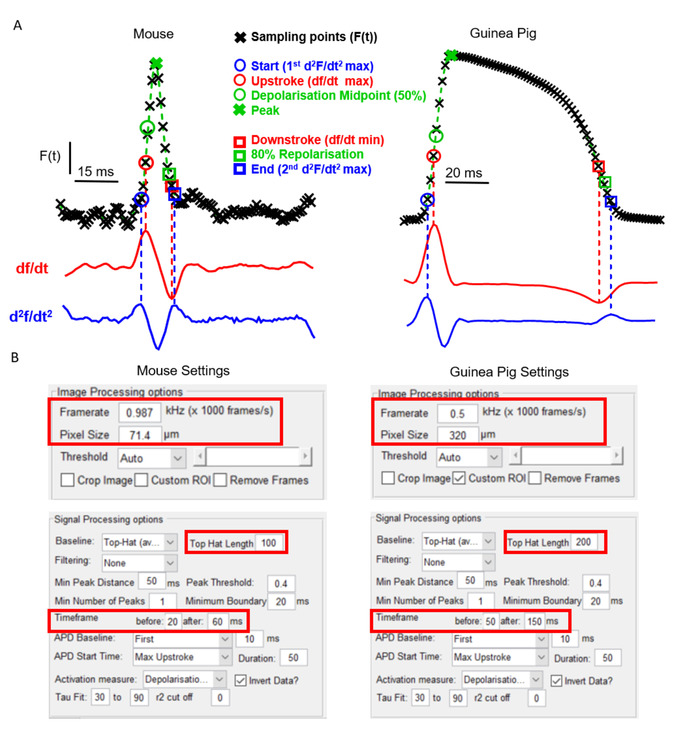
図2:エレクトロマップを用いたマウスとモルモットのデータの解析(A) マウスのアトリアおよびモルモットの心室から光学的に記録された作用電位と、これらの信号の最初の(df/dt)と第2(d2 f/dt2)の両方を導出する。ElectroMap 内で使用できる活性化および再分極時間のさまざまな定義が強調表示されます。(B) ElectroMaps インターフェイスで使用される画像と信号処理設定のスクリーンショット。赤いボックスは、マウスとモルモットデータの分析の間に変更が必要な設定を強調表示します。オシェイらから適応フィギュア, 201913.この図のより大きなバージョンを表示するには、ここをクリックしてください。
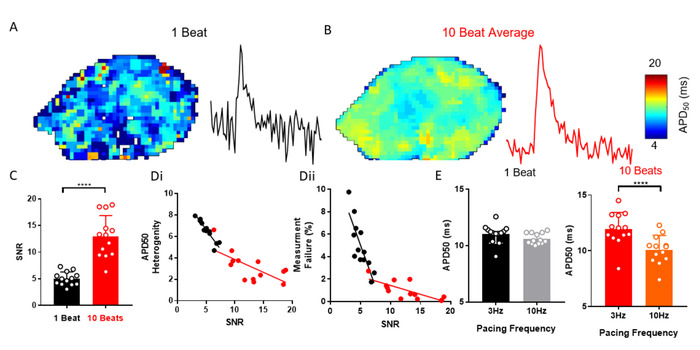
図 3: APD の変更を解決するための平均化をアンサンブルします。(A) APD50マップと例の単一ピクセル信号は、単一ビート光学作用電位から。(B)APD50マップと例えば、10連続ビート(ピーク法)のアンサンブル平均によって生成された光学作用電位からの単一画素信号。(C) 10ビート平均信号と比較して単一ビートのSNR。(D) APD50不均一性(i)および測定失敗数(ii)は、単一ビートおよび10ビート平均APD50マップのSNRの関数として。(E) APD50で 3 および 10 Hz のペーシング周波数を、単一のビートと 10 ビート マップから測定します。(平均±標準誤差、n = 13左アトリア、****p<0.001、学生のペアt-testによるデータ)。 この図のより大きなバージョンを表示するには、ここをクリックしてください。
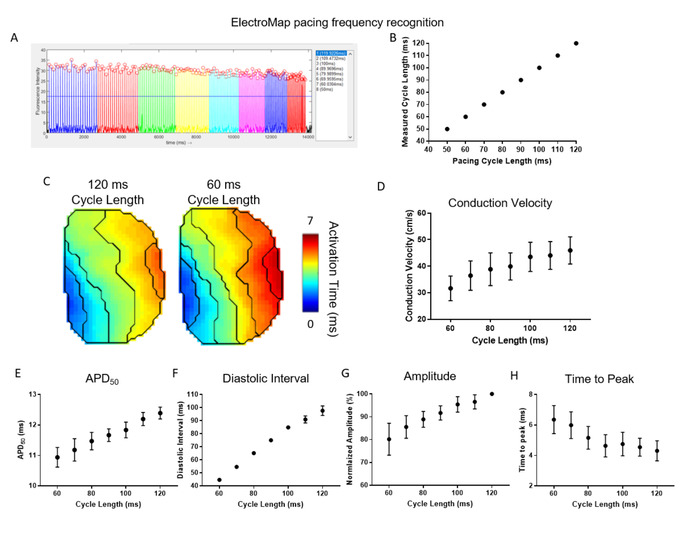
図4:心臓組織におけるペーシング周波数応答を研究するためにElectroMapを使用する。(A) ペーシング周波数認識とセグメンテーションのエレクトロマップスクリーンショットの例。(B) 既知とエレクトロマップの比較は、ペーシングサイクルの長さを測定した。(C) アクティベーションは、120 ミリ秒と 60 ミリ秒のペーシング サイクルの長さでマップされます。(D-H)伝導速度(D)、APD50(E)、拡張間隔(F)、振幅(G)、ピークまでの時間(H)を10ミリ秒単位で120msから60ミリ秒に減少させるペーシングサイクルの関数としてグループ化した。 (平均±標準誤差、n = 5左アトリアとして示されるデータ)この図のより大きなバージョンを表示するには、ここをクリックしてください。
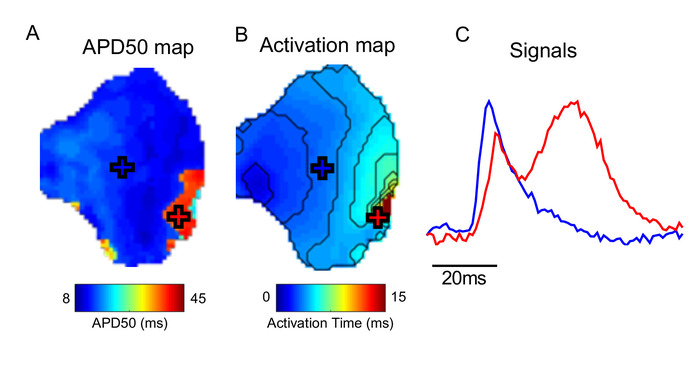
図 5: モーション アーティファクトの効果。(A) APD50マップ。(B) アクティベーションマップ。(C) APD およびアクティベーション マップでマークされた(十字)とマークされた場所からの信号の例。赤十字でマークされた組織の領域では、収縮が正常に結合解除されておらず、測定された光信号を歪める。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここでは、心臓光学マッピングデータセットの柔軟かつ多可変数解析のためのオープンソースソフトウェアElectroMapの利用に関するステップバイステップガイドを紹介します。エレクトロマップを正常に使用するには、イメージングデータが .tif または .MAT 形式。ElectroMap には、いくつかの変更可能なユーザー設定が組み込まれています。図2Aで示すように、これは実験モデルとイメージングハードウェアの間に存在する広い不均一性のために必要である。ただし、ソフトウェア内の既定の設定が常に最適であるとは限らないため、ソフトウェアを使用する上で重要な手順は、ユーザーが特定の実験的なセットアップの設定を調整することです。これには、図 2Bに示すように、カメラの設定とタイムスケールが含まれます。最適な設定が見つかったら、[構成ファイル]を選択して後で保存して再読み込みできます。
自動化されたCL測定および信号セグメンテーションの組み込みは、ソフトウェアの主な利点です。これらの特徴は実験記録の急性応答の分析を可能にし、単一拍動に焦点を合わせから分析を広げる。必要なセグメンテーションが達成されると、シングルファイル分析モジュールは、個々のセグメント(単一ビートを含む)の自動分析を可能にし、記録全体の複数の変数のハイスループット分析を実現し、単一の .csv ファイル。組み合わせて、グループ化されたピークのアンサンブル平均化は、ElectroMap で自動的に実行されるノイズノイズ信号の品質を向上させる効果的な方法です。しかし、アンサンブル平均は、例えばビート対ビート変動の研究において、普遍的に有益ではありません。したがって、ElectroMapは、アンサンブル平均化を避けるために単一のビートセグメンテーションを統合し、SNR(空間および時間フィルタリング)を改善するための代替処理オプションを含み、さらに調査し、マップするためのAlternans解析モジュールが含まれていますビート対ビートの変動。
オプティカル マッピング データセットは、多くの場合、ベースライン ドリフトやモーション アーティファクトなどのアーティファクトを示します。同様に、生成される信号は、小さなピクセルサイズ、短い露光時間および低分画蛍光変化2のために低品質であることができます。これらの要因は、基になる EP 動作の効果的かつ正確な分析を妨げる。前述のとおり、ElectroMap には、これらの問題を克服するためのいくつかの処理戦略があります。しかし、これらのアルゴリズムを根本的に低品質/歪んだデータに適用することは、効果的な分析を妨げるでしょう。したがって、SNR は ElectroMap で測定および表示されるパラメータの 1 つです。同様に、ユーザーは、ピクセル情報と比較モジュールを使用してサンプルからの特定の領域からの信号を選択して比較することができ、図5に示すモーションアーティファクトなどの現象を識別することができ、適切なデータの除外。
現時点では、ElectroMap はベースライン補正と同じ方法で生データからモーション アーティファクトを除去することはできません。したがって、ソフトウェアの将来の開発の可能性は、報告されているように計算方法によるモーションアーティファクト除去を含有する31,32である。さらに、エレクトロマップは現在、1つの光信号の研究に限定されている。しかしながら、レシオメトリック染料と電圧及びカルシウム染料27の同時使用には、2つの波長チャネルの同時処理が必要である。したがって、デュアル信号解析の統合は、ソフトウェアに対する重要な将来の追加です。位相特異点追跡などの不整脈データセットに適用可能な分析オプションの拡張は、ソフトウェア33,34の範囲を均等に広げるだろう。最後に、記載されたいくつかの解析オプションは、電極マッピングデータの分析にも有用である。実際、ElectroMapは対照的な電グラム波形20、35にもかかわらず電極マッピングデータを分析するために使用されており、さらなる最適化は、このモダリティの使用を拡大します。
開示事項
P.K.は、心房細動で活動する複数の薬剤・デバイス企業から研究支援を受け、そのような企業数社から名誉を受けています。L.F.は、EU、BHF、MRC、DFG、ギリアドに対する制度研究助成金を受けています。P.K.およびL.F.は、バーミンガム大学が保有する2つの特許(心房細動療法WO 2015140571、心房細動のためのマーカー2016012783)の発明者として記載されています。
他のすべての著者は、潜在的な利益相反を宣言しません。
謝辞
この研究は、EPSRC学生シップ(博士課程研修L016346のためのSci-Phy-4-ヘルスセンター)からD.P.に資金提供されました。 K.R.とL.F.、ウェルカムトラストシード賞助成金(109604/Z/15/Z)、英国心臓財団助成金(PG/17/55/33087、RG/17/15/33106)をD.P.、欧州連合(交付協定No 633196 [CATCH ME])、英国心臓財団(FS/13/43/30324からP.K.およびL.F.;PG/17/30/32961からP.K.、A.H.へ)、およびレダック財団をP.K.にJ.W.は英国心臓財団(FS/16/35/31952)の支援を受けています。
資料
| Name | Company | Catalog Number | Comments |
| MATLAB and Simulink R2018a | Mathworks, Inc, Natick, MA | MATLAB software |
参考文献
- Efimov, I. R., Nikolski, V. P., Salama, G. Optical Imaging of the Heart. Circulation Research. 94, 21-33 (2004).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110, 609-623 (2012).
- Boukens, B. J., Efimov, I. R. A century of optocardiography. IEEE Reviews in Biomedical Engineering. 7, 115-125 (2014).
- Myles, R. C., Wang, L., Kang, C., Bers, D. M., Ripplinger, C. M. Local β-adrenergic stimulation overcomes source-sink mismatch to generate focal arrhythmia. Circulation Research. 110, 1454-1464 (2012).
- Syeda, F., et al. PITX2 Modulates Atrial Membrane Potential and the Antiarrhythmic Effects of Sodium-Channel Blockers. Journal of the American College of Cardiology. 68, 1881-1894 (2016).
- Winter, J., et al. Sympathetic nervous regulation of cardiac alternans in the intact heart. Frontiers in Physiology. 9, 1-12 (2018).
- Faggioni, M., et al. Suppression of spontaneous ca elevations prevents atrial fibrillation in calsequestrin 2-null hearts. Circulation: Arrhythmia and Electrophysiology. 7, 313-320 (2014).
- Sato, P. Y., et al. Loss of Plakophilin-2 Expression Leads to Decreased Sodium Current and Slower Conduction Velocity in Cultured Cardiac Myocytes. Circulation Research. 105, 523-526 (2009).
- Yu, T. Y., et al. Optical mapping design for murine atrial electrophysiology. Computer Methods in Biomechanics and Biomedical Engineering: Imaging & Visualization. 5, 368-378 (2017).
- Laughner, J. I., Ng, F. S., Sulkin, M. S., Arthur, R. M., Efimov, I. R. Processing and analysis of cardiac optical mapping data obtained with potentiometric dyes. American Journal of Physiology. Heart and Circulatory Physiology. 303, H753-H765 (2012).
- Crocini, C., Ferrantini, C., Pavone, F. S., Sacconi, L. Optogenetics gets to the heart: A guiding light beyond defibrillation. Progress in Biophysics and Molecular Biology. 130, 132-139 (2017).
- Entcheva, E., Bub, G. All-optical control of cardiac excitation: Combined high-resolution optogenetic actuation and optical mapping. The Journal of Physiology. 9, 2503-2510 (2016).
- O’Shea, C., et al. ElectroMap: High-throughput open-source software for analysis and mapping of cardiac electrophysiology. Scientific Reports. 9, 1-13 (2019).
- Yu, T. Y., et al. An automated system using spatial oversampling for optical mapping in murine atria. Development and validation with monophasic and transmembrane action potentials. Progress in Biophysics and Molecular Biology. 115, 340-348 (2014).
- Jaimes, R., et al. Functional response of the isolated, perfused normoxic heart to pyruvate dehydrogenase activation by dichloroacetate and pyruvate. Pflugers Archiv. 468, 131-142 (2016).
- Wang, K., et al. Cardiac tissue slices: preparation, handling, and successful optical mapping. American Journal of Physiology. Heart and Circulatory Physiology. 308, H1112-H1125 (2015).
- Parrish, D. C., et al. Transient denervation of viable myocardium after myocardial infarction does not alter arrhythmia susceptibility. American Journal of Physiology. Heart and Circulatory. , (2017).
- Ihara, K., et al. Electrophysiological Assessment of Murine Atria with High-Resolution Optical Mapping. Journal of Visualized Experiments. (132), e56478 (2018).
- Holmes, A. P., et al. A Regional Reduction in Ito and IKACh in the Murine Posterior Left Atrial Myocardium Is Associated with Action Potential Prolongation and Increased Ectopic Activity. Plos One. 11, e0154077 (2016).
- Lang, D., et al. Arrhythmogenic remodeling of β2 versus β1 adrenergic signaling in the human failing heart. Circulation: Arrhythmia and Electrophysiology. 8, 409-419 (2015).
- Kang, C., et al. Human Organotypic Cultured Cardiac Slices: New Platform For High Throughput Preclinical Human Trials. Scientific Reports. 6, 1-13 (2016).
- Wen, Q., et al. Transverse cardiac slicing and optical imaging for analysis of transmural gradients in membrane potential and Ca2+ transients in murine heart. The Journal of Physiology. 596, 3951-3965 (2018).
- Houston, C., et al. Characterisation of re-entrant circuit (or rotational activity) in vitro using the HL1-6 myocyte cell line. Journal of Molecular and Cellular Cardiology. 119, 155-164 (2018).
- Yu, T. Y., et al. Optical mapping design for murine atrial electrophysiology. Computer Methods in Biomechanics and Biomedical Engineering: Imaging and Visualization. 5, 368-376 (2017).
- Laughner, J. I., Ng, F. S., Sulkin, M. S., Arthur, R. M., Efimov, I. R. Processing and analysis of cardiac optical mapping data obtained with potentiometric dyes. AJP: Heart and Circulatory Physiology. 303, H753-H765 (2012).
- Bayly, P. V., et al. Estimation of Conduction Velocity Vector Fields from Epicardial Mapping Data. IEEE Transactions on Bio-Medical Engineering. 45, 563-571 (1998).
- Jaimes, R., et al. A technical review of optical mapping of intracellular calcium within myocardial tissue. American Journal of Physiology. Heart and Circulatory Physiology. 310, H1388-H1401 (2016).
- Wang, L., et al. Optical mapping of sarcoplasmic reticulum Ca2+ in the intact heart: Ryanodine receptor refractoriness during alternans and fibrillation. Circulation Research. 114, 1410-1421 (2014).
- Winter, J., Shattock, M. J. Geometrical considerations in cardiac electrophysiology and arrhythmogenesis. Europace. , (2016).
- Mironov, S., Jalife, J., Tolkacheva, E. G. Role of conduction velocity restitution and short-term memory in the development of action potential duration alternans in isolated rabbit hearts. Circulation. 118, 17-25 (2008).
- Khwaounjoo, P., et al. Image-Based Motion Correction for Optical Mapping of Cardiac Electrical Activity. Annals of Biomedical Engineering. 43, 1235-1246 (2014).
- Christoph, J., Luther, S. Marker-Free Tracking for Motion Artifact Compensation and Deformation Measurements in Optical Mapping Videos of Contracting Hearts. Frontiers in Physiology. 9, (2018).
- Umapathy, K., et al. Phase Mapping of Cardiac Fibrillation. Circulation: Arrhythmia and Electrophysiology. 3, 105-114 (2010).
- Tomii, N., et al. Detection Algorithm of Phase Singularity Using Phase Variance Analysis for Epicardial Optical Mapping Data. IEEE Transactions on Biomedical Engineering. 63, 1795-1803 (2016).
- Cantwell, C. D., et al. Techniques for automated local activation time annotation and conduction velocity estimation in cardiac mapping. Computers in Biology and Medicine. 65, (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved