Method Article
インフルエンザ抗原マイクロアレイを用いたウイルスサブタイプにわたる血清抗体の幅を測定
要約
我々は、異なるウイルス株から250以上の抗原に対して複数の抗体アイソタイプの血清を同時にプローブするために、ニトロセルロースコーティングされたスライドにインフルエンザ抗原を印刷することによって構築されたタンパク質マイクロアレイを使用するためのプロトコルを提示し、したがって、ウイルスサブタイプ間の血清抗体の幅の測定を可能にする。
要約
インフルエンザウイルスは、現在利用可能なワクチンの有効性が限られているため、世界的に死亡率の重要な原因のままです。ユニバーサルインフルエンザワクチンの開発における重要な課題は、抗原ドリフトに起因する高い抗原多様性です。この課題を克服するには、異なる抗原サブタイプにまたがる多くのウイルス株に対して向けられた血清抗体の幅を測定するための新しい研究ツールが必要です。ここでは、インフルエンザ抗原のタンパク質マイクロアレイを用いて多様なインフルエンザウイルス株に対する血清抗体の幅を解析するためのプロトコルを提示する。
このインフルエンザ抗原マイクロアレイは、精製ヘマグルチニンおよびノイラミニダーゼ抗原をマイクロアレイプリンタを用いてニトロセルロース被覆膜上に印刷することによって構築される。ヒトのセラは、インフルエンザ抗原に対する抗体を結合するためにマイクロアレイ上でインキュベートされる。量子ドット共役二次抗体は、マイクロアレイ上の各抗原に結合するIgGおよびIgA抗体を同時に検出するために使用される。定量抗体結合は、携帯用イメージャーを用いて蛍光強度として測定される。代表的な結果は、ヒトのセラにおけるサブタイプ特異的および交差反応性インフルエンザ抗体の測定におけるアッセイ再現性を実証することが示されている。
ELISAのような従来の方法と比較して、インフルエンザ抗原マイクロアレイは、短い時間枠で数百の抗原に対して複数の抗体アイソタイプに対して数百のセラをテストすることができる高スループット多重アプローチを提供し、血清監視およびワクチン開発の応用。制限は、結合抗体と中和抗体を区別できないことです。
概要
インフルエンザウイルスは、毎年世界の死亡者の1%を含む死亡または障害によって年間2000万人の生命の損失を引き起し、熱帯地方および発展途上国の高齢者と人口に不均衡な影響を与える。 2,3.季節的な流行の病気の負担に加えて、遺伝的再品揃えを介した新しいインフルエンザ株の出現は、一般的な宿主で自然に、またはバイオテロリズムのために人工的に、急速な広がりと高い致死性を持つ世界的なパンデミックにつながる可能性があります。4,5.現在、多数のインフルエンザワクチンが入手可能であるが、その有効性はサブタイプ特異性6によって制限されており、複数のウイルスに対して長期的な免疫を与える普遍的なインフルエンザワクチンを開発する必要性を生み出している。株7.
ユニバーサルインフルエンザワクチンの開発における重要な課題は、株間の高い抗原多様性です。現在のワクチンの抗原特異性と循環ウイルスの抗原変動を組み合わせることで、ワクチン株と循環株の不一致が生じ得る。これは、流行の間にワクチン株から離れてさらなる遺伝的ドリフトを好む進化的優位性を与え、ワクチンの有効性をしばしば50%未満に制限する 8,9.抗原不一致の追加の原因は、ワクチン製造中に生成される卵適応型ウイルス変異であり、これは循環ウイルス10,11に不十分に結合する抗体につながる。
高い抗原多様性のこの挑戦を克服するには、血清および粘膜標本の臨床的に関連する抗原変異体全体で既存および引き出された免疫応答の広さを特徴付ける新しい研究ツールが必要です。ヘマグルチン化阻害(HAI)、微中中和(MN)、および従来のELISAを含む現在利用可能な方法は、一度に単一のウイルス株に対する抗体の検出に限定されているので、複数の抗体アイソタイプの検出に使用します。複数のウイルス株に対してすぐに利用可能な臨床標本および実験室の資源を使い果たす。さらに、HAIおよびMNは専門の実験室でしか利用できない生きたウイルス培養を要求する。
タンパク質マイクロアレイは、図1に示すように、ニトロセルロースコーティングされたスライドに印刷された数千もの抗原からなる可能性があり、この必要性12を満たすことができる。これらのマイクロアレイは、少量の臨床試料を消費しながら高スループットの方法で製造およびプローブすることができ、アレイ上の個々の抗原に対する定量抗体アイソタイプ/サブタイプレベルを決定します。抗原発見に対するこのアプローチは、複数の感染性病原体に対する診断およびワクチン開発に適用されている13.現在までに、60,000以上の総発現タンパク質を含む35以上の病原体用タンパク質マイクロアレイを製造し、感染者から30,000人以上のヒトセラをプローブし、個人を制御するために使用してきました。マイクロアレイスライド用の最近開発されたポータブルイメージングプラットフォームにより、この方法論はエンドユーザー14にアクセスしやすくなりました。
フィールド15、16、17、18、19の複数の貢献者による広範な以前の研究に基づいて、インフルエンザタンパク質マイクロアレイが最近開発されました。全18のサブタイプ12、20の表現を持つ250精製ヘマグルチニン(HA)抗原変異体。この方法論を用いて、自然インフルエンザ感染は、系統的に関連するHAサブタイプに対して広く反応性IgGおよびIgA抗体を生成することが実証され、一方、筋肉内インフルエンザワクチン接種はサブタイプ特異的IgGのみを生成した。抗体21.しかしながら、インフルエンザワクチンに有料受容体を活性化するアジュバントを添加すると、動物実験22におけるHAサブタイプ全体で引き出されたIgG抗体応答を広げることが示された。
このマイクロアレイは現在、インフルエンザ感染に続いた大学生のコホート研究から採取したセラを調るために使用されている。ここで、本研究から試料のサブセット内でサブタイプ特異的抗体および交差反応性抗体を検出するアッセイ再現性のデモンストレーションを用いたインフルエンザ抗原マイクロアレイの方法論が報告されている。
プロトコル
すべての人間のセラは、保護パーソナル機器を使用してバイオセーフティのための承認された制度プロトコルに従って処理され、処分されます。このプロトコルに参加するすべての研究室の職員は、バイオセーフティと研究倫理の訓練を受けています。
1. インフルエンザ抗原マイクロアレイの生成
-
マイクロアレイ用抗原セットの設計と取得
- 凍結乾燥粉末として発現および精製タンパク質抗原を得る。
-
マイクロアレイスライドに抗原を印刷する
- 各凍結乾燥抗原をリン酸緩衝生理食塩基中の0.1mg/mLの濃度に0.001%のTween-20(T-PBS)で再構成する。未処理の384ウェル平底板の個々のウェルに再構成された抗原の10μLを移す。
- マイクロアレイプリンタを使用して抗原を印刷する(この研究で使用されるマイクロアレイプリンタはもはや市販されていない、議論を参照)、サンプルチャネルに抗原を吸引し、直接介して堆積する少量のマイクロアレイスポッティングピンを使用して、議論を参照してください。16パッドのニトロセルロースコーティングガラススライドに接触し、毛細血管アクション。
- ソース・プレートの構成と印刷パラメータを使用して、印刷ソフトウェア(Gridderなど)をプログラムします。
- プルダウン メニューを使用して、この印刷方法で使用するプレート タイプの名前を選択します。この研究では、未処理の384ウェルフラットボトムプレートを使用します。
- [プレート数]の横にあるテキスト ボックスを選択し、この印刷プロトコルで使用するサンプル プレートの数を入力します。このスタディでは、1つのプレートを使用します。
- この方法で使用するピン構成を選択します。このスタディでは、8 ピン構成を使用します。
- 原点オフセットが、スライドの原点 (管理セクションで校正されている) と、印刷ピンがスライド上で印刷を開始する位置との間の距離 (X 方向と Y 方向) であることを確認します。
- [配列の設計] タブを使用して、配列のサイズと形状 (ドット間隔とサブ配列あたりのドット数) を定義します。このスタディでは、8ピンを使用して18x18形式の16パッドスライドに324個(直径180μm、間隔300μm)を印刷します。
- 印刷ピンがサンプルをピックアップして分配する方法のパラメータを選択します。この研究では、各ピンは抗原溶液の250 nLを引き出し、40箇所のそれぞれに1 nLを印刷します(全8ピンにつき合計20枚のスライド)。
- ピンクリーニングプロトコルとブロッティングプロトコルを設定します。この研究では、各ピンが抗原を印刷し、超音波洗浄容器内の無菌ddH2Oに浸漬し、次の抗原をアセチマチ化する。
- サンプル ブロックをスライドに印刷する順序を定義します。アレイソフトウェアは、各マイクロアレイ内の抗原の配置を記述するために、アレイグリッドインデックス(.gal)ファイルを構築します。
注:一番上の行は、イメージングに使用されるすべての波長で蛍光を使用し、例えば、Qdot 585 nmストレプトアビジンコンジュゲートとQdot 800 nmストレプトアビジンコンジュゲートの混合物)をイメージング中にグリッドの向きに使用します。長時間の印刷実行では、ソースプレート内の抗原を、ピペッティングして上下にピペ状にして、遠心分離機を定期的に再懸濁させたり、新しいソースプレートを作成して使用したりできます。
- ソース・プレートの構成と印刷パラメータを使用して、印刷ソフトウェア(Gridderなど)をプログラムします。
- プローブされていないマイクロアレイスライドを防光ボックスに入れ、室温でデシケータキャビネットに保管して長期保存します。
注: この時点で、プロトコルは無期限に一時停止される場合があります。
-
品質管理チェックを実行する(ポリヒスチジンタグが必要)
- ステップ 2.1.1-2.1.2 で説明し、図 2に示すように、プローブ チャンバにスライドを取り付け、ブロッキング バッファで水分補給します。
- 濾過された1xブロッキングバッファーでマウスモノクローナルポリヒス抗体1:100を希釈する。
注:非精製タンパク質抗原(例えば、インビトロ転写および翻訳系で発現される)がマイクロアレイの印刷に直接使用される場合、タンパク質発現系の成分(例えば、大腸菌リサート)を1:10の比率で追加し、これらの成分に対して向けられた任意の抗体を遮断するために血清希釈に使用されるブロッキングバッファー。 - 吸引後にアレイパッドを含む各スライドチャンバに希釈されたポリヒス抗体を100μL追加し、室温で2時間、またはシェーカーで4°Cで一晩インキュベートします。ステップ 2.2.1 で説明したように、T-TBS バッファーで 3x を洗浄します。ビオチン結合ヤギ抗マウスIgG二次抗体1:200をブロッキングバッファーに希釈し、吸引後1ウェル当たり100μLを添加し、シェーカー上の室温で1時間インキュベートする。T-TBSバッファで3倍を洗浄します。
- 希釈Qdot 585 nm連鎖化ビンはブロッキングバッファーで4nMに結合し、吸引後にウェル当たり100μLを加え、シェーカーの室温で1時間インキュベートする。T-TBSバッファで3xを洗浄し、その後TBSバッファで1回(Tweenなし)。
- 手順 2.2.5 ~ 3.1.2 で説明されているように、スライドを分解して定量化します。
注:タンパク質抗原は、この品質管理プロトコルを使用するために、His10タグを含む必要があります。あるいは、別のタグが含まれている場合、そのタグの抗体またはリガンドを使用して品質管理チェックを行うことができます。
2. マイクロアレイを用いたインフルエンザ抗体のプローブセラ
-
抗体結合のためのマイクロアレイ上のセラをインキュベートする
- クリップを使用してマイクロアレイスライドをチャンバーに取り付け、図3に示すようにフレーム内に配置します。
注:常に手や楽器でマイクロアレイパッドに触れないようにしてください。スライドがパッド側を上に、右上隅の小さなノッチの向きであることを確認します。 - 濾過された1xブロッキングバッファーのウェルあたり100 μLのマイクロアレイスライドを再水和し、ブロッキングバッファーの100 μLで血清1:100を希釈します(未処理の96ウェルプレートまたは2 mLチューブを使用できます)。カバーされたフレームで水分補給されたマイクロアレイスライドと希釈されたセラの両方を、100-250 rpmの軌道シェーカーの室温で30分間別々にインキュベートします。シェーカーで同様に、後続のすべてのインキュベーション手順を実行します。
注:Seraは、凍結融解サイクルを最小限に抑えるために-80 °Cでアリクォートおよび凍結する必要があり、使用前に微粒子を除去するために混合し、遠心分離する必要があります。スライドチャンバの組み立て直しが必要な漏れを検出するには、このステップの間および後にスライドチャンバを注意深く観察してください。 - 二次コレクションフラスコと真空ラインに接続されたピペットの先端を使用して、パッドに触れることなく、各チャンバーのコーナーから慎重にブロッキングバッファを吸引します。後続のすべての吸引手順を同様に実行します。パッドが乾燥しないように、吸引後すぐにパッドに希釈されたセラを追加します。
- 湿ったペーパータオルで囲まれた二次容器の中に覆われたフレームをトレイに入れ、蒸発を防ぐために密閉します。ロッキングシェーカーで一晩4°Cでインキュベートします(または、100-250 rpmでオービタルシェーカーの室温で2時間インキュベートすることができます)。
- クリップを使用してマイクロアレイスライドをチャンバーに取り付け、図3に示すようにフレーム内に配置します。
-
量子ドット共役二次抗体を使用した標識結合血清抗体
- 上記のように室から慎重に吸引セラを、T-TBSバッファーのウェル当たり100μLを加え(20mM Tris-HCl、150 mM NaCl、ddH2Oで0.05%Tween-20をpH 7.5に調整し、濾過し、商業的に得ることができ、軌道上で5分間インキュベートすることができる)100-250のrpm。この洗浄工程を合計3倍繰り返します(後続のすべての洗浄工程も同様に行われます)。
- ブロッキングバッファーで1μMに希釈した二次抗体の混合物を調作し、均質性を維持するために使用前および使用中にピペッティングによって完全に混合する。
注:アッセイの再現性を維持するために、各二次抗体の同じバッチを、実験間のデータの定量的比較が計画されているすべてのプローブ実験に使用する必要があります。二次抗体の特異的濃度は、親和性に応じて変化する必要があります。可能な限り製造元のプロトコルに従ってください。 - 最終洗浄後にチャンバーから吸引バッファーを吸引し、二次抗体混合物のウェル当たり100μLを加え、シェーカー上の室温で2時間インキュベートする。
- 二次抗体混合物をT-TBSバッファーで3倍洗浄し、その後TBSバッファーで1回洗浄する(Tweenなし)。
- マイクロアレイは、パッドに触れないように注意深くチャンバーからスライドし、濾過されたddH2Oで穏やかに洗い流し、50 mLチューブに入れ、500 x gで10分間遠心を入れて乾燥させます。
- プローブされたマイクロアレイスライドを防光ボックスに入れ、室温でデシケータキャビネットに保管して長期保存します。
注: この時点で、プロトコルは最大 1 週間一時停止される場合があります。
3. マイクロアレイ内の抗原への抗体結合を定量化する
-
マイクロアレイスライドを可視化し、スポット蛍光強度を定量して抗体結合を測定
- 内蔵ソフトウェアを使用してポータブルイメージャーを使用してマイクロアレイスライドの画像を取得します。
- [イメージャーの構成] タブで、適切なスライド構成を選択します。この調査では、16 パッドのスライドを使用します。
- [画像制御]タブで、適切な蛍光チャネルを選択し、セラの反応性に応じてゲイン、露光時間、取得時間を調整して最適な画像を得ます。本研究では、IgAとIgGの蛍光チャネルはそれぞれ585nmと800nmであり、撮像設定は50、露光時間は50ms、集録時間は1秒であった。
- [キャプチャ]をクリックして、イメージの取得プロセスを開始します。
注:マイクロアレイスライドは、暗くて乾燥して保存されている限り、信号の劣化なしに複数の設定で再イメージ化することができます。スライドと互換性がある場合は、他のイメージングシステムを使用できます。
- フィデューシャルマーカーに基づいて配向されたグリッドを使用して配列スポットを検出し、スポット周辺で測定されたピクセル強度から背景を引いた背景の中央値としてスポット強度を測定します。この定量アルゴリズムは、ステップ 1.2.2 で構築された .gal ファイルを使用して、各マイクロアレイ上の個々の抗原にスポット強度を接続する組み込みのイメージャー ソフトウェアを使用してバッチで実行します。
- [ファイル情報]パネルで、コンピュータ上のフォルダから選択して .gal ファイルをアップロードし、分析出力ファイルを[分析オプション]セクションに保存するフォルダを指定します。
- [イメージコントロール] タブで、取得した画像の 1 つを開いて定量化し、右上隅にある[自動]ボタンを選択します。
- 右下隅の[アレイ分析]セクションで、ソフトウェアの指示に従って fiducial テンプレートを作成します。
- バッチ分析をクリックし、定量化するイメージを含むフォルダを選択し、前の手順で作成した fiducial テンプレートを選択します。ソフトウェアは、各画像を分析し、スポット強度を定量化します。
注:このステップでは、各血清試料内の抗体を定量するスポット強度を含む.csvファイルを生成し、その後、スプレッドシート操作または解析ソフトウェアで操作することができるマイクロアレイ上の個々の抗原に結合します。
- 生データを分析して、抗原間および血清標本間の抗体結合を比較します。本研究では、585nmと800nmの蛍光スポット強度として測定されたIgA抗体とIgG抗体を、異なる日に異なるスライドを用いた実験の2つの独立した実行間のすべての抗原間で比較し、相関分析を行った。アッセイの再現性を測定します。
注:発現混合物として印刷される非精製タンパク質の場合、データ分析はDNAコントロールなしのバックグラウンド減算から始める必要があります。
- 内蔵ソフトウェアを使用してポータブルイメージャーを使用してマイクロアレイスライドの画像を取得します。
結果
プロトコルのデモンストレーションとして、ベースラインセラは、インフルエンザ抗原マイクロアレイ上のインフルエンザ感染に続く大学生の将来のコホート研究内の16人からアッセイされた。アッセイの再現性を実証するために、これらの検体は、異なるスライドおよび異なる日に2回プローブされた。
本研究では、His10タグを含む精製インフルエンザ抗原を、商業ベンダー(材料の表参照)および共同研究者から得た。これらの抗原には、251の全HA抗原が含まれ、63の球状頭部ドメイン(HA1)および186の全長タンパク質(HA0)、96個の単量状HA0タンパク質および90個のトリマー化を含む90個のトリマー化されたHA0タンパク質(「フォールトン」)ドメイン23を含む。この研究で使用される抗原とコントロールの完全なリストは、補足ファイルとして含まれています.本研究では、使用した二次抗体は、ヤギの抗ヒトIgGを800nm(GAH-IgG-Q800)で発光する量子ドットに結合し、ヤギの抗ヒトIgAを585nm(GAH-IgA-Q585)で発光する量子ドットに結合し、IgGおよびIgA抗体の多重検出を行った。図3に示します。インフルエンザHA抗原の異なるサブタイプおよび分子形態に結合するIgGおよびIgA抗体を、上述の臨床コホートから得られた血各種用血症と比較した。
結果のヒート マップは図4に示され、図 5にグラフィカルな表現が表示されます。これらの図では、配列上の表現が高い臨床的に関連するサブタイプのみがスペースを節約するためにラベル付けされ、"+" は残りの高い数のサブタイプをすべて示し、マイナーまたはそれ以下の適切に表現されたサブタイプが順序付けされたサブタイプ (例えば、H1 の間の H2) に含まれています。と H3)。配列上のひずみとサブタイプの完全なリストは、補足ファイルとして含まれています。これらのデータは、HAの頭部群に対する抗体が、臨床的に流行している株(H1N1、H3N2、B)に対する高量の抗体と、他の株に対する抗体の量が少ないサブタイプ特異的であることを示している。しかし、ストーカードメインを含むHA全体に対する抗体は、サブタイプ間でより多くのクロスリアクティブであり、HA全体がトリマー化されると、この効果は増強されるようです。この結果は、HA全体にステム領域が含まれており、サブタイプ間で高度に保存されているため、予期しない結果ではありません。したがって、非臨床サブタイプ(例えば、H5およびH7)からのHA分子全体に対する抗体は、他のHAサブタイプのステム領域と交差反応している臨床サブタイプ(例えば、H1およびH3)に対して最初に引き起こされた抗ステム抗体を表す可能性が高い。アレイ上に。この点は、頭部に対する抗体と異なる反応性プロファイルを示すステム領域を区別するために、アレイ上に頭部HAと分子HAの両方を含める重要性を示す。
このアッセイは、プロービング実行全体で良好な再現性を示します。2番目の実行は、株間のパターンは一貫しているが、すべての株にわたってわずかに低いIgG抗体を示す。この全面的なわずかな減少は、IgGの実行の間で変更された二次抗体のバッチ間変動が原因である可能性が高いが、IgAでは変更されていない。したがって、プロトコルに記載されているように、定量比較が計画されている任意の実験に対して、各二次抗体の同じバッチを使用することをお勧めします。検査するサンプルの数が多いために異なるバッチの抗体が必要な場合は、異なる抗体バッチを用いた実験実行間の共有サンプルを含めることを推奨し、補正による定量的比較を可能にします。
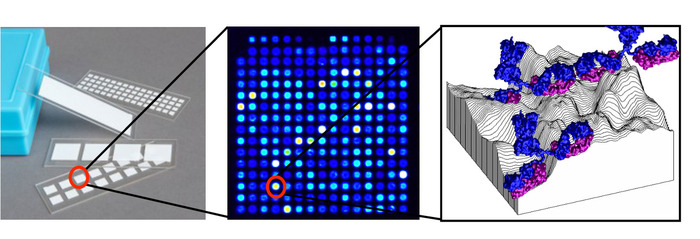
図1:タンパク質マイクロアレイの概略図。各スライドには、グリッドに配置されたスポットに印刷された数百の抗原で構成される1つの配列を持つ複数のパッドが含まれており、各スポットは、ニトロセルロース表面の3次元地形に吸着された1つの抗原を含む各スポットで構成されています。血清からの抗体は結合している。この図のより大きなバージョンを表示するには、ここをクリックしてください。
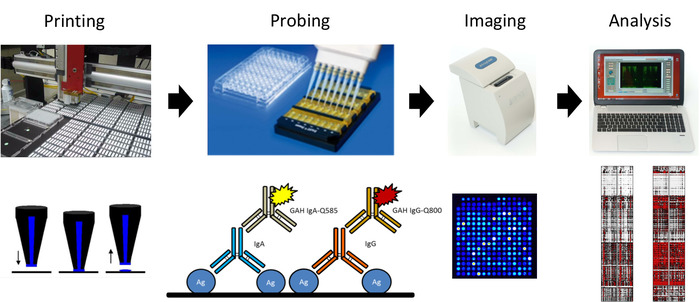
図2:インフルエンザ抗原マイクロアレイ印刷およびプローブプロトコルの概略図。左から、マイクロアレイは、量子ドット共役二次抗体を用いてIgGおよびIgA抗体のセラをプローブするために使用されるニトロセルロースコーティングスライドを使用して印刷され、ポータブルイメージャーを使用して画像化されたスライドを用いて、その結果を分析して解析した。ヒート マップを生成します。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図3:マイクロアレイスライドにプローブチャンバを取り付ける手順。AからFまで、プローブチャンバはスライドの上に正しい向きで置かれ、側面の水平クリップを使用してスライドに取り付けられ、プローブトレイに配置されます。この図のより大きなバージョンを表示するには、ここをクリックしてください。
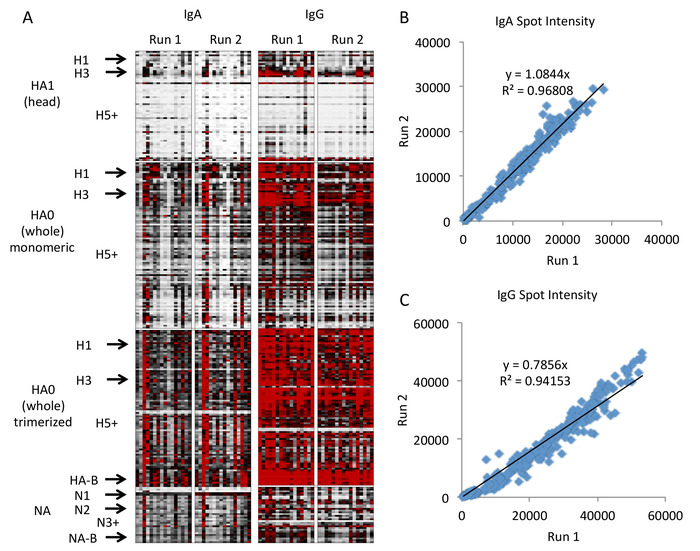
図4:インフルエンザ抗原マイクロアレイの代表的な結果。ヒートマップは抗原特異的抗体応答を表し、各行は分子、サブタイプ、およびひずみによって配置された単一の抗原を表し、各列は、抗体アイソタイプによって配置された単一の標本のプローブ実行を表し、実行(A、白 = 0、黒 = 20000、赤 = 40000 蛍光強度)。1から18までのすべてのヘマグルチニンサブタイプと1から10までのすべてのノイラミニダーゼサブタイプを含む抗原サブタイプは、垂直方向に配置され、左側に標識されています。2つの実行間の蛍光強度の比較は、IgA(B)およびIgG(C)の線形回帰による良好なアッセイ再現性を示す。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図5:インフルエンザ抗原マイクロアレイで測定された血清抗体の幅。血清IgA(A)およびIgG(B)は、HAおよびNA分子形態およびサブタイプによってグループ化され、臨床サブタイプに対するHAヘッド群抗体の高い特異性およびHA全体の高い交差反応性を実証し、および全HA抗体をトリマー化したストーカー地域を含む。この図のより大きなバージョンを表示するには、ここをクリックしてください。
補足ファイル:インフルエンザ抗原マイクロアレイ上の抗原のリスト。ブランク、フィデューシャル、コントロール(ヒトIgGおよびIgAおよび抗ヒトIgGおよび0.3 mg/mL)、およびソース、分子形態、サブタイプ、および株に関する情報を含む抗原を含む、アレイ上のすべての324スポットの内容が表示されます。略語は以下の通りです: ソース, Sino = Sino生物学株式会社, FKL = フロリアンクラムマー研究所;分子形態の場合、HA1=ヘッドHA、HA0=HA=HA全体、HA2=ストークHA、NP=ヌクレオタンパク質。Sinoバイオロジカル社から供給された抗原については、カタログ番号が表示されます。クランマー研究所から供給された抗原については、抗原の一覧に記載されています。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで説明するインフルエンザ抗原マイクロアレイプロトコルは、多くの抗原に対する抗体応答を分析する必要があるあらゆるプロジェクトに適応可能である。マイクロアレイプラットフォームは、前述の12のように精製の有無にかかわらず0.1mg/mL以上の収率を達成することができる任意のシステムで発現されるタンパク質抗原の任意のセットで使用することができる。非精製タンパク質抗原(例えば、インビトロ転写および翻訳系で発現)がマイクロアレイの印刷に直接使用される場合、タンパク質発現系の成分(例えば、大腸菌リサート)を用いて使用する遮断バッファーに1:10を添加する必要があります。これらの成分に対する抗体を遮断するために、セラおよび品質管理抗体の希釈。スライド構成は、各スライド上のより大きなパッドの数が少ないほど利用可能で、アレイあたりの抗原数が多くなります。本研究では、ニトロセルロース表面に直接接触するピンを利用してアレイ上のスポットを堆積させるGeneMachines OmniGrid 100マイクロアレイプリンタを用いた。このマイクロアレイプリンタは市販ではなくなりましたが、他の市販のマイクロアレイプリンタはこのプロトコルで使用できますが、カスタムピン(接触または非接触)とソフトウェアが必要であり、十分なスポット解像度を持っている必要があります。スライドやイメージャーとの互換性を備えています。セラの反応性に応じて、1:50から1:400までの希釈を使用することができます。無血清バッファーは陰性対照として使用することができ、一方、抗原に結合することが知られているモノクローナル抗体は、陽性対照として使用することができる。
ユーザーは、いくつかのトラブルシューティングの問題に注意する必要があります。Hisタグに対する抗体を使用した品質管理チェックの目的は、印刷が成功しなかった抗原をチェックすることです。複数のアレイの品質管理チェックで一貫して低信号を与えるスポットは、印刷された抗原が不十分である可能性が高い。考えられる理由としては、ソースプレートの凝集または沈殿または抗原、またはニトロセルロースパッドの可変厚さによる印刷ピンとマイクロアレイスライド間の接触が不十分である。この時点で、アンチヒス抗体の検出された結合が3次元立体構造に依存するこのタグの利用可能性によって影響を受けることができることを考えると、品質管理チェックの定量的な結果に基づくアッセイ正規化は行いません。各抗原に固有です。
インフルエンザ抗原マイクロアレイは、ELISAなどの従来の方法に対していくつかの利点を提供し、HAIやMNなどの機能的アッセイに相補的です。16パッドタンパク質マイクロアレイは、1μLの血清から約300の抗原に対して複数のアイソタイプの抗体を同時に測定する能力を持つサンプルスペアリング技術です。抗原の数は、スライドあたりのパッドの数を減らすことによって数千に増加することができます。多重化アッセイは、数百のセラを2日間で抗体に対してプローブでき、スライドや試薬以外のすべての材料が再利用可能なので、大量のプラスチック廃棄物を発生させないように、人員の時間と消耗品のリソースを節約します。
マイクロアレイプリンタは広く配布されていない場合がありますが、マイクロアレイスライドは集中管理された場所で印刷し、エンドユーザーに転送してプローブすることができます。プロービングに必要な唯一の機器は、低コストでポータブルイメージャーです。このプロトコルを普及させる目的は、この手法の利用をより広範にすることです。
インフルエンザ抗原マイクロアレイの主な制限は、検出された抗体の機能および運動学を特徴付けることができないことである。マイクロアレイは、各抗原に対する結合抗体のポリクローナルセットを検出している。これらの抗体は、HAIおよびMNアッセイにおいて中和ウイルスにおいて機能してもよいし、そうでない場合もある。しかし、HAIおよびMNアッセイは、インフルエンザの鳥類サブタイプに対する抗体をテストするために、高レベルのバイオセーフティキャビネットを備えた特殊な施設に関連する必要があるライブウイルス培養を必要としますが、タンパク質マイクロアレイには生ウイルスは含まれません。コンポーネントは、任意の基本的な実験室で利用することができるので。結合運動学に関しては、各抗原の単一濃度を含む配列でプローブされた血清の単一希釈は、抗原に結合するすべての抗体上に要約された量と親和性の複合体を表す単一のデータポイントを得る。.抗原抗体結合動態を完全に解決するには、複数の抗原濃度および/またはセラのシリアル希釈が必要です。
これらの制限にもかかわらず、インフルエンザ抗原マイクロアレイは、スループットと可用性がより制限されている機能的アッセイを補完できる抗原性の広い広さを特徴付ける有用なツールです。
開示事項
著者は開示を持っていません。
謝辞
著者らは、DARPA N66001-18-2-4015 P00001によって資金提供されたメリーランド大学IRBプロトコル#313842の下でヒトのセラを収集するためのドン・ミルトン教授(応用公衆衛生研究所、メリーランド大学、カレッジパーク、米国)を認めたい。著者らはまた、フロリアン・クラムマー教授(Icahn医学部、シナイ山、米国、ニューヨーク州)がODNI IARPA DJF-15-1200-K-0001725によって資金提供されたトリマー化されたHAおよびNA抗原を提供したことを認めたい。S.カーンは、KL2 TR001416の助成金を通じて、国立研究資源センターと国立国立衛生研究所の翻訳科学推進センターによって部分的に支援されています。コンテンツは著者の責任のみであり、必ずしもNIHの公式見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| 16-pad nitrocellulose-coated glass slides | Grace Bio Labs | 305016 | |
| 1x GVS FAST blocking buffer | Fischer Scientific | 10485356 | |
| ArrayCam portable imager | Grace Bio Labs | 400S | Other imaging devices can be used to visualize slides if capable of achieving the resolution of the microarray spots and the excitation and emission wavelengths of the quantum dots. |
| Biotin-conjugated goat anti-mouse-IgG antibody | Thermo Fischer | 31800 | |
| HiBase 384-well plate | Greiner Bio-One | T-3037-11 | |
| Microarray pins | ArrayIt | GMP2 | Each different microarray printer may require its own custom microarray pins. |
| Mouse monoclonal poly-His antibody | Sigma-Aldrich | H1029 | |
| OmniGrid 100 microarray printer | GeneMachines | The version of the microarray printer used in this work is no longer commercially available, but the updated similar equipment is the OmniGrid Accent microarray printer from Digilab (Hopkinton, MA), and the same protocol can be carried out with most commercially available microarray printers. | |
| ProPlate slide chambers | Grace Bio Labs | 246890 | |
| ProPlate slide clips | Grace Bio Labs | 204838 | |
| ProPlate slide frames | Grace Bio Labs | 246879 | |
| Quantum dot 585 nm conjugated goat anti-human-IgA antibody | Grace Bio Labs | 110620 | |
| Quantum dot 585 nm streptavidin conjugate | Thermo Fischer | Q10111MP | |
| Quantum dot 800 nm conjugated goat anti-human-IgG antibody | Grace Bio Labs | 110610 |
参考文献
- Murray, C. J., et al. Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study. Lancet. 380 (9859), 2197-2223 (2010).
- Renegar, K. B., Crouse, D., Floyd, R. A., Krueger, J. Progression of influenza viral infection through the murine respiratory tract: the protective role of sleep deprivation. Sleep. 23 (7), 859-863 (2000).
- Li, L., et al. Heterogeneity in Estimates of the Impact of Influenza on Population Mortality: A Systematic Review. American Journal of Epidemiology. 187 (2), 378-388 (2018).
- Fauci, A. S. Seasonal and pandemic influenza preparedness: science and countermeasures. Journal of Infectious Diseases. 194 Suppl 2, S73-S76 (2006).
- Duggal, A., Pinto, R., Rubenfeld, G., Fowler, R. A. Global Variability in Reported Mortality for Critical Illness during the 2009-10 Influenza A(H1N1) Pandemic: A Systematic Review and Meta-Regression to Guide Reporting of Outcomes during Disease Outbreaks. PLoS One. 11 (5), 2009-2010 (2016).
- Demicheli, V., Jefferson, T., Ferroni, E., Rivetti, A., Di Pietrantonj, C. Vaccines for preventing influenza in healthy adults. Cochrane Database Systematic Reviews. 2, CD001269 (2018).
- Erbelding, E. J., et al. A Universal Influenza Vaccine: The Strategic Plan for the National Institute of Allergy and Infectious Diseases. Journal of Infectious Diseases. , (2018).
- Xie, H., et al. H3N2 Mismatch of 2014-15 Northern Hemisphere Influenza Vaccines and Head-to-head Comparison between Human and Ferret Antisera derived Antigenic Maps. Scientific Reports. 5, 15279 (2015).
- Tricco, A. C., et al. Comparing influenza vaccine efficacy against mismatched and matched strains: a systematic review and meta-analysis. BMC Medicine. 11, 153 (2013).
- Katz, J. M., Webster, R. G. Efficacy of inactivated influenza A virus (H3N2) vaccines grown in mammalian cells or embryonated eggs. Journal of Infectious Disease. 160 (2), 191-198 (1989).
- Zost, S. J., et al. Contemporary H3N2 influenza viruses have a glycosylation site that alters binding of antibodies elicited by egg-adapted vaccine strains. Proceedings of the National Academy of Science. 114 (47), 12578-12583 (2017).
- Davies, D. H., et al. Profiling the humoral immune response to infection by using proteome microarrays: high-throughput vaccine and diagnostic antigen discovery. Proceedings of the National Academy of Science U. S. A. 102 (3), 547-552 (2005).
- Liang, L., Felgner, P. L. A systems biology approach for diagnostic and vaccine antigen discovery in tropical infectious diseases. Current Opinion in Infectious Diseases. 28 (5), 438-445 (2015).
- Jain, A., et al. Evaluation of quantum dot immunofluorescence and a digital CMOS imaging system as an alternative to conventional organic fluorescence dyes and laser scanning for quantifying protein microarrays. Proteomics. 16 (8), 1271-1279 (2016).
- Desbien, A. L., et al. Development of a high density hemagglutinin protein microarray to determine the breadth of influenza antibody responses. Biotechniques. 54 (6), 345-348 (2013).
- Mace, C. R., et al. Label-free, arrayed sensing of immune response to influenza antigens. Talanta. 83 (3), 1000-1005 (2011).
- Koopmans, M., et al. Profiling of humoral immune responses to influenza viruses by using protein microarray. Clinical and Microbiology Infections. 18 (8), 797-807 (2012).
- Bucukovski, J., Latorre-Margalef, N., Stallknecht, D. E., Miller, B. L. A Multiplex Label-Free Approach to Avian Influenza Surveillance and Serology. PLoS One. 10 (8), e0134484 (2015).
- Meade, P., Latorre-Margalef, N., Stallknecht, D. E., Krammer, F. Development of an influenza virus protein microarray to measure the humoral response to influenza virus infection in mallards. Emerging Microbes and Infection. 6 (12), e110 (2017).
- Vigil, A., Davies, D. H., Felgner, P. L. Defining the humoral immune response to infectious agents using high-density protein microarrays. Future Microbiology. 5 (2), 241-251 (2010).
- Nakajima, R., et al. Protein Microarray Analysis of the Specificity and Cross-Reactivity of Influenza Virus Hemagglutinin-Specific Antibodies. mSphere. 3 (6), (2018).
- Van Hoeven, N., et al. A Formulated TLR7/8 Agonist is a Flexible, Highly Potent and Effective Adjuvant for Pandemic Influenza Vaccines. Scientific Reports. 7, 46426 (2017).
- Krammer, F., et al. A carboxy-terminal trimerization domain stabilizes conformational epitopes on the stalk domain of soluble recombinant hemagglutinin substrates. PLoS One. 7 (8), e43603 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved