このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
浸漬による微生物誘導カルサイト沈殿(MICP)による砂土壌改善
要約
ここで、微生物誘導カルサイト沈殿(MICP)技術は、浸漬によって土壌特性を改善するために提示される。
要約
この記事の目的は、微生物誘導カルサイト沈殿(MICP)処理サンプルを改善する浸漬法を開発することです。バッチ反応器を組み立て、土壌サンプルをセメント培地に浸漬した。セメント培地は、注入されるセメント媒体の代わりにバッチ反応器内の土壌サンプルに自由に拡散することができます。フルコンタクトフレキシブル金型、剛性フルコンタクト金型、およびコードレンガ型を使用して、異なる土壌サンプルホルダーを調作しました。合成繊維及び天然繊維を選択し、MICP処理土壌試料を補強した。MICP処理試料の異なる領域における沈殿CaCO3を測定した。CaCO3分布結果は、浸漬法により土壌試料中に沈殿したCaCO3が均一に分布していることを実証した。
概要
生物学的地盤改良技術として、微生物誘導カルサイト沈殿(MICP)は、土壌の工学的特性を向上させることができる。土壌の強度、剛性、透過性を高めるために使用されています。MICP技術は、世界的な土壌改善のために多くの注目を集めています1,2,3,4.炭酸塩沈殿は自然に起こり、土壌環境5に固有の非病原性生物によって誘導されうる。MICPバイオジオ化学反応は、尿毒細菌、尿素およびカルシウムが豊富な溶液5,6の存在によって駆動される。スポロスアルシナ・パステウリは、カルサイト7,8の沈殿に向けて反応ネットワークを触媒する非常に活性な尿酵素である。尿素加水分解プロセスは、溶解アンモニウム(NH4+)および無機炭酸塩(CO32-)を生成します。炭酸イオンはカルシウムイオンと反応して炭酸カルシウム結晶として沈殿します。尿素加水分解反応はここに示されています:
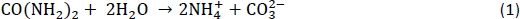

沈殿したCaCO3は、MICP処理土壌のエンジニアリング特性を向上させるために砂粒子を結合することができます。MICP技術は、土壌の強度と剛性の向上、コンクリートの修理、環境改善9、10、11、12、および様々な用途に応用されています。13歳,14歳,15.
Zhaoらは16を用いた浸漬法を開発し、MICP処理サンプルを調製した。この方法では、ジオテキスタイル製のフルコンタクトフレキシブル金型を使用しました。沈殿したCaCO3は、MICP処理サンプル全体に均一に分布した。Bu et al.17は、浸漬法によりMICP処理ビームサンプルを調製する剛性フルコンタクト金型を開発した。この方法により調製されたMICP処理試料は、剛性フルコンタクト金型を用いて、適当なビーム形状を形成することができる。MICP処理試料を4つに分け、CaCO3内容物を測定した。CaCO3含有量は8.4±1.5%~9.4±1.2%の重量で、浸漬法によりMICP処理試料にCaCO3が均一に分布していることを示した。これらのMICP処理サンプルはまたよりよい機械特性を達成した。これらのMICP処理バイオ試料は950kPaの屈曲強度に達し、これは20-25%のセメント処理されたサンプル(600-1300 kPa)のそれに類似していた。Liら10は、砂の土壌にランダムに分散した離散繊維を加え、MICP浸漬法により土壌を処理した。その結果、MICP処理土壌のせん断強度、延性、故障歪みは、適切な繊維を添加することで明らかに増強されたことがわかった。
MICPの浸漬方法は、継続的に10、16、17を改善してきました。この方法は、レンガや梁などのMICP処理土壌サンプルとMICP処理プレハブ建材を調製するために使用することができます。サンプル調製金型の異なる形状寸法を開発した。繊維は、その特性を高めるためにMICP処理サンプルに添加された。この詳細なプロトコルは、MICP処理のための浸漬方法を文書化することを意図した。
Access restricted. Please log in or start a trial to view this content.
プロトコル
注:以下の手順で使用される関連するすべての材料は、非危険です。個人用保護具(安全メガネ、手袋、ラボコート、フルレングスパンツ、クローズドトーシューズ)が必要です。
1. 細菌溶液の調製
- 成長培地の調製(NH4-YE培地)
注:脱イオン水のリットル当たりの成長培地の成分は:酵母エキスの20グラム。10 g の (NH4)2SO4;0.13 Mトリスバッファ(pH 9.0)。- オートクレーブ成分は別途。
- 酵母エキスの20g、および0.13Mトリスバッファーを含む脱イオン水の1Lに(NH4)2SO4の10gを溶解する。
- 磁気撹拌機ポスト殺菌を使用してコンポーネントを一緒に混ぜます。
- スポロサルチーナ・パステウリの伝播手順
注: この実験では、50 mL 遠心分離管を使用します。- 冷凍細菌をバイアルで解凍します。
- バイアルを開きます。
- 新鮮な成長培地の10 mLで遠心管に細菌懸濁液の0.1 mLを転送します。手でよく混ぜます(接種率は1:100)。成長培地でさらに5つの細菌懸濁液を繰り返す。内部に新鮮な成長培地の10でのみ制御管を準備します。
注:凍結/乾燥手順で使用される凍結保護剤は、一次チューブの成長を阻害する可能性があります。好気性の状態を維持するために、チューブのふたを緩く締めました。 - すべてのチューブをシェーカーで30°Cで200rpmで48~72時間インキュベートします。それ以外の場合は、成長培地が48時間後に濁った場合にインキュベーションを停止し、最大72時間までインキュベーションを延長する。
- 細菌と成長培地でチューブを4,000 x gで20分間遠心分離します。
- 上清を取り出し、新鮮な成長培地の25mLに置き換え、渦機械を使用してよく混ぜます。
- 細菌の活性を完全に刺激するために、手順1.2.3-1.2.6を2回繰り返します。
- ステップ1.2.7のチューブからの懸濁液を使用して、細菌の培養を強化するために成長培地の25 mLでより多くのチューブを接種します(接種率は1:100)。
- すべてのチューブをシェーカーで30°Cで200rpmで48時間インキュベートします。
- 細菌と成長培地でチューブを4,000 x gで20分間遠心分離します。
- 上清を取り除き、新鮮な成長培地に置き換え、渦機械を使用してよく混ぜます。
- MICP実験の前に新鮮な成長培地を用いて細菌濃度を調整する。600nmで懸濁液の光学密度で細菌濃度を算出し、分光光度計を用いて測定した。この実験のOD600は0.6であった。
2. セメント培った調製剤
注:セメント培地は、MICP処理中に石灰質沈殿を誘導する化学物質を提供するために使用されます。尿素-Ca2+モル比は1:1です。セメント培地の化学成分を表1に示す。以下の手順は、0.5 M Caを持つ20Lのセメント培媒についてである。
- プラスチック製の箱に20Lの水を準備します。
- NH4 Clの200g、栄養スープ60g、NaHCO3の42.4g、尿素600g、CaCl2の2H2Oを蒸留水の20Lに溶解する。攪拌ロッドを使用してよく混ぜます。
3. 金型の調製
- フルコンタクトフレキシブル金型(FCFM)の調製
注:フルコンタクトフレキシブル金型はジオテキスタイルで作られています。ジオテキスタイルは、グラブ引張強度1,689N、台形引裂強度667N、見かけの開口部サイズ0.15mm、水流速度34mm/s、厚さ1.51mm、単位質量200g/m2を有する。金型のサイズは、異なるサンプルサイズ(例えば、無制限の圧縮試験試料または直接せん断試験サンプル)を調出すために変化させることができる。- FCFMは環状部品、底部、カバーで構成されているため、ジオテキスタイルをFCFMの構成部分にカットします。
- 図 1に示すように、FCFM の 3 つの部分を一緒に縫います。
- バイオレンガ用剛性フルコンタクト金型(RFCM)の調製
注: リジッド フルコンタクト 金型は、フレキシブル レイヤとリジッド ホルダーで構成されます。フレキシブル レイヤーは、FCFM と同じジオテキスタイルで構成されています。堅いホールダーはポリプロピレン穿孔シートに分散される6.35 mmの直径のずらされた穴が付いているポリプロピレンの穿孔シートから成り、隣接する穴間のクリアランス間隔は9.53 mmである。1つの金型は3つの部屋から成り、各部屋のサイズは長さ177.8 mm、幅76.2 mmおよび高さ38.1 mmである。RFCMのサイズは異なったサンプルサイズを準備するために変えることができる。剛性ホルダーの穴は、セメント媒体がフレキシブル層を自由に流れることを可能にします。- リジッドホルダーの構成部分用のポリプロピレン穿開シートを準備します。
- プラスチック製のネジとナットを使用して、剛性ホルダーの部分を組み立てます。
- ジオテキスタイルフレキシブル レイヤーの構成部分を準備します。フレキシブルレイヤーは、底部とカバーで構成されています。
- リジッド ホルダーにフレキシブル レイヤーの下部を囲みます。
- 砂を金型に加えたら、フレキシブル層のカバーを置き、図2に示すように砂サンプルの上に縫製して固定します。
- 中空レンガ型の調製
注:中空レンガ型には、剛性ホルダー、フレキシブル層、および段ボールチューブが含まれています。段ボール管のサイズは60のmm x 140のmm x 60のmmである。3つの部屋は1つの金型に含まれ、各金型部屋のサイズは長さ177.8 mm、幅76.2 mmおよび高さ38.1 mmである。- 剛性ホルダーの構成部分にポリプロピレン穿開シートを準備します。
- リジッドホルダーピースの底面に穴をあけます。穴の大きさは直径61mmです。各チャンバー内の穴の位置を図 3aに示します。
- プラスチック製のネジとナットを使用して、剛性ホルダーの部分を組み立てます。
- 剛性ホルダーの底面の穴に段ボールチューブを組み立てます。
- ジオテキスタイルフレキシブル レイヤーの構成部分を準備します。フレキシブルレイヤーは、底部とカバーで構成されています。段ボールチューブの同じ場所にあるフレキシブル層にも穴が必要です。
- 砂を金型に加えたら、フレキシブル層のカバーを置き、図3bに示すように砂サンプルの上に縫製して固定します。
4. バッチ反応器の調製
注:図4に示す原子炉は、プラスチック製の箱、セメント媒体、サンプルサポートされた棚、およびエアポンプで構成されています。土壌サンプルはセメント媒体に十分に浸漬することができ、セメント媒体はこの方法によって土壌サンプルに自由に拡散することができる。原子炉内の空気ポンプは細菌に酸素を供給する。スポロスカルシナ・パスシュライで触媒されたMICP治療に対する異なる酸素供給の影響を調べるために、Li et al. 201718は、通気状態、空気制限状態、およびオープンエアコン。彼らは、有酸素細菌によって触媒されるMICPプロセスを改善するために十分な酸素化状態が不可欠であることを発見した。
- プラスチックホースを使用してエアポンプをエアサプライに接続します。
- エアポンプをプラスチック製のボックスに入れます。
- プラスチックボックスにセメントメディアを注ぎます。
5. 土壌サンプルの調製
- MICP処理土壌サンプルの調製
注:オタワ砂(99.7%石英)が実験に使用されます。砂は0.46 mmの中央の粒子サイズと均一であり、罰金は含まれていない。これは、統一土壌分類システム(USCS)に基づいて、不十分なグレードの砂として分類されます。- 空気の耕作方法(FCFM、RFCM、中空レンガ型)によって金型に乾燥砂を加え、中央分離帯の緻密な状態(約42~55%の範囲のDr、および1.58-1.64 g/cm3の範囲の砂の乾燥密度)に達する。
注:砂の重量は、金型の異なる種類に応じて異なります:直径38.6ミリメートルと高さ76.2ミリメートルであるUCS試験サンプルのための145 ±5 g砂。 - カバーをサンプルの上に置き、縫製で固定します。
- 透過性ジオテキスタイルカバーを通して、固定光学密度値を持つ細菌溶液をサンプルに注ぎ、それらが飽和していることを確認します。
注:細菌溶液の量は、異なるサンプルに応じて変化しました:直径38.6mm、高さ76.2 mmであるUCS試験試料用の細菌溶液の50 mL。 - 図 5aに示すように、サンプルサポートされているシェルフにサンプルを配置します。
- セメントメディアで満たされたバッチ反応器に棚全体を浸します。
- 空気供給をオンにし、空気出力を調整して100%の空気飽和状態を保ちます。MICP反応の7日間待ちます。
- 図 5b に示すように、反応器からサンプルを取り出します。
- フルコンタクトフレキシブルモールドを切断するか、リジッドホルダーを減らし、フレキシブル層を切断してサンプルを除去します。
- サンプルを水で洗い、細孔内の残留溶液を除去します。
- 105 °C オーブンにサンプルを 48 時間置き、重量が一定になるまで置きます。サンプルはオーブンの乾燥の後にさらにテストされるか、または処理することができる。
- 空気の耕作方法(FCFM、RFCM、中空レンガ型)によって金型に乾燥砂を加え、中央分離帯の緻密な状態(約42~55%の範囲のDr、および1.58-1.64 g/cm3の範囲の砂の乾燥密度)に達する。
- 繊維強化MICP処理土壌試料の調製
注:図6に示すように、合成繊維(材料の表を参照)と天然ヤシの繊維は、これらの手順で使用されています。- 合成繊維の場合は、提案された繊維と900gの乾燥砂を少量ずつ少量で混合し、均一な混合物を得る。この実験の繊維含有量は、乾燥砂の重量で0.3%に固定されている。
- 天然のヤシの繊維の場合は、760gの砂を4つの等しい部分に分配します。これらの4つの砂の部分とRFCMの繊維の3つの層を間隔で追加します。
- MICP 処理サンプルを取得するには、手順 5.1.2 ~ 5.1.10 と同じ手順を繰り返します。
- 生体表面処理によるセメント処理レンガの調製
注:比重3.15のポートランドセメント(TYPE I/II)は、この実験でセメント処理サンプルのセメント剤として使用されます。このセメントの初期の強度ゲインは、様々な硬化時間を7日から21日の範囲にすることができました。この手順で添加されたセメントの割合は、乾燥した砂の重量で10%です。- 900gの砂、90gのセメント、200mLの水を混ぜて均一な混合物を実現します。
- リジッド 金型に混合物を追加します。剛性金型のサイズは、長さ177.8mm、幅76.2mm、高さ38.1mm。
- 100%の一定湿度と25°Cの一定温度で7日間硬化します。
- 105°Cのオーブンにサンプルを48時間置き、その重量が一定になるまで置きます。
- 手順 5.1.3 — 5.1.8 と同じ手順を繰り返します。
- 105°Cのオーブンにサンプルを48時間置き、その重量が一定になるまで置きます。サンプルはオーブンの乾燥の後にさらにテストされるか、または処理することができる。
Access restricted. Please log in or start a trial to view this content.
結果
図7は、MICP処理試料全体における沈殿CaCO3の分布を示す。MICP処理試料を3つの異なる領域に分けた。各領域におけるCaCO3含有量を酸洗浄方法により試験した。沈殿した炭酸塩を溶解させるために、乾燥MICP処理試料をHCl溶液(0.1M)で洗浄し、次いですすり、水切りし、オーブン乾燥を48時間行った。酸洗浄前後のサンプルの質量の差値は、MICP処理試料中に沈殿...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
本論文では、浸漬によるMICP技術を発表した。土壌試料をバッチ反応器に浸漬し、MICPプロセスにおけるセメント化媒体によって完全に浸透した。この方法では、フルコンタクトフレキシブル金型、剛性フルコンタクト金型、およびコードレンガ金型を適用し、MICP処理サンプルを調製しました。
異なる金型は、異なるジオメトリ要件に合って設計できます。ジオテキスタ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
何も開示することはない
謝辞
この研究は、国立科学財団助成金第1531382号とMarTRECによって支援されました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Ammonium Chloride, >99% | Bio-world | 40100196-3 (705033) | |
| Ammonium Sulfate | Bio-world | 30635330-3 | |
| Calcium Chloride Dihydrate, >99% | Bio-world | 40300016-3 (705111) | |
| Nutrient Broth | Bio-world | 30620056-3 | |
| Sodium Bicarbonate, >99% | Bio-world | 41900068-3 (705727) | |
| Sporosarcina pasteurii | American Type Culture Collection | ATCC 11859 | |
| Synthetic fiber | FIBERMESH | Fibermesh 150e3 | |
| Tris-Base, Biotechnology Grade, >99.7% | Bio-world | 42020309-2 (730205) | |
| Urea, USP Grade, >99% | Bio-world | 42100008-2 (705986) | |
| Yeast Extract | Bio-world | 30620096-3 (760095) |
参考文献
- Cheng, L., Shahin, M. A., Mujah, D. Influence of key environmental conditions on microbially induced cementation for soil stabilization. Journal of Geotechnical and Geoenvironmental Engineering. 143 (1), 04016083-04016091 (2016).
- Whiffin, V. S., van Paassen, L. A., Harkes, M. P. Microbial carbonate precipitation as a soil improvement technique. Geomicrobiology Journal. 24 (5), 417-423 (2007).
- van Paassen, L. A., Ghose, R., van der Linden, T. J., van der Star, W. R., van Loosdrecht, M. C. Quantifying biomediated ground improvement by ureolysis: large-scale biogrout experiment. Journal of Geotechnical And Geoenvironmental Engineering. 136 (12), 1721-1728 (2010).
- Montoya, B. M., DeJong, J. T. Stress-strain behavior of sands cemented by microbially induced calcite precipitation. Journal of Geotechnical and Geoenvironmental Engineering. 141 (6), 04015019(2015).
- DeJong, J. T., Fritzges, M. B., Nüsslein, K. Microbially induced cementation to control sand response to undrained shear. Journal of Geotechnical and Geoenvironmental Engineering. 132 (11), 1381-1392 (2006).
- Zhao, Q., et al. Factors affecting improvement of engineering properties of MICP-treated soil catalyzed by bacteria and urease. Journal of Materials in Civil Engineering. 26 (12), 04014094(2014).
- Castanier, S., Le Métayer-Levrel, G., Perthuisot, J. P. Ca-carbonates precipitation and limestone genesis—the microbiogeologist point of view. Sedimentary Geology. 126 (1-4), 9-23 (1999).
- Burne, R. A., Chen, Y. Y. M. Bacterial ureases in infectious diseases. Microbes and Infection. 2 (5), 533-542 (2000).
- Bernardi, D., DeJong, J. T., Montoya, B. M., Martinez, B. C. Bio-bricks: biologically cemented sandstone bricks. Construction and Building Materials. 55, 462-469 (2014).
- Li, M., et al. Influence of fiber addition on mechanical properties of MICP-treated sand. Journal of Materials in Civil Engineering. 28 (4), 04015166(2015).
- Achal, V., Kawasaki, S. Biogrout: a novel binding material for soil improvement and concrete repair. Frontiers in Microbiology. 7, 314(2016).
- Al Qabany, A., Soga, K., Santamarina, C. Factors affecting efficiency of microbially induced calcite precipitation. Journal of Geotechnical and Geoenvironmental Engineering. 138 (8), 992-1001 (2011).
- Lin, H., Suleiman, M. T., Brown, D. G., Kavazanjian, E. Mechanical behavior of sands treated by microbially induced carbonate precipitation. Journal of Geotechnical and Geoenvironmental Engineering. 142 (2), 04015066(2015).
- Lauchnor, E. G., Topp, D. M., Parker, A. E., Gerlach, R. Whole cell kinetics of ureolysis by sporosarcina pasteurii. Journal of Applied Microbiology. 118 (6), 1321-1332 (2015).
- Nafisi, A., Montoya, B. M. A new framework for identifying cementation level of MICP-treated sands. IFCEE. , conference paper (2018).
- Zhao, Q., Li, L., Li, C., Zhang, H., Amini, F. A full contact flexible mold for preparing samples based on microbial-induced calcite precipitation technology. Geotechnical Testing Journal. 37 (5), 917-921 (2014).
- Bu, C., et al. Development of a Rigid Full-Contact Mold for Preparing Biobeams through Microbial-Induced Calcite Precipitation. Geotechnical Testing Journal. 42 (3), 656-669 (2018).
- Li, M., Wen, K., Li, Y., Zhu, L. Impact of oxygen availability on microbially induced calcite precipitation (MICP) treatment. Geomicrobiology Journal. 35 (1), 15-22 (2018).
- Martinez, B. C., et al. Experimental optimization of microbial-induced carbonate precipitation for soil improvement. Journal of Geotechnical and Geoenvironmental Engineering. 139 (4), 587-598 (2013).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved