Method Article
hiPSC由来心筋細胞を用いた虚血性心疾患のモデルと心筋細胞収縮の映像的比較
要約
ヒト人工多能性幹細胞由来の心筋細胞を用いた虚血性心疾患のモデルを、虚血による組織損傷の定量的評価方法と共に提示する。このモデルは、薬物スクリーニングおよび虚血性心疾患に関するさらなる研究のための有用なプラットフォームを提供することができる。
要約
虚血性心疾患は、世界中の死亡の重大な原因です。したがって、多くの場合、げっ歯類などの小動物モデルで、膨大な量の研究の対象となっています。しかし、ヒト心臓の生理学はげっ歯類の心臓の生理学とは大きく異なり、心臓病を研究するために臨床的に関連するモデルの必要性を強調している。ここでは、ヒト人工多能性幹細胞(hiPS-CM)と分化した心筋細胞を用いて虚血性心疾患をモデル化し、虚血性心筋細胞の損傷および機能障害を定量化するプロトコルを提示する。グルコースおよび血清を含まない2%の酸素への曝露は、ヨウ化プロピジウムで核を染色することによって示される負傷細胞の割合を増加させ、細胞の生存率を低下させる。これらの条件はまた、顕微鏡ビデオ画像の変位ベクトル場分析によって確認されるようにhiPS-CMの収縮性を低下させる。このプロトコルは、個々の患者からのhiPS細胞の使用を促進することによって、さらに個別の薬物スクリーニングのための便利な方法を提供することができる。したがって、この虚血性心疾患モデルは、ヒト起源のiPS-CMに基づいて、虚血性心疾患に関する薬物スクリーニングおよびさらなる研究のための有用なプラットフォームを提供することができる。
概要
虚血性心疾患(IHD)は、死亡の主な原因として世界的に認識され、2016年に900万人以上の死亡者の原因であると推定された1。心血管疾患の罹患率は増加し続けており、グローバリゼーションは発展途上国における心臓病の危険因子の蔓延に寄与していると考えられます。したがって、IHDの研究はますます緊急になりつつあります 2.
心血管疾患の実験モデルは、疾患のメカニズム、診断の正確さ、新しい治療法の開発を研究するために重要です。いくつかの実験モデルは、多くの研究室によって提案されています。大きな利点を持つモデルを選択することが最も重要です。人間の病気に対する実現可能性、再現性および類似性は、心血管疾患モデル3の選択における重要な要因である。ヒト誘導多能性幹細胞(hiPSC)は、特定の心筋症関連変異を有する動物モデル4に代わる有望な代替物である。iPSC,,95,6,7,8,96,7を用いて心筋細胞を5誘導する戦略は数多く記載されているが、ここでは、マーカーを用いた心筋細胞の手間の選定が行われていないhiPSCと区別した心筋細胞を用いてIHDモデルを作製する簡単な方法を提供する。8この方法では、自然収縮を解析して機能的に心筋細胞を選択する。
HIPSCを用いた心筋細胞の誘導は、動物の犠牲や技術的に困難な手術を避ける。IHDの動物モデルを確立するには、挑戦的な外科技術10が必要です。げっ歯類の生理学から心拍数や行動電位などの人間の心臓病の様々な病態生理学的側面を完全にシミュレートすることはほぼ不可能です。動物モデルを用いた道徳や倫理と相まって、動物モデル以外の新しい実験モデルの開発が不可欠です。ヒトiPS細胞から分化した心筋細胞は、ヒトの心臓の生理学的状態をよりよく模倣する。このプロトコルでは、HiPS細胞(hiPS-CM)由来の心筋細胞を用いたIHDモデルを確立する。我々のモデルでは、酸素とグルコースの欠乏は、hiPS-CMの収縮力と生存率の低下につながります。我々の方法は、モデルIHDへの新しいアプローチを提供し、この疾患の研究のための新しいプラットフォームを示しています。
プロトコル
1. hiPSC メンテナンス文化
- 6ウェルの培養プレートにラミニン(材料表)を貼り付けます。
- リン酸緩衝生理食塩水(PBS)でラミニンを0.5 μg/mLに希釈します。
- 希釈したラミニンを6ウェルプレートに2.0 mL/wellのボリュームで加えます。
- プレートを37°Cで30分間インキュベートします。
- 井戸からラミニン溶液を取り除きます。
- iPSC維持培地(材料表)の2mLにヒPSCを、表面を乾燥させることなく3×4細胞/ウェルの密度でコーティングされた井戸に播種します。
- ハイポスティクスをサブカルチャーします。
- 0.5×細胞解離酵素(材料表)溶液を調製する。
- 0.5 M エチレンジアミネトラ酢(EDTA)と10 mLのPBSを混ぜて0.5 mM EDTA/PBSを作ります。
- 10mLの1×0mLの細胞解離酵素を0.5×に希釈し、0.5mEDTA/PBSの10mLを加えた。
- 井戸から使用済み培地を吸引する。
- 2 mL/ウェルのPBSを加えて細胞を洗浄し、PBSを捨てます。
- 0.5×の細胞解離酵素を800μL加え、5%CO2を含む加湿インキュベーターで37°Cで7分間培養する。2
注意: 0.05% トリプシン-EDTAは細胞の解約に使用できます。 - 0.5×細胞解離酵素溶液を静かに除去します。
- 2 mL PBSで細胞を洗浄し、その後、PBSを捨てます。
注:細胞解離酵素溶液を添加した後、細胞が容易に剥離するので、穏やかである。 - 10 μM Y-27632 を含む iPS メンテナンスメディア (表) を 1 mL 追加します。
注: Y-27632 を追加すると、hipscs の生存率が増加します。 - 細胞スクレーパーを使用して細胞を取り出し、15 mL遠心分離管に集めます。
- セルの数をカウントします。10 μM Y-27632 を含む iPS メンテナンスメディアを追加して、セル密度を 1.5 × 10個の 4セル/mL に調整します。
メモ:細胞の損傷を防ぐために遠心分離を使用しないでください。 - ラミニンコーティングされた6ウェルプレート上の細胞混合物の種子2 mL(最終密度:3×104細胞/ウェル)。
- 5%CO2を含む加湿インキュベーターで37°Cの細胞をインキュ2ベートする。
- 1日目、4日目、5日目、6日目に、Y-27632を使用せずに、培養培地をiPSメンテナンス培地に交換します。
- 0.5×細胞解離酵素(材料表)溶液を調製する。
- 7日目に細胞をサブ培養する。
注:hiPSCのランダムな分化を阻害するために、7日目までに細胞をサブ培養します。
2. HIPSCの心臓分化誘導
- ラミニン(材料表)で96ウェルの培養プレートをコーティングします。
- PBSでラミニンを1.675 μg/mLに希釈します。
- 希釈したラミニン溶液を0.1 mL/wellの体積で96ウェルプレートに加えます。
- プレートを37°Cで30分間インキュベートします。
- 3×の密度で96ウェルプレートにハイプスをシード/ウェル。4
- 5%CO2を含む加湿インキュベーターで37°CでHIPSCを増殖2させる。
- 1日後、培地を200 μL/well iPS成長培地(資料表)に交換してください。
- 細胞が70%から80%の合流度に達するまで、さらに2〜3日間、培地を毎日変更してください。
- 差別化メディアを適用します。
- 使用済み培地を吸引し、事前に温めた分化培地A(材料表)の200 μL/wellにゆっくりと交換してください。
- プレートを5%CO2を含む加湿インキュベーターに37°Cに2入れる。
- 48時間後、培地を吸引し、ゆっくりと200 μL/ウェルの事前温分化培地B(材料表)に交換してください。
- プレートを5%CO2を含む加湿インキュベーターに37°Cに2入れる。
注: 差別化メディアを新鮮に保つのは 非常に重要 です。彼らは徐々に彼らの分化効果を失います, 通常2週間以内に.必要に応じて、アリコート新鮮な培地と-20 °Cで保存します。
- 心筋細胞維持培地を適用する。
- 48時間後、培地を吸引し、温める前の心筋細胞維持培地(材料表)の200μL/wellにゆっくりと交換してください。
- プレートを5%CO2を含む加湿インキュベーターに37°Cに2入れる。
- 心筋細胞分化培地を1日おきに30日目まで交換します。
注:分化メディアAとBの適用期間を正確に48時間に設定して、分化に必要な遺伝子の正確な発現シーケンスを確保することが重要です。
3. 虚血への暴露
- 栄養素と酸素の培養培地を奪う。
- グルベッコの修飾イーグル培地(DMEM)をブドウ糖と血清なしで準備します。
- hiPS-CMを含む96ウェルプレートのウェルから吸気培地を吸引する。
- 200 μL/wellの体積で、栄養を奪われた培地を井戸に加えます。
- 培養プレートを低酸素インキュベーター(材料表)に入れる。
- 窒素ガスを注入し、24時間5%で2%およびCO2 濃度の内部酸素濃度を維持した。
- 目的の分析に進みます: 例えば、生存率アッセイ、収縮性の評価、または細胞損傷の評価。
MTTアッセイを用いた細胞生存率の評価
- MTTアッセイキット(材料表)を使用して、細胞の生存率を定量的に評価します。
注:DMEMで1mM過酸化水素に1時間曝露すると、細胞に損傷を与えることができます(正のコントロール)。DMEMで0 mM過酸化水素への曝露は、陰性制御に使用することができる。- 繰り返しピペットを使用して細胞に10μLのMTT試薬を加えます。
- 軌道シェーカーで1分間やさしく混ぜます。
- 5%CO2インキュベーターで37°Cで3〜4時間細胞を2インキュベートします。インキュベーション後、細胞内で産生されるフォルマザンは、ウェルの底部に暗い結晶として現れます。
- 上清を除去した後、不溶性フォルマザン結晶をジメチルスルホキシド溶液(DMSO)の100μLに溶解する。この溶液は、フォルマザン結晶を溶解し、紫色の溶液を生成します。
注意: DMSOは目、呼吸器系、皮膚を刺激する可能性があります。適切な手袋と目/顔保護を着用してください。 - 波長570nmのマイクロプレートリーダーで各サンプルの吸光度を測定します。
5. iPS-CMの契約性評価
- インストールされていない場合は、https://sites.google.com/site/qingzongtseng/pivでパーティクルイメージVelocimetry ImageJプラグイン11 を入手してインストールします。
- 位相コントラスト顕微鏡を使用して、約10秒間に約20フレーム/秒で4×対物レンズを使用してhiPS-CMのビデオ画像を記録し、「analyze.avi」として保存します。虚血前後の収縮性の比較については、関心のある場所が記録されていることを確認する。
注意:自動ステージを備えた顕微鏡は、対象の場所をターゲットにするのに便利です。ムービー ファイルは、後で分析できるように .avi 形式にする必要があります。見えない場合は、ムービーを .avi に変換します。 - 図 1に示すようにフォルダ構造を作成します。"joblist.txt" の例は補助ファイルに示されています。
- 細胞変位の離散的な2次元ベクトル場を解析する。
- フィジー (ImageJ) ソフトウェア12を起動し、 プラグイン > マクロ > 編集 して "vector_analysis.ijm" (補足コーディング ファイル) に移動します。
- [ ファイルを実行 ]をクリックします。解析は自動的に実行されます。
注: 変位ベクトル D(x,y)は、参照フレーム(最初のフレーム)とそれ以降のすべてのフレーム(フレーム1対2、1対3、1対4など)の間の16×16ピクセルごとに計算されます。結果は、すべてのフレームに対して計算され、"vec_x.txt"(x はフレーム番号) として保存されます。最大変位のベクトル M(x, y)は、(x, y) ペアごとに次のように定義されます。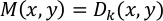
ここで kは、 |Dk (x,y)| = 最大 [|D2 (x,y)||D3 (x,y)|., |Dn (x,y)|]n は最後のフレームを示します。結果は "Max_vector.txt" として保存されます。|M(x, y)|は、分析ポイント(x,y)における心筋細胞収縮によって生じる最大変位を表します。任意の単位での契約値Cは、次のように計算されます。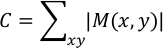
この値は、"Max_vector.txt" の列 7、行 1 に保存されます。C は、すべての変位の合計を表します (x, y)。心筋収縮による変位が大きい部分が大きいほど、Cの値が大きくなる。最大変位のベクトルフィールド M(x, y)は、最初のフレーム(「Phase_contrast.png」)の位相コントラストイメージでオーバーレイされ、「オーバーレイ.png」として保存されます。変位ベクトルの大きさは、ビデオの第1フレームに基づいて計算されるので、hiPS-CMが第1フレームの日座期を安静にすることが好ましい。
フローサイトメトリーによる細胞損傷の評価
- ヨウ化プロピジウムの1mg/mL溶液をPBSで1:1,000に希釈します。
- 取り外した細胞をヨウ化プロピジウムで染色する。
- 培地を吸引し、適当なサイズの遠心分離チューブに入れる。
- チューブを1,000×gで5分間遠g心し、沈降細胞を失わないように上清を慎重に取り除きます。
- 希釈したヨウ化プロピジウム溶液を暗所で15分間室温で培養します。
- チューブを1,000×gで5分間遠g心し、沈降細胞を失わないように上清を慎重に取り除きます。
- PBSの約1mLで細胞を再構成する。
注:細胞の損傷を正確に定量化するには、分離された浮遊細胞を媒体から収集することが重要です。
- 染色は、ヨウ化プロピジウムと結合した細胞.
- 取り付けた細胞をPBSで2回洗い、PBSを捨てます。
- 希釈したヨウ化プロピジウム溶液を暗で15分間インキュベートします。
- ヨウ化プロピジウム溶液を吸引する。
- 0.25%トリプシンを使用してセルを取り外します。細胞溶液を遠心管に移動します。
- チューブを1,000×gで5分間遠g心し、沈降細胞を失わないように上清を慎重に取り除きます。
- PBSの約1mLで細胞を再構成する。
- 蛍光活性化細胞分類(FACS)分析のために浮遊細胞と付着した細胞を混合する。
- 30 μmのフィルターを通してセル溶液を渡します。
メモ:正確なFACS測定のために、フィルタにセルを渡すことは非常に重要です。 - FACS システムを使用してサンプルを分析します。
7. 免疫染色
- セルサンプルを固定します。
- 培地を吸引する。
- PBSに4%パラホルムアルデヒドを室温で10分間加えます。
- PBSで細胞を3回洗います。
注:新鮮なパラホルムアルデヒド溶液は、最適な固定のために推奨されます。
- 0.2%トリトンX-100で細胞を15分間透過させ、試薬を捨てます。
- 3%のウシ血清アルブミンを加えて細胞を30分間ブロックします。
- 一次抗体を適用します。
- 培養プレートからウシ血清アルブミン溶液を捨てる。
- 一次抗体を4°Cで一晩インキュベートする。
- 抗体溶液を除去します。
- PBSで細胞を3回洗います。
- 二次抗体を適用する。
- 培養プレートからPBS溶液を廃棄する。
- 暗い温度で30分間二次抗体で細胞をインキュベートします。
注:一次抗心トロポニンT(TNNT2)マウスモノクローナル抗体は、3%BSAで1:750の希釈で使用されます。Alexa Fluor 488-共役二次ヤギ抗マウス抗体は、3%BSAで1:1,000に希釈されます。
- 核およびアクチン繊維の付加的な染色。
- 抗体溶液を除去します。
- 細胞を核染色試薬(材料表)にインキュベートし、PBSで暗い温度で30分間、アクチン染色試薬(材料表)をインキュベートします。
注:4'、6-ジミディノ-2-フェニリンドール(DAPI)またはHoechst 33342は、核染色に使用することができます。 - PBSで細胞を3回洗います。
- 蛍光顕微鏡を使用して蛍光画像をキャプチャします。
結果
正常に分化した細胞は、顕微鏡下での自発的な収縮を示す(ビデオ1)。通常、ウェルの50%は<20日で自発的な収縮を示す(補足図1)。心臓マーカータンパク質(例えば、cTnT)は、正常な分化を確認するために使用することができる(図2)。
典型的には、虚血性基からの細胞は、MTTアッセイ(図3A)および収縮性(図3E,F、補足図2)において、ノルモキシ性対照群の細胞よりも低い生存率を示す。また、ヨウ化プロピジウム陽性細胞の割合は、細胞の損傷が高いことを示す対照群(図3B–D)よりも虚血性群において高い。

図1 imageJを用いた変位ベクトル解析用のフォルダ構造
"joblist.txt" は、各行の動画ファイルへのパスを記述します。分析するファイルが 3 つある場合、"analyze.avi" (対象のムービー) を配置する 3 つのフォルダー (movie1、movie2、および movie3) があります。"vector_analysis.ijm" コードで解析を実行すると、各ムービー フォルダにファイルが生成されます(青で示されます)。各ファイルに格納されている情報は、本文で詳しく説明されています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
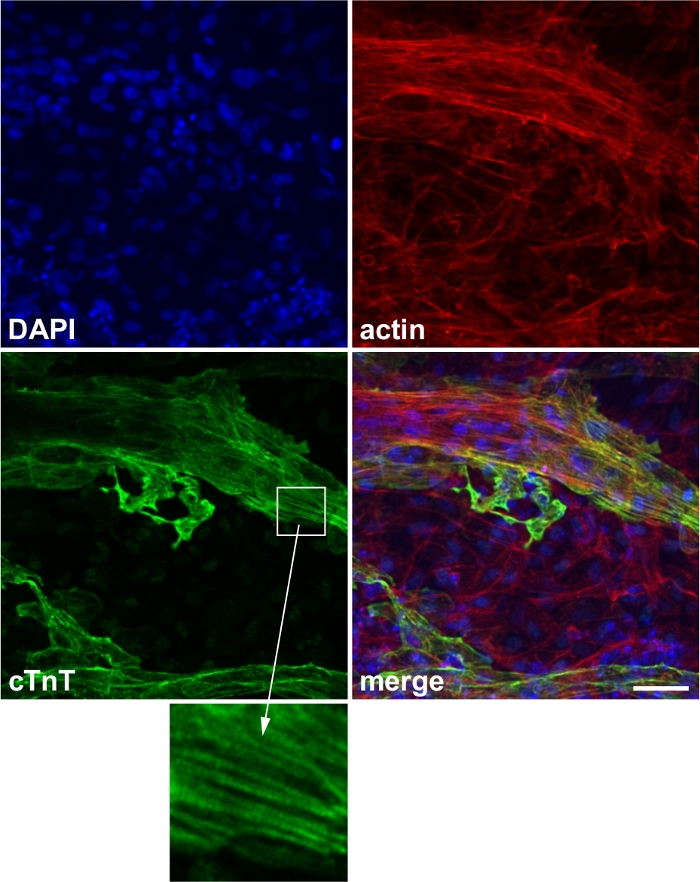
図2:心臓マーカー染色の代表的な画像。
心臓マーカータンパク質心トロポニンT(cTnT)の発現。青:4',6-ジミジノ-2-フェニリンドール(DAPI)、赤:アクチン、グリーン:cTnT。インセット:サルコメア構造に対応するcTnTの線条化式。スケールバー、50 μm。この図はWeiら13から修正されました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
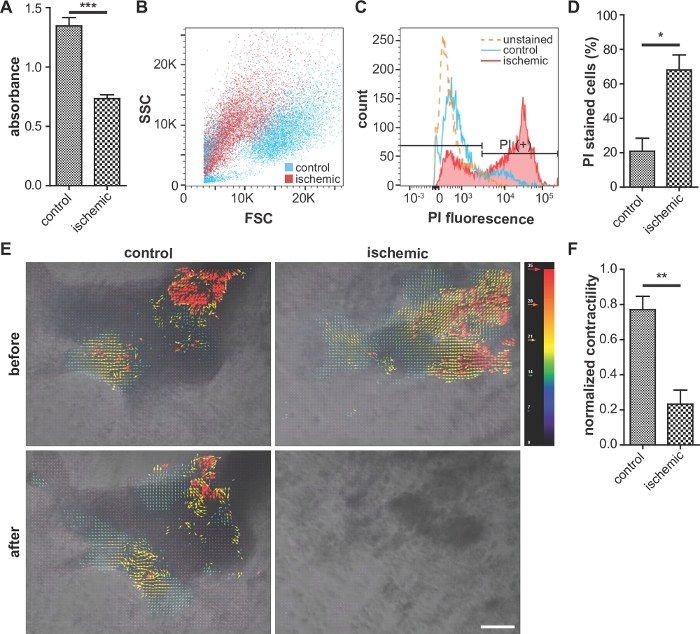
図3:細胞生存率アッセイ、細胞損傷評価、収縮性の代表的な画像。
(A)細胞生存率の比較(MTTアッセイ)。吸光度が高いほど、生存率が高いことを示します。 n = 各条件に対して 5。(B、C、D)ヨウ化プロピジウム(PI)染色細胞のフローサイトメトリー解析虚血性細胞は、コントロールと比較して、前方散乱強度の低下およびPI蛍光の増加を示す。(D)フローサイトメトリー分析におけるPI染色細胞の割合。 n = 各条件の 3。(E) ImageJ ソフトウェアを用いた iPS-CM の契約性の分析赤と青のベクトルは、それぞれ最大および最小の収縮を示します。スケールバー、100 μm。(F) コードを用いたiPS-CM契約の定量分析 n = 3 は制御 、n = 虚血状態の場合は 8。誤差範囲は平均の標準誤差を表します。統計分析では、ペアになっていない両側のスチューデントのt検定が行われました。*: p < 0.05, **: p < 0.01.: p < 0.0001.この図はWeiららから引用されていますこの図のより大きなバージョンを表示するには、ここをクリックしてください。
ビデオ1:分化細胞は顕微鏡下での自発的な収縮を示す。こちらをクリックして、このビデオをダウンロードしてください。
補足図1:自発的収縮のないサンプルの割合のカプランマイヤー分析。 iPS-CMサンプルの50%は20日目に収縮を示した。30日目には、サンプルの64.4%が収縮を示した。 n = 83。 こちらをダウンロードしてください。
補足図2:心臓の収縮の評価 収縮性Cを解析ポイント数で割ったスケーリングされた収縮性(x,y)は、24時間低酸素への曝露前後の制御および虚血基についてプロットした。 n = 3 は制御 、n = 虚血状態の場合は 8。 こちらをダウンロードしてください。
補足図3:心筋細胞の含有量の評価 96ウェルプレート上の心臓マーカータンパク質の免疫染色。緑: cTnT, ブルー: DAPI.分化した細胞の割合は、cTnT染色領域の面積をDAPI染色領域の面積で除算することにより、20.7±9.6%であると計算した。スケールバー = 1 mm. n = 4 制御条件。 こちらをダウンロードしてください。
補足コーディング ファイル。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
研究者は、多くの場合、IHD実験を行うために実験室の小動物モデルを使用しています.そこで、このような実験を行うヒトIHDの細胞培養モデルを開発しました。
このプロトコルのユーザーが直面する主な問題は、分化された心筋細胞の低率である。正常な分化の速度を改善するために細心の注意を払って行う必要があります:(a)細胞解離酵素試薬の添加後に容易に切り離す細胞、(b)Y-27632を添加すると、分離時のiPS細胞の生存率が増加し、(c)分化の開始時の培地変化のタイミングは、異なる遺伝子の分解を確実にするために正確に48時間でなければならない。
培養プレートの表面をコーティングするために使用される細胞外マトリックスタンパク質に関しては、このプロトコルで使用したラミニン以外の材料も使用できます。例えば、Matrigel14、15、およびゼラチン14,16、17,17は、hiPSCのフィーダーフリー維持培養に使用される。原口らによると、マトリゲルに播種されたhiPSCは、心臓細胞シート18に正常に分化された。
HIPSC由来の心筋細胞を用いた疾患モデルモデルの培養モデルに関する先行研究が数多く行われている。虚血再灌流損傷のモデル化に関しては、高カリウム血症、アシドーシス、乳酸蓄積などの細胞環境の操作が導入された19.他の方法としては、酸素拡散20 を妨げる細胞ペレット化やシアン化物21を用いた代謝抑制が挙げられる。現在のプロトコルでは、細胞損傷は比較的単純な方法、すなわち酸素および栄養素の24時間の剥奪によって達成された。しかし、3次元細胞環境や血液の有無など、生体内疾患と現在のプロトコルの疾患モデルとの間には確かに違いがあるので、虚血性心疾患の正確な病態生理学的プロセスを考慮するように注意する必要があります。
心筋細胞機能の評価の技術的側面について、ToepferらはhiPS-CM22におけるサルコメア収縮および弛緩を決定するMatLabベースのアルゴリズムを報告した。22Smithらは、hiPS-CMに由来する興奮性細胞の高スループット電気生理学的解析の高度な方法を報告し、高度なナノトポグラフィパターン多電極アレイ23,24,24を用いた。私たちのプロトコルの利点は、imageJソフトウェアや96ウェルプレートなどの従来のソフトウェアと消耗品しか必要としなくていいということです。
心臓の酸素濃度に関しては、心臓に到達する静脈の酸素圧力は40mmHg25と考えられている。McDougalらのご報告によると、低酸素下の細胞外酸素圧は<12.8mmHg26であると推定される。ラウンドスら27の方法を適用することにより、現在のプロトコルで処理された37°Cの低酸素状態(2%酸素)下の培養培地中の酸素圧力(35‰)は、上記の推定値より高い14.9mmHgであると計算される。興味深いことに、Al-Aniらは、培養培地中に酸素圧の勾配があり、酸素圧力が細胞型、播種密度、および中容積28の影響を受けていることを報告した。典型的には、細胞が存在する培養プレートの底部の酸素濃度が最も低い。したがって、培養培地における深さの効果は、hiPS-CMの近傍の有効な酸素圧力をさらに低下させるであろう。低酸素状態を用いてhiPS-CMに十分な損傷を与えるためには、培地の深さと細胞の密度に細心の注意を払う必要があります。
ヒト心臓筋細胞の生理的条件に非常に近いhiPS-CMモデルは、有利にヒトIHDを模倣する。動物モデルに基づくアプローチには、倫理的、技術的、学術的な問題が含まれます。特に、生体内モデルでは、再現性データを達成するためのマイクロサージャリーの高度な技術が必要である:例えば、げっ歯類3における左冠動脈の前下方枝の閉塞。本明細書に記載されているhiPS-CMモデルは、これらの重大な障壁を克服し、心血管疾患に有用で、関連性があり、反復可能なプラットフォームを提供する。
ただし、いくつかの制限に注意する必要があります。iPS誘導型心筋細胞と正常心筋細胞の明らかな違いはT-tubule29の欠如であり、白血球によって引き起こされる組織損傷や補体系の活性化などの体液性因子は含まれていなかった。また、このモデルにおける分化心筋細胞の割合(20.7±9.6%、 補足図3)を改善する必要があります。最近の出版物は、マーカー30による選択を必要とせずに化学WNT経路変調器によって>95%のhiPS-CM純度を誘導するスケーラブルで化学的に定義された方法を説明している。それにもかかわらず、ヒトIHDのモデルは比較的単純で臨床的に適用可能です(例えば、患者由来のiPS細胞を用いた薬物スクリーニング)。また、当社のモデルは、基礎となるIDのメカニズムをさらに解明するためのユニークなプラットフォームでもあります。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、JSPS KAKENHI(国際共同研究推進基金)17KK0168によって支援されました。著者らは、FACSの支援を受け入れた岡山大学医学部中央研究所を認めている。
資料
| Name | Company | Catalog Number | Comments |
| Actin staining reagent (ActinRed 555 ReadyProbes Reagent) | Thermo Fisher Scientific, Waltham, MA, USA | R37112 | |
| Anti cardiac troponin T antibody | Thermo Fisher Scientific, Waltham, MA, USA | MA5-12960 | |
| Cardiomyocyte maintenance medium (PSC Cardiomyocyte Differentiation Kit) | Thermo Fisher Scientific, Waltham, MA, USA | A2921201 | |
| Cell dissociation enzymes (TrypLE Select) | Thermo Fisher Scientific, Waltham, MA, USA | 12563011 | |
| Differentiation medium A (PSC Cardiomyocyte Differentiation Kit) | Thermo Fisher Scientific, Waltham, MA, USA | A2921201 | |
| Differentiation medium B (PSC Cardiomyocyte Differentiation Kit) | Thermo Fisher Scientific, Waltham, MA, USA | A2921201 | |
| FACS Aria III system | BD Biosciences, San Jose, CA, USA | ||
| Fluorescenct microscope | KEYENCE, Osaka, Japan | BZ-X710 | |
| Goat anti-mouse Alexa Fluor 488 secondary antibody | Thermo Fisher Scientific, Waltham, MA, USA | A28175 | |
| Human iPS cells | RIKEN, Tsukuba, Japan | 201B7 | |
| Hypoxic incubator | SANYO, Osaka, Japan | MCO-175M | |
| iPSC growth medium (Essential 8 Medium) | Thermo Fisher Scientific, Waltham, MA, USA | A1517001 | |
| iPSC maintenance medium (StemFit AK02N) | Ajinomoto, Tokyo, Japan | RCAK02N | |
| Laminin (iMatrix-511) | Nippi, Tokyo, Japan | iMatrix-511 | |
| MTT assay kit (MTT Cell Proliferation Assay Kit) | Cayman Chemical Company, Ann Arbor, MI, USA | 10009365 | |
| Nucleus staining reagent (NucBlue Fixed Cell ReadyProbes Reagent) | Thermo Fisher Scientific, Waltham, MA, USA | R37606 | |
| Triton X-100 | Nacalai Tesque, Kyoto, Japan | 35501-02 |
参考文献
- Naghavi, M. Global Burden of Disease Self-Harm, C. Global, regional, and national burden of suicide mortality 1990 to 2016: systematic analysis for the Global Burden of Disease Study 2016. BMJ. 364, 94(2019).
- Nowbar, A. N., Gitto, M., Howard, J. P., Francis, D. P., Al-Lamee, R. Mortality From Ischemic Heart Disease. Circulation: Cardiovascular Quality and Outcomes. 12 (6), 005375(2019).
- Oh, J. G., Ishikawa, K. Experimental Models of Cardiovascular Diseases: Overview. Methods in Molecular Biology. 1816, 3-14 (2018).
- Brodehl, A., et al. Human Induced Pluripotent Stem-Cell-Derived Cardiomyocytes as Models for Genetic Cardiomyopathies. International Journal of Molecular Sciences. 20 (18), (2019).
- Garbern, J. C., et al. Inhibition of mTOR Signaling Enhances Maturation of Cardiomyocytes Derived from Human Induced Pluripotent Stem Cells via p53-Induced Quiescence. Circulation. , (2019).
- Horikoshi, Y., et al. Fatty Acid-Treated Induced Pluripotent Stem Cell-Derived Human Cardiomyocytes Exhibit Adult Cardiomyocyte-Like Energy Metabolism Phenotypes. Cells. 8 (9), (2019).
- Hu, D., et al. Metabolic Maturation of Human Pluripotent Stem Cell-Derived Cardiomyocytes by Inhibition of HIF1alpha and LDHA. Circulation Research. 123 (9), 1066-1079 (2018).
- Correia, C., et al. Distinct carbon sources affect structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Scientific Reports. 7 (1), 8590(2017).
- Yang, X., et al. Tri-iodo-l-thyronine promotes the maturation of human cardiomyocytes-derived from induced pluripotent stem cells. Journal of Molecular and Cellular Cardiology. 72, 296-304 (2014).
- Tamargo, J., et al. Genetically engineered mice as a model for studying cardiac arrhythmias. Frontiers in Bioscience. 12, 22-38 (2007).
- Tseng, Q., et al. Spatial organization of the extracellular matrix regulates cell-cell junction positioning. Proceedings of the National Academy of Sciences of the United States of America. 109 (5), 1506-1511 (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Wei, H., Wang, C., Guo, R., Takahashi, K., Naruse, K. Development of a model of ischemic heart disease using cardiomyocytes differentiated from human induced pluripotent stem cells. Biochemical and Biophysical Research Communications. 520 (3), 600-605 (2019).
- Ghaedi, M., Niklason, L. E. Human Pluripotent Stem Cells (iPSC) Generation, Culture, and Differentiation to Lung Progenitor Cells. Methods in Molecular Biology. 1576, 55-92 (2019).
- Hou, J., et al. Retaining mTeSR1 Medium during Hepatic Differentiation Facilitates Hepatocyte-Like Cell Survival by Decreasing Apoptosis. Cellular Physiology and Biochemistry. 51 (4), 1533-1543 (2018).
- Yoshida, K., et al. Differentiation of mouse iPS cells into ameloblast-like cells in cultures using medium conditioned by epithelial cell rests of Malassez and gelatin-coated dishes. Medical Molecular Morphology. 48 (3), 138-145 (2015).
- Guzzo, R. M., Drissi, H. Differentiation of Human Induced Pluripotent Stem Cells to Chondrocytes. Methods in Molecular Biology. 1340, 79-95 (2015).
- Haraguchi, Y., Matsuura, K., Shimizu, T., Yamato, M., Okano, T. Simple suspension culture system of human iPS cells maintaining their pluripotency for cardiac cell sheet engineering. Journal of Tissue Engineering and Regenerative. 9 (12), 1363-1375 (2015).
- Chen, T., Vunjak-Novakovic, G. In vitro Models of Ischemia-Reperfusion Injury. Regenerative Engineering and Translational Medicine. 4 (3), 142-153 (2018).
- Strijdom, H., Genade, S., Lochner, A. Nitric Oxide synthase (NOS) does not contribute to simulated ischaemic preconditioning in an isolated rat cardiomyocyte model. Cardiovascular Drugs and Therapy. 18 (2), 99-112 (2004).
- Cavalheiro, R. A., et al. Potent cardioprotective effect of the 4-anilinoquinazoline derivative PD153035: involvement of mitochondrial K(ATP) channel activation. PLoS One. 5 (5), 10666(2010).
- Toepfer, C. N., et al. SarcTrack. Circulation Research. 124 (8), 1172-1183 (2019).
- Smith, A. S. T., et al. NanoMEA: A Tool for High-Throughput, Electrophysiological Phenotyping of Patterned Excitable Cells. Nano Letters. , (2019).
- Smith, A. S., Macadangdang, J., Leung, W., Laflamme, M. A., Kim, D. H. Human iPSC-derived cardiomyocytes and tissue engineering strategies for disease modeling and drug screening. Biotechnology Advances. 35 (1), 77-94 (2017).
- Sitkovsky, M., Lukashev, D. Regulation of immune cells by local-tissue oxygen tension: HIF1 alpha and adenosine receptors. Nature Reviews Immunology. 5 (9), 712-721 (2005).
- McDougal, A. D., Dewey, C. F. Modeling oxygen requirements in ischemic cardiomyocytes. Journal of Biological Chemistry. 292 (28), 11760-11776 (2017).
- Rounds, S. A., Wilde, F. D., Ritz, G. F. Chapter A6. Section 6.2. Dissolved oxygen. Report No. 09-A6.2. , Reston, VA. (2006).
- Al-Ani, A., et al. Oxygenation in cell culture: Critical parameters for reproducibility are routinely not reported. PLoS One. 13 (10), 0204269(2018).
- Cadet, J. S., Kamp, T. J. A Recipe for T-Tubules in Human iPS Cell-Derived Cardiomyocytes. Circulation Research. 121 (12), 1294-1295 (2017).
- Halloin, C., et al. Continuous WNT Control Enables Advanced hPSC Cardiac Processing and Prognostic Surface Marker Identification in Chemically Defined Suspension Culture. Stem Cell Reports. 13 (2), 366-379 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved