Method Article
分子動力学シミュレーションによるEGFR体型変異の活性化の構造効果の解読
要約
このプロトコルの目的は、分子動力学シミュレーションを用いて、EGFRキナーゼタンパク質の活性化変異に起因する動的構造変化を調べることである。
要約
表皮成長因子受容体(EGFR)ファミリーの受容体チロシンキナーゼ(RTK)の多くの体細胞変異が癌患者から報告されているが、比較的少数の試験が行われ、Erbに機能的変化を引き起こすことが示されている。ErbB受容体はリガンド結合時に二量体化され活性化され、受容体の動的な立体構造変化は下流シグナル伝達の誘導に固有である。EGFR関数を変化させるために実験的に示された2つの変異、A702VおよびΔ746ELREA750 欠失変異について、分子動力学(MD)シミュレーションが野生型EGFRと比較して変異型チロシンキナーゼ構造の(1)立体構造安定性を探査する方法を次のプロトコルで示す。(2)構造的な結果と立体構造の推移と、観察された機能的変化との関係(3) 結合ATPの強度に及ぼす変異の影響、ならびに活性化された非対称二量体におけるキナーゼドメイン間の結合に対する影響;(4)活性化酵素に関連するEGFR結合部位内の主要な相互作用に対する突然変異の影響。このプロトコルは、構造力学と生物学的機能との関係を調査する手段として、MDシミュレーションを用いたタンパク質構造の調査に役立つ詳細なステップバイステップの手順とガイダンスを提供します。
概要
受容体チロシンキナーゼ(RTKs)のヒト上皮成長因子受容体(EGFR)ファミリー(ErbB)には、EGFR/ErbB1/HER1、ErbB2/HER2、ErbB3/HER3およびErbB4/HER4の4つのメンバーが含まれています。ErbB受容体は、細胞の増殖および増殖、分化、移動および生存11、22などの基本的な細胞プロセスを調節し、したがって強力な原始腫瘍遺伝子である。ErbB受容体の異常な活性は、特にEGFRおよびErbB2は、癌治療のための主要な標的であるErbB受容体を作るヒト癌にしばしば関連している22、3。3
ERBB遺伝子のいくつかの体細胞変化は、ヒト悪性腫瘍33、4、54,5から報告されている。最も特徴ある例としては、非小細胞肺癌(NSCLC)におけるEGFRキナーゼドメインにおける再発、活性化点突然変異および短いフレーム内欠失が含まれる。これらのEGFR突然変異は、癌増殖の主要な要因を表し、癌治療薬66、7、87を標的とするEGFRに対する感受性を8予測する。しかし、ほとんどの癌において、EGFRにおける体細胞突然変異は、これらの再発性の「ホットスポット」の外で起こり、受容体の全1210残基スパンにわたって分布している。実際、EGFRの一次配列に沿った残基のほとんどは、ヒト癌9において変異することが判明している。それにもかかわらず、いくつかのホットスポットとは別に、癌関連EGFR突然変異の大部分の機能的意義は不明のままである。
ErbBsの単量体構造は、細胞外の大きなアミノ末端から構成され、続いて細胞内チロシンキナーゼドメインとC末端の尾部領域に至る膜貫通ヘリックスが、細胞内シグナル伝達タンパク質のドッキング部位を含む。リガンド結合は細胞外ドメインの劇的な立体構造変化を引き起こし、互いに対称的に交差し、それらの芳香/疎水性表面と相互作用する二量体化アームを露出させることによって受容体二量体の形成を促進する。受容体二量体形成の際にチロシンキナーゼドメインが非対称的に接触し(図1)、受容体モノマーのC末端尾をリン酸化するキナーゼの活性化をもたらし、その後、下流シグナル10,11,11の活性化を行う。
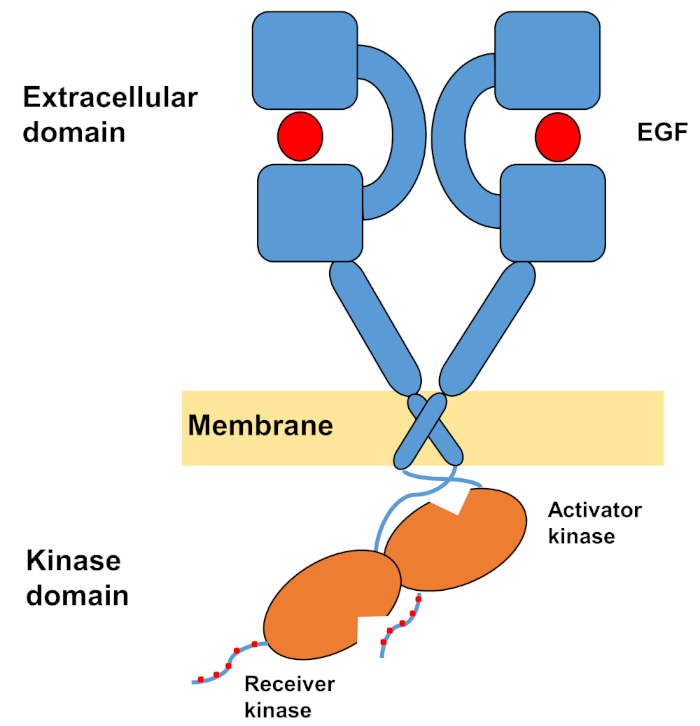
図1:EGFRダイマーの構造。EGFRは、細胞外ドメインが成長因子(EGF、上皮成長因子)に結合すると二量体化する。次いで、受信機キナーゼドメインは活性化因子キナーゼドメインとの非対称相互作用によって活性化され、C末端尾部はチロシン残基で自己リン酸化される(タミラットらから改変)。この図の大きなバージョンを表示するには、ここをクリックしてください。
単量体二量体移行中に起こる動的な構造再調整のために 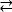 、非対称二量体の形成に関連するキナーゼ活性化と共に、受容体構造の全長に沿った突然変異は、受容体機能に影響を及ぼす可能性がある。ここでは、変異と可視化のモデリングが機能の結果を説明するのに十分であった我々の以前の研究からいくつかの例を説明する。
、非対称二量体の形成に関連するキナーゼ活性化と共に、受容体構造の全長に沿った突然変異は、受容体機能に影響を及ぼす可能性がある。ここでは、変異と可視化のモデリングが機能の結果を説明するのに十分であった我々の以前の研究からいくつかの例を説明する。
実施例1:報告された変異の1つ、ErbB413におけるD595Vは、ErbB4二量体化およびリン酸化14の増加につながった。変異の位置の可視化は、観察された機能的効果を理解する上で重要な要因であった:D595Vは、エクストドメインの二量体アームの対称的な交差で起こった(図2A)。腕は主に芳香族および疎水性であり、そして、バリンによる極性アスパラギン酸の置換は、二量体を安定させ、したがってリン酸化が起こる時間の長さを増加させる「粘着性」疎水性相互作用を増加させることが期待されるであろう。最初は各腕にアスパラギン酸塩を見つけることは驚きでしたが、振り返ってみると、極酸側鎖が無傷の二量体の親和性と寿命を低下させ、キナーゼ媒介リン酸化とシグナル伝達を制限する活動のタイミングメカニズムと考えるかもしれません。valineによる交換は、ErbB4ダイマーをさらに安定化させることによってこのセーフガードを取り除くだろう。
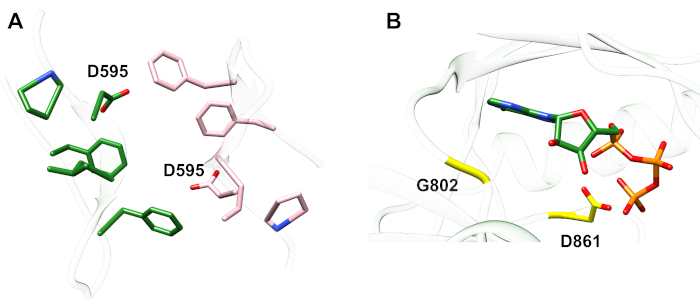
図2:キナーゼ死死性ErbB4を産生するErbB4活性化突然変異および突然変異の位置。 (A) D595 (活性化D595V突然変異) ErbB4エクトドメインモデルの芳香族/疎水性二量体アームに位置しています。成長因子結合に関連する武器;(近くの残基は棒として示される)。(B)ErbB4において、G802(G802dup突然変異を不活性化)は、ATPおよび触媒D861(不活性化D861Y突然変異)のアデニン環の周りに結合ポケットを形成するのに役立つ (D861Y突然変異を不活化する)とATPのγ-リン酸基の両方に結合する。 この図の大きなバージョンを表示するには、ここをクリックしてください。
例2:キナーゼドメインのATP結合部位を標的とする体細胞突然変異が、シグナル伝達ができない障害またはキナーゼ死んだ受容体につながる酵素活性を変化または排除すると予想される。乳房、胃、大腸、またはNSCLC15の患者からの9つの報告された突然変異のうち、試験時の9つの突然変異のうち2つは、リン酸化活性16(G→GG)およびD861Yを非常に減少させた。16両方の不活性化体変異は、チロシンキナーゼドメイン構造のATP結合部位内で発見された(図2B):フレキシブルグリシン、複製された、アデニン環部位を改変し、末端リン酸塩付近の嵩高いチロシンに置き換えられた小さなアスパラギン酸は、Mg2+-ATPの結合を物理的に妨げるだろう。しかし、 ErbB4はErbB2とヘテロダイマーを形成することができるので-ErbB2は成長因子を結合せず、ヘテロ二次化するために行うErbBとの関連に依存する - ErbB2(活性)-ErbB4(キナーゼ死死)ヘテロダイマーは、Erk/Aktシグナル伝達経路を介して細胞増殖を刺激するが、キナーゼ死性ErbB4およびSTAT5経路活性化16の欠如のために細胞は分化しない。
最近の研究では、ErbBの動的な動きは、ErbB機能、特にチロシンキナーゼドメイン内で起こる突然変異に対するいくつかの突然変異の影響を理解することに関連することが明らかになった。チロシンキナーゼドメインは、AtPが結合する触媒部位によって分離されたN-lobe(主にβシート)とC-lobe(主にアルファヘリカル)で構成されています。N-lobeはαCヘリックスとPループを含み、活性化(Aループ)と触媒ループはC-lobe17、18、19,に17,存在する。19チロシンキナーゼドメインの結晶構造は2つの不活性な立体構造を明らかにし、構造の大部分はSrc様不活性状態を有する。アクティブな立体構造では、AtP結合部位に向かうAループ点の触媒的なアスパラギンスとαCヘリックスがATP結合ポケット(「αC-in」の立体構造)に向き、強いグルタミン酸リジンイオンペア相互作用を形成する。
Erbおよび成分キナーゼドメインは非常に動的な実体であり、特に機能および生物学的活性に対する突然変異の影響がErbBsの立体構造状態と密接に関連している可能性が高い場合、それらが経験する動的変化の範囲に関して突然変異を評価することが重要である。ErbBsのX線結晶構造は、突然変異の動的な結果を理解するのに関連する場合と関係ない3D構造の静的スナップショットを提供します。3次元(3D)構造に利用可能な「エネルギーランドスケープ」に対応する動的変化の範囲を探査するために、分子動力学(MD)シミュレーションは広く用いられている20。チロシンキナーゼドメイン内の局所的な立体構造変化または複合体の安定化につながる突然変異の場合、100nsの順序でのシミュレーションで十分であろう。しかしながら、より大きなスケールの立体構造変化(例えば、キナーゼドメインの能動と不活性な立体間の遷移)は、より長いシミュレーション時間を必要とする-マイクロ秒21の順に。
以下に説明するプロトコルに関して、チロシンキナーゼドメイン内の2つの活性化変異を考慮する(図3)。両方の突然変異はキナーゼドメイン内に位置し、キナーゼが活性かどうかを決定する局所的な立体構造変化が発生し、MDシミュレーションは両方のインスタンスに適用された。最初のケースでは、EGFR受信機キナーゼドメインのATP結合部位および触媒機械に直接影響する変化を検討し、NSCLC4,7に広く関与しているエキソン19欠失変異の結果を具体的に調べる。4,7δ746ELREA750突然変異は、αCヘリックスの前のβ3-αCループの長さを減少させる - キナーゼ活性化上の結合/活性部位に向かって移動し、ATPとの相互作用のためのリジンを配置することによって、らせんのE762とK745の間の重要な静電相互作用の形成に関与するらせん-12第2のケースでは、EGFRのA702V突然変異を考慮し、iScreamプラットフォーム9によって明らかにされた新規の機能獲得活性化突然変異であることを示し、NSCLC患者22で同定した。受信機キナーゼドメイン上のアラニン-702は、受信機と活性化剤キナーゼドメインの界面で並膜セグメントB上に位置し、この非対称キナーゼダイマー複合体およびキナーゼ立体構造変化が活性化9に必要である。
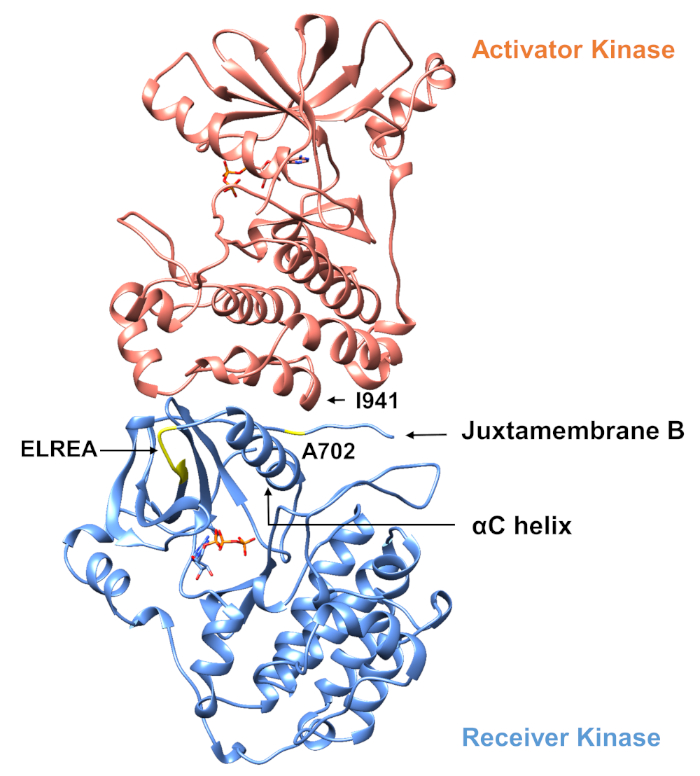
図3:EGFRの非対称キナーゼドメインダイマー。 A702V突然変異は、活性化剤および受信機キナーゼドメインの重要な界面に位置し、αCヘリックスに隣接し、アクチベータキナーゼのイソロイシン941に近い。非対称二量体の形成によって誘導される立体構造変化はキナーゼ活性化を導く。ELREAシーケンスを含むβ3-αCループは、αCヘリックスの直前に起きます。活性化中、αCのらせんはATP結合部位に向かって内側に移動します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
プロトコル
注: Md シミュレーションを使用して、EGFR 構造に対する ΔELREA および A702V 突然変異の影響を調べる詳細な手順を次に示します。
1. 構造準備
注:ΔELREA突然変異の構造的影響を研究するために、野生型および変異型のアポ活性、ATP結合活性およびアポ不活性EGFRモノマー構造は以下のように調製される。
- キメラ23可視化プログラム(https://www.cgl.ucsf.edu/chimera/)を開き、野生型アポ活性EGFRキナーゼ構造を準備します。[ファイル]メニューで[ID でフェッチ] オプションをクリックし、プロテイン データ バンク (PDB24)データベースを選択し、PDB コード2GS2 2525 (2.8 Å 解像度) を指定します。PDBは、X線結晶学、核磁気共鳴分光法、クライオ電子顕微鏡、中性子回折など、さまざまな実験技術によって解決された3D構造のリポジトリです。
- EGFR PDB構造1M14 26(2.6 Å)および3W2S26 27(1.9 Å)からこれらのセグメントを27取り出すことによって、2GS2の不足している構造要素を構築します。これを行うには、1M14 と 3W2S を開き、ツール→構造比較メニューのMatchMakerオプションを使用して 2GS2 に重ね合わせします。
- 1M14および3W2Sから追加するセグメントを切り抜く。2GS2のギャップの前の残基の端子原子と1M14および3W2Sから追加される原子を選択します(追加されたセグメントの詳細については、 表1を参照してください)。コマンドラインで 「ボンド」と 入力し、ヒット を入力します。この構造は 、テンプレート 構造です。
- ステップ1.2のテンプレート構造を使用して、EGFRキナーゼドメインのΔELREA欠失変異体形態を構築する。テンプレート構造のシーケンス (ファイルとして保存→→好きな→シーケンス→ファイル) を保存し、残余番号 746-750 で ELREA シーケンスを削除することにより、ΔELREA EGFR の FASTA フォーマット シーケンスを生成します。
- キメラで ΔELREA EGFR シーケンスを開き、シーケンスメニューを使用して 2GS2 テンプレート構造のシーケンスに合わせます。アライメントウィンドウで、モデラー(相同性)28→構造オプションを28選択します。
- ポップアップウィンドウで、テンプレートとして 2GS2 複合構造を指定し、モデル化するクエリとしてミュータント シーケンスを指定します。次に [OK]を押します。zDOPE スコア (通常は最低スコア) と目視検査に基づいて、結果モデルの中からミュータント モデルを選択します。
- ATP バインド型の野生型 EGFR キナーゼ構造を準備するには、PDB 構造体2ITX 29 (2.98 Å) を主構造体として使用します。ステップ 1.2の手順に従って、構造 2GS625 (2.6 Å) および 3W2S を使用して欠落セグメントを構築します (表 1 を参照)。テキストエディタでPDBファイルを開き、ANPのN3B窒素原子を酸素原子に変更することにより、得られた構造のリガンドANPをATPに変換します。
- ステップ 1.1 で述べたように、キメラでステップ 1.4 の構造を開きます。Mg2+イオンに対して同様の位置を達成するために、PDB構造2ITN 29(2.47Å)からこの構造にマグネシウムイオンを加える。29
- ステップ1.5から得られた構造で、ステップ1.3に従ってΔELREA変異体をモデル化する。
| アポアクティブEGFR | アポ非アクティブEGFR | ATP バインド アクティブ EGFR | |
| 主構造 | 2GS2 | 2GS7 | 2ITX |
| 欠落しているループの構築に使用される構造体 | 1M14 (723-725) | 3W2S (958-984) | 2GS6 (862-865) |
| 3W2S (967-981) | 4HJO (848-850) | 3W2S (990-1001) |
表 1: アポアクティブ、アポ非アクティブ、ATP バインドのアクティブな構造の複合モデルを構築するために使用される構造体。 主構造中の欠損領域(括弧内のアミノ酸範囲)は、リストされた構造から構築した。
- 野生型アポ不活性EGFRキナーゼ構造を調製するために、ステップ1.1のようにPDB構造2GS7 25(2.6Å)を開き、結合リガンドおよび結晶水を削除する。25ステップ 1.2 の手順を使用して、構造体 3W2S および 4HJO30 (2.75 Å) から欠落セグメントを 2GS7 (表 1を参照) に追加します。最終的な非アクティブなEGFR構造に基づいて、ステップ1.3の手順を使用して変異モデルを準備する。
注:A702V突然変異研究では、EGFR非対称ダイマー構造は、ダイマー界面の大部分を形成するキナーゼドメインの並膜Bセグメントに位置する変異として研究される。野生型およびA702V変異型EGFR構造は、以下のように調製されます。 - 野生型の非対称二量体構造は、PDB構造2GS2から構築され、これは最初は単量体の形で表示される。非対称配置でアクティベーターキナーゼとレシーバキナーゼを含む生体アセンブリに変換するには、(1.1)のようにキメラで2GS2を開き、 単位セルメニューの[ツール]→高次構造→ユニットセル メニューをクリックして対称計算を行います。2GS2 構造を選択し、「 コピーを作成」と入力します。最後に、対称操作から得られたダイマーの複数のコピーから単一の非対称ダイマーを選択して保存します。
- ステップ1.8の野生型非対称EGFR構造を使用して、キメラの ツール→構造編集→ロタマー オプションを使用してアラニン702をバラインに置き換えることによってA702V変異体を構築します。
注:全体として、ΔELREAおよびA702V突然変異研究のために、6つの単量体および2つの二量体EGFR構造がそれぞれ調製される。各構造は、その後、Maestroプログラム31 のタンパク質調製ウィザードを使用してシミュレーションのために処理され、MDシミュレーションはAmberプログラム32で行われます。 - [ファイル→インポート構造] オプションを使用して、マエストロで構造を開きます。次に、タンパク質調製ウィザードボタンをクリックし、次の項目を選択します:水素原子を追加し、欠けている側鎖原子を構築し、PROPKAを使用してpH 7.0でイオン化可能な残基の原始状態を決定し、水素結合のためのアスパラギン、グルタミンおよびヒスチジン残基の配向を最適化し、最終的に構造を最小限に抑えます。
2. システムのセットアップ
- オレンジ色のソフトウェア パッケージに含まれているLeapプログラムを開きます。ff14SB力場33(ソースleaprc.protein.ff14SB)およびTIP3P水分子34(ソースleaprc.water.tip3p)をインポートします。ATP バウンド システムでは、ATP35のパラメータもインポートします(loadamberparams frcmod.リン酸、 loadamberprep ATP.prep)。次に、構造体 (mol = loadpdb 構造体.pdb) をロードします。
- タンパク質の表面原子から全方向に10Åを伸ばす明示的なTIP3P水分子を有する8面体ボックス内の構造をソルベートする(ソルバテクモールTIP3PBOX 10.0)。
- 構築されたシステムをチェックしてください (チェック mol) 必要なイオンを加えて中和します (加剤モル Na+ 0).生体分子系を十分にモデル化するには、シミュレーションボックスにNa+/Cl- 原子を追加して、システム塩濃度を0.15 M(加イオンモルNa+ X、加剤モルCl- X)に置き換え、Xは結果に置き換えられます:所望の塩濃度*水分子あたりの体積*水分子あたりの体積*
- システムのトポロジファイルと座標ファイルを生成して保存し、その後のプロダクションシミュレーションの入力として機能します (saveamberparm mol X.prmtop X.inpcrd)。
3. 分子動力学シミュレーション
- Amberを使用して、最初にシミュレーションシステムを最も急な降下の5000サイクルに適用し、好ましくない構成を回避するために勾配エネルギー最小化を共役させる。複数のステップで最小化を行い、溶質原子に対して適用される拘束を25kcal mol-1 Å-2 から0 kcal mol-1 Å-2に徐々に下げる。
- 最小化入力ファイル min.inで、合計最小化サイクルの maxcyc 変数 (maxcyc = 5000) を調整し、最急降下アルゴリズムのサイクル数を示すように ncyc を調整します。 restraint_wt 変数を使用して、拘束マスクパラメータで指定された溶質原子に 拘束 力を適用します。次に、次のように最小化を実行します。
$AMBERHOME/ビン/サンダー -O -i min.in -o min.out -p X.prmtop -c X.inpcrd -r min.rst -ref X.inpcrd
注: 使用される戦略と実際のパラメータは、自分の好みに応じて異なる場合があります。詳細とガイダンスは、アンバーマニュアルとウェブサイト(https://ambermd.org/index.php)から見つけることができます
- 最小化入力ファイル min.inで、合計最小化サイクルの maxcyc 変数 (maxcyc = 5000) を調整し、最急降下アルゴリズムのサイクル数を示すように ncyc を調整します。 restraint_wt 変数を使用して、拘束マスクパラメータで指定された溶質原子に 拘束 力を適用します。次に、次のように最小化を実行します。
- 溶質原子に10kcalモル-1 Å-2 拘束を設定して、0 Kから300 Kまでの100 psのシステムを加熱します。そのためには 、tempi = 0.0 、temp0 = 300.0 、dt = 0.002ps、nstlim = 50000、restraint_wt = 10 を heat.in 入力ファイルに設定します。次のコマンドで加熱を実行します。
$AMBERHOME/ビン/サンダー -O -i heat.in -o heat.out -p X.prmtop -c min.rst -r heat.rst -x heat.mdcrd -ref min.rst - NPTアンサンブルの下で900 psのためのシステムを平衡化;原子の定数数、温度(温度0 = 300.0)と圧力(ntp = 1)、ベレンセン法(ntt = 1)でそれを制御する。長距離静電相互作用の場合は、9 Å 距離カットオフ (カット = 9.0)を設定します。溶質原子拘束を0.1kcal mol-1 Å-2 (restraint_wt = 0.1)に徐々に下げる。上記のパラメータを記述する equil.in 平衡化入力ファイルを次のように実行します。
$AMBERHOME/ビン/サンダー -O -i equil.in -o equil.out -p X.prmtop -c heat.rst -r equil.rst -x equil.mdcrd -ref heat.rst - 拘束されていない 5 ns シミュレーションで平衡を完成します(dt = 0.002 ps 、ntslim = 2500000)。
$AMBERHOME/ビン/サンダー -O -i equil_final.in -o equil_final.out -p X.prmtop -c equil.rst -r equil_final.rst -x equil_final.mdcrd -ref equil.rst - 温度、圧力、密度、エネルギー値を調べて、システムが平衡していることを確認します。
$AMBERHOME/ビン/process_mdout.perl heat.out equil.out equil_final.out
xmgrace の概要。一時/密度/エトー/エクトット/エクト - 100 ns(dt = 0.002 ps 、ntslim = 5000000 prod.in)の生産シミュレーションを実行し、10 psごとにコンフォメーションを保存します(ntwx = 5000)。
$AMBERHOME/ビン/サンダー -O -i prod.in -o prod.out -p X.prmtop -c equil_final.rst -r prod.rst -x prod.mdrcd -ref equil_final.rst
4. 分析
- 目視検査
- 野生型および変異型 EGFR キナーゼシミュレーション中にサンプリングされた立体構造を 、X.prmtop アンバー トポロジ ファイルと対応する prod.mdcrd 軌道ファイルを VMD36で開いて視覚化します。便利な二次構造表現を用いて、記録された軌道からタンパク質の全体的な構造力学を解析する。触媒的に必須K745 - E762塩橋など、対象の原子/残基間の特定の相互作用を表示します。
- または、PDB形式でシミュレーション中にサンプリングされた複数の立体構造を保存し、 キメラ プログラムを使用してそれらを開きます。 MatchMaker オプションを使用して、初期構造または中央値構造に構造を重ね合わせ初期/中央値構造をソリッドで表示し、残りの位置合わせ構造を色あせた白で表示します。このアプローチにより、記録された構造の動きを、より明確に視覚化することができます。
注:MDSからの立体構造アンサンブルの効果的な表現と処理のための提案はMelvinら37で見つけることができます。
- RMSD および RMSF 分析
- Cpptrajプログラム38を用いて、根平均平方偏差(RMSD)と平方根平方偏差(RMSF)計算を計算し、タンパク質のグローバル安定性を分析し、異なる構造単位の柔軟性を調べる。入力ファイルrmsd.inおよびrmsf.inでは、RMSフィッティングの基準として初期構造のバックボーン原子(RMSDの場合)とCα原子(RMSF用)を指定します。rmsd/rmsf.inファイルでは、オレンジ色のトポロジ ファイル (parm X.promtop) と対応するトラジリパス ファイル (trajin prod.mdcrd) をインポートします。次に、コマンドCpptraj -i rmsd/rmsf.inを実行します。分析用に出力データをプロットします。
- あるいは、Cα原子RMSDに基づいて、立体構造アンサンブルを整列し、各残基を色付けする。これを行うには、キメラで立体構造を開き、 マッチメーカー オプションに合わせます。
- [ツール→アトリビュートによるレンダリング→表示] に移動します。コンフォメーションアンサンブルの残基とCα RMSDを属性として選択し、[OK]をクリックします。次に、立体構造の鎖の痕跡は、高、中、低の構造安定性の領域をそれぞれ反射する青→白→赤から着色されます。
- 水素結合解析
- ATPと野生型/ΔELREA EGfrsの水素結合相互作用を分析する。このタスクを実行するために、Cpptraj スクリプト hbond.inを準備します。ドナー・アクサクサの距離が3.5Å以下、結合角が135°以上の水素結合を定義します。 アイントラモル 変数、すなわちATPとEGFRの間の水素結合(hbond All nointramol dist 3.5 out nhb.agr avgout avghb.dat)の分子間水素結合についてのみ分析を指定する。スクリプトを Cpptraj -i hbond.inとして実行します。
- このスクリプトを使用して、EGFRキナーゼ活性の重要な残基である残基K745とE762の間など、分子内相互作用を評価します。これを行うには、水素結合ドナーとしてK745を 、hbond.in の水素結合アクセプターとしてE762を指定し、それに応じてスクリプトを実行します。
- 原子間の距離の監視
- VMDで野生型と ΔELREA アポ EGfrs の軌道を開くことによって K745 と E762 の間の距離を測定します。Glu762 の Cδ と Lys745 の Nz を選択するには、マウス → ラベル→ボンドをクリックします。グラフィックス→ラベルを使用してグラフをプロットし、→グラフを結合して、シミュレーション中→距離を監視します。
- 自由エネルギー計算
- ATPと野生型/ΔELREA EGfr間の推定結合自由エネルギー、および野生型/A702V EGfrの活性化剤および受信機キナーゼの間の推定結合自由エネルギーを計算するには、AMBERパッケージで入手可能な分子力学一般化生立表面積(MM-GBSA)モジュール39 を使用する。D.S.研究では、リガンドとしてATPを、EGFRを受容体として設定します。A702Vの研究では、レシーバキナーゼをリガンド、アクチベーターキナーゼを受容体として指定します。
- まず、PBRadii値をmbondi2に設定する飛躍プログラムで、リガンド、受容体およびリガンド-受容体複合体PDBファイルを別々に準備する。PDB ファイルの場合は、ガス相アンバー トポロジ(.prmtop)と座標(.inpcrd)ファイルを保存します。
- そして、mmgbsa 入力ファイルに 、mmgbsa.in igb = 2を設定し 、saltcon = 0.1を設定します。シミュレーションの軌跡、準備された受容体/リガンドアンバーファイル 、mmgbsa.in のパラメータを使用して、次のように MMPBSA.py スクリプトを使用して、バインドエネルギー計算を実行します。
$AMBERHOME/ビン/MMPBSA.py -O -i mmgbsa.in -o mmgbsa.dat -sp X.prmtop -cp complex.prmtop -rp 受容体.prmtop -lp リガンド.prmtop -y prod.mdcrd -eo 出力.csv - グラフをプロットして出力データ output.csvを分析します。
結果
記載されたプロトコルは、EGFRキナーゼ構造に対するΔELREAおよびA702V突然変異の構造的効果を研究するために使用された。このプロトコルの応用の一つは、MDシミュレーションからRMSD値とRMSF値を計算することによって、局所的な構造/立体構造の安定性に対する突然変異の影響を調査することでした。A702V突然変異がジャクスタメ膜Bセグメントに位置するので、開始構造に対する受信機キナーゼのこのセグメントのRMSDは、野生型およびA702V EGfrsの両方について計算された。結果(図4A)は、変異体の並生膜Bセグメントが、野生型EGFRキナーゼドメイン(平均RMSD1.1Å-95%CI 0.01)と比較して、100nsシミュレーション中に立体安定性を増加させたことを明らかにした(平均RMSD 0.7Å-95%信頼区間(CI)0.009)。これは、アラニン702(メチル基側鎖)を嵩高い疎水性残基に置き換え、バリン(イソプロピル基側鎖)によるダイマー界面での疎水性相互作用の引き締まりの結果である可能性が非常に高く、イソロイシン941のイソロイシンドメインでV702の疎水性相互作用が増加する。
ΔELREA突然変異は、機能的に重要なαCヘリックスに隣接するβ3-αCループに位置する。αCヘリックスの立体構造は、EGFRキナーゼの活性状態と非アクティブ状態の間をシフトする鍵となる。活性状態におけるαCヘリックスの立体安定性は、MDシミュレーション中にヘリックス内の残基のCα原子に対するRMSFを調べることによって評価された(図4B):全体として、変異体(平均RMSF 1.1Å - 95%CI 0.4)の変動が低い。N末端残基に対して記録された変動の差が最も高い。野生型キナーゼドメインの中央値構造とΔELREAキナーゼドメインの中央値構造に重ね合わせたサンプリングされた立体構造は、それぞれこれらの結果を支持する(図4C):野生型およびΔELREAキナーゼドメインは、β3-αCループおよびαCヘリックスを除いて、重ね合わせた立体構造に対して全体的に類似した安定性を有する。これらの知見は、ELREA配列の欠失が活性状態αC螺旋の動きを抑制し、したがって活性立体構造を抑制し、安定化することを示している。さらに、αCヘリックスは非対称ダイマー界面の一部を形成するので、変異体におけるαCヘリックスの拘束は、不斉二量体を安定化させる可能性が非常に高く、活性化状態の持続時間を延長する。
このプロトコルのもう一つの応用は、シミュレーション中に起こる主要な分子内および分子間相互作用の挙動を調査することです。従って、EGFR酵素活性の基本であるK745とE762の相互作用は、 MDシミュレーション中に2つの残基の側鎖極性原子間に形成された水素結合の占有率を測定することによって活性型野生型およびΔELREA EGFRキナーゼの両方について分析した(図5A):この主要な静電相互作用は、ΔELREAキナーゼドメインと比較してより頻繁に形成された。シミュレーション中のMg2+-ATPと野生型とΔELREA EGFRキナーゼドメイン(図5B)の相互作用も評価された(図5C):水素結合の数は、野生型EGFR(平均値3.2-95%CI.04)よりもΔELREA(平均値4.0〜95%CI 0.03)の方が大きかった。水素結合のさらなる分析は、K745がΔELREA EGFRにおけるATPのリン酸基とより頻繁に相互作用することを明らかにした。
プロトコルに記載されているMDシミュレーションは、タンパク質とタンパクリガンド相互作用に対する結合の相対的な自由エネルギーを評価するのにも有用である。野生型とA702V EGfrsのアクチベーターとレシーバキナーゼドメイン間の結合エネルギーと、ATPと野生型とΔELREA変異体キナーゼドメインとの間の結合エネルギーは、 分子力学の一般化された生まれた表面積(MMGBSA)計算(図6A):A702V突然変異体は、より低い平均ΔG結合値(平均ΔG結合=-76kcal/mol-95%CI 0.47)を産生し、野生型EGFRドメイン(平均ΔG結合=-61k/0.61)とは対照的に、より良好な二量体相互作用を表す。この観察は、A702V EGFRキナーゼドメインに対して観察された疎水性相互作用の増加による、より安定な並膜Bセグメントおよびより緊密な二量体界と一致する。野生型およびΔELREA EGFRキナーゼドメインにATP結合する場合(図6B)、MMGBSA計算は、野生型EGFR(ΔG結合-平均-48kcal/mol-95%CI.03)と比較して、ΔELREA突然変異体(平均ΔG結合-57kcal/molbind - 95%CI.43)と比較してより強いATP結合を予測する。この結果は、野生型ドメインと比較してATPとΔELREA EGFR(図5C)の間で記録された水素結合の数が多いと一致しています。
このプロトコルは、シミュレーション中に観測された立体構造の変化を調査するためにも使用できます。現在の研究では、ΔELREA突然変異が不活性なEGFR立体構造に及ぼす影響を、シミュレーションからのサンプル立体構造の目視検査および重ね合わせによって検討した。この解析により、ΔELREA EGFRキナーゼドメイン(図7A)におけるαCヘリックスの内向きの動きが明らかになった。これに対し、野生型不活性EGFRのαCらせんは、その初期の立体構造を維持した(図7B)。このように、MDシミュレーションは、キナーゼ活性40,41,41を増加させるという欠失突然変異を実験的に示す提案を支持し、非活性キナーゼから活性状態への立体シフトを促進する。
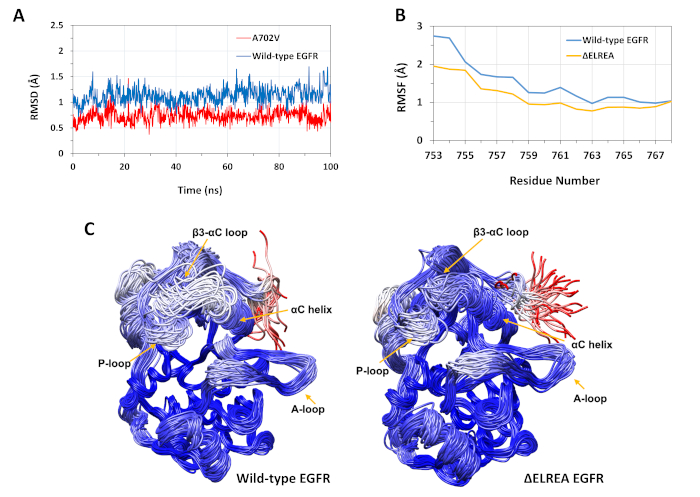
図4:MDシミュレーション中の活性EGFRキナーゼドメインの野生型および変異体の立体構造安定性。(A)野生型(青)とA702V(赤)受信機キナーゼドメインの並膜Bセグメント上のRMSD(バックボーン原子)。(B) αCヘリックスの残基に対する RMSF (Cα原子): 野生型 (青) および ΔELREA (金)(C)野生型(左)およびΔELREA(右)EGFRキナーゼドメインの重ね合わせたサンプリングされた立体構造;連鎖痕跡は、中央値構造に対して各残基のRMSD(Cα原子)に基づいて着色される。色彩は青から白、赤までさまざまで、高い立体構造の安定性を表します。なお、孤立キナーゼドメインの「遊離」N末端領域は、赤色で着色され、無傷のEGFR構造においてこのレベルの移動性を示さないであろう。チャクロボルティら9(図4Aは、生物化学雑誌の許可を得て再現)およびタミラットらから適応した図。この図の大きなバージョンを表示するには、ここをクリックしてください。
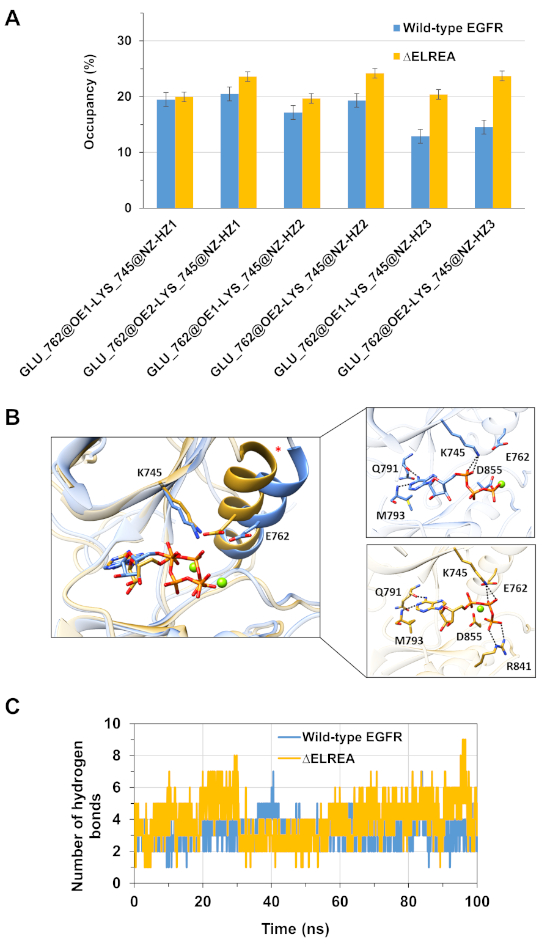
図5:MDシミュレーション中のアクティブレシーバーキナーゼに見られる主な特徴:K745-E762塩ブリッジ、αCヘリックス、ATPとの相互作用。(A)野生型(青)およびΔELREA(金)EGFRキナーゼドメインのシミュレーション中のK745-E762相互作用の占有率。(B) 野生型およびΔELREA変異体の残基がATPと相互作用する(スティック)。Mg2+ (緑) は ATP と D855 の座標です。(C) MDシミュレーション中に野生型およびΔELREA EGFRキナーゼドメインの両方を用いてATPによって形成される水素結合の数。タミラットらから図12.この図の大きなバージョンを表示するには、ここをクリックしてください。
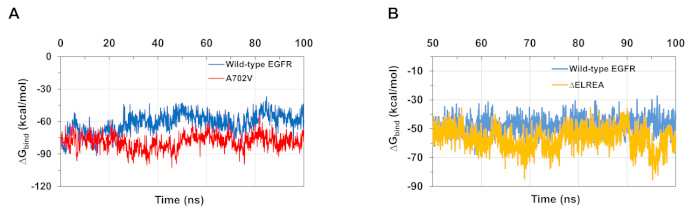
図6:シミュレーション中に変異型キナーゼドメインに対して結合の低い相対自由エネルギーが観察される。(A)野生型(青色)とA702V(赤)EGfrsのアクチベーターとレシーバキナーゼドメインとの相互作用について計算された結合エネルギー。(B)野生型(青)およびΔELREA(金)のEGFRキナーゼドメインへのATPのΔG結合。チャクロボルティら9(図6Aは生物化学雑誌の許可を得て再現)およびタミラットらから適応した図。この図の大きなバージョンを表示するには、ここをクリックしてください。
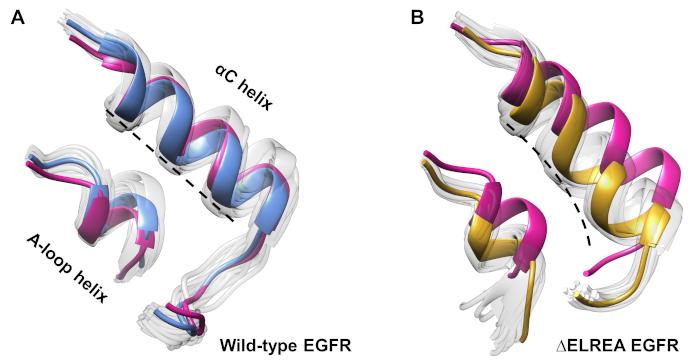
図7:野生型およびΔELREA非活性EGFRキナーゼドメインからの上置された立体構造。αCヘリックスの立体構造(A)の野生型(青の中央値構造)および(B)ΔELREABEGfrs(金)。他のサンプリングされた立体構造、色あせた白色;MDシミュレーション前の初期構造、ピンク色。タミラットらから図12.この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
本研究で説明するプロトコルは、分子動力学シミュレーションを用いて、EGFRキナーゼドメインの体細胞変異を活性化することから生じる局所的および全体的な構造変化を調査することに焦点を当てている。野生型および変異型EGOFのX線結晶構造は、非常に貴重な構造洞察を提供するが、それらは、1つまたはいくつかの静的表現を描写する。しかし、ErbBsの生物学的機能に固有のは、酵素的に不活性なチロシンキナーゼと活性チロシンキナーゼの間の必要な移行であり、キナーゼモノマー間の構造および分子内相互作用の両方の動的変化を引き起こす。このようにMDシミュレーションは、野生型構造、導入されたΔELREA欠失突然変異、およびA702V突然変異を含むEGFRチロシンキナーゼドメインの動的性質をプローブするために実施した。これらのシミュレーションは、これらの突然変異の構造における可能性の高い役割を解明し、チロシンキナーゼドメインの立体構造に及ぼす影響が、EGFRキナーゼ活性の実験的に観察された増加をもたらす方法を解明することに成功した。
このプロトコルの重要なステップは、突然変異の影響を評価するために関連する構造を使用することです。関連するシミュレーション入力構造を選択する方法の1つは、静的な3D構造における突然変異の位置を可視化し、隣接するアミノ酸および構造単位に対するその影響を調べることである。本研究では、例えば、A702V EGFR突然変異が非対称ダイマー界面を形成する並膜Bセグメントに位置しているため、単量体とは対照的にシミュレーション用のダイマー構造の使用が重要である。単量体構造の使用は、レシーバキナーゼの並膜Bセグメントを溶媒に露出させ、安定化相互作用から奪い、より大きな疎水性残基への突然変異および活性化剤キナーゼのC-lobe残基からのイソロイシン941との相互作用によって増強されたであろう。また、PDBファイル内の座標によって表される3D構造は、必ずしも研究に使用されるべき生物学的関連構造に対応していないことに注目に値する。例えば、ErbB4、PDBコード3BCEの構造では、PDB座標は三量体に対応するが、これは結晶接触によるものである(この構造を視覚化する際にモノマー間の接触が少ない)。PDBファイル内の行列は、結晶関連構造を再構築するために(例えば、キメラ内)使用することができ、これは、元の出版物42で報告されるように生物学的に関連する3D構造に対応する鎖を識別するために視覚化することができる。プロトコルのもう一つの重要なステップは、異なるループ領域で欠損アミノ酸を構築する、特に突然変異の近くに位置する場所で、シミュレーション入力構造を適切に準備することです。PDBには数多くの野生型EGFR構造が存在するが、利用可能な変異型EGFR構造の数は限られている。したがって、変異構造もモデル化する必要があります。A702Vのような単一の残基突然変異のために、キメラは残基を突然変異させるために使用された。一方、ΔELREA欠失変異については、モデラーが使用された。
シミュレーション入力ファイルで利用される様々なパラメータ(例えば、最小化サイクルの数、システムを一度に所望の温度に加熱する、またはいくつかの中間温度を通してゆっくりと加熱する、平衡化と生産シミュレーションのための期間)は、研究の分子、作業の目的と自分の好みに基づいて変更することができます。MDシミュレーションを行う間、入力ファイル、使用中のシミュレーションソフトウェアに関連する問題、あるいはユーザエラーから発生する可能性のあるエラーに遭遇することも一般的です。したがって、エラー メッセージを注意深く調べることによって、エラーの原因を理解することが非常に重要です。ほとんどのシミュレーションプログラムにはメーリングリストがあり、ユーザーはソフトウェア開発者や他のユーザーに質問を投げかけ、ほとんどの問題を解決することができます。さらに、ユーザーマニュアルは、仮定や制限を含むシミュレーションプロトコルの詳細を理解するための重要な支援を提供します。MDシミュレーションは分子の動的特性を探索する重要なツールですが、その有効性を評価するためには、計算結果を他の情報源と組み合わせて慎重に評価する必要があります。可能な限り、研究中のタンパク質の専門家である研究者、特に関連する湿式実験研究が行われる場合は、構造解釈の結果を提供し、仮説をテストするために構造観察に基づいて行われる可能性のある実験を提案するのに役立ちます。
本研究では、このプロトコルは、ΔELREAおよびA702V変異がEGFRキナーゼ構造に及ぼす動的構造への影響を調べる上で有効であった。このシミュレーションにより、ΔELREAは機能的に本質的なαCヘリックスを抑制し、非アクティブキナーゼから安定化された活性キナーゼへの立体シフトを促進することが明らかになった。このシミュレーション結果は、ΔELREA欠失変異および野生型EGFRを有する肺癌細胞株に対するチロシンキナーゼ阻害剤の効果を実証した薬物応答データによって独立して支持され、野生型EGFR12よりもΔELREAに対して活性キナーゼ立体構造を認識する薬剤によるより大きな阻害が報告された。A702V突然変異により、MDシミュレーションは、野生型と比較して、活性化剤と受信機キナーゼ界面の安定化の増加、ならびに活性化剤と受信機キナーゼの互いの親和性の高さを示し、共にEGFRキナーゼの活性化された立体構造の維持を支持する。A702V突然変異は、受信機キナーゼの並膜Bセグメントに位置し、活性化キナーゼとの疎水性相互作用を増加させ、活性化状態の持続時間を延長するように機能する。A702V変異は、増殖因子 の存在しない 細胞生存を支持し、EGFR変異9のインビトロスクリーニングで同定された。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、フィンランドアカデミー(308317、320005)、シグリッド・ジュリウス財団とTor、ジョーとペンティ・ボーグ記念基金、フィンランドの癌財団(274728、316796)、トルコ大学中央病院からのK.E.への助成金によって資金提供されています。M.Z.T.は、情報構造生物学のオーボ・アカデミ博士ネットワークによって資金提供されています。我々は、コンピューティングリソースのためのCSC ITセンターとバイオセンターフィンランドバイオインフォマティクスネットワークの下でのITサポートのためのユッカ・レフトネン博士に感謝します。バイオセンターフィンランド構造生物学インフラネットワーク。
資料
| Name | Company | Catalog Number | Comments |
| Amber software | University of California, San Francisco | Version 2018 | Executable |
| Chimera program | Resource for Biocomputing, Visualization, and Informatics at the University of California, San Francisco | Version 1.13.1 | Executable |
| EGFR struture files | The Protein Data Bank | 3D coordinates of EGFR structures | |
| Maestro | Schrödinger LLC | Version 2018-3 | Executable |
| Modeller program | The Andrej Šali Lab, Departments of Biopharmaceutical Sciences and Pharmaceutical Chemistry, University of California San Francisco | Included in the Chimera program | |
| VMD software | Theoretical and Computational Biophysics Group, University of Illinois at Urbana-Champaign | Version 1.9.3 | Executable |
参考文献
- Yarden, Y., Sliwkowski, M. X. Untangling the ErbB signalling network. Nature Reviews Molecular Cell Biology. 2, 127-137 (2001).
- Lemmon, M. A., Schlessinger, J., Ferguson, K. M. The EGFR family: not so prototypical receptor tyrosine kinases. Cold Spring Harbor Perspectives in Biology. 6, a020768 (2014).
- Arteaga, C. L., Engelman, J. A. ERBB receptors: From oncogene discovery to basic science to mechanism-based cancer therapeutics. Cancer Cell. 2, 282-303 (2014).
- Mishra, R., Hanker, A. B., Garrett, J. T. Genomic alterations of ERBB receptors in cancer: Clinical implications. Oncotarget. 8, 114371-114392 (2017).
- . cBioPortal for Cancer Genomics Available from: https://www.cbioportal.org (2020)
- Lynch, T. J., et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. New England Journal of Medicine. 350 (21), 2129-2139 (2004).
- Paez, J. G., et al. EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science. 304 (5676), 1497-1500 (2004).
- Pao, W., et al. EGF receptor gene mutations are common in lung cancers from "never smokers" and are associated with sensitivity of tumors to gefitinib and erlotinib. Proceedings of the National Academy of Sciences U.S.A. 101 (36), 13306-13311 (2004).
- Chakroborty, D., et al. Unbiased in vitro screen for activating EGFR mutations. Journal of Biological Chemistry. 294 (24), 9377-9389 (2019).
- Leahy, D. J. Structure and Function of the Epidermal Growth Factor (EGF/ErbB) Family of Receptors. Advances in Protein Chemistry. 68, 1-27 (2004).
- Roskoski, R. ErbB/HER protein-tyrosine kinases: Structures and small molecule inhibitors. Pharmacological Research. 87, 42-59 (2014).
- Tamirat, M. Z., Koivu, M., Elenius, K., Johnson, M. S. Structural characterization of EGFR exon 19 deletion mutation using molecular dynamics simulation. PLoS ONE. 14 (9), e0222814 (2019).
- Ding, L., et al. Somatic mutations affect key pathways in lung adenocarcinoma. Nature. 455, 1069-1075 (2008).
- Kurppa, K. J., Denessiouk, K., Johnson, M. S., Elenius, K. Activating somatic ERBB4 mutations in non small-cell lung cancer. Oncogene. 35 (10), 1283-1291 (2016).
- Soung, Y. H., et al. Somatic mutations of the ERBB4 kinase domain in human cancers. International Journal of Cancer. 118, 1426-1429 (2006).
- Tvorogov, D., et al. Somatic mutations of ERBB4: selective loss-of-function phenotype affecting signal transduction pathways in cancer. Journal of Biological Chemistry. 284, 5582-5591 (2009).
- Hubbard, S. R., Till, J. H. Protein tyrosine kinase structure and function. Annual Review of Biochemistry. 69 (1), 373-398 (2000).
- Huse, M., Kuriyan, J. The conformational plasticity of protein kinases. Cell. 109 (3), 275-282 (2002).
- Jura, N., et al. Catalytic control in the EGF receptor and its connection to general kinase regulatory mechanisms. Molecular Cell. 42, 9-22 (2011).
- Karplus, M., Kuriyan, M., J, Molecular dynamics and protein function. Proceedings of the National Academy of Sciences U.S.A. 102 (19), 6679-6685 (2005).
- Shan, Y., Arkhipov, A., Kim, E. T., Pan, A. C., Shaw, D. E. Transitions to catalytically inactive conformations in EGFR kinase. Proceedings of the National Academy of Sciences U.S.A. 110 (18), 7270-7275 (2013).
- Reckamp, K. L., et al. A phase I trial to determine the optimal biological dose of celecoxib when combined with erlotinib in advanced non-small cell lung cancer. Clinical Cancer Research. 12 (11 Pt 1), 3381-3388 (2006).
- Pettersen, E. F., et al. UCSF Chimera-a visualization system for exploratory research and analysis. Journal of Computational Chemistry. 25 (13), 1605-1612 (2004).
- Berman, H. M., et al. The Protein Data Bank. Nucleic Acids Research. 28 (1), 235-242 (2000).
- Zhang, X., Gureasko, J., Shen, K., Cole, P. A., Kuriyan, J. An Allosteric Mechanism for Activation of the Kinase Domain of Epidermal Growth Factor Receptor. Cell. 125 (6), 1137-1149 (2006).
- Stamos, J., Sliwkowski, M. X., Eigenbrot, C. Structure of the epidermal growth factor receptor kinase domain alone and in complex with a 4-anilinoquinazoline inhibitor. Journal of Biological Chemistry. 277 (48), 46265-46272 (2002).
- Sogabe, S., et al. Structure-Based Approach for the Discovery of Pyrrolo[3,2-d]pyrimidine-Based EGFR T790M/L858R Mutant Inhibitors. ACS Medicinal Chemistry Letters. 4 (2), 201-205 (2013).
- Sali, A., Blundell, T. L. Comparative protein modelling by satisfaction of spatial restraints. Journal of Molecular Biology. 234 (3), 779-815 (1993).
- Yun, C. H., et al. Structures of lung cancer-derived EGFR mutants and inhibitor complexes: mechanism of activation and insights into differential inhibitor sensitivity. Cancer Cell. 11 (3), 217-227 (2007).
- Park, J. H., Liu, Y., Lemmon, M. A., Radhakrishnan, R. Erlotinib binds both inactive and active conformations of the EGFR tyrosine kinase domain. Biochemical Journal. 448 (3), 417-423 (2012).
- . Release 2018-3: Maestro Available from: https://www.schrodinger.com/maestro (2018)
- Case, D. A., et al. . AMBER 2018. , (2018).
- Maier, J. A., Martinez, C., Kasavajhala, K., Wickstrom, L., Hauser, K. E., Simmerling, C. ff14SB: Improving the Accuracy of Protein Side Chain and Backbone Parameters from ff99SB. Journal of Chemical Theory and Computation. 11 (8), 3696-3713 (2015).
- Jorgensen, W. L., Chandrasekhar, J., Madura, J. D., Impey, R. W., Klein, M. L. Comparison of simple potential functions for simulating liquid water. Journal of Chemical Physics. 79 (2), 926-935 (1983).
- Meagher, K. L., Redman, L. T., Carlson, H. A. Development of polyphosphate parameters for use with the AMBER force field. Journal of Computational Chemistry. 24 (9), 1016-1025 (2003).
- Humphrey, W., Dalke, A., Schulten, K. VMD: Visual molecular dynamics. Journal of Molecular Graphics. 14 (1), 33-38 (1996).
- Melvin, R. L., Salsbury, F. R. Visualizing ensembles in structural biology. Journal of Molecular Graphics and Modelling. 67, 44-53 (2016).
- Roe, D. R., Cheatham, T. E. PTRAJ and CPPTRAJ: Software for processing and analysis of molecular dynamics trajectory data. Journal of Chemical Theory and Computation. 9 (7), 3084-3095 (2013).
- Miller, B. R., et al. MMPBSA.py: An Efficient Program for End-State Free Energy Calculations. Journal of Chemical Theory and Computation. 8 (9), 3314-3321 (2012).
- Guha, U., et al. Comparisons of tyrosine phosphorylated proteins in cells expressing lung cancer-specific alleles of EGFR and KRAS. Proceedings of the National Academy of Sciences U.S.A. 105 (37), 14112-14117 (2008).
- Furuyama, K., et al. Sensitivity and kinase activity of epidermal growth factor receptor (EGFR) exon 19 and others to EGFR-tyrosine kinase inhibitors. Cancer Science. 104 (5), 584-589 (2013).
- Qiu, C., et al. Mechanism of Activation and Inhibition of the HER4/ErbB4 Kinase. Structure. 6 (3), 460-467 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved