Method Article
ダイヤモンド光源のXChem施設における効率的なフラグメントスクリーニングの実現
* これらの著者は同等に貢献しました
要約
このホワイトペーパーでは、水晶ベースのフラグメントスクリーニングのための完全なXChemプロセスについて、アクセスの申請から始まり、その後のデータ配布までのすべてのステップについて説明します。
要約
フラグメントベースの創薬では、~300 Da未満の数百または数千の化合物を目的のタンパク質に対して試験し、強力な医薬品候補に開発できる化合物を特定します。化合物が小さいため、相互作用が弱いため、スクリーニング法は高感度でなければなりません。さらに、構造情報は、これらのヒットを鉛のような化合物に精緻化するために重要になる傾向があります。したがって、タンパク質結晶構造解析は常にゴールドスタンダードの手法でしたが、歴史的に見ても、一次スクリーニングとして広く使用するには難しすぎます。
2014 年に最初の XChem 実験が実証され、その後、プロセスを検証するために学術および産業界の共同研究者と試行されました。それ以来、多大な研究努力と大幅なビームタイムにより、サンプル調製の合理化、迅速なフォローアップが可能なフラグメントライブラリの開発、I04-1ビームラインの無人データ収集機能の自動化と改善、データ管理、分析、ヒット同定のための新しいツールの導入が行われました。
XChemは現在、大規模な結晶学的フラグメントスクリーニングのための施設であり、結晶から堆積までのプロセス全体をサポートし、世界中の学術および産業ユーザーが利用できます。2016年以降、査読付きアカデミックユーザープログラムは、十分に検証されたプロジェクトや探索的なプロジェクトなど、可能な限り幅広い科学的範囲のプロジェクトに対応するために積極的に開発されています。アカデミックアクセスは、査読付き提案の半年ごとの募集を通じて割り当てられ、独自の作業はダイヤモンドの産業連絡グループによって手配されます。このワークフローは、すでにさまざまな治療領域の100以上のターゲットに日常的に適用されており、化合物設計の高品質の出発点として機能し、結合部位に関する広範な構造情報を提供する弱い結合剤(ヒット率1%〜30%)を効果的に特定します。このプロセスの回復力は、COVID-19パンデミックの間、メインプロテアーゼの3週間のターンアラウンドを含む、SARS-CoV-2標的の継続的なスクリーニングによって実証されました。
概要
フラグメントベース創薬(FBDD)は、リード創薬に広く利用されている戦略であり、25年前に登場して以来、4つの医薬品を臨床用に供与し、40以上の分子が臨床試験に進んでいます1,2,3。フラグメントは、通常、分子量が300Da以下の小さな化学体です。これらは、化学的複雑性が低いため、優れた物理化学的特性を備えたリガンド効率の高い阻害剤を開発するための良い出発点となるために選ばれました。その大きさは、より大きな薬物や鉛様化合物のライブラリーよりもタンパク質の結合ランドスケープを徹底的にサンプリングし、ホットスポットや推定アロステリック部位を明らかにすることを意味します。フラグメントは、構造情報と組み合わせることで、タンパク質とリガンドの間の潜在的な分子相互作用の詳細なマップを提供します。しかし、標的タンパク質への結合が弱い傾向にあるこれらの実体を確実に検出および検証するには、表面プラズモン共鳴(SPR)、核磁気共鳴(NMR)、等温滴定熱量測定(ITC)などの一連の堅牢で高感度な生物物理学的スクリーニング法が必要です4,5。
X線結晶構造解析は、FBDDツールキットの重要な部分であり、弱い結合体を同定するのに十分な感度を持ち、分子レベルでの相互作用に関する構造情報を直接得ます。これは他の生物物理学スクリーニングを補完するものであり、通常、フラグメントヒットをリード化合物に進行させるために不可欠です。高品質の結晶システムが必要であり、結晶化の再現性が高く、結晶は理想的には 2.8 Å 以上の分解能に回折する必要があります。
歴史的に、結晶学を一次フラグメントスクリーン6,7,8として使用することは、学界であろうと産業界であろうと非常に困難であった。対照的に、シンクロトロンは、ロボット工学、自動化9,10,11、検出器技術12,13において桁違いの進歩を達成し、同様に加速された計算能力とデータ処理のアルゴリズム14,15,16と組み合わせることで、LillyCAT 7で開拓されたように、完全な回折データセットを数秒で測定し、多数の回折データセットを完全に無人で測定することができますその後、MASSIF17,18(欧州放射光施設(ESRF))に認定されました。これにより、シンクロトロンは、幅広いユーザーコミュニティが主要なスクリーニングとして水晶ベースのフラグメントスクリーニングにアクセスできるように、高度に合理化されたプラットフォームを開発しました(XChem at Diamond;EMBL/ESRF19でのCrystalDirect。BESSY at Helmholtz-Zentrum Berlin20;MaxIV21のFragMax)。
この論文では、サンプル調製から3Dモデルヒットの最終的な構造結果まで、X線結晶構造解析によるフラグメントスクリーニングのためのXChemプラットフォームを構成するプロトコルを文書化します。パイプライン(図1)では、結晶同定22、浸漬23、および収穫24への新しいアプローチ、データ管理ソフトウェア25、および現在コミュニティで広く使用されているフラグメント同定26へのアルゴリズムアプローチの開発が必要でした。結晶採取技術は現在、ベンダーによって販売されており(材料表を参照)、ツールがオープンに利用できるようになったことで、他のシンクロトロンはそれらを適応させて同等のプラットフォームをセットアップできるようになりました21。進行中のプロジェクトは、Fragalysisプラットフォーム27を通じて、データ分析、モデル完成、およびデータ普及に取り組んでいます。サンプル調製ラボはビームラインI04-1に隣接しているため、数百個の凍結サンプルをビームラインに移すためのロジスティクスが簡素化され、I04-1の専用ビームタイムにより、キャンペーンの指針となる迅速なX線フィードバックが可能になります。
XChemはDiamondのユーザープログラムに欠かせない存在で、年に2回(4月上旬と10月初旬)の電話があります。ピアレビューのプロセスは、学界や産業界の創薬の専門家と協議して洗練されています。提案プロセス28 では、強力な科学的ケースに加えて、申請者は結晶システムの準備状況だけでなく、生化学的および直交的な生物物理学的方法の専門知識と、フォローアップ化学を通じてスクリーニングヒットを進行させる能力も自己評価する必要があります。アクセスモードも、学際的なユーザーコミュニティに対応するために進化しています。
Tier 1 (単一 プロジェクト) は、探索段階のプロジェクト用であり、ヒット検証ツール (生物物理学または生化学ツール) であり、フォローアップ戦略を用意する必要はありません。採択されれば、プロジェクトには概念実証に十分なビームタイムシフトの回数が減ります。
Tier 2 (単一プロジェクト) は、十分に検証されたプロジェクト用であり、下流のツールとフォローアップ戦略を整備する必要があります。採択された場合、プロジェクトには完全なフラグメントスクリーニングキャンペーンに十分なビームタイムが割り当てられます。単一プロジェクト(ティア1またはティア2)は、配分期間(4月から9月または10月から3月)の6か月以内に完了する必要があります。
ブロック・アロケーション・グループ(BAG) は、グループとプロジェクトのコンソーシアムのためのもので、BAG内で堅牢なターゲット選択と優先順位付けのプロセスが実施され、明確なフォローアップ・パイプラインが実施されています。BAGには、XChemのトレーニングを受けたエキスパート(スーパーユーザー)が少なくとも1人必要で、ダイアモンドスタッフと活動を調整し、BAGメンバーをトレーニングします。ビームタイムシフトの割り当て数は、BAG内の科学的に強いプロジェクトの数によって定義され、BAGのレポートに基づいて割り当て期間ごとに再評価されます。アクセスは2年間利用できます。
XChem実験は3つの段階に分かれており、それぞれに溶媒耐性試験、プレスクリーニング、メインスクリーンの判断ポイントがあります(図2)。溶媒耐性試験は、浸漬パラメータ、結晶システムが許容できる溶媒(DMSO、エチレングリコール、または必要に応じて他の凍結保護剤)の量、および期間を定義するのに役立ちます。溶媒濃度は通常、少なくとも2つの時点で5%〜30%の範囲です。回折データが収集され、結晶系の塩基回折と比較されます。これにより、次の段階のソーキング パラメーターが決まります。プレスクリーニングでは、溶媒試験で決定された条件を使用して100〜150個の化合物を浸し、その目的は、結晶がそれらの条件で化合物に耐えられることを確認することです。必要に応じて、凍結保護剤を、すでにフラグメントを含む液滴に添加します。成功基準は、結晶の80%以上が良好で一貫した品質の回折データを生成するのに十分なほど生き残ることです。これがうまくいかない場合は、通常、浸漬時間や溶媒濃度を変更して浸漬条件を修正します。事前スクリーニングが成功したら、実験用に選択した残りの化合物を最終パラメーターを使用してセットアップできます。
DSI態勢を整えたライブラリ( 材料表を参照)は、構えた化学29 を使用して迅速なフォローアップ進行を可能にするように意図的に設計されており、施設の主力ライブラリとなっています。DMSO中の濃度が500 mMです。アカデミックユーザーは、DMSOの濃度が100〜500mMで、共同研究者が提供する他のライブラリ(合計2,000を超える化合物)にアクセスすることもできます(完全なリストはウェブサイト28にあります)。全体的なコレクションの多くは、DMSOに耐えられない結晶系用のエチレングリコールでも利用できます。ユーザーは、音響リキッドハンドリングシステムと互換性のあるプレートに入っている場合、独自のライブラリを持ち込むこともできます( 材料表を参照)。
実験の 3 つのステップ(溶媒特性評価、プレスクリーニング、またはフルスクリーン)すべてにおいて、以下のサンプル前処理手順は同じです(図 3)。溶媒と化合物の両方に対する音響液体分注システムを使用して滴に分注する23;クリスタルシフター24を使用した結晶の効率的な収穫。ビームラインデータベース(ISPyB)へのサンプル情報のアップロード実験の設計と実行のための現在のインターフェースは、Excelベースのアプリケーション(SoakDB)であり、プラットフォームのさまざまな機器に必要な入力ファイルを生成し、すべての結果をSQLiteデータベースに追跡して記録します。バーコードスキャナーは、サンプルの追跡を支援するためにプロセス全体のさまざまな段階で使用され、このデータはデータベースに追加されます。
回折データは、ビームラインI04-1の専用ビームタイムを用いて無人モードで収集します。センタリングモードには、光学式とX線式の2種類があります17.針状結晶や棒状結晶にはX線センタリングが推奨されますが、分厚い結晶は一般的に光学モードをサポートしているため、割り当てられたビーム時間内により多くのサンプルを収集できます。結晶の分解能(プラットフォームに入る前に確立)に応じて、データ収集は60秒または15秒の総曝露のいずれかになります。溶媒試験段階でのデータ収集により、通常、ビームラインI04-1の性能に最も適した組み合わせがわかります。
大量のデータ分析はXChemExplorer(XCE)25を介して管理され、PanDDA26を使用してヒット識別ステップを起動するためにも使用できます。XCEは、タンパク質-リガンド構造の大規模解析をサポートするデータ管理およびワークフローツールです(図4)。ダイヤモンド光源(DIALS16、Xia214、AutoPROC30、STARANISO31)で収集されたデータから自動処理結果を読み取り、データ品質と参照モデルとの類似性に基づいて結果の1つを自動選択します。このモデルがXChemスクリーニングに用いる結晶系を代表するものであり、すべての水またはその他の溶媒分子、および溶媒のみに浸した結晶で見られるすべての補因子、リガンド、および代替コンフォメーションが含まれていることが重要です。この参照モデルの品質は、モデルの構築と改良の段階で必要な作業量に直接影響します。PanDDAは、すべてのデータを分析し、結合部位を特定するために使用されます。構造を参照構造に位置合わせし、統計マップを計算し、事象を識別し、事象マップを計算する26,32。PanDDAパラダイムでは、完全な結晶学的モデルを構築する必要はなく、望ましくもありません。モデル化されなければならないのは、フラグメントが結合しているタンパク質のビュー(結合状態モデル)のみであるため、イベントマップ32に従って、リガンドと周囲の残基/溶媒分子を構築することのみに焦点を当てる必要があります。
プロトコル
1. プロジェクト提案書の提出
- プロポーザルの内容:XChemプログラムは申し込み超過であるため、プロポーザルの完全かつ完全な情報は、ピアレビューに合格するために重要です。
- ケースを作る!ターゲットの重要性を提示し、より広い文脈で捉えます。
- フラグメントスクリーニングキャンペーン後の戦略(ヒットを検証するための直交的な方法と、その進行方法)を明確にします。必要に応じて、コラボレーションを並べます。
- ラボとデータ解析の部分が集中するため、事前に経験豊富な結晶学者を割り当てることを強くお勧めします。
- 堅牢な水晶システムは、技術的なばらつきをなくすための鍵であり、ユーザーはこれらの重要な点に対処する必要があります。
- 結晶化条件により、リザーバー容量が30 μL(またはそれ以下)で、液滴サイズが200〜500 nLのプラットホームでの使用に適したプレートに、同様の回折品質の結晶で再現性のある滴が得られることを確認してください。理想的には、プレート中の液滴の50%以上が、少なくとも35μmサイズの結晶を有するであろう33。
- 結晶の一貫した回折品質(2.6 Å以上)を確保します。
- 結晶充填や既知の部位のアクセス性など、フラグメントスクリーニングに対する結晶系の適合性を確認します。これらの部位に分子が結合しているという以前の証拠は、しばしば安心させるものです。
- ケースを作る!ターゲットの重要性を提示し、より広い文脈で捉えます。
2. 訪問の準備
- 現場での結晶化のための結晶化プロトコルの転送。
- すぐに使用できる 2 x 50 mL のリザーバー溶液を用意します。
- 結晶化に必要な濃度のタンパク質溶液を、30〜50μLのアリコートですぐに使用できるように提供します。
- 10 mLのタンパク質緩衝液を用意します。
- シードストックを提供します(結晶化プロトコルで必要ない場合でも)。
注:播種は結晶化の再現性を助長し、核生成時間を短縮する33。 - XChem の Web サイト28 で入手できる結晶化情報フォームに記入します。
- XChem の Web サイト28 で入手できる配送フォームに保管情報を提供します。
- NoMachine をインストールし、Diamond (https://www.diamond.ac.uk/Users/Experiment-at-Diamond/IT-User-Guide/Not-at-DLS/Nomachine.html) へのリモート デスクトップを設定します。
- 専門の結晶学者またはXChemサポートスタッフと相談して、優れた参照モデルを生成して転送します。
3. フラグメントスクリーニング実験
- コンパウンドのディスペンス位置を定義します。
- 結晶化プレートのイメージング。
- 実験に必要なすべての結晶板(材料表参照)を結晶板イメージャー(材料表参照)で撮像します。イメージャーソフトウェアを使用して、プレートタイプの正しいディレクトリに、提案Number_Plate番号の形式でプレート名を生成します。
- バーコードを印刷し(プレート名を右クリックしてメニューから選択)、行文字とは反対側のプレートに配置し、バーコードをユーザーの反対側に向けてプレートをロードポートに入れます。
- イメージャー制御ソフトウェアを使用して、ロードポートをスキャンし、プレートを右クリックして、 イメージプレートを選択します。
- イメージングが完了したら、イメージャーからプレートを取り外します。
- 結晶と化合物の位置の選択
注:結晶化液滴の画像は、TexRankのテキストンベースのアルゴリズムRankerを使用してLuigiパイプライン内で処理され、結晶の存在の可能性によって液滴をランク付けします22。これには約 10 分かかり、画像は TexRank で利用できるようになります。- PCから TeXRank を開き、右下のリストから、または左上のボックスにバーコードを入力して、クリスタルトレイを選択します。
- 正しいイメージャーフォーマットとシングルウェルビューを選択します。液滴の画像を移動し、実験で使用するのに適した結晶がある場合は、結晶から離れて右クリックしますが、液滴の内側では、液滴のどこに溶媒/化合物を追加するかが目的であるため、結晶23に直接当たらないようにします。
- プレート全体を続行し、終了したら、[ Echo 1 Target ]ボタンを選択します。Crystal Targets ディレクトリの該当する訪問の下に保存します。ファイル名は変更しないでください。
- 追加のプレートについても繰り返します。
- 結晶化プレートのイメージング。
- コンパウンドディスペンシング
- コンパウンドディスペンス用ファイルの生成
- SoakDB で、ライブラリ/溶媒テーブルにライブラリ選択または溶媒情報を入力します。
- 対象クリスタルのリストに液滴量と負荷を入力します。
- 必要なバッチを生成します。
- ソークパラメータを入力します。「 計算 」をクリックし、「 エクスポート保留中 」ボタンをクリックします。溶媒については、さまざまな濃度を表に追加します。これにより、アコースティックディスペンサーで使用するファイルが生成されます。
- 凍結保護剤を使用する場合は、濃度を入力し、同じ方法でファイルを作成します。
- アコースティックディスペンサーを使用したディスペンスソリューション( 材料表を参照)
- ソースプレート(化合物または溶媒/凍結保護剤)を取り出し、プレートを遠心分離機で1,000 x gで2分間回転させます。
- 溶媒または凍結保護剤を分注する場合は、384PPプレート上の関連するウェルに30 μLをピペットで移します。マイクロシールフィルムで覆い、上記のように遠心分離します。
- ソフトウェアを開きます。 [新規 ]を選択し、正しいソースウェルプレート(384PP、384LDV、または1536LDV)と液体クラス(DMSO、CP、BP、またはGP)を選択します。正しいプレート タイプがデスティネーション プレートとして選択されていることを確認します。次に、[ カスタム ]チェックボックスをオンにして続行します。
- [ インポート] を選択し、関連するバッチ ファイルを選択します。ソフトウェアの指示に従ってインポート手順を完了します。
- プレートマップを使用して、ディスペンスする溶液と宛先の場所を確認します。
- 表示されるプロンプトに従って、プロトコルを実行します。ソースプレートからの溶液は、選択した結晶滴に分注されます。
- プレートをインキュベーターに必要時間保管します。
注:これらのパラメータは溶媒特性評価ステップで決定され、温度は結晶成長温度に応じて4°Cまたは20°Cのいずれかであり、時間は通常1時間から3時間の間です。
- コンパウンドディスペンス用ファイルの生成
- 半自動結晶採取装置を用いた結晶の採取( 材料表).
注:凍結保護が必要な場合は、サンプルを回収する前に、ステップ3.2.2を繰り返して、結晶滴に凍結保護溶液を添加します。- 収穫の準備
- SoakDB での収集に必要なファイルを準備します。尋ねられたら、ソークが完了し、バッチが完了したことを確認します。
- 正しいプロポーザル番号で実験に必要なパックの数をスキャンします。
- 水晶振動子に適したサイズのループ(35 μm、75 μm、または150 μm)のトレイを選択します。重要なことは、ビームラインへの自動センタリングをより正確にし、バックグラウンドを低減してデータ品質を向上させ、凍結保護剤の必要性をなくすために、結晶のサイズにできるだけ近いループサイズを選択することです。
- 関連するソフトウェアを開き、ワークフロータブを開きます。
- パックをスキャンしてソフトウェアに取り込み、リストの一番上までスクロールして、最初のパックを強調表示します。
- パックをフォームデュワーに入れ、液体窒素で冷却します。
- [ Import File From SoakDB (SoakDB からファイルをインポート )] を選択し、収集するバッチを選択します。バッチが左側のホルダーに割り当てられているかどうかを確認します。ワークリストが表示されます。
- クリスタルプレートを取り、シールをはがし、左側のホルダーに入れます。プレートを駐車位置に移動します。
- 結晶の採取
- 慣れてきて、 ワークフローの開始 ボタン(画面はタッチスクリーン)を押して、最初に選択したウェル位置に移動します。
- 結晶が生き残った場合は、水晶をループに取り付け、液体窒素に突入して、リストの最初のパックの位置1に置きます。
- 界面から結晶の適切な説明(通常、溶融、亀裂、ゼリー、または色付き)を選択します。
- 滴がコンパウンドのソークの場合は、コンパウンドの状態(透明、結晶、沈殿、不良ディスペンス、または相分離)の説明を記録します。
- 水晶振動子が正常にマウントされた場合は「 マウント済み 」を選択し、そうでない場合は 「失敗」を選択します。
- プレートは、次に選択したウェルに移動します。すべてのパックの位置を連続して埋めます(クリスタルが故障した場合は隙間を空けないでください)。ワークフローが終了するまで続けてください。
- ワークフローの最後に、追加のバッチをロードし、パックを順番に充填し続けます。新しいバッチのために新しいパックを開始する必要はありません。
- 収穫結果のバーコード追跡
- すべての結晶が収穫されたら、パックをバーコードスキャナーに持って行き、一度に1つずつホルダーに入れてパックをスキャンし、バーコードをピンで留めます。
- これが終わったら、パックに蓋をして、液体窒素貯蔵デュワーに保管します。
- 出力ファイルを SoakDB インターフェースにロードします。
- ISPyB34,35,36へのサンプル情報の記録
- サンプルデータをISPyBにアップロードする
- SoakDBで、ビームラインを更新し、ISPyBの更新にアクセスし、エクスポートをクリックして、ISPyBにアップロードするファイルを作成します。
- パテを開きます。ログインして、ディレクトリdls/labxchem/data/year/lbXXXX-1/processing/lab36/ispybを参照します。
- スクリプト csv2ispyb (csv2ispyb lbXXXX-1-date.csv) を実行します。
注: これで、サンプルが ISPyB にロードされました。
- パックの位置とデータ収集戦略を記録します。
- パックの詳細と場所を記録します
注:パックの位置を特定してビームラインに積み込むことができるように、パックの詳細と位置を記録することが重要です。- SoakDB で、 Pucks というラベルの付いた 2 番目のタブを開きます。
- 上部のボックスに詳細を入力します。具体的には、パック(貯蔵デュワーと杖)の場所、予想される解像度と提案番号を含むデータ収集パラメータ。
- [ 保存 ]ボタンをクリックすると、すべてのパックのリストがテーブルに表示されます。最近充填されたパックをコピーします。
- XChem キュー スプレッドシート (デスクトップのショートカット) を開き、情報を貼り付けます。その他の関連情報を入力します。
- パックの詳細と場所を記録します
- サンプルデータをISPyBにアップロードする
- 収穫の準備
4. データ収集
注:データは無人モードで収集され、XChem/ビームラインチームによって管理されます。
- 中心がずれたサンプルの回収。
注:これらは、特定のサンプルのデータ収集で問題が発生した場合に必要であり、ピンが正しくセンタリングされていない場合に原因である可能性があります。- ISPyBのサンプルチェンジャービューを見て、[ APによるランク] を選択して、緑から赤への色目盛りの自動処理解像度でサンプルをグレーディングします。
- サンプルをクリックして、赤または黄色のサンプルを確認します。
注:これにより、データ収集が表示されます。 - 水晶のスナップショットをチェックして、水晶が中央に配置されているかどうかを確認します。
- センタリングされていないものをすべてメモし、不足しているサンプルを回収する地元の連絡先に送信します。
5. データ解析
- XChemExplorer (XCE)25 による Diamond の自動処理結果の取得と分析。
- ターミナルで、サブフォルダ Processing:cd /dls/labxchem/data/year/visit/processing、 XChem BAGs:cd /dls/labxchem/data/year/visit/processing/project/processing/に移動します。
- エイリアス xce を使用して XChemExplorer を開きます。
- 「 データソースからテーブルを更新 」ボタンを選択します。
- [概要] タブの下に、実験データの概要があります。[データソース] メニューの [表示する列の選択] オプションを使用して、カテゴリを追加します。
- 「 設定 」タブで、データ収集ディレクトリ (/dls/i04-1/data/year/visit/) を選択します。
- 「データセット」タブを開き、「ターゲットの選択」ドロップダウンメニューからターゲットを選択し、「データセット」ドロップダウンメニューから「自動処理」から「新しい結果」を選択して、「実行」をクリックします。
注:XCEは、自動処理結果を得るためにデータ収集訪問を解析します。これは、解析されるデータセット/ディレクトリの数によっては、初回実行時に時間がかかる場合があります。 - 解像度、スペースグループ、およびマージをチェックして、データの一貫性と品質を確認します。分解能が 2.8 Å 未満のデータは除外します。
注: デフォルトでは、データセットの選択は I/sigI、完全性、および一意のリフレクションの数から計算されたスコアに基づいて行われますが、他の処理結果を選択して使用することもできます25. - 個々のデータセットに対して異なる処理結果を選択するには、必要に応じて[サンプルID]をクリックし、目的のプログラム/実行を選択します。すべてのデータセットの処理パイプラインを変更するには、[Preferences] (設定)メニューから[Edit preferences] (設定の編集)を選択し、[Dataset Selection Mechanism] (データセット選択メカニズム)を変更します。
- 必要に応じて、ISPyB37 を介してデータを再処理します。
- サンプルの処理済みデータが許容できない場合は、 Failed to exclude from further analysis(さらなる分析から除外できませんでした)というラベルを付けます。
- 完了したら、[データ ソースからテーブルを更新 ]をクリックして、後続のテーブルにデータを追加します。
- DIMPLE38 を使用した初期マップの計算。
- [ マップ ] タブを開き、ドロップダウン メニューから参照モデルを選択して目的のデータセットを選択し、選択した MTZ ファイルに対して [DIMPLE を実行] を選択します。
- XCEは、Diamondのクラスタで多数のDIMPLEジョブを同時に実行します。これらのジョブのステータスを [ ディンプル ステータス ] 列で確認し、[ データソースからテーブルを更新] ボタンを使用するか、Linux の qstat コマンドを使用して更新します。
- 完了したら、[ディンプル リスクリスト]、[ディンプル リスク フリー]、および [スペース グループ] の値が許容されるかどうかを確認します。必要に応じて(Rfreeが高い/空間群が間違っている/単位セル体積の差が大きい)、前述のように自動処理結果を変更し、これらのデータセットに対してマップ生成を繰り返します。
- Grade39、AceDRG40、またはphenix.eLBOW41を使用したリガンド拘束の生成。
- 目的のプログラム(Preferences、Edit preferences、Restraints generation program)を選択し、Mapsタブでデータセットを選択してから、Maps & RestraintsドロップダウンからCreate CIF/PDB/PNG file of SELECTEDコンパウンドを実行します。
- 「データ・ソースから表を更新」ボタンを使用して、「複合ステータス」列にあるこれらのジョブのステータスを更新します。
- 基底状態モデルの構築 (実行前)
注:基底状態モデルという用語は、100のデータセットで観察されたリガンドフリーの形態のタンパク質の構造を表します(この数は任意に選択されます)。基底状態モデルは、リガンド結合状態を構築するための基準として使用されるため、フラグメントスクリーニングキャンペーン全体の分析に先立って、すべての溶媒分子と水分子を含む正確な基底状態モデルを構築することが重要です。このステップでは、PanDDAによって興味深い事象がない(したがってリガンドフリーである可能性が高い)とマークされた最初の100の最高解像度データセットを使用して基底状態平均マップを生成し、Rフリー が最も低いデータセットを細分化のために選択します。基底状態平均マップは結晶学的マップではありませんが、このマップは基底状態モデルの構築にのみ使用することが重要です。- 「PanDDAs」タブを開き、必要に応じてデータソースからテーブルを更新します。
- 出力ディレクトリ(/dls/labxchem/data/year/visit/processing/analysis/panddas)を定義します。
- Ground State ModelにPre-runを選択し、Runをクリックします。
注: 自由自由度が高く、予期しない空間群を持つデータセットは、自動的に解析から除外されます。 - 自由度が高く、予期しないスペースグループを持つデータセットを手動で除外するには、[ 完全に無視]を選択します。
- ターミナルウィンドウで qstat を使用して、実行前ジョブの状態を確認します。
- 完了したら、 [ Build ground state model](基底状態モデルの構築 ) を選択し、 [ Run] をクリックします。
注:これにより、Cootを使用して再モデリングおよび改良するための最高品質のデータセットからのPanDDA平均マップと参照モデル/ 2Fo-Fc / Fo-FcマップでCootが開きます。モデリングには、PanDDA平均マップのみを使用することが最も重要です。
- PanDDA26 を使用したヒットの識別
- PanDDA解析
注:データセットが多数あり、ユニットセルが大きく、非対称ユニットにタンパク質のコピーが複数ある場合、クラスターでの実行に時間がかかることがあります。- 「 DLS 自動処理結果の解析」 と「 初期マップ計算」で説明した手順を繰り返します。マップ計算では、基底状態モデルを参照として使用します: 参照 ファイルリストの更新 > 新しい参照の設定 新しいデータ に必要な 配位子拘束条件 を生成します (手順 6.1-6.3)。
- [PanDDAs] タブで、出力ディレクトリが以前と同じように設定されていることを確認し、[Hit Identification] ドロップダウン メニューから pandda.analyse を実行します。
- qstatコマンドを使用して、Linuxターミナルでジョブのステータスを確認します。
- PanDDA inspect - バインディングイベントのチェック/構築
- XCE の [PanDDAs] タブで、[Hit Identification] ドロップダウン メニューから pandda.inspect を実行し、PanDDA コントロール パネルで Coot42 を開きます。
注: pandda.inspect コントロール パネルには、PanDDA 統計の概要が表示され、ユーザーはバインド イベント/サイト間を移動できます。結果の概要 HTML ファイルも生成され、検査中に [HTML の更新] を選択して更新できます。 - リガンドをモデル化するには、別のイベントに移動する前に [ Merge Ligand With Model ] と [ Save Model] をクリックして、境界状態モデルへの変更が失われないようにします。
注: 更新および保存されたモデルのみが、後の段階で調整のためにエクスポートされます。 - 「イベント・コメント」フィールドを使用してバインディング・イベントに注釈を付け、「サイト情報の記録」を使用してバインディング・サイトに注釈を付けます。
- 負荷平均マップと2mFo-DFcマップ(DIMPLEから)を使用して、イベントマップおよびモデルと比較します。
- すべての実行可能なリガンドがイベントマップに基づいてモデル化され、マージされ、保存されたら、 pandda.inspectを閉じます。
- XCE の [PanDDAs] タブで、[Hit Identification] ドロップダウン メニューから pandda.inspect を実行し、PanDDA コントロール パネルで Coot42 を開きます。
- PanDDAのエクスポートと改良
注: PanDDA 検査後、モデルはプロジェクト ディレクトリにエクスポートされ、最初のリファインが開始されます。現在、XCEのPANDDAタブでは、2つのパイプラインが利用可能です。- Export NEW/ALL/SELECTED PANDDA models は、リファインメントのために境界モデルと非境界モデルのアンサンブルを生成し、Refmac43の占有拘束パラメータを生成します。
注: アンサンブル モデルは調整に使用されますが、バインド状態モデルのみが Coot で更新され、PDB に格納されます。このパイプラインは、占有率の低いフラグメントやタンパク質モデルへの大幅な変更を含むデータセットに最適です。 - BusterでNEW/ALL 境界状態モデルをリファインするBusterは、Buster44でのみ境界状態をリファインします。
注:これは、タンパク質モデルへの変更が最小限に抑えられた高占有率のリガンド/データセットで使用するのが最適です。
- Export NEW/ALL/SELECTED PANDDA models は、リファインメントのために境界モデルと非境界モデルのアンサンブルを生成し、Refmac43の占有拘束パラメータを生成します。
- PanDDA解析
- ヒットの絞り込み (絞り込みのために選択されたすべてのデータセットが [絞り込み] タブに表示されます)。[Refinement] ドロップダウン メニューから [Open COOT - BUSTER Refinement] または [Open COOT - REFMAC Refinement] を選択し、[XCE Refinement] コントロール パネルで Coot を開きます。
- [ Select Samples ]ドロップダウンから精製するサンプルのステータスを選択し(通常は 3 - in refinement)、[ GO]をクリックします。
注: XCEコントロールパネルには、そのカテゴリのデータセット数のサマリーが表示され、リファインメント統計のサマリーを提供しながら、データセット間を移動することができます。 - XCEコントロールパネルでリガンドの信頼性にアノテーションを付けます: 0 - リガンドが存在しない - フラグメントが結合していない。 1 - 低信頼度 - フラグメントは結合している可能性がありますが、特に説得力はありません。 2 - 正しいリガンド、弱い密度 - ユーザーはフラグメントが結合したと確信しているが、占有率が低いか、マップにいくつかの問題があります。3-明確な密度、予期しないリガンド-マップは、提供された化学構造と相関 しないリガンド結合を明確に示しています。 4-高い信頼度-リガンドは明確に結合しています。
- この段階でモデルに必要な変更を加え、[リファイン]ボタンを使用してさらに リファイン を開始します。
- Show MolProbity To-Do List ボタンを使用して、すべての細分化サイクルで実行されたMolProbity45 分析にアクセスします。
- 必要に応じて、[細分化パラメータ]ボタンを選択して、異方性温度係数、双晶データ、占有細分化などの 細分化パラメータ を追加します。
注:データ処理統計はXCEの[ Refinement ]タブでも提供され、Busterパイプラインでリファインメントが実行されると、MOGUL解析46を含むBusterレポートが提供されます。 - リファインメントの進行に合わせて、XCEのメインウィンドウの「 Refinement 」タブまたは Coot XCE コントロールパネルの両方で、データセットのステータスを変更します。モデルがリガンド周辺で正確であり、さらなる分析のために共有するのに適していることを確認したら、ステータスを CompChem Readyに変更します。リファインメントが完了し、モデルをPDBにアップロードする準備ができたら、ステータスを [Deposition ready]に変更します。
- [ Select Samples ]ドロップダウンから精製するサンプルのステータスを選択し(通常は 3 - in refinement)、[ GO]をクリックします。
6. データの預け入れ
注:フラグメント画面からのすべてのデータセットと、PanDDAイベントマップの生成に使用される基底状態モデルは、グループデポジションを使用してPDBにデポジットできます。
- [Hit Identification] メニューから Event Map ->SF を実行して、すべての PanDDA イベント マップを MTZ 形式に変換します。
- 著者やメソッドなどの追加のメタデータを指定するには、登録 >情報の編集を選択します。必要な項目をすべて入力し、[ Save to Database ] をクリックして、基底状態モデルの堆積のためにこの情報を保存します。これは、モデルのステータスが [Deposition Ready]に変更された後に行います。
- [ 堆 積]タブで、[ mmcifの準備] ボタンを選択して、すべての 堆積準備完了 データセットの構造因子 mmcif ファイルを生成します。これが完了すると、ターミナルウィンドウに「 Finished Preparing mmcif Files for wwPDB Deposition」というメッセージが表示されます。
- [ mmcifのコピー ]ボタンを選択して、これらすべてのファイルを訪問のグループ 登録ディレクトリ 内の単一のbzip圧縮tarアーカイブにコピーします。
- https://deposit-group-1.rcsb.rutgers.edu/groupdeposit に移動します。ユーザー名:grouptester、パスワード:!2016rcsbpdbでログインします。セッションを作成し、リガンド結合.tar.bz2ファイルをグループ登録ディレクトリからアップロードします。
- リガンド結合構造の登録に成功すると、PDBコードが記載された電子メールが送信されます。[Deposition]メニューから[Update DB with PDB Codes]を選択します。この電子メールの情報をコピーしてポップアップウィンドウに貼り付け、[データベースの更新]をクリックしてPDB IDを追加します。
- PanDDA で使用される基底状態モデルを格納するには、XCE で関連する PanDDA ディレクトリを選択し、[Hit Identification] メニューから apo->mmcif を実行します。
注記 : XCE は、堆積バンドルのモデルとして Rfree の低い高分解能構造を任意に選択し、すべての構造因子 mmcif ファイルを 1 つのファイルにコンパイルします。 - [Deposition] タブで、[Group Deposition of Ground-State Model] セクションの下にある [Add to Database] ボタンを選択します。
- 基底状態モデルのメタデータを入力し (ここでも [Deposition > Edit Information] を選択して)、前のファイルを読み込み、[ Save to Database] を選択します。
- 「基底状態モデルの集団堆積」セクションから「mmcif の準備」を実行して基底状態の mmcif ファイルを準備し、完了したら、同じセクションの [Copy mmcif] ボタンを選択して、mmcif をグループ堆積ディレクトリにコピーします。
- 前と同じように、https://deposit-group-1.rcsb.rutgers.edu/groupdeposit に移動します。ユーザー名:grouptester、パスワード:!2016rcsbpdbでログインします。セッションを作成し、グループ登録ディレクトリから ground_state_structures.tar.bz2 ファイルをアップロードします。
結果
X線結晶構造解析によるフラグメントスクリーニング用のXChemパイプラインは大幅に合理化され、科学界に採用されています(図5)。このプロセスは、ヒット率が1%から30%の間で変動する150以上のスクリーニングキャンペーンで検証されており47、48、49、50、51、52、および多くのリピートユーザーによって検証されています。適さない(分解能が低い、結晶化や回折品質に一貫性がない)結晶系や、DMSOやエチレングリコールに耐えられない結晶系は、プロセスの早い段階で排除され、時間、労力、リソースを節約できます。キャンペーンが成功すると、標的タンパク質上の潜在的な相互作用部位の3次元マップが提供されます。典型的な結果は、SARS-CoV-2の主要なプロテアーゼのXChemスクリーニングです(図6)。典型的には、フラグメントヒットは、(a)酵素活性部位およびサブポケット48などの既知の関心部位において見出される。(b)推定アロステリック部位、例えば、タンパク質間相互作用53;(c)一般に偽陽性と見なされる結晶パッキング界面(図6)。この構造データは一般に、フラグメントヒットを鉛様の低分子に融合、連結、または成長させるための基礎を提供する1,3。
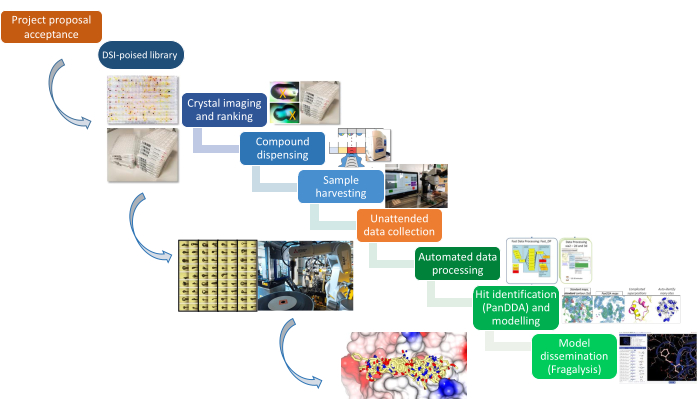
図 1: XChem パイプライン このプラットフォームは、プロジェクトの提案からサンプルの準備、データ収集、ヒットの識別まで、概略的に表現されています。 この図の拡大版をご覧になるには、ここをクリックしてください。
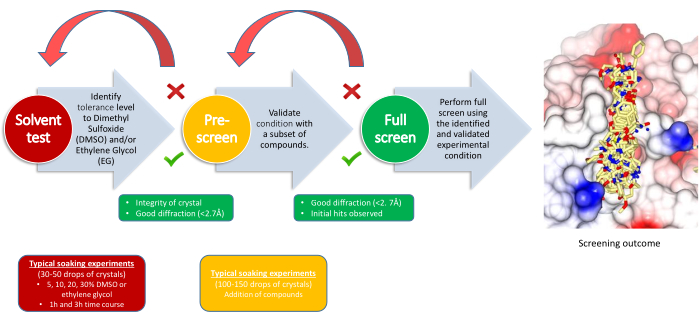
図2:スクリーニング戦略。 ワークフローは、各マイルストーンの目的、実験の要件、および決定ポイントを示します。 この図の拡大版をご覧になるには、ここをクリックしてください。
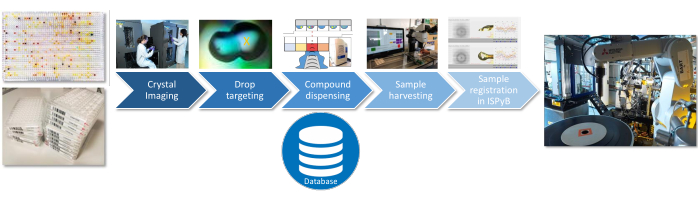
図3:サンプル前処理のワークフロー。 サンプル調製の重要なステップは、SQLiteデータベースに記録されている各ステップの情報で表されます。 この図の拡大版をご覧になるには、ここをクリックしてください。
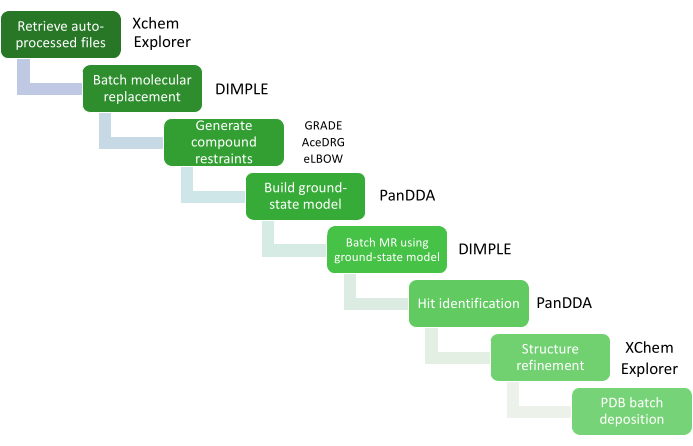
図4:XCEを用いたデータ解析 データ分析の重要なステップは、関連するソフトウェアパッケージを含むワークフロー図で表されます。 この図の拡大版をご覧になるには、ここをクリックしてください。
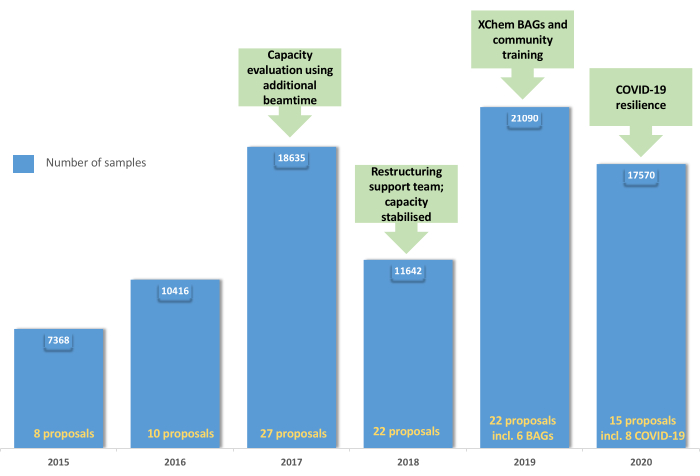
図5:XChemユーザープログラムの進化:このグラフは、2015年から2019年にかけてのユーザープログラムの採用と統合を示しており、2019年のBAGの作成と、2020年のCOVID-19パンデミックによるプラットフォームの回復力を示しています。この図の拡大版をご覧になるには、ここをクリックしてください。
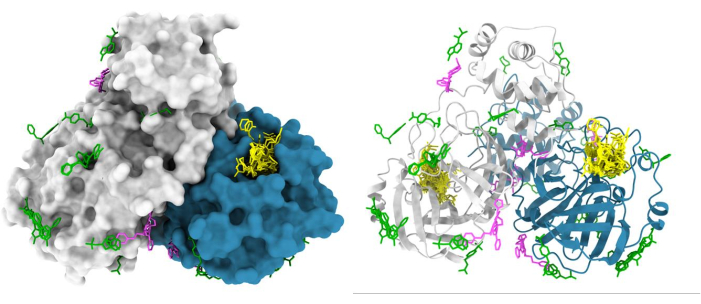
図6:XChemフラグメントスクリーニングの代表的な結果。 SARS-CoV2メインプロテアーゼ(Mpro)二量体は表面で表され、活性部位ヒットは黄色、推定アロステリックヒットはマゼンタ、表面/結晶充填アーチファクトは緑色で示されています。この図は、グループ堆積G_1002156のChimeraおよびMpro PDBエントリを使用して作成されました。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
このホワイトペーパーで概説したプロセスは、ユーザーコミュニティによって広範囲にテストされており、ここで説明するプロトコルの適応性は、プラットフォームで通常遭遇するさまざまなプロジェクトを処理するための鍵となります。ただし、結晶系にはいくつかの前提条件が必要です。
X線結晶構造解析を使用して実施するフラグメントスクリーニングキャンペーンでは、再現性のある堅牢な結晶システムが重要です。標準的なXChemプロトコルでは、結晶滴にフラグメントを直接添加する必要があるため、最適化では、結晶の総数ではなく、高品質の結晶を含む滴の数に焦点を当てる必要があります。液滴に複数の結晶が含まれている場合、それらは効果的に冗長ですが、収穫プロセスを軽減する可能性があります。さらに、結晶化プロトコルをホームインスティテュートからオンサイト施設に移すことは困難な場合があります。これは一般に、再現性のある核生成を促進するために結晶播種を用いて最もよく達成される54ので、したがって、ユーザがタンパク質および結晶化溶液とともに種子ストックを提供することが良い習慣である。
良好な化合物の溶解性と担体を確保するために、弱いフラグメントの結合を促進することを目的とした高濃度の浸漬、フラグメントライブラリは有機溶媒、特にDMSOおよびエチレングリコールで提供されます。2種類の溶媒を用意することで、DMSOをまったく許容しない結晶や、目的部位でのフラグメントの結合を閉塞させる結晶の代替品となります。ユーザーは水性バッファーで代替ライブラリを供給できます:化合物は、液体ディスペンスロボットと互換性のあるプレートで完全に溶解およびフォーマットされていれば、適切にディスペンスされます。
ライブラリーを可溶化し、結晶系で許容される適切な有機溶媒を見つけることが不可能なプロジェクトでは、BESSY55で確立された乾燥化合物を使用するという代替手順があります。
コミュニティでは、高塩濃度の結晶化条件で成長した結晶に化合物を浸すことができるかどうかについて長年の疑問があります。実際には、収穫段階での化合物のより多くの沈殿および塩結晶の急速な形成が観察され、これは収穫地域の周囲に湿潤な環境を適用することによって減少する。一般に、高塩分結晶化条件からの結晶系でのスクリーニングキャンペーンは、低塩分条件と同等のヒット率をもたらします。
XChemプロセスの初期段階(溶剤耐性試験と事前スクリーニング)は、比較的小規模で迅速な実験ですが、プロジェクトの明確な実行/中止の決定を可能にします。最も厄介なのは、どちらの溶媒も許容されない場合、または事前スクリーニングの結果、ヒット率が非常に低い場合は、代替の結晶システムを見つける必要があることです。対照的に、成功した場合、結果はスクリーニング実験に使用する浸漬条件とデータ収集の最良の戦略を直接通知します。データの品質、特に分解能は、ヒットの同定と分析のための電子密度の品質に影響を与えるため、回折品質に悪影響を与えない可能な限り高い化合物濃度で浸漬することを目的としています(データセットの大部分(~80%)は2.8 Å以上の分解能に回折します)。
データ解析プロセスはXChemExplorer内で合理化されており、弱いバインダーの検出にはPanDDAソフトウェアに依存しており、ユーザーはスクリーニングキャンペーンの結果を迅速に視覚化して確認することができます。XChemExplorerは、Diamondで入手可能なパッケージ(DIALS16、autoPROC 30、STARANISO31、Xia214)から、各パッケージの標準的な方法(CC1/2 = 0.3)によって決定された分解能制限でデータ処理結果をインポートします。デフォルトでは、データセットの選択は、I/sigI、完全性、および多数の一意の反射から計算されたスコアに基づいているが、特定の処理結果は、グローバルまたは個々のサンプルの両方に使用するために選択することができる25。また、分解能、Rフリー、リファレンスデータとターゲットデータ間の単位セル体積の差(デフォルトはそれぞれ3.5 Å、0.4、12%)などの基準に基づいて、PanDDAによる分析からデータを除外し、回折が不十分な結晶、偏芯、または誤ったインデックスが分析に影響を与えないようにします。
PanDDAアルゴリズムは、フラグメントキャンペーン中に収集された大量のデータセットを利用して、標準的な結晶構造マップでは見えない部分占有リガンドを検出します。最初に、PanDDAは溶媒耐性試験と事前スクリーニングのステップで収集されたデータを使用して平均密度マップを作成し、それを使用して基底状態モデルを作成します。このモデルはその後のすべての分析ステップに使用されるため、フラグメントスクリーニングに使用される条件下でリガンド化されていないタンパク質を正確に表すことが重要です。次に、PanDDAは統計解析を使用して結合配位子を同定し、結晶の結合状態のイベントマップを生成します。イベントマップは、部分占有データセットから結晶の結合していない画分を差し引くことによって生成され、リガンドが全占有で結合した場合に観察されるものを示します。従来の2mFのo-DFCマップでは明瞭に見えるフラグメントでさえ、事象マップを参照しなければ、モデル化が誤られる可能性がある32。PanDDAは、平均マップ(通常はフラグメント結合を示す)とは異なるデータセットを特定するための強力な方法であり、RSCC、RSZD、Bファクター比、リファインメント中のRMSDなどの指標がユーザーの利益のために提供されていますが、観察された密度が予想されるリガンドと最適なコンフォメーションを正確に表しているかどうかを判断する最終的な責任はユーザーにあります。
データの解析と精緻化により、XChemExplorerを用いて、すべてのユーザーが同時にタンパク質データバンク(PDB)に複数の構造を寄託することが可能になりました。各フラグメントスクリーンに対して、2つのグループ堆積が行われます。最初の堆積には、MMCIFファイルに含まれるPanDDAイベントマップを計算するための係数を持つ、すべてのフラグメント結合モデルが含まれています。2回目の堆積では、実験の全データセットの測定された構造因子に沿って、付随する基底状態モデルが提供され、このデータはPanDDA分析の再現や将来のアルゴリズムの開発に使用できます。ヒットの構造に関しては、フラグメント占有率が低い場合、モデルがリガンド結合と交絡基底状態構造の複合体である場合、精緻化はより良好に動作します32。それにもかかわらず、完全な複合モデルは一般的に複雑で解釈が難しいため、実際には束縛状態分数のみを堆積させます。その結果、PDBによって再計算される一部の品質指標(特にR/Rfree)は、わずかに上昇することがあります。Zenodo56 などのプラットフォームを使用してすべての生データを提供することもできますが、これは現在 XChem パイプラインではサポートされていません。
全体として、2016年の運用以来、この手順を使用してターゲットの95%以上でフラグメントリガンドを同定することができました。XChemがサポートした多くのプロジェクトからの経験は、結晶調製33のベストプラクティスに凝縮され、フラグメントの進行を支援するための確立された概念を実装したフラグメントライブラリが進化し29、ライブラリ組成を公開する慣行の確立にも役立ちました。このプラットフォームは、ここで詳述されているように、よく維持されたインフラストラクチャと文書化されたプロセスの重要性を実証し、他のフラグメントライブラリ57,58を評価し、ライブラリ48を比較し、共同EUOpenscreen-DRIVEライブラリ59,60の設計に情報を提供することを可能にしました。
開示事項
著者には開示すべき利益相反はありません。
謝辞
この研究は、ダイヤモンド光源と構造ゲノムコンソーシアムの間の大規模な共同作業を表しています。著者らは、i04-1ビームラインの自動化に貢献し、すべてのMXビームラインで共通して実行されるデータ収集と自動処理パイプラインを提供してくれたDiamondのさまざまなサポートグループとMXグループに感謝したいと思います。また、SGC PXグループのレジリエンス(回復力)と、セットアップをテストした最初のユーザーであるEvotecと、最初の本格的な産業ユーザーであるEvotecにも感謝しています。この研究は、欧州委員会のHorizon 2020プログラムの資金提供を受けたiNEXT-Discovery(助成金871037)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| DSI-poised library | Enamine | DSI-896 | fragment library |
| Echo 550 and 650 series | Beckman-Coulter | acoustic dispensing system | |
| Echo microplates | Beckman-Coulter | 001-12380; 001-8768; 001-6025 | 1536-well and 384-well microplates |
| Shifter | Oxford Lab Technology | harvesting device | |
| Microplate centrifuge with a swing-out rotor | Sigma | model 11121 | microplate centrifuge |
| 3-drops crystallisation plates | Swissci | 3W96T-UVP | Crystallisation plates |
| Formulatrix plate imager and Rockmaker software | Formulatrix | Crystallisation plates imaging device |
参考文献
- Erlanson, D. A., Fesik, S. W., Hubbard, R. E., Jahnke, W., Jhoti, H. Twenty years on: The impact of fragments on drug discovery. Nature Reviews Drug Discovery. 15 (9), 605-619 (2016).
- Jacquemard, C., Kellenberger, E. A bright future for fragment-based drug discovery: what does it hold. Expert Opinion on Drug Discovery. 14 (5), 413-416 (2019).
- Jahnke, W., et al. Fragment-to-lead medicinal chemistry publications in 2019. Journal of Medicinal Chemistry. 63 (24), 15494-15507 (2019).
- Li, Q. Application of fragment-based drug discovery to versatile targets. Frontiers in Molecular Biosciences. 7, 180 (2020).
- Kirsch, P., Hartman, A. M., Hirsch, A. K. H., Empting, M. Concepts and core principles of fragment-based drug design. Molecules. 24 (23), 4309 (2019).
- Patel, D., Bauman, J. D., Arnold, E. Advantages of crystallographic fragment screening: functional and mechanistic insights from a powerful platform for efficient drug discovery. Progress in Biophysics and Molecular Biology. 116 (2-3), 92-100 (2014).
- Wasserman, S., et al. Automated synchrotron crystallography for drug discovery: the LRL-CAT beamline at the APS. Acta Crystallographica Section A Foundations of Crystallography. 67 (1), 46-47 (2011).
- Hartshorn, M. J. Fragment-based lead discovery using X-ray crystallography. Journal of Medicinal Chemistry. 48 (2), 403-413 (2005).
- Arzt, S., et al. Automation of macromolecular crystallography beamlines. Progress in Biophysics and Molecular Biology. 89 (2), 124-152 (2005).
- Beteva, A. High-throughput sample handling and data collection at synchrotrons: Embedding the ESRF into the high-throughput gene-to-structure pipeline. Acta Crystallographica Section D, Biological Crystallography. 62, 1162-1169 (2006).
- Papp, G., et al. FlexED8: The first member of a fast and flexible sample-changer family for macromolecular crystallography. Acta Crystallographica. Section D, Structural Biology. 73, 841-851 (2017).
- Casanas, A., et al. EIGER detector: Application in macromolecular crystallography. Acta Crystallographica Section D, Structural Biology. 72, 1036-1048 (2016).
- Henrich, B., et al. PILATUS: A single photon counting pixel detector for X-ray applications. Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 607 (1), 247-249 (2009).
- Winter, G., Lobley, C. M. C., Prince, S. M. Decision making in xia2. Acta Crystallographica Section D, Biological Crystallography. 69, 1260-1273 (2013).
- Winter, G., McAuley, K. E. Automated data collection for macromolecular crystallography. Methods. 55 (1), 81-93 (2011).
- Winter, G., et al. DIALS: Implementation and evaluation of a new integration package. Acta Crystallographica Section D, Structural Biology. 74, 85-97 (2018).
- Bowler, M. W. MASSIF-1: A beamline dedicated to the fully automatic characterization and data collection from crystals of biological macromolecules. Journal of Synchrotron Radiation. 22 (6), 1540-1547 (2015).
- Von Stetten, D., et al. ID30A-3 (MASSIF-3) - A beamline for macromolecular crystallography at the ESRF with a small intense beam. Journal of Synchrotron Radiation. 27, 844-851 (2020).
- Cipriani, F., et al. CrystalDirect: a new method for automated crystal harvesting based on laser-induced photoablation of thin films. Acta Crystallographica. Section D, Biological Crystallography. 68, 1393-1399 (2012).
- . Helmholtz Zentrum Berlin Available from: https://www.helmholtzberlin.de/forschung/oe/np/gmx/fragment-screening/index_en.html (2021)
- Lima, G. M. A., et al. FragMAX: the fragment-screening platform at the MAX IV Laboratory. Acta crystallographica. Section D, Structural biology. 76 (8), 771-777 (2020).
- Ng, J. T., Dekker, C., Kroemer, M., Osborne, M., Von Delft, F. Using textons to rank crystallization droplets by the likely presence of crystals. Acta Crystallographica. Section D, Biological Crystallography. 70, 2702-2718 (2014).
- Collins, P. M., et al. Gentle, fast and effective crystal soaking by acoustic dispensing. Acta Crystallographica. Section D, Structural Biology. 73, 246-255 (2017).
- Wright, N. D., et al. The low-cost Shifter microscope stage transforms the speed and robustness of protein crystal harvesting. Acta Crystallographica. Section D, Structural Biology. 77, 62-74 (2021).
- Krojer, T., et al. The XChemExplorer graphical workflow tool for routine or large-scale protein-ligand structure determination. Acta Crystallographica. Section D, Structural Biology. 73, 267-278 (2017).
- Pearce, N. M., et al. A multi-crystal method for extracting obscured crystallographic states from conventionally uninterpretable electron density. Nature Communications. 8, 15123 (2017).
- . Fragalysis Available from: https://fragalysis.diamond.ac.uk (2021)
- . Diamond Light Source Ltd Available from: https://www.diamond.ac.uk/Instruments/Mx/Fragment-Screening.html (2021)
- Cox, O. B., et al. A poised fragment library enables rapid synthetic expansion yielding the first reported inhibitors of PHIP(2), an atypical bromodomain. Chemical Science. 7 (3), 2322-2330 (2016).
- Vonrhein, C., et al. Data processing and analysis with the autoPROC toolbox. Acta Crystallographica. Section D, Biological Crystallography. 67, 293-302 (2011).
- Vonrhein, C., et al. Advances in automated data analysis and processing within autoPROC , combined with improved characterisation, mitigation and visualisation of the anisotropy of diffraction limits using STARANISO. Acta Crystallographica Section A: Foundations and Advances. 74 (1), 360 (2018).
- Pearce, N. M., Krojer, T., Von Delft, F. Proper modelling of ligand binding requires an ensemble of bound and unbound states. Acta Crystallographica. Section D, Structural Biology. 73, 265-266 (2017).
- Collins, P. M., et al. Achieving a good crystal system for crystallographic x-ray fragment screening. Methods in Enzymology. 610, 251-264 (2018).
- Delageniere, S., et al. ISPyB: an information management system for synchrotron macromolecular crystallography. Bioinformatics. 27 (22), 3186-3192 (2011).
- Fisher, S. J., Levik, K. E., Williams, M. A., Ashton, A. W., McAuley, K. E. SynchWeb: a modern interface for ISPyB. Journal of Applied Crystallography. 48, 927-932 (2015).
- Ginn, H. M., et al. SynchLink: an iOS app for ISPyB. Journal of Applied Crystallography. 47, 1781-1783 (2014).
- . Diamond Light Source Ltd Available from: https://www.diamond.ac.uk/Instruments/Mx/Common/Common-Manual/Data-Analysis/Reprocessing-in-ISPyB.html (2021)
- Wojdyr, M., Keegan, R., Winter, G., Ashton, A. DIMPLE - a pipeline for the rapid generation of difference maps from protein crystals with putatively bound ligands. Acta Crystallographica. Section A, Foundations of Crystallography. 69, 299 (2013).
- Long, F., et al. AceDRG: A stereochemical description generator for ligands. Acta Crystallographica. Section D, Structural Biology. 73, 112-122 (2017).
- Moriarty, N. W., Grosse-Kunstleve, R. W., Adams, P. D. Electronic ligand builder and optimization workbench (eLBOW): A tool for ligand coordinate and restraint generation. Acta Crystallographica. Section D, Biological Crystallography. 65, 1074-1080 (2009).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica. Section D, Biological Crystallography. 66, 486-501 (2010).
- Murshudov, G. N., Vagin, A. A., Dodson, E. J. Refinement of macromolecular structures by the maximum-likelihood method. Acta Crystallographica. Section D, Biological Crystallography. 53, 240-255 (1997).
- Bricogne, G., et al. Buster version 2.10.3. Global Phasing Ltd. , (2017).
- Chen, V. B., et al. MolProbity: All-atom structure validation for macromolecular crystallography. Acta Crystallographica. Section D, Biological Crystallography. 66, 12-21 (2010).
- Bruno, I. J., et al. Retrieval of crystallographically-derived molecular geometry information. Journal of Chemical Information and Computer Sciences. 44 (6), 2133-2144 (2004).
- Delbart, F., et al. An allosteric binding site of the α7 nicotinic acetylcholine receptor revealed in a humanized acetylcholine-binding protein. TheJournal of Biological Chemistry. 293, 2534-2545 (2018).
- Douangamath, A., et al. Crystallographic and electrophilic fragment screening of the SARS-CoV-2 main protease. Nature Communications. 11 (1), 5047 (2020).
- Guo, J., et al. In crystallo-screening for discovery of human norovirus 3C-like protease inhibitors. Journal of Structural Biology: X. 4, 100031 (2020).
- Keedy, D. A., et al. An expanded allosteric network in PTP1B by multitemperature crystallography, fragment screening, and covalent tethering. eLife. 7, 36307 (2018).
- McIntyre, P. J., et al. Characterization of three druggable hot-spots in the aurora-a/tpx2 interaction using biochemical, biophysical, and fragment-based approaches. ACS Chemical Biology. 12 (11), 2906-2914 (2017).
- Thomas, S. E., et al. Structure-guided fragmentbased drug discovery at the synchrotron: Screening binding sites and correlations with hotspot mapping. Philosophical Transactions. Series A, Mathematical, Physical and Engineering Sciences. 377 (2147), 20180422 (2019).
- Nichols, C., et al. Mining the PDB for tractable cases where x-ray crystallography combined with fragment screens can be used to systematically design protein-protein inhibitors: Two test cases illustrated by IL1β-IL1R and p38α-TAB1 complexes. Journal of Medicinal Chemistry. 63 (14), 7559-7568 (2020).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallographica. Section F, Structural Biology Communications. 70, 1117-1126 (2014).
- Wollenhaupt, J., et al. F2X-Universal and F2X-Entry: Structurally diverse compound libraries for crystallographic fragment screening. Structure. 28 (6), 694-706 (2020).
- . Zenodo Available from: https://zenodo.org (2021)
- Foley, D. J., et al. Synthesis and demonstration of the biological relevance of sp(3) -rich scaffolds distantly related to natural product frameworks. Chemistry. 23 (60), 15227-15232 (2017).
- Kidd, S. L., et al. Demonstration of the utility of DOS-derived fragment libraries for rapid hit derivatisation in a multidirectional fashion. Chemical Science. 11 (39), 10792-10801 (2020).
- . EU-openscreen ERIC Available from: https://www.eu-openscreen.eu/ (2021)
- Schuller, M., et al. Fragment binding to the Nsp3 macrodomain of SARS-CoV-2 identified through crystallographic screening and computational docking. bioRxiv. 393405, (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved