Method Article
全血とバフィーコートからのヒト好中球の分離
要約
全血、バフィーコート、または白血病膜からの好中球の分離方法を詳述し、良好な収率、高純度、および最小限の細胞活性化を達成する。我々は、精製の勾配、赤血球(RBC)沈殿、RBC溶菌を利用して、高品質/純度好中球製剤を得る。
要約
好中球(PMN)は、全血白血球の40~70%に及ぶヒト循環において最も豊富な白血球である。彼らは血管を介して急速な飛び出しを介して炎症部位で募集された最初の細胞である。そこでは、好中球は侵入病原体を殺し、免疫シグナル伝達を媒介する機能の配列を実行する。ヒト血液から精製された新鮮な好中球は、細胞株がPMN機能と生物学を完全に複製しなくて済むため、研究に適したモデルです。しかし、好中球は短命で、終末分化した細胞であり、物理的(温度、遠心速度)および生物学的(内毒素、ケモおよびサイトカ)刺激に応答して活性化する可能性が高い。したがって、純粋で非活性化細胞を得るためには、標準化された信頼性の高い、高速な方法に従うことは重要です。このプロトコルは、高いPMN純度を得て細胞の活性化を最小限に抑えるために、密度勾配遠心分離、赤血球(RBC)沈殿、およびRBCリシスを組み合わせた更新されたプロトコルを提示する。さらに、好中球の分離の質、生存率および純度を評価する方法も議論される。
概要
自然免疫系は、他の多くの生理機能と共に免疫恒常性および病原体クリアランスを維持する多くの細胞タイプで構成される。好中球は、ヒト循環中の白血球の最大のプールを含む1.ほとんどの成熟した好中球は、顆粒球とも呼ばれる新しい好中球の発生部位である骨髄に保存されています。骨髄において、顆粒球前駆体は細胞周期を抜け出し、末端分化し、それらの特徴的なセグメント化された核および顆粒2を獲得する。炎症性の条件下では、ケモカイン、サイトカイン、および損傷関連および病原体関連の分子パターンに応答して、好中球は血流からおよび骨髄から動員され、幅広い機能を実行する。これらには、サイトカイン分泌、病原体の直接貪食、活性酸素種の放出、抗菌タンパク質の脱顆粒、好中球外細胞トラップの形成が含まれる。
好中球が感染と戦うために使用する分子は、微生物と宿主に有毒である。したがって、老化/死にかけている好中球の寿命と適切な除去は高度に規制されており、循環する寿命が限られている(<48 h)3。この短い生存のために、人体は人口恒常性4を維持するために毎日平均1000億個の新しい好中球を産生する。緊急顆粒は、炎症および感染時の血液中の成熟および未熟な好中球の放出をさらに増加させることができる5。自然免疫応答における好中球の重要性は、細菌および真菌感染の影響を受けやすい後天性または先天性好中球減少症の患者によって強調される6。
好中球生物学とその性質による免疫応答における役割(短い生存率、細胞傷害性含有量など)を研究する際に多くの課題が生じます。好中球様細胞株は、ヒト前骨髄球性白血病HL-60細胞とPLB-985細胞7,8と一般に分化されてきた。好中球のような形態を示し、走性を発揮することはできるが、これらの細胞株は好中球の生物学を完全に再現することはできない。これらの細胞株を用いたインビトロアッセイは、インビボ実験も再現できない。さらに、これらの細胞の分化は誘導される必要があり、分化前の遺伝子操作によって悪影響を受ける可能性があります。
近年、HL-60細胞9における遺伝子発現後の分化を調節する誘導性プロモーターを用いてこれらの問題を回避する方法が開発されている。このようなツールを使用しても、主ヒトPMNは薬理学的アプローチを使用してターゲットを検証する必要があります。したがって、細胞株および動物モデルの知見を検証するために、血液から分離された純粋で不活性化された好中球を得ることが不可欠である。本稿では、現在の方法の長所と短所を評価した改正PMN絶縁プロトコルを提示する。他の免疫細胞からPMNを分離するための勾配遠心分離、RBCの大部分を除去するための短いデキストランベースの沈み込み、浸透圧による急速な残留RBCリシス、および血小板汚染を除去するための低速遠心分離からなる組み合わせが考案された。
プロトコル
注:人間の好中球は、ボストン小児病院の血液バンクラボから得られた廃棄された白血球フィルターから静脈血から隔離されました。献血者は特定不能であり、生きている個人との相互作用や識別可能な個人情報の知識はありませんでした。したがって、この研究は、HHSヒト被験者規則(45 CFR Part46)の下でヒト被験者研究として分類されない。ボストン小児病院機関審査委員会(IRB)は、プロトコルを承認しました。
1. グラデーションを重ね
- バフィーコートまたは全血包装とラミナーフードを殺菌した後、血液を各チューブに10 mLの血液を入れて50 mLチューブに分けます。
- 5%のウシ血清(FBS)/ハンクのバランス塩溶液(HBSS)で最大35 mLのボリュームを持って血液を希釈し、よりきれいな勾配を得ます。
注意:白血病膜を使用する場合、60 mLシリンジと30 mLの5%FBS/HBSSを使用して、フィルタごとに細胞を洗い流すことができます。描きたての全血を扱う場合は希釈は不要です。 - 50 mLチューブ蓋を閉め、反転して数回混ぜ、逆さまにして底部にRBCsを欠かします。
- 血液の真下に10mLの密度勾配培地(材料表を参照)を加えます。媒体と血液が混ざり合わないこと、およびインターフェースが鋭いことを確認してください(図1A)。
注: この手順は非常に重要です。密度勾配溶液が室温(RT)にあり、各勾配の前に十分に混合されていることを確認します。密度勾配媒体の最初のミリリットルは、慎重かつ着実にできるだけゆっくりと層化する必要があります。電子ピペット速度を低く設定することをお勧めします。 - 傾斜を乱さずにチューブを遠心分離機にそっと置き、RTで30分間400×gで回転し、ブレーキを無効にします。 紡解勾配が上の血清/血漿層、末梢血単核細胞(PBMC)の中白環、曇密度勾配媒体層、および白色の薄い好中球帯からなるボトムペレットを、RBCsの上に分離する方法を観察する(図1B)。
注:遠心分離後のチューブの曇りまたは不透明な側は、細胞(好中球)が活性化され、使用するのに適していない可能性があることを示唆することができます。 - PBMC層に直接吸引ピペットを出現させることによってPBMCを最初に取り外します。リングを取り除くにつれて血清/血漿層が減少する間、それを完全に吸引するようにしてください。細胞が吸引ピペットでペレット化されたチューブの側面を掻き取り、PMBCの除去を最大化します。PBMCリングと好中球/RBCペレットの間の曇密度勾配媒体層を慎重に除去します。
注:チューブの側面にペレット状の細胞を掻き取り、かなり分離の純度を増加させます。ほとんどの好中球はRBCsの上に直接座っているため、ペレットを吸引しないように注意してください。
2. 赤血球(RBC)の沈下
- 10 mL ピペットを使用して、好中球/RBC ペレットをクリーンチューブに移します。ピペットを上下にしないでください。5%のFBS/HBSSを最終容積25mLに追加します。反転によってやさしく混ぜます。
注:PBMC除去後にRBC沈積を行うと歩留まりが改善され、活性化10が減少します。 - 希釈した好中球/RBCペレットを含むチューブに25mLのプリウォーム(37°C)3%デキストラン/0.9%NaCl/H2 Oを直接加え、反転して軽く混ぜます。チューブを15分間、非振動面に置きます(図1C)。
注:長い沈み付けはRBC汚染を減らすが、また歩留まりを減らす。さらに、長時間のデキストラン曝露は、好中球の活性化または細胞死11を招く可能性がある。 - チューブをフードにそっと戻します(滅菌分離のため)。ピペットを液体にわずかに浸漬するだけで、下向きの液面に続く上層(〜30mL)を集める。
注:沈み付けが媒体とRBCの間に鋭い界面を生じる場合、RBCペレットは小さい、またはより高い収率が望まれる場合は、35 mLまで集める。 - チューブを回転させる(400×g、10分、RT、ローブレーキ(3)を使用して、メディアに浮遊する粒子のない赤いペレットを生じる。
3. 残留RBCのリシス
- ペレットを破壊することなく上清を優しく吸引します。
- 25 mLの無菌超純水をチューブに直接加え、28 sを反転して穏やかに混ぜてRVCをライスします。ペレットを再懸濁するためにピペットを使用しないでください。
注:長期の低血圧状態が活性化し、好中球の死12につながる可能性がありますので、30 sを超えないでください。 - すぐにチューブに滅菌1.8%NaCl/H2Oの25 mLを加え、逆に溶かして穏やかに混ぜて、溶液を等張条件に戻します。
注:解決策は赤ですが、濁りがないはずです。 - 低ブレーキ(レベル3)で3〜5分間200×gでスピンダウンして、好中球(図1Dおよび図2)13、14と共にRBCおよび血小板沈降を最小限に抑える。
注:ペレットは、上清が吸引されている間、穏やかに除去することができ、上に最小限のRBC層と白でなければなりません。 - 培養液(10%FBS/RPMI1640)をペレットに直接ピペット化して好中球を再懸濁させるが、ピペットは上下しない。細胞の活性化を最小限に抑えるために、チューブを左右に水平に揺らす。
注:細胞は、より高い密度が細胞活性化/死15を増加させるので、〜2×106細胞/mLの濃度に保たれるべきである。同じ理由で、細胞ペレットはできるだけ早く再懸濁する必要があります。 - 細胞の凝集または凝集が観察された場合は、70 μmメッシュを使用して細胞懸濁液を濾過し、塊状の好中球を捨てます。
4. 好中球の分離品質の決定
- 好中球に特異的なマーカー(CD66b、CD11b)、好酸球(CD193)(図3)、およびCD62L(図4)などの活性化マーカーを用いて細胞を染色する。フローサイトメトリーにより20,000個の細胞を獲得します。 図3 および 図4で提案されている格言戦略を用いて細胞の純度と活性化を分析する。
注:好中球製剤の品質は、好中球のユニークなロブ核を視覚化するために3%酢酸メチレンブルー溶液を使用して評価することができます。 - アネキシンV/ヨウ化プロピジウム(PI)を使用して細胞生存率を決定する(図5)。
注: トリパンブルー染色は、細胞の生存率を評価するために使用することができます。
結果
密度勾配を使用して好中球を精製する場合、血液と密度勾配媒体との界面を可能な限り鋭くし、遠心分離後に明確な層分離が残ることは重要である(ステップ1.4)。RBCのライシスに続いて、緩衝液は明確な赤色で、濁っていない(ステップ3.3)。調製物が曇っている場合、第2の溶菌(ステップ3)が必要となるが、これは好中球生存に影響を与える可能性がある(図1)。それに続いて、血小板汚染をかなり減らすため、純度を優先する場合は低速遠心分離(200×g)が推奨されます。しかし、高速遠心分離(400×g)は純度を犠牲にして歩留まりを増加させる(ステップ3.4、図2)。好中球分離後、蛍光活性化細胞選別は、単離純度を評価するために使用することができ(ステップ4.1)顕微鏡法よりも選択する必要があります。細胞のFSC/SSC分布だけでは細胞分離品質の推定値を提供しますが(図3A)、特定のセルマーカーの使用が好ましいはずです。この場合、最も一般的な汚染細胞集団は、特に顆粒球上で発現されるCD66bと共に特異的抗体で染色される。CD45染色は、白血球(CD45+)と赤血球および血小板(CD45-)を区別するために使用される。
その他の汚染物質としては、リンパ球(CD3+またはCD19+、図3F)、単球(CD14+、図3D)、好酸球(CD193+、図3G)が含まれる。CD11bは、骨髄系に発現するインテグリンである。好中球および単球はCD11b+であるのに対し、リンパ球はCD11b-(図3C)である。好中球の活性化は下流の実験に影響を与える可能性がありますので、CD62Lの発現を評価する必要があります。好中球はCD62L-一度活性化される(ステップ4.1)。ペプチドfMLPは、CD62L脱落の陽性制御として使用することができる(図4)。また、アッセイを行う前に好中球の健康を評価することも重要です。好中球は比較的短い半減期を有し、活性化はそれをさらに短くすることができる(ステップ4.2)。標準的なアネキシンVおよびPI染色は、指定された時間に好中球培養の生きている/死んでいる状態に関する情報を与えることができる(図5)。

図1:顆粒球の密度勾配培地ベースの分離(A)前および(B)遠心分離後。血液と密度勾配媒体層の間の鋭い界面に注意してください。(C)B中のペレットの沈沈(1:1)を5%FBS/HBSSおよび3%デキストラン-0.9%NaClに再懸濁した。 (D)(C)の上清中の残留RBCのリシス後の PMN ペレット H2O. 略語: PBMC = 末梢血単核細胞;PMN = 好中球;RBC = 赤血球;FBS = 牛胎児血清;HBSS = ハンクのバランス塩ソリューション。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:RBCのリシス後に低速で回転すると、血小板汚染が減少した。H2Oを有するRBCのリシス後、細胞を200×g(A)または400×g(B)でスピンダウンした。 好中球を染色し、血小板にラベルを付ける抗CD41を添加して図3に記載されているように、フローサイトメトリー分析を行った。略語: RBC = 赤血球;CD41 = 分化 41 のクラスター;SSC-A = 側面散乱領域この図の大きなバージョンを表示するには、ここをクリックしてください。
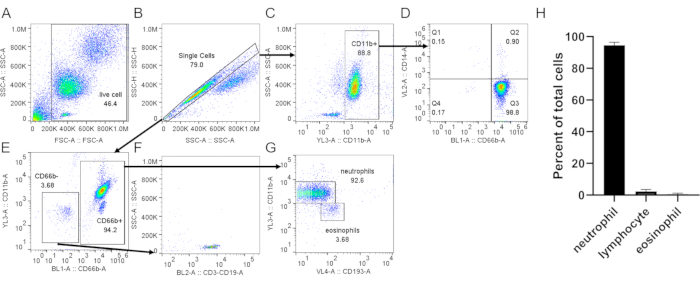
図3:バフィーコートから分離された好中球の評価単離された好中球は、標準プロトコルに従って抗CD66b、抗CD11b、抗CD14、および抗CD193で染色された。単一のセル (B) は、合計セル (A) からゲートを作成しました。(C)CD11b+細胞を単細胞からゲートした。(D) 好中球(CD66b+、CD14低/-)と非常に低い単球汚染(CD66b-、CD14+、Q1)を示すドットプロット。(E)CD66b-およびCD66b+細胞をゲートした。 (F)CD66b-細胞はリンパ球マーカーについて陽性であった(CD3、CD19)。(G)CD66b+細胞におけるCD11bおよびCD193の発現は、明確な好中球(CD66b+、CD11b+、CD193−)および好酸球(CD66b+、CD11b−、CD193+)個体群を示す。ここに示す代表的な結果では、好中球の純度は~3.7%のリンパ球および~3.7%の好酸球汚染で〜93%である。(H)精製後の好中球純度の定量化。データは5つの個別試行からコンパイルされ、SD.略語±平均として提示されます: CD = 分化のクラスター;SSC-A = SSC-A = サイドスキャッタエリア;FSC-A = 前方散乱面積。この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:勾配精製はCD62L脱落を起こさなかった(A-B)コントロール(A)またはfMLP刺激好中球(B)(37°Cで15分間1mM fMLP)を好中球マーカーとCD62Lで染色した。(C)cd62Lの蛍光平均強度は、fMLP処理細胞において減少し、CD62Lの脱落および好中球活性化を示す。略語: CD26L = L-セレクチン;fMLP = N-ホルミルメチオニル-ロイシル-フェニルアラニン;SSC-A = SSC-A = サイドスキャッタエリア;FSC-A = 前方散乱領域;PE = フィコエリスリン。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:密度勾配または好中球分離キットによって精製された好中球の自発的な死好中球は、密度勾配(AおよびB)または市販のマイクロビーズ(CおよびD)で精製し、RPMI-10%FCSで0h(AおよびC)または24時間(BおよびD)のために培養した。細胞は、標準プロトコルに従ってそれぞれの時点でアネキシンVおよびPIを使用して染色した。(E) 精製中性球の自然死の定量化n=5、平均 ±sD.略語:SSC-A = SSC-A = 側面散乱領域;FSC-A = 前方散乱領域;PI = ヨウ化プロピジウム;FCS = 胎児の子牛の血清;FITC = フルオレセインイソチオシアネート;AV5 = アネキシン V.この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
短寿命、末端分化状態、好中球の溶菌含有量のために、これらの細胞を研究することは常に困難でした。マウスモデルや患者コホートの細胞を利用することとは別に、細胞株は好中球生物学16の研究に役立つ有用なツールである。しかし、好中球様細胞株は好中球生物学のすべての側面を完全に繰り返すことができず、これらの細胞を研究する上で困難な余分な層を追加します。最も一般的に使用されるインビトロモデルは、HL-60細胞株であり、これはジメチルスルホキシドまたはレチノイン酸17,18で処理することにより好中球様細胞に分化することができる。これらの細胞は、移動および呼吸バーストの研究に有用であるが、好中球の微生物活性を研究するのに適していない。他の細胞株(PLB-98、NB4)が存在し、それらはまた、それらの制限のセット19に関連付けられている。
マウス病モデルおよび細胞株で行われたヒト好中球の原発性観察で検証することは極めて重要である。好中球は効率的に凍結保存することができないので、しばしばドナーから得られた全血またはバフィーコートから新鮮に分離され、すぐに処理される。いったん単離されると、細胞は、好中球顆粒20、21に見られる酸化、細胞質カスパーゼ、およびプロテアーゼによって調節される、複雑な形の自発的死を受け始める。不適切な分離方法または技術は、好中球の活性化を引き起こし、細胞の消滅を加速させるだけです。ドナーから純粋で高品質の好中球を得るためには、信頼性と一貫した方法が不可欠です。
ヒト好中球の分離10,22に関する多くの方法が公開されている。彼らは主に2つのカテゴリに分類され、いくつかの共有戦略があります。最初のカテゴリは、正または陰性の選択を介して、抗体ベースです。正の選択は、好中球を直接標識し、したがって、非常に純粋な細胞集団を提供し、また、急速な細胞活性化、細胞死、ならびに好中球23の望ましくないタグ付けをもたらす。負の選択は、細胞にラベルを付けず、非常に純粋な集団を与えるが、正確なメカニズムは不明であるが、好中球死を加速させた(図5)。正または陰性の選択後に遺伝子またはタンパク質の発現も変化するかは、さらに調査する必要があります。また、他の種類の細胞を枯渇させるために必要な抗体の量のために、これらの方法は、好中球を大量に出力することはできません。しかし、抗体ベースのアッセイは、より小規模な短期間の培養や実験に使用することができ、遺伝子やタンパク質発現研究など、非常に高い細胞純度を必要とする実験に適した方法です。
2 番目のタイプの分離方法は、勾配と密度ベースです。これは、通常、パーコール、フィコール·パケ、または他の多糖/ポリビニルピロリドン成分を含み、細胞密度に基づいて血液細胞の異なるタイプを分離するために遠心力を利用します。これらの方法は、多くの場合、デキストランによる赤血球の沈下と補完されます。これらの方法は、出発原料のより大きなスケールを処理することができ、同様に高純度を達成することができます。密度ベースの分離の1つの注意点は、好中球からの他のはるかに少ないあまり豊富でない顆粒球(主に好酸球)の非効率的な分離であり、したがって、小さな細胞汚染の存在でさえ好中球応答24に影響を与える可能性があるため、提示されるプロトコルの大きな限界である。
ここでは、グラデーションの分離に基づく要約メソッドを示し、以前の方法10,22を改良します。我々は、好中球特異性の現在の過小評価を利用して、限られた残留血小板およびRBCを有する純粋なヒト好中球を確実に分離し、好中球の活性化および加速死を防ぐ。最も重要なステップは、鋭い界面を得るために血液の下に密度勾配媒体を添加することによってはるかに効果的に得られる勾配の層化である。PBMCリングと遠心分離後の勾配を迅速に調べると、汚染、活性化、低収率の可能性が明らかになります。白血病膜またはバフィーコートを使用する場合、過剰な細胞密度が細胞凝集を引き起こし、不純物および細胞活性化につながるため、血液を希釈することが重要です。
このプロトコルは、細胞の鮮度を確保するために2時間以内に完了する必要があり、これらの溶液への暴露は好中球を変えることができるので、密度勾配媒体、デキストラン、およびリシスを含むステップを直ちに行う必要があります。このプロトコルでは、好中球の期待される収量は、全血の少なくとも〜1000万/10mLおよび少なくとも6000万/10mLのバフィーコートである。分離品質の評価は、活性化された好中球が10%未満、リンパ球汚染が5%未満、最低の好酸球(同じ側散乱が、前方散乱人口が低い)、および細胞生存率が90%を超えるべきである。低い純度は、不適切な層状または密度勾配媒体の貯蔵から、または開始血液産物の品質と鮮度に起因する可能性があります。
開示事項
著者らは、研究は利益相反がない場合に行われたと宣言している。
謝辞
このプロジェクトはP01HL095489によってサポートされました。A.Y.H は T32HL066987 によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 3% Acetic Acid with Methylene Blue | Stemcell technologies | #07060 | |
| Attune NxT | invitrogen | A24858 | FACS analyzer |
| Cd11b-PE | biolegend | 301305 | |
| CD14-BV421 | biolegend | 367144 | |
| CD193-BV605 | biolegend | 310716 | |
| CD19-PerCP | biolegend | 302228 | |
| CD3-PerCP | biolegend | 300326 | |
| CD41-APC | biolegend | 303710 | |
| Cd45-APC | biolegend | 103111 | |
| CD62L-PE | biolegend | 304802 | |
| CD66b-FITC | biolegend | 305103 | |
| Centrifuge 5810R | Eppendorf | 22625101 | Centrifuge |
| Dextran | Fisher | BP1580 | |
| Fetal Bovine Serum (FBS) | R&D systems | S11150H | complement inactivation of FBS is recommended |
| FITC Annexin V Apoptosis Detection Kit I | BD | 556547 | |
| Hanks balanced salt solution (-CaCl2), (-MgCl2) (-MgSO4) | Gibco | 14175-095 | HBSS without Ca2+/Mg2+ is advised as they have been shown to lead to neutrohpil activation |
| Lymphoprep | Stemcell technologies | #07801 | density gradient medium |
| MACSxpress Whole Blood Neutrophil Isolation Kit, human | Miltenyi | 130-104-434 | |
| RPMI-1640 | Gibco | 11875093 | |
| Sodium chloride | sigma | 71376 | |
| Trypan Blue Solution, 0.4% | Thermofisher | 15250061 | |
| ultrapure water | KD medical | RGF-3410 |
参考文献
- Rosales, C. Neutrophil: A cell with many roles in inflammation or several cell types. Frontiers in Physiology. 9, 113 (2018).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annual Review of Immunology. 30, 459-489 (2012).
- Stoller, J. K. Murray & Nadel's textbook of respiratory medicine, 6th edition. Annals of the American Thoracic Society. 12 (8), 1257-1258 (2015).
- Dancey, J. T., Deubelbeiss, K. A., Harker, L. A., Finch, C. A. Neutrophil kinetics in man. Journal of Clinical Investigation. 58 (3), 705-715 (1976).
- Manz, M. G., Boettcher, S. Emergency granulopoiesis. Nature Reviews. Immunology. 14 (5), 302-314 (2014).
- Summers, C., et al. Neutrophil kinetics in health and disease. Trends in Immunology. 31 (8), 318-324 (2010).
- Pedruzzi, E., Fay, M., Elbim, C., Gaudry, M., Gougerot-Pocidalo, M. A. Differentiation of PLB-985 myeloid cells into mature neutrophils, shown by degranulation of terminally differentiated compartments in response to N-formyl peptide and priming of superoxide anion production by granulocyte-macrophage colony-stimulating factor. British Journal of Haematology. 117 (3), 719-726 (2002).
- Tucker, K. A., Lilly, M. B., Heck, L., Rado, T. A. Characterization of a new human-diploid myeloid-leukemia cell-line (Plb-985) with granulocytic and monocytic differentiating capacity. Blood. 70 (2), 372-378 (1987).
- Hsu, A. Y., et al. Inducible overexpression of zebrafish microRNA-722 suppresses chemotaxis of human neutrophil like cells. Molecular Immunology. 112, 206-214 (2019).
- Kremserova, S., Nauseef, W. M. Isolation of human neutrophils from venous blood. Methods in Molecular Biology. 2087, 33-42 (2020).
- Quach, A., Ferrante, A. The application of dextran sedimentation as an initial step in neutrophil purification promotes their stimulation, due to the presence of monocytes. Journal of Immunological Research. 2017, 1254792 (2017).
- Thorson, L. M., Turkalj, A., Hung, J. C. In vitro evaluation of neutrophil viability after exposure to a hypotonic medium. Nuclear Medicine Communications. 16 (7), 615-620 (1995).
- Dhurat, R., Sukesh, M. Principles and methods of preparation of platelet-rich plasma: a review and author's perspective. Journal of Cutaneous and Aesthetetic Surgery. 7 (4), 189-197 (2014).
- Etulain, J., et al. An optimised protocol for platelet-rich plasma preparation to improve its angiogenic and regenerative properties. Scientific Reports. 8 (1), 1513 (2018).
- Hannah, S., et al. Constitutive neutrophil apoptosis in culture is modulated by cell density independently of beta2 integrin-mediated adhesion. FEBS Letters. 421 (2), 141-146 (1998).
- Hsu, A. Y., et al. Phenotypical microRNA screen reveals a noncanonical role of CDK2 in regulating neutrophil migration. Proceedings of the National Acadermy of Sciences of the United States of America. 116 (37), 18561-18570 (2019).
- Martin, S. J., Bradley, J. G., Cotter, T. G. HL-60 cells induced to differentiate towards neutrophils subsequently die via apoptosis. Clinical and Experimental Immunology. 79 (3), 448-453 (1990).
- Hauert, A. B., Martinelli, S., Marone, C., Niggli, V. Differentiated HL-60 cells are a valid model system for the analysis of human neutrophil migration and chemotaxis. International Journal of Biochemistry and Cell Biology. 34 (7), 838-854 (2002).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: Cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Kambara, H., et al. Gasdermin D exerts anti-inflammatory effects by promoting neutrophil death. Cell Reports. 22 (11), 2924-2936 (2018).
- Loison, F., et al. Proteinase 3-dependent caspase-3 cleavage modulates neutrophil death and inflammation. Journal of Clinical Investigation. 124 (10), 4445-4458 (2014).
- Siemsen, D. W., et al. Neutrophil isolation from nonhuman species. Methods in Molecular Biology. 1124, 19-37 (2014).
- Hasenberg, M., et al. Rapid immunomagnetic negative enrichment of neutrophil granulocytes from murine bone marrow for functional studies in vitro and in vivo. PLoS One. 6 (2), 17314 (2011).
- Calzetti, F., Tamassia, N., Arruda-Silva, F., Gasperini, S., Cassatella, M. A. The importance of being "pure" neutrophils. Journal of Allergy and Clinical Immunology. 139 (1), 352-355 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved