Method Article
生体 内 カルシウムイメージングのための定位ウイルス注入および勾配指数レンズ移植
Erratum Notice
要約
インビボカルシウムイメージングのミニスコープは、自由に行動するマウスのニューロンダイナミクスとマイクロサーキットを研究するための強力な技術です。このプロトコルは、ミニスコープを使用して良好なin vivoカルシウムイメージングを達成するために脳手術を行うことを記載しています。
要約
小型蛍光顕微鏡(ミニスコープ)は、自由に行動する動物からの 生体内 カルシウムイメージングのための強力なツールです。従来の多光子カルシウムイメージングシステムに比べていくつかの利点があります:(1)コンパクト。(2)軽量;(3)手頃な価格。(4)自由に行動する動物からの記録を可能にする。このプロトコルは、カスタム開発のミニスコープ記録システムを使用した脳深部 in vivo カルシウムイメージングのための脳外科手術を記述しています。調製手順は、(1)マウス脳の所望の脳領域にウイルスを定位的に注入し、ニューロンの特定のサブグループを遺伝的にコードされたカルシウムセンサーで標識することを含む3つのステップからなる。(2)脳深部領域からミニスコープシステムにカルシウム像を中継できるグラジエントインデックス(GRIN)レンズの移植;(3)ミニスコープホルダーをマウスの頭蓋骨の上に貼り付け、後でミニスコープを取り付けることができます。 インビボ カルシウムイメージングを行うために、ミニスコープをホルダーに固定し、同時に行動記録とともにニューロンカルシウム画像を収集します。本手術プロトコルは、 インビボ カルシウムイメージングのための任意の市販またはカスタムビルドの単一光子および2光子イメージングシステムと互換性がある。
概要
細胞内Ca2+ シグナル伝達は、細胞増殖、増殖、分化、遊走、遺伝子転写、分泌、およびアポトーシス1の必須調節因子である。ニューロンでは、Ca2+ シグナル伝達は、その時空間パターンが膜興奮性、神経伝達物質放出、シナプス可塑性などの重要な機能に関連しているため、正確に制御されています2。
インビボカルシウムイメージングは、正常な動物の行動に元素的な神経回路表現を解読し、脳障害の動物モデルにおける異常なニューロン活動を特定し、これらの変更された回路を正常化する可能性のある潜在的な治療標的を解明するために利用できる強力な技術です。2つの一般的なインビボカルシウムイメージングシステムは、2光子レーザー走査蛍光顕微鏡3、4、5、6およびヘッドマウント小型内視鏡(miniscope)7、8、9、10、11、12、13である。.従来の2光子顕微鏡は、より良い解像度、低ノイズ、およびより低いフォトブリーチングなどの主要な利点を提供する。しかし、実験動物は頭を固定する必要があり、3、4、5、6を行うことができる行動研究が制限されています。これに対して、ヘッドマウント型ミニスコープシステムは小型で持ち運びが容易であり、自由に行動する動物7、8、9、10、11、12、13を用いた多種多様な行動試験の研究を可能にする。
2つの主要なCa2+指標、化学指標5,14および遺伝的にコードされたカルシウム指標(GECI)15,16がある。Ca2+イメージングは、標的回路内のニューロンの特異的標識を可能にするウイルスベクターと共に送達される高感度GECIを使用することによって促進されてきた。感度、寿命、および細胞下区画でさえも標識する能力を高めるための継続的な努力により、GECIは様々なin vivoカルシウムイメージング研究に理想的です17,18,19。
イメージング中の脳組織における光の散乱は、2光子顕微鏡を用いても、深さの光学的浸透を制限する。しかし、グラジエントインデックス(GRIN)レンズは、GRINレンズを生体組織に直接埋め込み、脳深部領域から顕微鏡対物レンズに画像を中継することができるため、この問題を克服します。光学的に均質な材料で作られ、焦点を合わせて画像を作成するために複雑な形状の表面を必要とする従来のレンズとは異なり、GRINレンズの性能は、平面面20との焦点を達成するレンズ材料内の緩やかな屈折率変化に基づいている。GRINレンズは直径0.2mmまで製作可能です。そのため、微細化されたGRINレンズを、あまりダメージを与えることなく脳深部に埋め込むことができます。
この記事では、脳深部のin vivoカルシウムイメージングのための完全な手術プロトコルを提示する。実証の目的で、マウス脳の内側前頭前野(mPFC)を特異的に標的とした脳手術と、国立薬物乱用研究所(NIDA/IRP)のLin博士のグループが開発したカスタムメイドのミニスコープシステムによる生体内カルシウムイメージング記録について説明します7,12。実験手順には、2つの主要な脳手術が含まれます。最初の手術は、GCaMP6f(GECI)を発現するウイルスベクターをmPFCに定位的に注入することである。2番目の手術は、GRINレンズを同じ脳領域に移植することです。これらの脳手術からの回復後、その後の手順は、歯科用セメントを使用してマウスの頭蓋骨にミニスコープホルダー(ベース)を貼り付けることである。インビボでCa2+イメージングは、ミニスコープをベースに取り付けた後、いつでも実行できます。ウイルス注射およびGRINレンズ移植のための手術プロトコルは、インビボカルシウムイメージングにおける深部脳のための市販またはカスタムビルドの単一光子および2光子イメージングシステムと互換性があります。
プロトコル
実験プロトコルは、ワイオミング大学の動物ケアガイドラインに従っています。本研究で用いたマウスは生後6ヶ月のオスC57BL/6Jである。この手順は、 in vivo カルシウムイメージングのために任意の脳深部領域を標的とするために使用することができる。ここで、実証のために、標的脳領域はマウスmPFC(前部および後部(A/P):1.94mm、内側および側方(M/L):0.5mm、背側および腹側(D/V):1.8mm)である。このプロトコルは、以前に公開されたプロトコル21に基づいて修正される。
1. mPFCへのウイルスの定位注射(図1)
- 手術の準備
- オートクレーブを使用してすべての手術器具を滅菌し、滅菌表面上に置きます。
- 10 μLのシリンジを生理食塩水でプライミングし、5 μLの生理食塩水で予備充填して準備します。シリンジをマイクロポンプに取り付けます( 材料表を参照)。
- 加熱パッドの電源を入れ、温度を35°Cに保ちます。
- マウスを誘導チャンバー(5インチ x 10インチ x 4インチ、長さ x 幅 x 高さ)に5%のイソフルランと1 L/分の酸素流量で配置します。マウスの呼吸数を注意深く見てカウントします。マウスの呼吸数が1呼吸/秒に減少したら、マウスを取り出します。
注:マウスの呼吸数は、各吸入中の背中筋の動きの下向きおよび上向きを見ることによって容易に監視することができる。 - マウスが手術領域から分離されたベンチトップ領域に落ち着くのを待ちます。シェービングバリカンで、マウスの頭から最初の頸椎まで髪を剃ります。
- マウスを定位ステージ( 材料表を参照)にセットし、イヤーバーとノーズクリップでマウスの位置を固定します。定位段階までのイソフルラン流量を1.5%のイソフルランと0.5L/分の酸素流量に維持します。
- 手術中の目の乾燥を防ぐために、清潔な綿棒で両目に潤滑眼軟膏を塗布してください。手術を開始する前に、マウスのペダル反射を評価して、マウスが完全に麻酔されていることを確認します。
- 無毛領域を7.5%ポビドンヨウ素溶液( 材料表を参照)と70%エタノールで滅菌綿棒を使用してそれぞれ3回消毒する。
- 無毛領域の皮膚の下に少量(50μL)の2%リドカインを注入する。
- メスを使用して正中線に沿って皮膚を2cm切開し、頭蓋骨のラムダとブレグマを露出させます。
- 乾いた綿棒と尖った鉗子の助けを借りて頭蓋骨から筋膜を取り除きます。
- ブレグマとラムダが見えたら、デンタルドリルバリ(直径0.5mm)の先端を使用して、ブレグマとラムダのZ座標を測定します( 材料表を参照)。ブレグマとラムダが同じZ位置になるまでノーズホルダーの高さを調整します。
- 0.5 mmの歯科用ドリルバリを、ブレグマからA/P:1.94 mm、M/L:0.5 mmの位置に見つけます。頭蓋骨をドリルスルーします。
注:ここでは、デモンストレーションのために、標的脳領域はマウスmPFCである。このプロトコルは、他の任意の深部脳領域を標的とするために使用することができる。例えば、標的となる脳領域が側坐核(NAc)である場合、対応する位置はA / P:0.9 mm、M / L:1.2 mmでなければなりません。 - 30Gの針先を使用して硬膜を取り除き、45°の角度の鋭い鉗子を使用してすべての骨破片をきれいにします。
注:洗浄ステップ中に小さな血管が破裂する可能性があるため、出血は一般的です。滅菌綿棒を使用して出血を止め、生理食塩水を塗布してその領域を洗ってください。露出した頭蓋骨領域に生理食塩水を塗布して、湿った状態に保ちます。 - マイクロポンプのコントロールパネルを使用して、ウイルスをマイクロリットルのシリンジにロードします。500 nLの気泡を引き出し、続いて50 nL/sの流量で800 nLのウイルスを抜き取ります。
注:ここでは、実証の目的で、GCaMP6f(GECI)を発現するアデノ随伴ウイルス血清型1(AAV1)、AAV1-CamKII-GCamp6fをmPFCに注入する( 材料表参照)。ウイルスの力価は2.8 x 1013 GC/ mLである。注射前に生理食塩水で1:2希釈する。 - ブレグマに触れるだけに針の先端をブレグマの上に置き、ブレグマのZ座標を書き留めます。ドリルで開けた穴の上に針を動かし、100 nLのウイルスを注入して、針が詰まらないようにします。
- 針をゆっくりと脳組織に下ろし、目標とするD/VのZ座標(1.75 mm)まで移動し、その後、D/VのZ座標(1.65 mm)までわずかに移動させます。
注:これは、ウイルス溶液を注入するための小さなポケットを作成するためです。標的脳領域がNAcの場合、D/Vの対応する標的Z座標は4.2mmでなければならず、その後4.1mmまでわずかに移動する。 - コントロールパネルを使用して、マイクロポンプを50 nL/minの流量で500 nLのウイルスを注入するように設定します。コントロールパネルの RUN ボタンを押してウイルスを注入します。
注:注射には約10分かかります。注射が終わったら、さらに5〜10分待ってから脳から針を取り出します。注射期間中、露出した頭蓋骨領域を湿らせておくために生理食塩水を頻繁に塗布してください。 - 針を上下に動かし、脳から出ます。500 nL/sの流量で500 nLの容量を2回注入します。
注:このステップは、適切な量のウイルスが脳に投与されたことを確認します。最初の500nL注射の間に、ウイルスが放出され、続いて気泡が放出される。2回目の500nL注入では、気泡が最初に現れ、続いて生理食塩水が現れる。これで、シリンジは次のマウスにウイルスをロードする準備が整いました。手術が完了したら、マイクロリットルの注射器と針をアセトンで徹底的に洗浄し、続いて生理食塩水で洗浄します。 - 皮膚の端を整列させ、縫合糸(サイズ4.0)で切開部を慎重に閉じます。感染を防ぐために縫合された領域に抗生物質軟膏を塗布する。
- マウスを定位ステージから取り外し、ホームケージに戻します。マウスが歩行可能になるまで、ホームケージを33°Cのインキュベーターに入れます。
注:マウスが動き始める前に、イソフルラン麻酔から目を覚ますのに通常10〜15分かかります。 - マウスが動き回った後、非ステロイド性抗炎症薬を術後3日間投与する( 材料表を参照)。マウスを手術から14日間回復させてから、GRINレンズ移植を追求します。
2. mPFCにおけるGRINレンズ注入(図1)
- 手術の準備
- 124 mM の NaCl、2.5 mM の KCl、1.25 mM の NaH2 PO 4、1.2 mM の MgCl 2、25 mM のグルコース、26 mM の NaHCO3、および 2.4 mM の CaCl 2を含む人工脳脊髄液 (ACSF) を準備します。
- オートクレーブを使用してすべての手術器具を滅菌し、滅菌表面上に置きます。
- 加熱パッドの電源を入れ、温度を35°Cに保ちます。
- 1%アガロースを溶かし、使用時まで42°Cの水浴中に保管する。
注:溶けたアガロースは、数時間水浴中に保管することができます。 - GRINレンズ(直径1mm、長さ4.38mm、 図2A)を70%エタノールで15分間消毒し、生理食塩水で満たされたチューブに移して適切にすすぎ、移植する前に適切にすすいでください。
注:GRINレンズ(材料表を参照)は、特殊なメガネで銀とリチウムイオン交換を介して製造され、無毒でニューロンに優しい6,7。しかし、多くの市販のGRINレンズは、毒性残留物を浸出させて神経変性を引き起こす可能性があり、長期間のin vivoイメージング研究のための生きた脳への移植には適していません。これらのGRINレンズは、隣接するニューロン22に対する毒性副作用を防止するために、パリレン−Cのような生体適合性薬剤によるコーティングを必要とし得る。
- マウスの体重を量り、ケタミン/キシラジン混合物の腹腔内注射( 材料表を参照)(ケタミン:100mg / kg;キシラジン:15ミリグラム/ kg)。
注:体重30gのマウスは、初期用量に300μLのケタミン/キシラジン混合物(ケタミン100mg / mLおよびキシラジン1.5mg / mL)を必要とし、手術中の追加用量に150μLのケタミン(10mg / mL)を必要とする。外科的プロセス全体を通してマウスを麻酔状態に保つためには、ケタミン(50mg / kg)の追加用量を少なくとも1時間に1回投与する必要がある。マウスの麻酔段階は、ペダル反射を評価することによって頻繁に監視される必要がある。 - シェーバーで手術部位の毛を剃り落とし、濡れたペーパータオルで髪を拭きます。
- マウスを定位ステージに置き、ノーズクリップとイヤーバーを締めてマウスの位置を固定します。滅菌綿棒で両目に潤滑眼眼軟膏を塗布する。ペダル反射を評価して、マウスが完全に麻酔されていることを確認します。
- 無毛領域を7.5%ポビドンヨウ素溶液と70%エタノールで滅菌綿棒を使用してそれぞれ3回消毒する。2mg/kgのデキサメタゾンを大腿部に筋肉内に投与し、手術関連の腫れや炎症のリスクを低くします。
- 手術領域の皮膚の下に50μLの2%リドカインを注入する。
- 細かいはさみを使用して、1.5 cm(高さ)x 1.0 cm(ベース)の三角形の皮膚領域を、目の間の前側からラムダの後ろの後側まで切り取ります。
- 細かい鉗子、マイクロブレード、綿棒を使用して頭蓋骨から骨膜組織を取り除きます。
注:頭蓋骨は、次のステップに進む前に徹底的に洗浄し、乾燥させる必要があります。 - シアノアクリレート( 材料表を参照)を皮膚の縁に塗布し、皮膚を頭蓋骨に取り付ける。シアノアクリレートが乾くまで5分間待ちます。
- 0.5 mmのドリルバリチップを使用して、ノーズクリップの高さを調整して、ブレグマとラムダを同じ水平面に合わせます。
- 歯科用ドリルバリ(直径1.2 mm)をブレグマからA/P:1.94 mm、M/L:0.8 mmの位置に置きます。頭蓋骨をドリルスルーします。30Gの針先を使用して硬膜を取り除き、45°の角度の鋭い鉗子を使用してすべての骨破片をきれいにします。
注:この骨の破片は、完全に除去されない場合、後続の吸引ステップを妨げる可能性があります。 - 手動で研磨した27Gの鈍い端の針(図2B)を、10°の角度で傾けたロボットアームに結合された針ホルダーに取り付けます(図2C)。ニードルホルダーのもう一方の端を家の真空システムに接続します。
注:ロボットアーム(材料表を参照)は、NIDA/IRPのリン博士のグループによって開発され、カスタム開発され、現在オープンアクセスのソフトウェアであるAutoStereota(https://github.com/liang-bo/AutoStereota)23によって制御されます。 - ブレグマに触れるだけの針の先端を見つけます。ブレグマのZ座標を0に設定するには、オートステレオタの ブレグマ ボタンをクリックします。
- 入力 X 値を 0.8、入力 Y 値を 1.94、入力 Z 値を 1.0 に設定し、[検索] ボタンをクリックして、頭蓋骨のドリル穴の上部に針を移動します。
- オートステレオタ を介して 露出した脳組織領域の中心に針の位置を調整します。
メモ: 針を横方向または内側方向に動かすには、ステップ値を入力し、 AutoStereota の横方向 または 内側 ボタンをクリックします。同様に、針を前または後、背側または腹側の方向に動かすには、それぞれ 吻 側または 尾 側および 背側 または 腹側の ボタンをクリックします。 - 真空をオンにし、先端が曲がった30G針に接続された重力制御チューブシステム( 材料表を参照)を介して、露出した脳領域をACSFですすぎ始めます。ACSFは、95%O2と5%CO2 の混合ガスで連続的にバブリングされ、 0.2μmのフィルターでろ過されます。
注: ACSF 流量は ~ 1.5 mL/分です。混合ガスの出力圧力は〜3psiに保たれる。 - AutoStereotaソフトウェアの助けを借りて、脳組織を層ごとに吸引する(図3).
注:脳組織の吸引は4ラウンドで完了し、カラムポケット(深さ1.8mm、直径1mm)が生成されます。- 「zStep」セッションで、1行目と2行目をクリックして確認します。最初の行の値を 0.2 と 1 に設定します。2 行目の値を 0.15 と 4 に設定します (図 3A)。
- 「モード」セッションで、 ニードルサイズ を27ゲージと1.2に設定し、 ディムを 0.9に設定します。他のすべての値はデフォルト値を使用します(図3A)。
- 「設定」、「ゼロを保持」、「開始」ボタンを順にクリックして、吸引を開始します。
注:これは願望の第 1ラウンドです。入力値は、吸引深さが 1 層の最初のステップで 0.2 mm (Z 座標 0 から) であることを示します。第2ステップの間、吸引深さは0.15mmであり、4層にわたって連続的に繰り返される。吸引分解能は1.2で、直径は0.9mmです。吸引中、針先の瞬間的な位置は、トラックグラフパネルを介して監視することができます。この吸引ラウンドを完了すると、深さ0.8mm、直径1mmのカラムポケットが生成されます。針先は Z 座標が 0 の中央に戻ります。 - 「zStep」セッションで、1行目と2行目をクリックして確認します。最初の行の値を 1 と 1 に設定します。2 行目の値を 0.15 と 4 に設定します (図 3B)。
- 「Mode」セッションでは、すべての値を前のラウンドと同じに保ちます(図3B)。
- 「設定」、「ゼロを保持」、「開始」ボタンを順にクリックして、吸引を開始します。
注:これは願望の第2ラウンドです 。入力値は、吸引深さが 1 層の最初のステップで (Z 座標 0 から) 1 mm であることを示します。第2ステップの間、吸引深さは0.15mmであり、4層にわたって連続的に繰り返される。この吸引ラウンドを完了すると、深さ1.6mm、直径1mmのカラムポケットが生成されます。 - 「zStep」セッションでは、最初の行のみをクリックしてチェックします。最初の行の値を 1.8 と 1 に設定します (図 3C)。
- 「モード」セッションで、 ニードルサイズを 27ゲージと2.2に設定します。他のすべての値は、前のラウンドの値と同じままです(図3C)。
- 「設定」、「ゼロを保持」、「開始」ボタンを順にクリックして、吸引を開始します。
注:これは願望の第3ラウンドです 。入力値は、吸引深さが 1.8 mm (Z 座標 0 から) で 1 層であることを示します。吸引分解能は2.2です。この吸引ラウンドが完了すると、深さ1.8mm、直径1mmのカラムポケットが生成されます。 - 「zStep」セッションでは、最初の行のみをクリックしてチェックします。最初の行の値を 1.6 と 1 に設定します (図 3D)。
- 「モード」セッションで、 ニードルサイズ を27ゲージ、2.2を設定し、 ディムを 0.6に設定します(図3D)。
- 「設定」、「ゼロを保持」、「開始」ボタンを順にクリックして、吸引を開始します。
注:これは願望の第4ラウンドです 。このステップの目的は、ポケットに蓄積された血液をきれいにすることです。出血は、吸引プロセス中に小さな血管が破裂するため一般的です。血液を完全にきれいにするには、ACSFの灌漑を5分間停止してから、再び灌漑をオンにします。ポケットが無血になるまで、4回目の 吸引を複数回繰り返します。このプロトコルは、他の深部脳領域を標的とするために使用することができる。たとえば、標的となる脳領域がNAcの場合、D/Vの最終的な対応するZ座標は4.4mmでなければなりません。
- ACSFの真空と灌漑を停止します。針を Z 座標 +2 mm、中心より 0.5 mm 前方にします。滅菌済みの1mm GRINレンズをポケットに入れます。
- 針の先端を露出したGRINレンズに接触させ、GRINレンズが10°の角度に収まるようにします。GRINレンズの上面を滅菌軟部組織紙で優しく押して、GRINレンズの下面が脳組織に接触していることを確認します。
- ヘラの助けを借りて、GRINレンズと脳組織の隙間に溶けたアガロースを塗布します。アガロースがゲルを形成した後、マイクロブレードを用いて余分なアガロースを除去する。
- 生理食塩水と綿棒で頭蓋骨を徹底的にきれいにしてください。その後の歯科用セメント( 材料表を参照)を塗布する前に頭蓋骨を乾燥させる。
- -20°Cの冷凍庫からよく混ぜたものを取り出す。歯科用セメント粉末と触媒液を混合し、頭蓋骨に自己硬化型接着レジンセメントの層を塗布する。まず、GRINレンズを囲み、露出した頭蓋骨全体を覆います。
- 5分間待ってから、完全に硬化します。吸引針を慎重に外します。
- きれいなプラスチック井戸で、歯科用セメント粉末、黒い木炭を液体と混合し、歯科用セメントの第1層の上に混合物の薄層を塗布する。それが固まるまで5分待ちます。
- 露出したGRINレンズをPCRチューブで作られたカスタマイズされたキャップで覆って保護します(図2D)。シアノアクリレートを塗布してキャップを歯科用セメントに取り付けます。
- 予め温めた生理食塩水1mLをマウスの皮下に注射し、続いて0.1mg/kgのブプレノルフィンを注入する。マウスをホームケージに戻します。ホームケージを33°Cのインキュベーターに入れ、マウスが歩行可能になるまでマウスを監視します。マウスが動き始める前に麻酔から目を覚ますのに通常20〜40分かかります。
- 非ステロイド性抗炎症薬を投与し、少なくとも3回手術後数日間マウスを監視する。マウスを手術から30日間回復させます。
3. マウスの頭蓋骨にミニスコープホルダー(ベース)を取り付ける(図1)
- マウスを5%のイソフルランと1 L/分の酸素流量で誘導チャンバーに入れ、呼吸数が1呼吸/秒に減少するまで麻酔します。
- マウスを定位ステージに置き、イヤーバーとノーズクリップでマウスの位置を固定します。イソフルラン(1.5%)と酸素(0.5 L/分)の連続的な流れを維持します。
- 眼科用軟膏をその目に塗布して、それらを湿らせておく。加熱パッドの電源を入れ、温度を35°Cに保ちます。 ペダル反射を評価して、マウスが完全に麻酔されていることを確認します。
- GRINレンズを覆っているキャップを尖った鉗子を使ってそっと外します。マイクロドリルを使用して、歯科用セメントから乾燥シアノアクリレート残渣を完全にドリルオフします( 材料表を参照)。
- 小さなはさみで歯科用セメント部分の周りの髪をカットします。圧縮空気ダスターの助けを借りて破片をきれいにしてください。アセトンに浸した綿棒を使用して、GRINレンズの上面を清掃します。
- ミニスコープをホルダー(ベース)で準備します。
- #00-90六角ナット( 材料表を参照)をベースにあるスロットに入れ、シアノアクリレートを塗布してそこに固定します(図2E)。
- ポリテトラフルオロエチレン(PTFE)テープをミニスコープのネジの周りにしっかりと巻き付け、余分なテープを切り取ります(図2F)。
- ミニスコープをベースに固定し、ロックネジを使用してミニスコープをベースに固定します(図2G)。
- ミニスコープをケーブルに接続し、カスタム開発の現在オープンアクセスのソフトウェアであるNeuViewをオンにします( 材料表を参照)。
注:NeuViewソフトウェアは、NIDA/IRP 7,12のリン博士のグループによるミニスコープの生体内カルシウムイメージング用にカスタム開発されています。オープンアクセス(https://github.com/giovannibarbera/miniscope_v1.0)です。 - NeuViewで、[ ハードウェア]をクリックし、 LED1をチェックし、[ ストリーム] ボタンをクリックしてライブ画像を表示します(図4A)。ライブストリーミングを停止するには、[ 停止 ]ボタンをクリックします。
- ミニスコープを、電動コントローラを使用してXYZ位置を操作できるカスタムメイドのミニスコープ保持アーム(図2H)にセットします(図2I)。
- 露出したGRINレンズのすぐ上にあるミニスコープの位置を確認し、レンズの表面に平行にします。ミニスコープをGRINレンズに向かってゆっくりと下ろし、最適な焦点面が見つかるまでZ位置を調整します。
注: 最適な焦点面は、いくつかの可能な Z 位置を比較し、ほとんどの細胞体を明確に視覚化して焦点面を選択することによって決定されます。 - ミニスコープの位置を変えずに、ミニスコープベースの周りに歯科用セメントの最初の層を慎重に塗布します。セメントが固まったら、ミニスコープがマウスヘッドの上に自立できるように、保持アームを静かに取り外します。
注:歯科用セメントは硬化後に収縮する傾向があり、ミニスコープを元の焦点面から引きずり下ろします。通常、ミニスコープのZ位置は、潜在的な変化を補償するために歯科用セメントを塗布する前に、元の焦点面よりわずかに持ち上げられる。 - ベースの周りに歯科用セメントの第2層を塗布して、すべての隙間を埋め、隙間からLEDライトが漏れていないことを確認します。歯科用セメントを硬化させます。
- マウスを定位ステージから取り外します。ロックネジを緩め、ミニスコープをベースから取り外します。3Dプリントされた保護キャップをベースに入れて、露出したGRINレンズを保護し、ベースのロックネジを締めます(図2J)。
- マウスをホームケージに戻します。
注:マウスが動き始める前に、イソフルラン麻酔から目を覚ますのに通常10〜15分かかります。
4. ミニスコープの取り付けと生体内Ca2+イメージング(図1)
- ミニスコープをベースに取り付けます。
- マウスを誘導チャンバー内で短時間麻酔する(5%イソフルランおよび1L/分の酸素流量)。マウスをクリーンベンチの上に置きます。
- 小さなドライバーでロックネジを緩め、保護キャップを外し、アセトンを浸した綿棒でGRINレンズの表面を拭きます。
- PTFE テープをミニスコープのネジにしっかりと巻き付け、ミニスコープをマウスヘッドのベースに固定します。
- ミニスコープをケーブルに接続し(図2K)、NeuViewソフトウェアの電源を入れます。
- NeuViewで、[ ハードウェア]をクリックし、 LED1をチェックし、[ ストリーム] ボタンをクリックしてライブ画像を表示します(図4A)。
- ベースに対するミニスコープの位置を調整して、鈍い鉗子の助けを借りてわずかに締め付けたり緩めたりして、最適な焦点面を特定します。
注: 最適な焦点面は、いくつかの可能な位置を比較し、ほとんどの細胞体を明確に視覚化した場所を選択することによって決定されます。 - ロックネジを締め、マウスをホームケージに戻します。
- NeuView で、LED ライトの電力を最適なレベルに調整します。[ キャプチャ ]ボタンをクリックし、[ トリガー] ボタンをクリックして録画を開始し、150フレーム後に [停止] をクリックします。
メモ: 可能な限り低い電力によって、十分に明るい画像を得るための LED 電力の最適なレベルが決まります。短いビデオを録画する目的は、反復的なイメージングのために将来同じ焦点面を識別することを容易にすることである。 - ミニスコープからケーブルを外します。実験を開始する前に、マウスを少なくとも30分間回復させます。
メモ:ミニスコープを保護するために、通常、ウォーターボトルとワイヤーフードフィーダーは、この短い時間の間に取り外されます。マウスが自宅のケージに長く滞在する必要がある場合は、市販のダイエットゲル( 材料表を参照)をホームケージに供給することをお勧めします。
- インビボカルシウムイメージングのためのデータ取得
注: インビボ カルシウムイメージングは、研究者が望む行動テストと同時に実施することができます。デモンストレーションの目的で、ここでの例は、オープンフィールドテスト中の in vivo Ca2+ イメージングです。この目標を達成するには、2 台のコンピューターが必要です。1台のコンピュータには、マウスの動作を自動的に記録するようにカメラを制御するための商用ソフトウェア( 材料表を参照)が装備されています。もう1台のコンピュータには、ミニスコープを制御し、Ca2 + 画像を記録するためのNeuViewが装備されています。- ビヘイビアカメラソフトウェア( 材料表を参照)をオンにして、ライブストリーム機能を使用してマウスビヘイビアアリーナを表示します。トップカメラのフォーカスを手動で調整します(図2L)。
- トリガー/ストロボを選択し、「トリガーを有効/無効にする」にチェックを入れます(図4B)。[記録]ボタンをクリックし、[参照]を使用して行動記録を保存する場所を選択し、目的の画像形式を選択します。
メモ:「トリガ制御」機能を有効にすると、NeuViewソフトウェアによって動作記録がトリガされ、動作フレームと対応するカルシウムイメージングフレームが時間的に結合されます。動作記録は、任意の形式で保存できます。動作の記録は、通常、指定されたフォルダにJPEG形式で保存されます。 - マウスをアリーナに近づけ、ミニスコープをデータ集録システムにリンクされているケーブルに接続します(図2L)( 材料表を参照)。その後、マウスはアリーナの中央に配置されます。
- NeuViewソフトウェアのライブストリーム機能を使用して、LEDの電力を調整してカルシウム画像の明るさを最適化します。
メモ: カルシウムイメージングの場合、記録フレームレートはデフォルトで 10 フレーム/秒です。 - NeuViewで、 LED1のチェックを外し、[ キャプチャ ]ボタン、[ トリガー] ボタンをクリックして録音を開始し、100フレーム後に [停止] をクリックします。
注:これは、LEDライトをオフにして約100フレームの背景画像を記録することです。 - 挙動カメラソフトウェアで、[ 録画の開始 ]をクリックします(図4C)。NeuView で LED1 をチェックし、[ キャプチャ] をクリックし、[ トリガー] ボタンをクリックして録音を開始します。3000フレーム後に 停止 を押します。
注:これは、カルシウムのイメージングと行動を同時に記録するためです。オープンフィールドテストは15分で、通常は5分間につき3つのレコーディングセッションに分かれています。これは、連続使用によるミニスコープの過熱を防ぐためです。 - カルシウムイメージングと行動記録の両方を指定されたフォルダに保存します。各セッションの前に背景を記録しながら、さらに2つのセッションの記録を繰り返し、指定されたフォルダにすべての記録を保存します。
- ミニスコープをベースから切り離します。
- 記録が完了したら、ミニスコープからケーブルを外します。
- 誘導チャンバー内でマウスを短時間麻酔する(5%イソフルランおよび1L/分の酸素流量)。清潔で暖かい場所にマウスを置きます。
- ベースにあるロックネジを外し、ミニスコープをベースから取り外します。保護キャップをベースに戻し、ロックネジを締めます。マウスをホームケージに戻します。
結果
図1は、ウイルス注射、GRINレンズ移植、マウス頭蓋骨へのミニスコープ基部の貼付、およびミニスコープを介したインビボカルシウムイメージングを含む概略実験手順を示す。全体の手順は〜2ヶ月かかります。図2は、インビボカルシウムイメージングのミニスコープのためのプロトコルに記載された主要成分を示す。図3は、GRINレンズ注入時のオートステレオタ・ソフトウェアのインタフェースを示しています。図4は、in vivoカルシウムイメージング中のNeuViewと行動記録ソフトウェアのインターフェースを示しています。
in vivoカルシウムイメージングの結果は、ウイルス注射とGRINレンズ移植手術の両方の成功に依存します。図5は、インビボカルシウム画像化記録からのアウトカムの範囲(すなわち、不成功、最適でない、および良好)を示す。失敗した場合、カルシウム画像は暗くも明るくも見えるかもしれませんが、通常は活動的なニューロンがまったくまたはほとんど現れません。私たちは通常、5つ未満の活性ニューロンがある場合、in vivoカルシウム記録実験を追求しません。優れたインビボカルシウムイメージングは、典型的には、数百の活性ニューロンを明らかにする。記録に含まれる活動ニューロンが100個未満の場合、最適ではない記録と見なします。
最適ではない記録と良好な記録の両方で、 インビボカルシウム イメージング実験が追求され、その後のデータ解析が行われました。 動画1は 、マウスmPFCからの代表的な 生体内 カルシウムイメージング記録を示す。行動ビデオとカルシウムイメージングデータは、通常、別々に処理されます。マウスの動作ビデオは手動でスコアリングできます。カルシウム画像化ファイルは、CaImAnカルシウム画像処理ツールボックス24を用いて処理される。 図6 は、良好な インビボ カルシウムイメージング記録からの代表的な細胞マップおよびいくつかのカルシウム微量を示す。
インビボカルシウムイメージングを完了した後、最終ステップは、ウイルス注入およびGRINレンズ移植が所望の脳領域において起こったかどうかを確認することである。この目的のために、マウスをリン酸緩衝生理食塩水(PBS)で灌流し、続いて4%パラホルムアルデヒド(PFA)を灌流した。マウス脳を採取し、4%PFA中で12時間後固定し、4°CでPBSに保存した。 次いで、マウス脳を、ビブラートームを用いて厚さ50μmのスライスで切片化した。脳スライスをDAPIで染色し、顕微鏡下で観察した(プロトコールには記載されていない)12。図7は、実験マウス由来のブレグマより前方〜1.94 mmのマウス脳スライスであって、GRINレンズが移植された軌跡を示す。GRINレンズトラックの下および周囲の緑色蛍光領域は、mPFC領域におけるGCaMP6fの発現を示す。
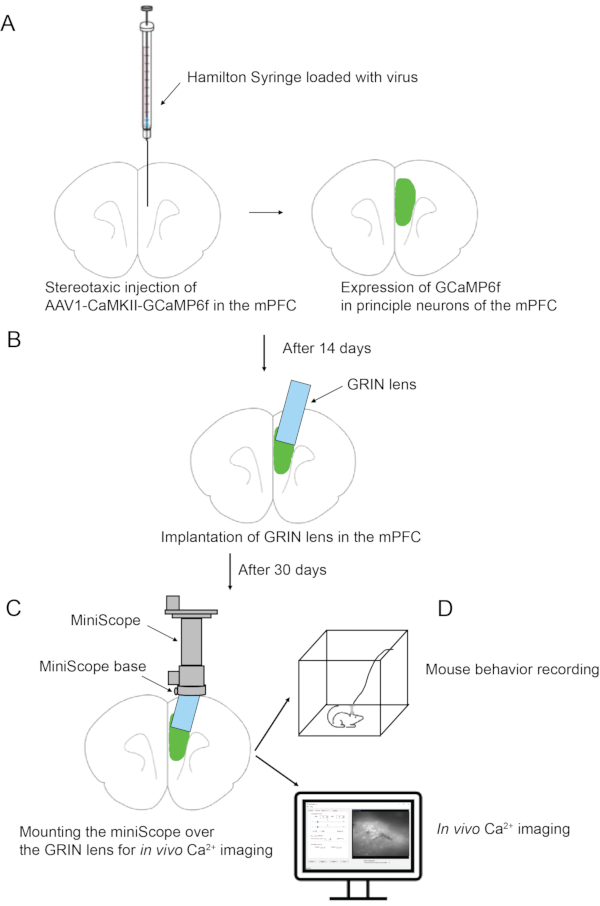
図1:実験手順の概略概要。(b)mPFCにおけるGRINレンズ移植。(C)マウスの頭蓋骨にミニスコープベースを貼り付ける。(d)ミニスコープ搭載およびインビボカルシウムイメージング。この図の拡大版を表示するには、ここをクリックしてください。

図2:in vivoカルシウムイメージングに必要な主要成分。 (A) 直径1mm、全長4.38mmのGRINレンズ。(B)脳組織の吸引に使用される27Gの手動研磨鈍い端の針。(C)針ホルダーに連結されたロボットアーム。(D)マウスの頭蓋骨にミニスコープベースが貼付されるまで露出したGRINレンズを保護するためのPCRチューブからのカスタムメイドのキャップ。(E) 六角ナット付きのミニスコープホルダー(ベース)。(F) ねじ部がPTFEテープで包まれているミニスコープ。(G) ロックネジでベースに固定されたミニスコープ。(H) アームを保持するミニスコープ。(I)XYZ位置でのミニスコープの移動を容易にするために使用されるカスタムメイドの3D電動コントローラ。(J)マウスがin vivoカルシウムイメージングを行っていない間に露出したGRINレンズを保護するために、ベースに固定された保護キャップ。(K) ケーブルに接続されているミニスコープ。(L)インビボCa2+イメージングのためのデータ収集システム。この図の拡大版を表示するには、ここをクリックしてください。
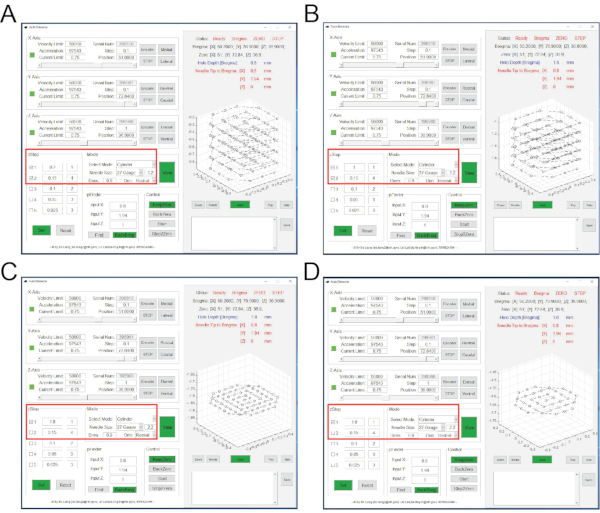
図3:層ごとの脳組織吸引中のAutoStereotaソフトウェアの インターフェース。 (A)ステップ2.17.1から2.17.3に対応するインターフェース。(B) ステップ 2.17.4 から 2.17.6 に対応するインターフェース。(C) ステップ 2.17.7 から 2.17.9 に対応するインターフェース。(D) ステップ 2.17.10 から 2.17.12 に対応するインターフェース。赤いボックスは入力値を強調表示します。 この図の拡大版を表示するには、ここをクリックしてください。
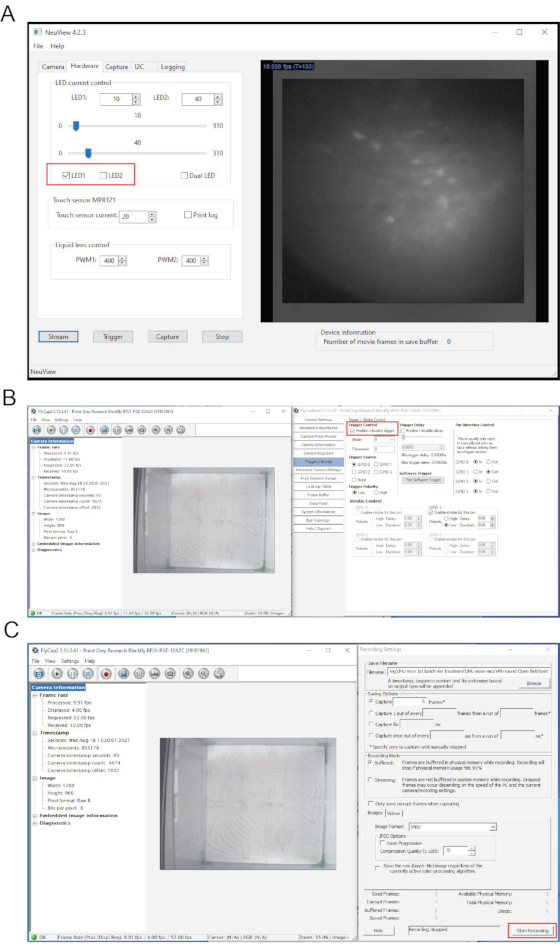
図4: NeuViewソフトウェアとin vivo カルシウムイメージング中の挙動記録ソフトウェアのインターフェース (A) NeuView のインターフェース。(B,C)動作記録ソフトウェアのインターフェイス。赤いボックスは、クリックする必要があるボタンを強調表示します。 この図の拡大版を表示するには、ここをクリックしてください。
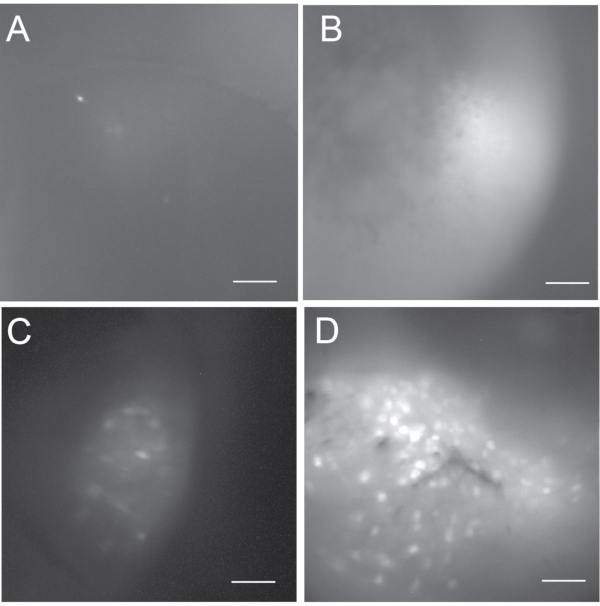
図5:最大投影蛍光細胞マップは、起こりうる結果の範囲を示す 。 (A,B)その後のデータ解析に許容できない インビボ カルシウムイメージングの失敗。(a)は暗く、5個未満の活性ニューロンを含む。(b)明るいが活性ニューロンを有さない。(C)いくつかの活性ニューロンを含む最適でない インビボ カルシウムイメージングからの細胞マップ。(d)数百の活性ニューロンを含む良好な インビボ カルシウムイメージングからの細胞マップ。スケールバー:100μm。 この図の拡大版を表示するには、ここをクリックしてください。
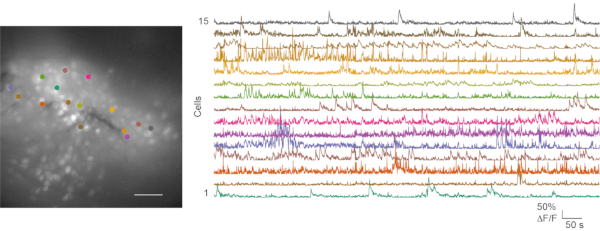
図6:代表的な細胞マップおよびカルシウム一過性からの、成功したインビボ カルシウムイメージング。 左パネルは、オープンフィールドテスト中のmPFC におけるin vivo カルシウムイメージング記録からの最大投影蛍光細胞マップである。録音は5分間続きます。右側のパネルは、関心のある15の領域からのカルシウム過渡現象を示しています(色一致)。スケールバー:100μm。 この図の拡大版を表示するには、ここをクリックしてください。
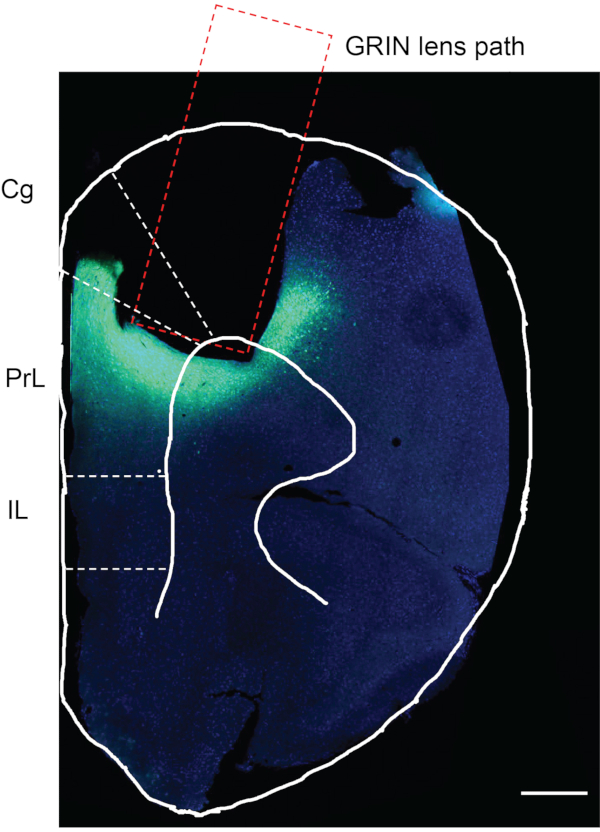
図7:実験マウスの死後評価。 実験マウスのmPFCにおけるGCaMP6f発現およびGRINレンズ移植についての死後評価。長方形の領域は、GRINレンズ移植のための経路を示す。GRINレンズ移植領域の下の緑色の領域は、GCaMP6fが発現されたことを確認し、GRINレンズが所望の脳領域に正確に移植された。Cg, 帯状皮質;PrL、前大脳辺縁系皮質;IL、脳辺縁系皮質。スケールバー:400μm。 この図の拡大版を表示するには、ここをクリックしてください。
表1:NIDAのカスタムメイドミニスコープシステムと他のミニスコープシステム 7,8,9,10,11,13,25,26との比較。この表をダウンロードするには、ここをクリックしてください。
映画1: オープンフィールドテスト中のマウスmPFCからのインビボカルシウムイメージング記録。デモンストレーションの目的で、このビデオは1分間の録画のみを示しています。元の記録フレームレートは10フレーム/秒です。ビデオは元の録画よりも6倍高速です。この映画をダウンロードするには、ここをクリックしてください。
ディスカッション
神経科学における中心的な問題は、神経ダイナミクスと回路がどのように情報をエンコードして保存し、脳疾患でどのように変化するかを理解することです。ミニスコープin vivo Ca2+イメージングシステムを使用して、局所微小回路内の数百のニューロンからの個々の神経活動を、自由に行動する動物から同時に監視することができる。ここでは、カスタム開発のミニスコープ記録システムを介して、脳深部in vivo Ca2+イメージング用のげっ歯類を調製するためのウイルス注射およびGRINレンズ移植のための詳細な手術プロトコルが記載されている。表1は、当社のミニスコープシステムと他の市販およびカスタムメイドのミニスコープシステム7、8、9、10、11、13、25、26との比較を示しています。本外科的プロトコルを用いたGRINレンズ移植は、脳深部in vivoカルシウムイメージングのための商業的またはカスタムメイドの単一光子および2光子イメージングシステムと互換性があることは注目に値します。
ウイルス注射から インビボ カルシウムイメージングのミニスコープのデータ取得まで、実験手順全体が完了するまでに少なくとも2ヶ月かかります。これは複雑で労働集約的なプロセスです。実験の最終的な成功は、GECIの適切な選択、標的脳領域におけるウイルスの正確な注入、所望の神経集団における十分なウイルス発現、所望の位置へのGRINレンズの正確な移植、手術からの適切な回復、ならびに、手術後に重度の炎症が起こるかどうか、および動物の行動が手術によって重篤に影響を受けるかどうかを含む複数の要因に依存する。 などなど。
2つの重要なステップには、ウイルスの定位注射とGRINレンズ移植が含まれる。実証の目的のために、立体マイクロインジェクションをマウスmPFCにおいて、mPFC中の錐体ニューロンを選択的に標識するCaMKIIプロモーターの制御下でGCaMP6fをコードするアデノ随伴ウイルス(AAV1)を用いて実施した。GCaMP6fは、71ms15の半減衰時間を有する最速かつ最も敏感なカルシウム指標の1つであるため、選択された。さらに、GCaMP6fのAAVウイルス発現は長期間(すなわち、数ヶ月)持続するため、神経変性疾患のマウスモデルにおける縦断的研究のために、長期間にわたって反復的なin vivo Ca2+イメージングを行うのに理想的である27。現在の手術プロトコルは、他の任意の脳領域における異なる細胞集団を標的とするために適合させることができる。様々な利用可能なウイルスツールは、所望の年齢で所望の脳領域における特定の神経集団の選択的標識を可能にする。さらに、研究者らは、Cre-LoxP組換えシステムおよび利用可能な様々なトランスジェニックマウスモデルを利用して、遺伝子改変を行い、行動および神経回路の結果を研究することができる28,29。
提示されたプロトコルのユニークな特徴の1つは、GRINレンズ(直径1mm)移植の前に、自動化された層ごとの脳組織吸引が行われたことである。これは、カスタムメイドのロボットアームとソフトウェア23によって制御される真空システムに接続された27G針を介して達成される。我々の経験に基づいて、この方法は、GRINレンズが接触するための均一な表面を生成し、手動組織吸引23よりも隣接する組織への損傷が少ない。このため、この手順は、比較的広い直径(例えば、1mm)を有するGRINレンズに明らかな利点をもたらす。しかし、より小さな直径(0.5mmまたは0.25mm)のGRINレンズを移植するために、組織吸引は必要ないかもしれない。代わりに、30Gニードル21で作られた先行トラックに沿って直接植えることができます。
上記で説明した 2 つの重要な手順に加えて、操作を成功させるには、他の多くの要因を慎重に検討する必要があります。(1)脳に接触する器具はすべて滅菌して感染を予防してください。(2)さらなる炎症および過剰な瘢痕組織形成を防ぐために、脳への損傷を最小限に抑えるために、すべての手術ステップを実行する必要があります。(3)最初に与えられ、手術中に維持された麻酔用量、特に腹腔内投与された麻酔用量は、慎重に検討する必要がある。麻酔用量は、異なるマウス系統に応じて変更することができ、いくつかはより感受性であり得る。(4)マウスの状態は、手術中に常に監視する必要があります。最後に、(5)手術後に多くの合併症が発生する可能性があるため、マウスは手術後に定期的に監視する必要があります。
脳組織の塊はGRINレンズ移植ステップ中に一方的に除去されるが、我々はいかなる明白な行動欠損も観察しなかった7、12。ミニスコープの重量は約2グラムで、ケーブルは軽くし、マウスが簡単に持ち運べるようにカスタム設計されています。ミニスコープとケーブルは、in vivoイメージングの前に動物にのみ取り付けられ、イメージング後に取り外しられます。イメージングプロセス全体は、通常、30分以上かかりません。したがって、これらのインストルメンテーションは、マウスが自由に動作することを妨げるものではありません。ミニスコープの取り付けと取り外しの手順では、動物の拘束を目的として、イソフルランによる簡単な麻酔(2分未満)が必要です。我々は通常、インビボイメージングを行う前に、マウスをイソフルランの短い曝露から30分間回復させる。我々は、マウスの健康状態およびマウスの社会的行動への影響に気付かずに、数週間にわたって週に1回、ミニスコープのin vivoカルシウムイメージングを実施した12。
現在のミニスコープ記録システムの主な制限の1つは、データ収集のために顕微鏡をケーブルに接続する必要があることです。ケーブルの存在は時々マウスのタスクのパフォーマンスを制限し、一度に1匹の動物の記録を制限します。最近、ワイヤレスミニスコープが開発されました25,26.これにより、タスクのパフォーマンスが広がり、グループ内の複数の動物からの同時in vivoイメージングが可能になります。さらに、スペクトル的に分離可能な波長とデュアルカラーミニスコープを組み合わせた、より高感度なGECIを開発することは、神経科学研究にとってよりエキサイティングな可能性を提供します。
開示事項
著者らは、競合する金銭的利益を報告していない。
謝辞
この研究は、国立衛生研究所(NIH)5P20GM121310、R61NS115161、およびUG3NS115608からの助成金によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 0.6mm and 1.2mm drill burrs | KF technology | 8000037800 | For craniotomy |
| 27-G and 30-G needle | BD PrecisionGlide Needle | REF 305109 and REF305106 | For both surgeries |
| 45 angled forceps | Fine Science tools | 11251-35 | For surgeries |
| 7.5% povidone-iodine solution (Betadine) | Purdue Products L.P. | NDC 67618-151-17 | Surface disinfectant |
| Acetone | Sigma-Aldrich | 179124-1L | GRIN lens cleaner |
| Agarose | Sigma-Aldrich | A9539-25G | For GRIN lens implantation |
| Antibiotic ointment | HeliDerm Technology | 81073087 | For virus injection |
| Anti-inflamatory drug (Ibuprofen) | Johnson & Johnson Consumer Inc | 30043308 | Acts as pain killer after surgeries |
| AutoStereota | NIDA/IRP | github.com/liang-bo/autostereota | For GRIN lens implantation |
| Behavior Recoding Software (Point Grey FlyCap2) | Point Grey | Point Grey Research Blackfly BFLY-PGE-12A2C | For recording behavior |
| Brass hex nut | McMASTER-CARR | 92736A112 | For GRIN lens implantation |
| Buprenorphine | Par Pharmaceuticals | NDC 4202317905 | For GRIN lens implantation |
| Calcium chloride | Sigma | 10043-52-4 | For preparing aCSF |
| Commutator | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Compressed Oxygen and Caxbondioxide tank | Rocky Mountain Air Solutions | BI-OX-CD5C-K | For GRIN lens implantation |
| Compressed Oxygen tank | Rocky Mountain Air Solutions | OX-M-K | For virus injection |
| Cordless Microdrill | KF technology | 8000037800 | For craniotomy |
| Cyanoacrylate | Henkel Coorporation | # 1811182 | For GRIN lens implantation |
| Data acquisition controller | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Data transmission cable | NIDA/IRP | Custom-designed | Component of image acquisition system |
| Dental cement set | C&B Metabond and Catalyst | A00253revA306 and A00168revB306 | For GRIN lens implantation |
| Dental cement set | Duralay | 2249D | For GRIN lens implantation |
| Dexamethasone | VETone | NDC 1398503702 | For GRIN lens implantation |
| Dextrose | Sigma | 50-99-7 | For preparing aCSF |
| Diet gel | Clear H20 | 72-06-5022 | Diet Supplement for mouse |
| GRIN lens | GRINTECH | NEM-100-25-10-860-S | For GRIN lens implantation |
| Heating Pad | Physitemp Instruments LLC. | #10023 | To keep the mouse body warm during surgeries |
| Isoflurane | VETone | V1 502017 | Anesthesia |
| Ketamine | VETone | V1 501072 | For GRIN lens implantation |
| Lidocaine | WEST-WARD | NDC 0143-9575-01 | Local anesthesia |
| Magnesium chloride hexahydrate | Sigma | 7791-18-6 | For preparing aCSF |
| Microliter syringe (Hamilton) | Hamilton | 7653-01 | For virus injection |
| MicroSyringe Pump Controller | World Precision Instrument | #178647 | For virus injection |
| Miniscope | NIDA/IRP | Custom-designed | For imaging |
| Miniscope base | Protolabs | Custom-designed | For mounting the base |
| Miniscope holding arm | NIDA/IRP | Custom-designed | For mounting the base |
| Miniscope protection cap | Protolabs | Custom-designed | For protecting the miniscope |
| Motorized controller | Thorlabs | KMTS50E | For mounting the base |
| NeuView | NIDA/IRP | https://github.com/giovannibarbera/miniscope_v1.0 | For in vivo imaging |
| Ophthalmic ointment | Puralube Vet Ointment | NDC 17033-211-38 | Ophthalmic |
| PCR tube | Thermo Scientific | AB-0622 | For GRIN lens implantation |
| Pinch Clamp | World Precision Instrument | 14040 | For clamping the tubing |
| Polytetrafluoroethylene (PTFE) tape | TegaSeal PTFE Tape | A-A-58092 | For fastening miniScope to the base |
| Potassium chloride | Sigma | 7447-40-7 | For preparing aCSF |
| Robotic arm | NIDA/IRP | Custom-designed | For GRIN lens implantation |
| Saline | Hospira | RL 7302 | For both surgeries |
| Set screw | DECORAH LLC. | 3BT-P9005-00-0025 | For screwing the brass hex nut in miniscope base |
| Silicone Rubber tubing, 0.062”ID, 1/8”OD | McMaster | 2124T3 | For irrigation of aCSF |
| Sodium bicarbonate | Sigma | 144-55-8 | For preparing aCSF |
| Sodium chloride | Sigma | 7647-14-5 | For preparing aCSF |
| Sodium phosphate monobasic | Sigma | 7558-80-7 | For preparing aCSF |
| Stereotaxic stage | KOPF | Model 962 Dual Ultra Precise Small Animal Stereotaxic | For both surgeries |
| Sterile cotton swab | Puritan | REF 806-WC | For both surgeries |
| Surgical tools | Fine Science tools | 11251-35 | For surgeries |
| Suture | Sofsilk | REF SS683 | For virus injection |
| Syringe filter (0.22 µm) | Millex | SLGVR33RS | For filtering aCSF during GRIN lens implantation |
| Viral suspension (AAV1-CamKII-GCamp6f) | Addgene | 100834-AAV1 | For virus injection |
| Titre: 2.8 X 10^13 GC/ml | |||
| Xylazine | VETone | V1 510650 | For GRIN lens implantation |
参考文献
- Clapham, D. E. Calcium signaling. Cell. 131 (6), 1047-1058 (2007).
- Brini, M., Cali, T., Ottolini, D., Carafoli, E. Neuronal calcium signaling: function and dysfunction. Cellular and Molecular Life Sciences. 71 (15), 2787-2814 (2014).
- Chen, T. W., Li, N., Daie, K., Svoboda, K. A Map of Anticipatory Activity in Mouse Motor Cortex. Neuron. 94 (4), 866-879 (2017).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Komiyama, T., et al. Learning-related fine-scale specificity imaged in motor cortex circuits of behaving mice. Nature. 464 (7292), 1182-1186 (2010).
- Peters, A. J., Lee, J., Hedrick, N. G., O'Neil, K., Komiyama, T. Reorganization of corticospinal output during motor learning. Nature Neuroscience. 20 (8), 1133-1141 (2017).
- Barbera, G., et al. Spatially compact neural clusters in the dorsal striatum encode locomotion relevant information. Neuron. 92 (1), 202-213 (2016).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- de Groot, A., et al. NINscope, a versatile miniscope for multi-region circuit investigations. Elife. 9, 49987 (2020).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Jacob, A. D., et al. A compact head-mounted endoscope for in vivo calcium imaging in freely behaving mice. Current Protocols in Neuroscience. 84 (1), 51 (2018).
- Liang, B., et al. Distinct and Dynamic ON and OFF neural ensembles in the prefrontal cortex code social exploration. Neuron. 100 (3), 700-714 (2018).
- Liberti, W. A., et al. Unstable neurons underlie a stable learned behavior. Nature Neuroscience. 19 (12), 1665-1671 (2016).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7319-7324 (2003).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Miyawaki, A., et al. Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 388 (6645), 882-887 (1997).
- Bassett, J. J., Monteith, G. R. Genetically encoded calcium indicators as probes to assess the role of calcium channels in disease and for high-throughput drug discovery. Advances in Pharmacology. 79, 141-171 (2017).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Tian, L., Akerboom, J., Schreiter, E. R., Looger, L. L. Neural activity imaging with genetically encoded calcium indicators. Progress in Brain Research. 196, 79-94 (2012).
- Moore, D. T. Gradient-index optics: A review. Applied Optics. 19 (7), 1035-1038 (1980).
- Zhang, L., et al. Miniscope GRIN Lens System for Calcium Imaging of Neuronal Activity from Deep Brain Structures in Behaving Animals. Current Protocols in Neuroscience. 86 (1), 56 (2019).
- Yang, Y., et al. A two-step GRIN lens coating for in vivo brain imaging. Neuroscience Bulletin. 35 (3), 419-424 (2019).
- Liang, B., Zhang, L., Moffitt, C., Li, Y., Lin, D. T. An open-source automated surgical instrument for microendoscope implantation. Journal of Neuroscience Methods. 311, 83-88 (2019).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, 38173 (2019).
- Barbera, G., Liang, B., Zhang, L., Li, Y., Lin, D. T. A wireless miniScope for deep brain imaging in freely moving mice. Journal of Neuroscience Methods. 323, 56-60 (2019).
- Shuman, T., et al. Breakdown of spatial coding and interneuron synchronization in epileptic mice. Nature Neuroscience. 23 (2), 229-238 (2020).
- Werner, C. T., Williams, C. J., Fermelia, M. R., Lin, D. T., Li, Y. Circuit mechanisms of neurodegenerative diseases: A new frontier with miniature fluorescence microscopy. Frontiers in Neuroscience. 13, 1174 (2019).
- Brault, V., Besson, V., Magnol, L., Duchon, A., Herault, Y. Cre/loxP-mediated chromosome engineering of the mouse genome. Handbook of Experimental Pharmacology. (178), 29-48 (2007).
- McLellan, M. A., Rosenthal, N. A., Pinto, A. R. Cre-loxP-mediated recombination: General principles and experimental considerations. Current Protocols in Mouse Biology. 7 (1), 1-12 (2017).
Erratum
Formal Correction: Erratum: Stereotaxic Viral Injection and Gradient-Index Lens Implantation for Deep Brain In Vivo Calcium Imaging
Posted by JoVE Editors on 5/05/2022. Citeable Link.
An erratum was issued for: Stereotaxic Viral Injection and Gradient-Index Lens Implantation for Deep Brain In Vivo Calcium Imaging. The Discussion was updated.
The following paragraph was added to the end of the Discussion:
Although a chunk of brain tissue is removed unilaterally during the GRIN lens implantation step, we did not observe any obvious behavior deficits7,12. The weight of the miniscope is around 2 grams and the cable is custom-designed to make it light and to ensure that the mouse can easily carry it. The miniscope and cable are only attached to the animal prior to in vivo imaging and detached after imaging. The entire imaging process usually takes no longer than 30 minutes. Therefore, these instrumentations do not prevent the mouse from freely behaving. The miniscope installation and deinstallation steps need a brief anesthesia (less than 2 minutes) with isoflurane for the purpose of animal restraining. We typically let the mouse recover from the brief exposure of isoflurane for 30 minutes before performing in vivo imaging. We have performed miniscope in vivo calcium imaging once per week for a few weeks without noticing any impact on mouse health and mouse social behavior12.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved