Method Article
膠芽腫のパルス電界治療のための柔軟な有機電子デバイス
要約
この研究では、3D脳腫瘍モデル、すなわち in vitro 培養、in ovo モデル、 およびin vivo マウスモデルに実装するための柔軟なインターデジット電極の開発について説明します。提案された方法は、さまざまなレベルの複雑さで腫瘍に対するパルス電界の影響を評価するために使用できます。
要約
膠芽腫は、その高度の侵襲性のために、標準的な腫瘍学療法で根絶することは困難です。パルス電界(PEF)に基づく生体電気処理は、処理効率の向上に有望です。しかし、それらは、特に脳などの軟部組織において、急性および慢性の損傷を引き起こす剛性電極に依存しています。この研究では、フレキシブルエレクトロニクスを使用してPEFを腫瘍に送達し、生物学的応答を蛍光顕微鏡で評価しました。薄く透明なパリレン-C基板上に桁間に配置された金電極を導電性ポリマーPEDOT:PSSでコーティングし、順応性のある生体適合性のあるデバイスを実現しました。腫瘍とその微小環境に対するPEFの影響を、さまざまな生物学的モデルを使用して調べました。まず、膠芽腫細胞の単層を電極上で培養し、 in vitroでの現象を調べた。中間ステップとして、操作された腫瘍スフェロイドをウズラの胚膜に移植する in ovo モデルが開発されました。免疫系がないため、これは高度に血管新生した腫瘍につながりました。発生のこの初期段階では、胚には免疫系がなく、腫瘍は異物として認識されません。したがって、彼らは貴重な3D癌モデルを表す既存の胚血管系から独自の血管を発達させながら速く発達することができます。最後に、PEFの柔軟な電極送達を、同世代のオルソグラフト(頭蓋内)マウスモデルを使用して、機能的な免疫系を備えた完全な生物で評価しました。腫瘍スフェロイドは、柔軟な有機電極デバイスの移植前に、トランスジェニック多蛍光マウスの脳に移植されました。密閉された頭蓋窓により、数週間にわたるPEFによる治療中の腫瘍とその微小環境の多光子イメージングが可能になりました。
概要
多形性膠芽腫(GBM)は侵襲性の高い腫瘍であるため、切除、放射線療法、化学療法などの標準治療では根絶が困難です。マルチモーダル治療にもかかわらず、予後は非常に悪く、ほとんどの患者は診断から1年以内に疾患の進行を経験します1,2。最近、生体電気治療の開発は、既存の治療法を改善する大きな可能性を示しています。これらの治療法は、通常、1回の治療セッションでパルス電界(PEF)を送達して、細胞膜の完全性と腫瘍の微小環境を破壊します。エレクトロポレーションとしても知られるこの細胞膜破壊は、電界強度およびパルス数に応じて可逆的または不可逆的であり得る。不可逆エレクトロポレーション(IRE)は、電気パルスが細胞膜に致命的な損傷を引き起こし、細胞死を引き起こす非熱組織アブレーション技術として適用されます3。可逆的エレクトロポレーションは、がん細胞への薬物取り込みを促進するために化学療法薬と組み合わせてPEFを送達することからなる確立された技術である電気化学療法(ECT)に適用されます4。さらに、最近の研究では、カルシウムエレクトロポレーションが癌治療のための高効率でECTの代替として実証されており、これも安価で副作用が少ないことが実証されています5。これらの有望な進歩にもかかわらず、PEFは一般に、軟部組織に損傷を与えることが知られている剛性のある金属電極を使用して適用されます6。脳は、機械的ミスマッチが炎症と星状膠体瘢痕を誘発するような侵襲的な装置に特に敏感です7。
これに関連して、微細加工からマウスモデルまで、膠芽腫腫瘍の3Dモデルと組み合わせた柔軟なPEFデリバリーシステムが提示されます。コンフォーマル電極は、パリレン-C、金、PEDOT:PSS 8,9などの柔らかく生体適合性のある材料の使用を含む、標準的な薄膜微細加工プロセスで作られています。電極指10間の画像化のための十分な透明性を維持しながら、大きな表面積をカバーするために、桁間電極設計が使用される。腫瘍モデルの場合、遺伝的にコードされた蛍光レポーターを発現する膠芽腫細胞の3Dスフェロイドが、液体オーバーレイ96ウェルプレート法11のバリエーションを使用して作製される。スフェロイドはウズラ胚の絨毛尿膜に移植され、血管新生または薬物毒物学の研究に広く使用されているinovoモデルをもたらします12,13。腫瘍は、胚発生のこの段階で免疫系がない場合、胚の血管系によって移植および血管新生することができます12。次に、柔軟な電極を血管新生腫瘍の上に配置して、スフェロイドとその血管系に対するPEF送達の効果を調べます。最後に、これらの影響は、マウスモデルの脳実質に操作されたスフェロイドを移植することによって、腫瘍微小環境および免疫系を含む完全な生物に対して調査される14。柔軟な電極が挿入部位の上に配置され、開頭術はガラス窓で密閉されているため、数週間にわたって2光子イメージングを繰り返すことができます。
これらの方法は、マイクロエレクトロニクス工学から腫瘍学アプリケーションに至るまでのさまざまな分野に関心のある人々に役立ちます。微細加工プロトコルは、PEDOT:PSSでコーティングされた薄膜金属電極を必要とするあらゆるアプリケーションに使用および適合させることができます。さらに、抗腫瘍電気治療の評価のために開発された生物学的モデルは、移植された材料に対する細胞、血管、および免疫応答の分化の研究にとって一般的な関心事となるでしょう。
プロトコル
すべての実験手順は、フランスの法律に従い、実験動物の世話と使用に関する1986年11月24日の欧州共同体理事会指令(86/609 / EEC)に準拠して実施されました。動物に関する研究は、ブッシュデュローヌのサービスデパルテメンタルデサービスデブッシュデュローヌによって承認され、プロヴァンスコートダジュールの倫理委員会によって承認されました(Apafis #22689-2019100414103054)。
1. フレキシブルデバイスの微細加工(図1)
- スライドガラスのクリーニング
- ガラススライドを2%石鹸溶液で15分間超音波処理します。水ですすいでください。
- 80%の純粋なアセトンと20%の純粋なイソプロパノールの混合物で15分間再び超音波処理する。
注意: これらの溶剤は有害で可燃性です。個人用保護具(PPE)を着用し、ドラフトの下で取り扱ってください。 - スライドをイソプロパノールですすぎ、エアガンで乾かします。
注意: プロセス全体を通して、アセトンが基板上で乾燥しないようにしてください。
- 金電極パターニング(図 1A)
- パリレン堆積システムで3 μmのパリレンC(PaC)層を堆積します(図1Aa)。
- 洗浄したスライドガラスを成膜チャンバーに入れます。チラーに石鹸をスプレーし、乾燥させて、堆積システムの指定されたコールドトラップに挿入します。この接着剤防止剤は、堆積後にチラーからPaCを簡単に除去することを容易にします。
注意: PaCは刺激物であり、健康上の危険をもたらします。取り扱い中は手袋を着用してください。 - アルミボートで6 gのPaCを計量し、炉に入れます。機械を排気し(P = 10 mTorr)、次のパラメータで堆積を開始します:Tチラー = -100 °C、T炉 = 690 °C、T気化器 = 175 °C、およびTチャンバー = 135 °C。
- 堆積が終了し、気化器の温度が40°Cを下回ったら、チラー、気化器、および炉の電源を切ります。機械をベントし、サンプルを収集します。
- 洗浄したスライドガラスを成膜チャンバーに入れます。チラーに石鹸をスプレーし、乾燥させて、堆積システムの指定されたコールドトラップに挿入します。この接着剤防止剤は、堆積後にチラーからPaCを簡単に除去することを容易にします。
- 30秒間(100 W、50 sccm)の酸素プラズマ処理によってサンプルの表面を活性化します。
- プラズマ処理したサンプルをネガ型フォトレジストで1,000 x g で40秒間スピンコートします。サンプルを110°Cのホットプレートに2分間置きます(図1Ab)。
注意: フォトレジスト溶液は可燃性であり、刺激を引き起こします。PPEを着用し、ヒュームフードの下で取り扱ってください。 - UV広帯域コンタクトアライナーのビームラインにiラインフィルターを配置し、インターディジット電極設計を特徴とするマスクを通してフォトレジストを露光します(図1Ac)。
注:ギャップ50または250μmの桁間電極はレイアウトエディタを使用して設計され、フォトマスクはレーザーフォトプロットによってポリエステルフォトマスクを製造する会社に注文されました。 - 上記のサンプルをホットプレートで110°Cで3分間焼き、室温まで5分間冷却します。サンプルを金属イオンフリーの現像液に3分間浸漬し、未露光のフォトレジストを除去します。サンプルを水ですすぎ、エアガンで乾燥させます(図1Ad)。
注意: 開発者ソリューションは刺激物です。PPEを着用し、ヒュームフードの下でハンドルを取ります。 - 60秒間(100W、50sccm)の酸素プラズマ処理によってサンプルの表面を活性化します。
- 次のように、20 nmのクロム付着層と300 nmの金の層を熱蒸発器で堆積させます(図1Ae)。
- 蒸発器マシンを通気し、金属ネジで上部の丸いプレートにサンプル(下向き)をクリップします。専用のるつぼにそれぞれクロムと金を入れます。機械を密閉して排気し、5・10-6 Torr未満の圧力に到達します。サンプルホルダーの回転を開始します。
- クロムを含むるつぼを選択し、0.2 Å·s-1 の堆積速度に達するまで、そこを流れる電流をゆっくりと増やします。シャッターを開き、20nmのクロムが堆積するまで待ちます。シャッターを閉じ、0mAになるまで電流をゆっくりと下げます。
- 金を含むるつぼを選択し、0.2 Å·s-1 の堆積速度に達するまで、そこを通過する電流をゆっくりと増やします。シャッターを開いて金を蒸発させ、10 nmの金が堆積するまで待ってから、約300 nmが堆積するまで堆積速度を1.5 Å・s-1 に上げます。シャッターを閉じ、電流をゆっくりと0mAまで下げます。
- 堆積後、サンプルを室温まで15分間冷却します。サンプルホルダーの回転を停止し、機械を通気してサンプルを収集します。
- サンプルをアセトンの入ったビーカーに浸します。ビーカーを110rpmに設定された振とうプレートに15分間置き、フォトレジストを持ち上げます。サンプルをイソプロパノールですすぎ、エアガンで乾燥させます(図1Af)。
- 30秒間(100 W、50 sccm)の酸素プラズマ処理によってサンプルの表面を活性化します。
- パリレン蒸着システムでPaCの3μm絶縁層を堆積します(ステップ1.2.1を参照)(図1Ag)。
- パリレン堆積システムで3 μmのパリレンC(PaC)層を堆積します(図1Aa)。
- アウトライン開口部(図1B)
- サンプルをポジ型フォトレジストで600 x g で35秒間スピンコートします。110°Cのホットプレートに2分間置きます(図1Ba)。
注意: フォトレジスト溶液は可燃性であり、刺激を引き起こします。PPEを着用し、ヒュームフードの下でハンドルを取ります。 - UVブロードバンドコンタクトアライナーのビームラインにiラインフィルターがないことを確認し、UVブロードバンドコンタクトアライナーでデバイスの輪郭を特徴とするマスクを通してフォトレジストを露光します(図1Bb)。
- サンプルを金属イオンフリーの現像液に4分間浸漬し、露光されたフォトレジストを除去します。サンプルを水ですすぎ、エアガンで乾燥させます(図1Bc)。
- 反応性イオンエッチャー(160W、22分、O2:50sccm、CF4:10sccm)でPaCの2層を通して輪郭をエッチングする(図1Bd)。
- 残りのフォトレジストをアセトンで取り除き、イソプロパノールですすぎ、エアガンでサンプルを乾燥させます。
- サンプルをポジ型フォトレジストで600 x g で35秒間スピンコートします。110°Cのホットプレートに2分間置きます(図1Ba)。
- PEDOT:PSSコーティング(図1C)
- 2%石鹸溶液を70 x g で35秒間スピンコートします(図1Ca)。
- パリレン蒸着システムでPaCの3 μm犠牲層を堆積します(ステップ1.2.1を参照)(図1Cb)。
- ポジ型フォトレジストを600 x g で35秒間スピンコートします。サンプルを110°Cのホットプレートに2分間置きます(図1Cc)。
- UV広帯域コンタクトアライナーのビームラインにi-lineフィルターがないことを確認し、電極の活性面を特徴とするマスクを通してフォトレジストを露光します(図1Cd)。
- サンプルを金属イオンフリーの現像液に4分間浸漬し、露光されたフォトレジストを除去します。サンプルを水ですすぎ、エアガンで乾燥させます(図1Ce)。
- 反応性イオンエッチャーでPaCをエッチングし、電極の活性面を開いた(160W、24分、O2:50sccm、CF4:10sccm)。活性表面に残留PaCがないことを顕微鏡で確認します(図1Cf)。
- 残りのフォトレジストをアセトンで取り除き、イソプロパノールですすぎ、エアガンでサンプルを乾燥させます。
- 酸素プラズマ処理を90秒間(100 W、50 sccm)使用してサンプルの表面を活性化します。
- 化学重合PEDOT:PSSの市販分散液を5体積%のエチレングリコール(EG)および0.1体積%のドデシルベンゼンスルホン酸(DBSA)と混合します。15分間超音波処理します。1重量%の(3-グリシジルオキシプロピル)トリメチルシロキサン(GOPS)を加え、5分間超音波処理する。溶液を1.2 μmフィルターでろ過します。
注意: EGは刺激物であり、健康上の危険をもたらします。DBSAは刺激性および腐食性です。GOPSは腐食性です。適切なPPEを着用し、これらの化学物質をヒュームフードの下で取り扱ってください。
注意: 総量はサンプル数によって異なります。10枚の標準スライドガラスに対して、次の量に対応する少なくとも20 mLを準備します:18.78 mLのPEDOT:PSS、1 mLのEG、20 μLのDBSA、および200 μLのGOPS。 - 4層のPEDOT:PSS溶液を150 x g で35秒間スピンコートします。各層を成膜した後、サンプルをホットプレート上で110°Cで60秒間焼き、室温まで5分間冷却してから、次の層を回転させます(図1Cg)。
- サンプルを水に浸して犠牲PaC層を除去します(図1Ch)。
- サンプルを140°Cで1時間焼きます。
- サンプルを脱イオン水に30分間浸漬して、PEDOT:PSSフィルムに残っている石鹸と低分子化合物を除去し、サンプルをガラス基板から剥離します(図1Ci)。
- 接続とパッケージング(図1D)
- 銅でコーティングされたポリイミドフィルムにアクリル塗料の薄層を堆積させます(図1Da)。エアロゾルを使用して、均一な塗料層を取得します(図1Db)。
- アクリル絵の具をレーザー(75 kHz、7 W、1レーザーパス、400 mm・s-1)でパターン化し、2つの長方形のコンタクトパッド(5 mm x 15 mm、1.5 mmギャップ)を得ました(図1Dc)。
- 銅を飽和30%(w / v)塩化第二鉄(FeCl3)で40°Cで15分間水中でウェットエッチングします(図1Dd)。
注意: FeCl3 は刺激性および腐食性です。ヒュームフードの下で手袋で取り扱ってください。 - アクリル絵の具を布で軽くこすり、アセトンで剥がします(図1De)。
- パターン化されたポリイミドフィルムをレーザー(15 kHz、10 W、30 レーザーパス、130 mm・s-1)で長方形(15 mm x 30 mm)にカットします(図1Df)。
- 銀ペーストを3軸分注機で3気圧の圧力で直径330μmの針(5m・min-1)で分注します(図1Dg)。
注意: 銀ペーストは刺激物です。手袋で取り扱ってください。 - ピンセットを使用して双眼顕微鏡下でPaCプローブをポリイミドフィルムに合わせ、取り付けます(図1Dh)。
注意: 位置合わせマークは、コンタクトパッドへのプローブの位置決めを容易にするために、手順1.5.2でパターン化できます。 - オーブンで140°Cで2時間焼きます。
- コンタクトパッドに1 cm2 のポリイミド保護テープを貼ります(図1Di)。
- PaCプローブとポリイミドフィルムが接続されている界面をPDMSに浸します(図1Dj)。
- 50°Cで2時間焼きます。
- 保護テープをはがしてコンタクトパッドを開きます(図1Dk)。
注意: in vitro デバイスの微細加工も同様ですが、手順1.2.1、1.3、および1.5はスキップする必要があります。
2. 膠芽腫GCaMP6f安定細胞株の作製
- レンチウイルス産生
- 75 cm²のフラスコで、レンチウイルス産生に最適化されたHEK 293T由来の細胞株を、4.5 g·グルコース、L-グルタミン、ピルビン酸ナトリウム、重炭酸ナトリウムのL-1、および10%テトラサイクリンフリーウシ胎児血清(FBS)、100単位・mL-1のペニシリンおよび100μg・mL-1のストレプトマイシンを80%コンフルエントになるまで少なくとも3日間補給した。
- フラスコから培地を取り出します。細胞を10 mLのリン酸緩衝生理食塩水(PBS)で穏やかにすすぎます。
- 1 mLの0.25%トリプシン/EDTA溶液を加え、フラスコを37°Cで5分間インキュベートします。
注意:トリプシン/ EDTA溶液は健康上の危険をもたらします。PPEを着用し、ヒュームフードの下でハンドルを取ります。 - 8 mLの培地を追加します。細胞懸濁液を静かに洗い流します。
- 細胞をカウントし、8mLの培養液中のシャーレ中の4 x 106 細胞をプレート化する。
- 翌日、遺伝子GCaMP6fおよびピューロマイシンに対する耐性を付与する選択マーカーを含むプラスミド25μgを総容量600μLの水で希釈する。トランスフェクション試薬のチューブに加えます。3,000rpmで10秒間渦巻き、チューブを室温で10分間インキュベートして、ナノ粒子の生成を可能にします。
- チューブの内容物をHEK 293 T細胞の培養物に滴下し、手で穏やかに揺らします。細胞を37°Cで少なくとも4時間インキュベートします。
- ナノ粒子複合体を含む培地を新鮮な培地と交換し、細胞を37°Cで戻します。
- 3日後、上清を収集し、500 x g で10分間遠心分離して細胞の破片を除去します。ウイルス粒子を含む液相を収集します。
注:上清中のウイルス産生は、定量的レンチウイルス力価試験を使用して確認でき、-80°Cで少なくとも2年間保存できます。
- 膠芽腫細胞形質導入
- 75cm²のフラスコに、1g・cm2を含む10mLのDMEM中で膠芽腫細胞を培養する。グルコース、L-グルタミン、ピルビン酸ナトリウム、重炭酸ナトリウムのL-1を、10%テトラサイクリンフリーFBS、100単位・mL-1のペニシリン、および100μg・mL-1のストレプトマイシンを少なくとも4日間補給した。
- 培地を廃棄し、ステップ2.1.9で得られた上清を標的細胞に加えます。
- 培地に5 μg・mL-1 の臭化ヘキサジメトリンを添加して、形質導入を改善します。37°Cで6時間インキュベートします。 培地を10 mLの新しい培地と交換します。
注意:臭化ヘキサジメトリンは刺激物です。.手袋で取り扱ってください。
- 安定細胞株の作製
- 形質導入の2〜3日後に、1g・1 g・sを含むDMEM10 mLを加えます。グルコースのL-1、L-グルタミン、ピルビン酸ナトリウム、および重炭酸ナトリウム、10%FBS、100単位・mL-1のペニシリン、100μg・mL-1のストレプトマイシン、およびピューロマイシンを添加して、形質導入されていない細胞を殺します。この培地で細胞を少なくとも3日間培養する。
注意:ピューロマイシンは刺激物です。手袋で取り扱ってください。
注:ピューロマイシンに対する細胞の感受性は、形質導入前に、異なる濃度のピューロマイシンを含む推奨培地で細胞を培養することによりテストする必要があります。1日後、顕微鏡で細胞を確認します。抗生物質が毒性が強すぎず、トランスフェクトされた細胞も殺す可能性があることを確認するために、大部分の細胞が死んでいるが生きている細胞はほとんどない適切な濃度を選択してください。 - 培地を取り出し、10 mLのPBSで細胞を洗い流します。
- 0.25%のトリプシン/EDTA溶液を1 mL加え、フラスコを37°Cで5分間インキュベートします。
- 8 mLの培地を追加します。細胞懸濁液を静かに洗い流します。
- 100 μLの細胞懸濁液を採取し、セルカウンターで細胞濃度を測定します。50 μLの細胞懸濁液を、60 μmセンサーを備えたハンドヘルド自動セルカウンターで吸引します。
- 1 セル/ウェルを 96 ウェルプレートにシードします。例えば、1mLあたり1×103 細胞の濃度の場合、1/(1×103)、すなわちウェル当たり0.001mLの細胞懸濁液を添加する。成功の可能性を高めるためにすべての井戸に種をまきます。培養液で完了し、ウェルあたり総容量200 μLに達します。
- 1日後、1つの細胞を含む各ウェルを見つけ、その蛍光を確認します(λexc = 490 nmおよびλem = 530 nm)。トランスフェクトされた細胞を1つだけ含むウェルに印を付けます。井戸がほぼ合流するまで数日間成長を続けます。
- 培地を廃棄し、200 μLのPBSで細胞を洗い流します。100 μLの0.25%トリプシン/EDTA溶液を加え、96ウェルプレートを37°Cで5分間インキュベートします。
- 100 μLの培地を加え、細胞懸濁液を静かに洗い流します。細胞懸濁液をペトリ皿に移す。5 mLの培地を加え、ペトリ皿がほぼコンフルエントになるまで細胞を数日間増殖させます。
- 培地を廃棄し、5 mLのPBSで細胞を洗い流します。1 mLの0.25%トリプシン/EDTA溶液を加え、ペトリ皿を37°Cで5分間インキュベートします。
- 6 mLの培地を加え、細胞懸濁液を静かに洗い流します。細胞懸濁液をT25フラスコに移します。フラスコがほぼコンフルエントになるまで数日間成長を続けます。
- 培地を廃棄し、5 mLのPBSで細胞を洗い流します。1 mLの0.25%トリプシン/EDTA溶液を加え、T25フラスコを37°Cで5分間インキュベートします。 1 g·グルコース、L-グルタミン、ピルビン酸ナトリウム、重炭酸ナトリウムのL-1、および10%FBS、100単位・mL-1のペニシリン、および100μg・mL-1のストレプトマイシンを補充した。細胞懸濁液を静かに洗い流します。
- 細胞懸濁液を4つのT25フラスコ(フラスコあたり2 mL)に分割し、各フラスコに5 mLの培地を追加します。フラスコがほぼコンフルエントになるまで、細胞を数日間成長させます。
- 3つのフラスコに対して手順2.3.12を繰り返し、最後のフラスコを手順3.1.3のために保管します。細胞懸濁液を15 mLコニカルチューブに移し、150 x g で5分間遠心分離します。上清を捨て、細胞ペレットを900 μLに再懸濁します。 細胞を穏やかに混合して、均質な細胞懸濁液を維持します。
- 細胞懸濁液を極低温保存バイアルに移します。100 μLのジメチルスルホキシドを加える。クライオバイアルを-80°Cで一晩置きます。凍結細胞を液体窒素に移し、さらなる実験を行います。
注:トランスフェクションの効率は、培地に5 μMのイオノマイシンカルシウム塩を添加し、蛍光顕微鏡(λexc = 490 nmおよびλem = 530 nm)で誘導蛍光の増加を確認することで評価できます。
- 形質導入の2〜3日後に、1g・1 g・sを含むDMEM10 mLを加えます。グルコースのL-1、L-グルタミン、ピルビン酸ナトリウム、および重炭酸ナトリウム、10%FBS、100単位・mL-1のペニシリン、100μg・mL-1のストレプトマイシン、およびピューロマイシンを添加して、形質導入されていない細胞を殺します。この培地で細胞を少なくとも3日間培養する。
3.3Dモデル
- 回転楕円体文化
- 脱イオン(DI)水中の1%(w / v)アガロースの溶液を調製します。
- 100 mLのDI水に100 gのアガロース粉末を加え、すべての粉末が溶解するまで電子レンジで溶液を加熱します。塊を避けるために定期的に溶液をかき混ぜます。溶液を120°Cで20分間オートクレーブします。
- オートクレーブから取り出したら、ウェルあたり75 μLのアガロース溶液を96ウェルプレートに慎重に加えます。それを井戸の側面に堆積させて半月板を形成し、付着しない丸い底をもたらします。室温で15分間固化させます。
- ステップ2.3.14で得られたフラスコから細胞を剥離する(ステップ2.3.12)。
- 膠芽腫細胞のウェルあたり10,000細胞を追加し、1g·グルコース、L-グルタミン、ピルビン酸ナトリウム、重炭酸ナトリウムのL-1、および10%ウシ胎児血清(FBS)、100単位・mL-1のペニシリンおよび100μg・mL-1のストレプトマイシンを添加した。
- プレートを動かさずに細胞を37°Cで3日間インキュベートします。次に、さらなる実験が行われるまで、2日ごとに培地の半分をマルチチャンネルピペットで新鮮な培地に交換します。アガロースまたはスフェロイド自体への損傷を避けるために、ピペットチップをウェルの上部に保管してください。
注:スフェロイドのサイズは、播種する細胞の数と細胞株に依存するため、実験に応じて調整する必要があります。
- 脱イオン(DI)水中の1%(w / v)アガロースの溶液を調製します。
- インオボモデル
- ウズラ(C. japonica)の受精卵をインキュベーター(37°C、湿度57%)に置き、2時間ごとに卵を回転させる自動回転子付きのトレイに置きます。この日は胚の日 (ED) 0 と見なされます。
- プラスチック製の計量ボートを70%(w / v)エタノールに入れて洗浄します。計量ボートを取り出し、ドラフトの下で乾燥させます。
注:この時点から、実験は無菌状態では実行されません。しかしながら、胚のカビの発生を避けるためには、清潔な条件が必要である。 - ED3では、70%(w / v)エタノールで事前に洗浄した細い先端のピンセットを使用して卵をそっと開きます。胚をプラスチック製の計量ボートに注ぎ、別の計量ボートで覆い、37°Cの標準的な加湿インキュベーターに3日間入れます。
- ED6では、23 Gの針で絨毛尿膜(CAM)を少し切開します。
- ピペットを使用して、切開部に7日間のスフェロイドを置き、さらなる実験が行われるまで、胚を3日間インキュベーターに戻します。
注:蛍光色素を胚の目に注入して、血管を視覚化することができます。 - 実験当日、マイクロマニピュレーターを使用して血管新生腫瘍の上にフレキシブルプローブを置きます。
- ザ in vivo モデル
注:プロトコルのこの部分は、以前にリファレンスで公開されたものから適応されています14.成体多色蛍光AMU-神経炎症マウス(B6.Cg-Tg(Thy1-CFP)23Jrs(Ly6a-EGFP)G5Dzk(Itgax-EYFP)1Mnz/FD)を用いた。これらのマウスは、Thy1の亜集団の標識を提示します+ ECFPの遺伝子導入発現による神経細胞、末梢LyzMの標識+ EGFPの遺伝子導入発現およびCd11cの制御下でEYFPを発現するミクログリアのサブタイプの標識による炎症細胞+.簡単に言えば、動物を治療または注射の前に1.5%イソフルランで2分間軽く鎮静させる。手術の前に、動物はケタミン(120 mg / kg;IP)およびキシラジン(12 mg / kg;IP)。次に、3%リドカインゲルを局所的に塗布して、定位サポートの固定に関連する耳の痛みを軽減します。次に、0.25%ブピバカイン溶液を手術部位に投与して、開頭術による痛みを軽減します。マウスが手術の準備をしたら、参照に従って直径4mmの開頭術を行った。14.26Gの針で、開頭術の中央の硬膜に穴を開け、腫瘍スフェロイドに参考文献に記載されている注射システムを注入しました。14.さらに、ここで説明したように、開頭術をガラス窓で密封する前に、腫瘍スフェロイドを発現するGCamp6またはDsRed上に可撓性電極を配置した。- 開頭術を覆うように、ダルベッコのリン酸緩衝生理食塩水(DPBS)を一滴置きます。フレキシブル電極をDPBSのドロップの上に置き、コンタクトパッド付きのプローブの背面をマウスの背面にそっと置きます(図4B)。
注意: 滅菌手袋と「チップのみ」のテクニックを使用してください。非滅菌面に接触した場合は、手袋を交換してください。この手順の間、熱サポートを提供します。 - プローブが硬膜の上に平らに置かれ、脳の湾曲を追跡するまで、DPBSを小さな紙で触れてDPBSを吸収します。DPBSの小さな層が電極の側面から逃げずに電極の下に残っていることを確認してください。これにより、次のステップでの接着剤の波及に対するバリアが保証されます。
注意: 使用前にすべての機器を滅菌してください。 - プローブにシリコン接着剤を少量滴下し、5mmの丸いカバーガラスで覆います。シリコーンが均等に分散し、カバーガラスとプローブの間の距離が最小になるまで、カバーガラスを押し下げます。カバーガラスをさらに30秒間押し下げて、シリコーンが固まるようにします。
- カバーガラスを固定するには、側面に瞬間接着剤をすばやく塗布し、接着剤が硬化して固まるまで押し下げます。
- つまようじを使用して、プローブの首に瞬間接着剤を塗布し、瞬間接着剤が首の下に引き込まれるように注意して、安定したサポートを提供します。
- 頭蓋骨を歯科用セメントで覆い、慢性キャップを作ります。カバーガラスの端だけを覆うように特に注意してください。
- プローブの背面を持ち上げ、プローブのネックの下にセメントを塗布します。プローブが硬化する前に、プローブをセメントの上に置きます。実験中にプローブの表面がカバーガラスの表面と同じ高さになり、顕微鏡の対物レンズの邪魔にならないように、鈍い鉗子でプローブの首をそっと押し下げます。
- プローブネックの上部を1.5mm以下の歯科用セメント層で覆い、プローブをしっかりと保持します。カバーガラスの周りに1〜2 mmの距離で1.5 mmの隆起を示すセメントウェルを構築し、2光子イメージング用の浸漬流体用の盆地を作成します(図4C)。
- セメントが硬化したら、ブプレノルフィン術後鎮痛薬(0.05 mg / kg、体重10 gあたり0.1 mL)を皮下投与し、動物が目覚めるまで暖かい雰囲気に保ちます。.これには、赤外線電球への近さや、動物をペーパータオルで包むことが含まれます。
注意: 温度を監視するために、マウスの高さに温度計を置きます。 - ポテンショスタットを使用して1〜10kHzの範囲のインピーダンスを特性評価します。
- 動物を少なくとも10日間手術から回復させます。手術直後に抗炎症薬を投与し、動物の状態を監視し続けて、適切な術後鎮痛を提供します。
- 開頭術を覆うように、ダルベッコのリン酸緩衝生理食塩水(DPBS)を一滴置きます。フレキシブル電極をDPBSのドロップの上に置き、コンタクトパッド付きのプローブの背面をマウスの背面にそっと置きます(図4B)。
4. パルス電界(PEF)の送達とイメージング
- 標本を蛍光顕微鏡の下に置きます。3Dモデルの場合、腫瘍は上からしか観察できません。
注:in ovo モデルでは、落射蛍光顕微鏡(ただし、2光子顕微鏡でも可能です)で実験を行いましたが、 in vivo モデルでの実験は2光子顕微鏡で行われました(図6)。 - ポゴピンコネクタ(in vitro)またはクロコダイルクリップ(in vivoおよびin vivo)を使用して、パルス発生器をデバイスのコンタクトパッドに接続します(図4A)。必要なパラメータ(パルス数、電圧、パルス幅、周波数)を設定し、発電機を実行してPEFを適用します(図4A)。蛍光を同時に測定して、PEFの効果をリアルタイムで観察します。
結果
このプロトコルは、柔軟なPEF送達システムが統合された2つの膠芽腫モデルへの適用を可能にする。微細加工およびパッケージングのステップに続いて、フレキシブル電極は、電気化学インピーダンス分光法(EIS)によって生理食塩水中で特性評価され、その性能を評価および検証されます。PEDOT:PSSコーティングされた電極は、カットオフ周波数によって分離された典型的な容量性および抵抗性が支配的な領域を示しますが、コーティングされていない電極は容量性挙動のみを示します(図2)。
液体オーバーレイ96ウェルプレート法のバリエーションを使用して、蛍光細胞内カルシウムレポーターを安定に発現するトランスフェクトされた膠芽腫細胞からなる3D腫瘍を増殖させます。スフェロイドの成長は明視野顕微鏡で観察できます(図3;ED 0)。球状および高密度のスフェロイドを得るには、細胞株および播種された細胞数に応じて、少なくとも2〜3日が必要である。
in ovoモデルでは、スフェロイドはウズラの胚の絨毛尿膜に移植されます(図3;エド6)。移植片の成功は、生細胞が細胞内カルシウムを有し、したがって蛍光性であるため、数日後に蛍光顕微鏡によって評価することができる(図3;エド9)。腫瘍の血管新生は、蛍光色素を血管に注入することにより、蛍光顕微鏡で観察することができます(図3;ED9)。ただし、スフェロイドは非常に密集しているため、腫瘍内の血管を常に視覚化できるとは限りません。柔軟なインターデジット電極は、血管新生腫瘍の上に配置されます(図3;ED9)とパルス発生器に接続した。プローブは、胚の出血を避けるために穏やかに配置する必要があります。そうしないと、蛍光色素が拡散する可能性があり、イメージングによる観察が妨げられます。生物学的環境へのパルスの正しい供給は、回路を流れる電流を測定することによって検証することができる。ovoモデルにおけるこれらのイメージングは、3D膠芽腫腫瘍における細胞内カルシウムに対するPEFの効果、ならびに腫瘍の血管系に誘導される血管収縮のリアルタイムモニタリングを可能にし、免疫系を含む他の細胞型の影響を回避することができる15。
膠芽腫に対するPEF効果の研究は、より完全で予測的なモデルでも行うことができます。実際に、上記14のin vivoモデルは、マウスの脳実質に3D膠芽腫腫瘍を移植することからなる(図4)。腫瘍の注射部位を架橋デキストランゲルヘミビーズによって塞ぎ、腫瘍の成長中の生理学的生物物理学的制約を再現する。参考文献14に記載されているが、デキストランヘミビーズが硬膜に正確に接着されることが非常に重要であることを再度強調する価値がある。そうしないと、腫瘍が開いた硬膜から逃げ出し、脳を完全に覆い、イメージングが不可能になります。慢性的なイメージングでは、頭蓋窓が治癒するときに発生する組織の内部成長は、新しい組織が不透明であり、画像が霧や使用できなくなるため、深刻な障壁をもたらします。したがって、ヘミビーズを挿入して接着した後、開いた頭蓋窓の側壁は、瞬間接着剤が滑ったり硬膜に流れたりすることなく、空洞壁全体に細心の注意を払って配置された瞬間接着剤の薄層で密閉する必要があります。フレキシブルプローブを腫瘍注入部位の上に配置した場合、2つの理由から、プローブの下に気泡が留まることはありません。まず、気泡が存在するとイメージングが進行しません。第二に、気泡は絶縁体として機能し、したがって電気刺激特性を変化させる。上記の予防措置を講じた後、開頭術は頭蓋骨に接着されたガラス窓で密閉され、数週間にわたる慢性的なイメージングが可能になります。腫瘍はGCaMPまたはDsRed発現細胞で構成されているため、注射は蛍光顕微鏡で確認できます。電極の電気化学インピーダンスは、移植後の性能を検証するために測定する必要があります。生理食塩水中のインピーダンスと比較して、生体内では生物学的環境の存在により100Hzを超える周波数でインピーダンスの増加が予想されます(図5)。血管新生神経実質および腫瘍浸潤は、2光子顕微鏡によって数週間にわたって透明な基質を通して観察および特徴付けることができます(図6)。目的の細胞(免疫細胞およびニューロン)において蛍光タンパク質を発現するトランスジェニック動物の使用は、例えば、電極移植のみによって誘導される最小炎症過程の実証を可能にし(図6A)、または増殖中のGBM腫瘍の上に移植されたPEF刺激電極の移植の26日後にミクログリアおよび単球の存在を示すことができる(図6B1).後者の場合、末梢単球由来細胞と脳常在性ミクログリア細胞の両方が腫瘍の周囲および内部に見られました(図6B2)。PEFの納入日には、フレキシブル電極のコンタクトパッドを2光子顕微鏡の真下でパルス発生器に接続することができます。全体として、このモデルは、脳腫瘍の発生に関与するさまざまな種類の細胞を使用して、約500μmの深さまでの経時的な生体電気治療の効果を調べるために使用できます。
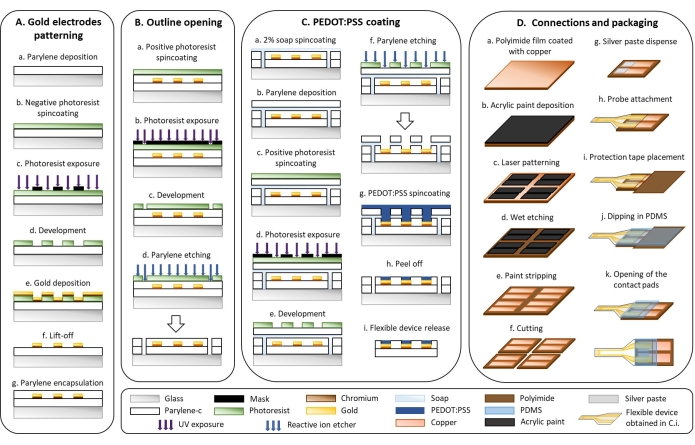
図1:フレキシブル電極の微細加工 。 (A)金電極パターニングとパリレンC基板。(B)アウトラインオープニング。(C)ペドット:PSSコーティング。(D)接続とパッケージング。この図の拡大版を表示するには、ここをクリックしてください。
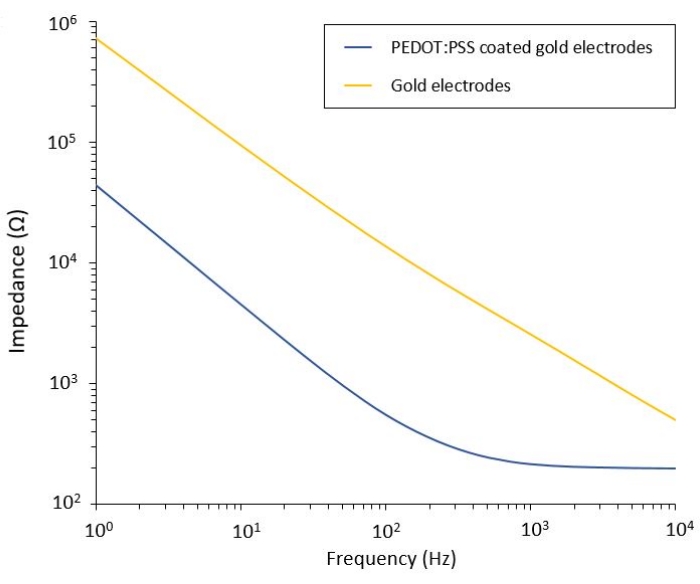
図2:生理食塩水中のフレキシブル金電極およびPEDOT:PSSコーティングされた低温電極の電気化学インピーダンス分光法。 この図の拡大版を表示するには、ここをクリックしてください。
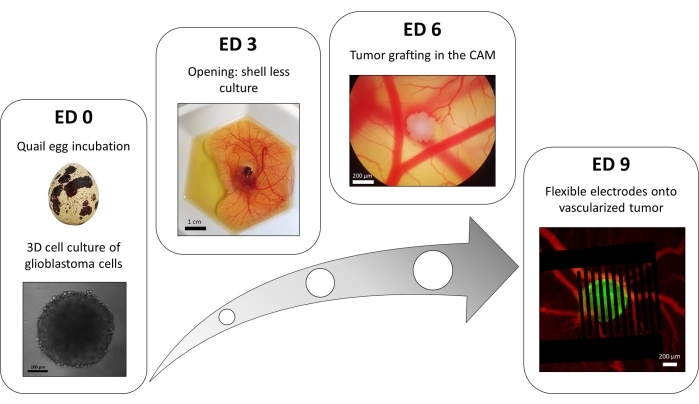
図3:膠芽腫の inovo モデル。 ED0:明視野顕微鏡で観察したスフェロイド。ED3:開封後3日目のウズラ胚の殻なし培養。ED6:明視野顕微鏡で観察したCAMに移植した腫瘍。ED9:血管新生腫瘍(緑色の腫瘍と赤色の血管)に配置された柔軟なデバイス。 この図の拡大版を表示するには、ここをクリックしてください。
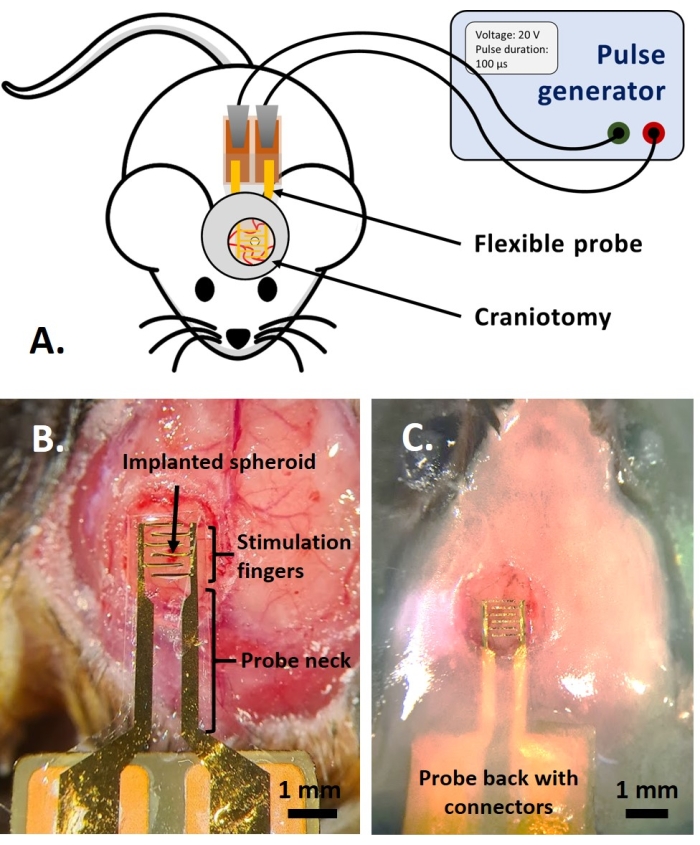
図4: インビボ アプリケーション 。 (A) インビボ 実験のためのスキーム。(B)カバーガラスとアクリル樹脂を塗布する前のプローブ配置。(C)プローブの移植が完了しました。 この図の拡大版を表示するには、ここをクリックしてください。
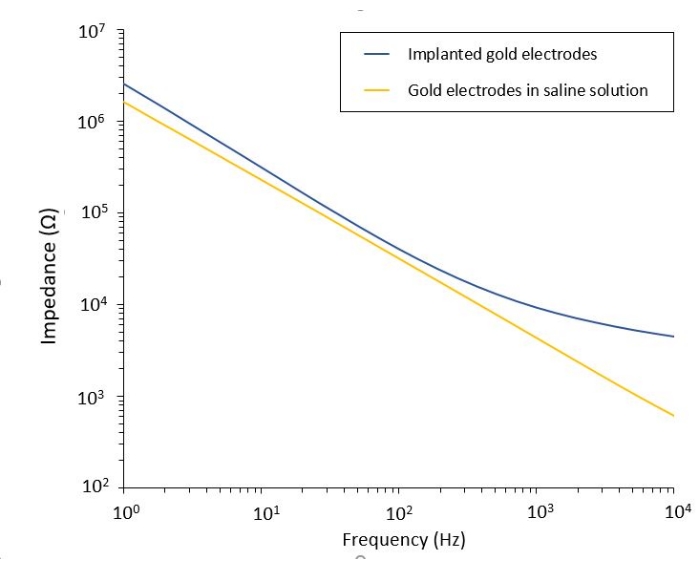
図5:生理食塩水中の柔軟な金電極の電気化学インピーダンス分光法と埋め込みプローブの比較。 この図の拡大版を表示するには、ここをクリックしてください。
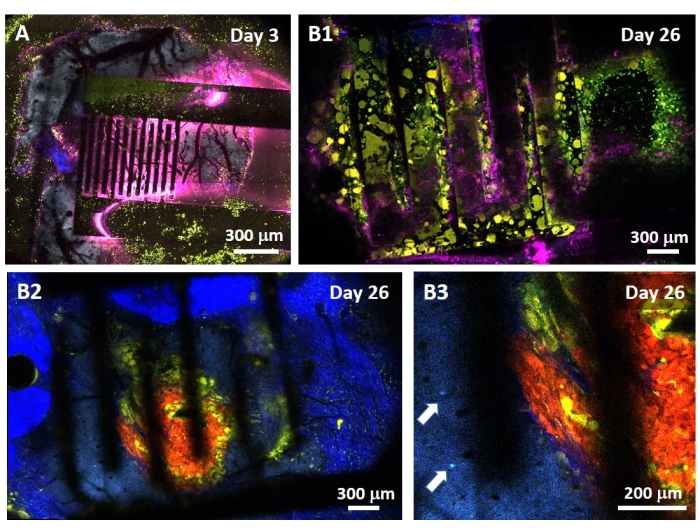
図6:電極を介した生体内マルチスペクトル2光子イメージング 。 (A)電極移植後3日目の対照多蛍光AMU-Neuroinflamマウスにおける健康な脳表面のタイル画像。シアンは第5層の錐体ニューロンの樹状樹状樹状化を示し、緑色は動員された顆粒球と単球を示し、黄色は活性化されたミクログリアと樹状細胞を示します。ピンクは蓄熱による赤外線拡散を示す。(B1) A と同様の画像であるが、腫瘍スフェロイド移植の26日後に皮質内部200μmの深さに電極移植を行った。緑と黄色の免疫細胞の蓄積に注意してください。(B2) B1 と同様の画像ですが、電極の表面から100μm下にあります。黄色ミクログリアおよび樹状細胞によって浸潤した赤色腫瘍塊自体の周辺における青色ニューロン樹状化の存在に留意されたい。濃い青色は、腫瘍周囲コラーゲンからの第2高調波信号を示す。(B3)腫瘍の近傍における介在ニューロン体の存在を示す B2 のズーム図(矢印で示す)。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この研究で説明されているアプローチにより、統合されたPEFデリバリーシステムを備えた脳腫瘍モデルは、生物学的組織のさまざまなレベルでのPEFの効果を研究することができます。微細加工プロトコルは、標準的な薄膜プロセスで構成されており、特定のアプリケーションに適応できる電極設計の自由度が高いです。場合によっては、製造中に発生した電極の曲げを減らすために、製造の最後に追加の熱アニーリングステップが役立つことがあります。
蛍光カルシウムインジケーターを発現する安定した膠芽腫細胞株を使用することで、特に非常に密度の高い3D腫瘍において、色素の送達と保持に関連するすべての合併症を回避できます16。実際に、標準的な化学蛍光カルシウム指示薬17と比較して長期間にわたって高い発現レベルが観察される。このプロトコルは、神経活動の画像化に一般的に使用されるように、様々な細胞株に適用することができる11。ここでは、ヒトおよびマウス細胞株を使用した(免疫不全マウスまたは免疫適格マウスへの移植にそれぞれU87およびGl261)。実際、最近の研究では、U87細胞株は、長年の細胞培養で多くの突然変異が獲得され、実験的再現性に影響を与えるため、元の細胞株とは異なることが示されました18。3D腫瘍の調製に使用される方法は、ハイスループットで再現性があり、細胞株、播種時の細胞数、および増殖時間に応じて特定のサイズのスフェロイドの生成を可能にします19。しかしながら、これらのスフェロイドは緻密であり、これは腫瘍の中心で画像化するときに不利を提示する。
in ovoモデルは、脳内に存在する他の細胞型との相互作用なしに、3D腫瘍とその血管系に対するPEFの効果を研究するための最初のアプローチとして有用です。このモデルは、動物モデルよりも安価で、高速で、高スループットであり、倫理的問題が少ないです。胚の生存と画像の品質に影響を与える可能性があるため、実験全体を通して胚の完全性を維持することが重要です。ウズラの卵を開くときは、胚膜への損傷を避けるために特別な注意を払う必要があります。移植片および可撓性電極の配置もまた、胚を殺す可能性のある出血を避けるために慎重に行われなければならない。血管への蛍光色素の注入により、腫瘍細胞の可視化と蛍光顕微鏡による血管新生を同時に行うことができます。眼内注射は、色素が胚液に漏れないように注意深く行う必要があり、バックグラウンドに残留蛍光が発生してイメージングの品質が低下する可能性があります。このモデルは、循環器系へのアクセスを可能にするため、薬物摂取の追跡にも使用できます。しかしながら、実験は胚の12日間の生存時間によって制限され、したがって7日間の観察を可能にし、これはin vivoモデル21よりも有意に短い。
in vivo脳腫瘍モデルは、動物が突然の20%の体重減少によって決定される倫理的実験エンドポイントに到達する前に、4〜5週間監視できます。それは忍容性が高く、電極の接続テールが長すぎない場合はその場に留まります。そうしないと、動物はフリッピングコネクタを傷つける傾向があり、最終的には引き裂かれ、その後の刺激装置への接続を妨げる可能性があります。それにもかかわらず、この4週間の期間は、膠芽腫の発症のさまざまな段階をカバーするために価値があります。異なる時間間隔で同じ体積の腫瘍細胞密度を比較すると、腫瘍増殖動態の進展が観察され得る。特に、免疫スイッチ22の時点で腫瘍増殖の亢進が認められた。刺激電極の存在下での同様の研究は、腫瘍増殖速度および免疫排除に対する腫瘍感受性に対するPEFの効果について情報を提供するであろう。in ovoモデルと比較して、in vivoモデルは、腫瘍の進行に対する免疫細胞の影響とPEFの治療効果への寄与を研究するための貴重な前臨床モデルと見なすことができます。このプロトコルは、頭蓋窓14を配置する前に腫瘍上に可撓性電極装置を追加した以前の記事から適応される。腫瘍の急性および慢性の生体電気治療は、初期刺激が細胞死を誘発し、免疫応答の持続的な調節不全を引き起こすことが予想されることを考えると、2光子顕微鏡による直接およびその後の観察によって特徴付けることができます。
フレキシブルプローブの接続は、2光子顕微鏡で簡単にアクセスできます。したがって、電気刺激パラメータは、医師が患者のMRIまたはCT画像を観察しながら介入手順を実行する方法と同様に、神経組織および/または標的細胞に対する観察された効果に基づいてリアルタイムで調整することができる。最後の考慮事項は、組織の再成長を防ぐために、スーパーグルーとシリコン接着剤で脳の電極を注意深く密閉することの重要性です。
結論として、ここに記載されているプロトコルは、膠芽腫腫瘍モデルに対する柔軟な有機ポリマー電極を用いたPEF療法の効果を研究するための革新的なモデルを表しています。2つのモデルは、細胞、血管、または免疫の影響を分離して作用機序をよりよく理解できるように、異なるレベルの複雑さを示します。コンフォーマルな表面電極は、医原性損傷を軽減しながら、腫瘍微小環境の破壊を可能にし、細胞内カルシウム15の血管収縮または調節不全を引き起こします。
開示事項
著者は、競合する経済的利益はないと宣言しています。
謝辞
ここで報告された研究は、フランス国立研究機関(ANR-18-CE19-0029)の支援を受けました。著者らは、安定したGCaMP6f細胞株の生成に貢献したS.M.バルデと、 inovo モデルに協力してくれたD.オコナーに心から感謝します。
資料
| Name | Company | Catalog Number | Comments |
| (3-Glycidyloxypropyl)trimethoxysilane | Sigma | 440167 | GOPS |
| 0.25% Trypsin-EDTA (1X) | Gibco | 25200-056 | |
| 4-Dodecylbenzenesulfonic acid | Sigma | 44198 | DBSA |
| 96-well plate | Falcon | 353075 | |
| Acetone | Technic | 530 | |
| Acrylic resin | Fischer scientific | NC1455685 | |
| agarose | Sigma | A9539 | |
| autoclave | Tuttnauer | 3150 EL | |
| AZ 10XT | Microchemicals | Positive photoresist | |
| AZ 826 MIF Developer | Merck | 10056124960 | Metal-ion-free developer for the negative photoresist |
| AZ Developer | Merck | 10054224960 | Metal-ion-free developer for the positive photoresist |
| AZ nLof 2070 | Microchemicals | Negative photoresist | |
| Buprenorphine | Axience | ||
| Carprofen | Rimadyl | ||
| Centrifuge Sorvall Legend X1R | Thermo Scientific | 75004260 | |
| CMOS camera Prime 95B | Photometrics | ||
| CO2 incubator HERAcell 150i | Thermo scientific | ||
| DAC board | National Instruments | USB 6259 | |
| Déco spray Pébéo | Cultura | 3167860937307 | Black acrylic paint |
| Dextran Texas Red 70.000 | Thermofisher | D1830 | |
| Die bonding paste "Epinal" | Hitachi | EN-4900GC | Silver paste |
| Dimethyl sulfoxide | Sigma | D2438 | |
| Dispensing machine | Tianhao | TH-2004C | |
| Dulbecco’s Modified Eagle’s Medium + GlutaMAX™-I | Gibco | 10567-014 | |
| Dulbecco's Modified Eagle's Medium | Sigma | D6429 | |
| Egg incubator COUVAD'OR 160 | lafermedemanon.com | ||
| Ethylene glycol | Carl Roth | 6881.1 | |
| Fertilized eggs of Japanese quail | Japocaille | ||
| Fetal Bovine Serum | VWR | S181BH | |
| Flask | Greiner | 658170 | |
| Fluorescence macroscope | Leica MZFLIII | ||
| Gl261 | DSMZ | ACC 802 | |
| Gold pellets - Dia 3 mm x 6 mm th | Neyco | ||
| Handheld automated cell counter | Millipore | PHCC00000 | |
| Heating and drying oven | Memmert | UF110 | |
| Hexadimethrine Bromide Sequa-brene | Sigma | S2667 | |
| hot plate Delta 6 HP 350 | Süss Microtec | ||
| Illumination system pE-4000 | CoolLed | ||
| Infrared tunable femtosecond laser (Maï-Taï) | Spectra Physics (USA) | ||
| Ionomycin calcium salt | Sigma | I3909 | |
| Kapton tape SCOTCH 92 33x19 | 3M | Polyimide protection tape | |
| Lab made pulse generator | |||
| Labcoter 2 Parylene Deposition system PDS 2010 | SCS | ||
| Lenti-X 293 T cell line | Takara Bio | 63218 | HEK 293T-derived cell line optimized for lentivirus production |
| Lenti-X GoStix Plus | Takara Bio | 631280 | Quantitative lentiviral titer test |
| Mask aligner MJB4 | Süss Microtec | ||
| Micro-90 Concentrated cleaning solution | International Products | M9050-12 | |
| Microscope slides 76 x 52 x 1 mm | Marienfeld | 1100420 | |
| Needles 30G | BD Microlance 3 | 304000 | |
| PalmSens4 potentiostat | PalmSens | ||
| parylene-c : dichloro-p-cyclophane | SCS | 300073 | |
| PCB Processing Tanks | Mega Electronics | PA104 | |
| PEDOT:PSS Clevios PH 1000 | Heraeus | ||
| penicillin / streptomycin | Gibco | 15140-122 | |
| Petri dish | Falcon | 351029 | |
| pGP-CMV-GCaMP6f | Addgene | 40755 | plasmid |
| Phosphate Buffer Saline solution | Thermofisher | D8537 | |
| Plasma treatment system PE-100 | Plasma Etch | ||
| PlasmaLab 80 Reactive Ion Etcher | Oxford Instruments | ||
| Plastic mask | Selba | ||
| Plastic weigh boat 64 x 51 x 19 mm | VWR | 10770-454 | |
| Poly-dimethylsiloxane: SYLGARD 184 Silicone Elastomer Kit | Dow chemicals | 1673921 | |
| Polyimide copper film 60 µm (Kapton) | Goodfellow | IM301522 | |
| Propan-2-ol | Technic | 574 | |
| Protolaser S | LPKF | ||
| puromycin | Gibco | A11103 | |
| Round cover glass 5 mm diameter | Fischer scientific | 50-949-439 | |
| Scepter Sensors - 60 µm | Millipore | PHCC60050 | |
| Silicone adhesive Kwik-Sil | World Precision Instruments | ||
| spin coater | Süss Microtec | ||
| Spin Coater | Laurell | WS-650 | |
| Super glue | Office depot | ||
| tetracycline-free fœtal bovine Serum | Takara Bio | 631105 | |
| Thermal evaporator Auto 500 | Boc Edwards | ||
| Two-photon microscope | Zeiss LSM 7MP | ||
| U87-MG | ATCC | HTB-14 | Human glioblastoma cells |
| Ultrasonic cleaner | VWR | ||
| Vortex VTX-3000L | LMS | VTX100323410 | |
| Xfect single shots reagent | Takara Bio | 631447 | Transfection reagent |
参考文献
- Koshy, M., et al. Improved survival time trends for glioblastoma using the SEER 17 population-based registries. Journal of Neuro-Oncology. 107 (1), 207-212 (2012).
- Davis, M. E. Glioblastoma: Overview of disease and treatment. Clinical Journal of Oncology Nursing. 20, 2-8 (2016).
- Edd, J. F., Horowitz, L., Davalos, R. V., Mir, L. M., Rubinsky, B. In vivo results of a new focal tissue ablation technique: irreversible electroporation. IEEE transactions on Bio-Medical Engineering. 53 (7), 1409-1415 (2006).
- Breton, M., Mir, L. M. Microsecond and nanosecond electric pulses in cancer treatments. Bioelectromagnetics. 33 (2), 106-123 (2012).
- Frandsen, S. K., et al. Direct therapeutic applications of calcium electroporation to effectively induce tumor necrosis. Cancer Research. 72 (6), 1336-1341 (2012).
- Lee, J. H., Kim, H., Kim, J. H., Lee, S. -. H. Soft implantable microelectrodes for future medicine: prosthetics, neural signal recording and neuromodulation. Lab on a Chip. 16 (6), 959-976 (2016).
- Lee, H., Bellamkonda, R. V., Sun, W., Levenston, M. E. Biomechanical analysis of silicon microelectrode-induced strain in the brain. Journal of Neural Engineering. 2 (4), 81-89 (2005).
- Fattahi, P., Yang, G., Kim, G., Abidian, M. R. A review of organic and inorganic biomaterials for neural interfaces. Advanced Materials. 26 (12), 1846-1885 (2014).
- Lecomte, A., Degache, A., Descamps, E., Dahan, L., Bergaud, C. In vitro and in vivo biostability assessment of chronically-implanted Parylene C neural sensors. Sensors and Actuators B: Chemical. 251, 1001-1008 (2017).
- Dijk, G., Ruigrok, H. J., O'Connor, R. P. PEDOT:PSS-coated stimulation electrodes attenuate irreversible electrochemical events and reduce cell electropermeabilization. Advanced Materials Interfaces. 8 (19), 2100214 (2021).
- Chen, T. -. W., et al. Ultra-sensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Ribatti, D. Chapter 5 Chick embryo chorioallantoic membrane as a useful tool to study angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Valdes, T. I., Kreutzer, D., Moussy, F. The chick chorioallantoic membrane as a novel in vivo model for the testing of biomaterials. Journal of Biomedical Materials Research. 62 (2), 273-282 (2002).
- Ricard, C., Stanchi, F., Rougon, G., Debarbieux, F. An orthotopic glioblastoma mouse model maintaining brain parenchymal physical constraints and suitable for intravital two-photon microscopy. Journal of Visualized Experiments: JoVE. (86), e51108 (2014).
- Lefevre, M. C. Integrating flexible electronics for pulsed electric field delivery in a vascularized 3D glioblastoma model. npj Flexible Electronics. 5, 19 (2021).
- Perry, J. L., Ramachandran, N. K., Utama, B., Hyser, J. M. Use of genetically-encoded calcium indicators for live cell calcium imaging and localization in virus-infected cells. Methods. 90, 28-38 (2015).
- Blömer, U., et al. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. Journal of Virology. 71 (9), 6641-6649 (1997).
- Lenting, K., Verhaak, R., ter Laan, M., Wesseling, P., Leenders, W. Glioma: experimental models and reality. Acta Neuropathologica. 133 (2), 263-282 (2017).
- Hickman, J. A., et al. Three-dimensional models of cancer for pharmacology and cancer cell biology: Capturing tumor complexity in vitro/ex vivo. Biotechnology Journal. 9 (9), 1115-1128 (2014).
- Tay, S. L. M., Heng, P. W. S., Chan, L. W. The CAM-LDPI method: a novel platform for the assessment of drug absorption. Journal of Pharmacy and Pharmacology. 64 (4), 517-529 (2012).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic Membrane Models of Various Avian Species: Differences and Applications. Biology. 10 (4), 301 (2021).
- Ricard, C., et al. Phenotypic dynamics of microglial and monocyte-derived cells in glioblastoma-bearing mice. Scientific Reports. 6 (1), 26381 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved