Method Article
ヒト人工多能性幹細胞由来ミクログリアの免疫適格マウス脳への非侵襲的経鼻経路による移植
要約
ここに提示されたプロトコールは、免疫適格マウスにおける鼻腔内経路を介して誘導多能性幹細胞由来ヒトミクログリア(iPSMG)の脳への移植を可能にする。iPSMGの維持のための細胞の調製および経鼻移植ならびにサイトカイン混合物の投与のための方法が示されている。
要約
ミクログリアは、脳のマクロファージ様細胞の特殊な集団である。それらは生理学的および病理学的脳機能の両方に不可欠な役割を果たす。ミクログリアに関する現在の理解のほとんどは、マウスで行われた実験に基づいています。ヒトミクログリアはマウスミクログリアとは異なるため、マウスミクログリアの応答および特性は、必ずしもヒトミクログリアの応答および特性を表すとは限らない。さらに、倫理的および技術的困難のために、ヒトミクログリアに関する研究は、ミクログリアのインビボ特性を降伏させない体外培養系に限定されている。これらの課題を克服するために、コロニー刺激因子1受容体(CSF1R)アンタゴニストを用いて内因性ミクログリアの薬理学的枯渇と組み合わせて経鼻経路を介して誘導多能性幹細胞由来ヒトミクログリア(iPSMG)を免疫適格マウス脳に非侵襲的に移植する簡便化方法が開発されている。このプロトコールは、マウス脳に細胞を非侵襲的に移植する方法を提供し、したがって、生理学的および病理学的脳機能におけるヒトミクログリアのin vivo役割を評価するために有用であり得る。
概要
ミクログリアは、中枢神経系(CNS)におけるマクロファージ様細胞の特殊な集団であり、神経回路の発達、神経伝達の調節、脳恒常性の維持などの様々な脳機能の制御に不可欠な役割を果たす1,2,3。マウスミクログリアはヒトのミクログリアと多くの機能を共有しているが、種特有の違いを示している。したがって、様々な刺激に対するマウスミクログリアの応答は、必ずしもヒトミクログリア4、5、6の応答を表すとは限らない。多くの研究がヒトミクログリアを分析しているが、これらの実験はインビトロ研究に限定されている。インビトロで培養されたヒトミクログリアは、インビボのものとは非常に異なる形態学的特徴および遺伝子発現を示す。したがって、インビトロ実験は、ヒトミクログリアのインビボ特性を必ずしも降伏させるとは限らない。そのため、ヒトミクログリアを生体内で研究する実験系が必要とされている。
近年、ヒトミクログリアのin vivo特性を研究するため、in vitroで作製された誘導多能性幹細胞(iPSC)-又は胚性幹細胞由来ヒトミクログリアがマウス脳7、8、9、10、11、12、13、14に外科的に移植されている。このアプローチを用いて、ヒトミクログリアの様々なインビボ特徴が特徴付けられてきた。しかしながら、この方法の広範な使用は、2つの理由で制限されている。第一に、免疫不全マウスの要件である。したがって、様々な神経変性疾患におけるヒトミクログリアの役割を研究するためには、疾患変異を有するマウスを免疫不全マウスに交配する必要があり、これには多大な時間と労力が必要である。さらに、様々な神経学的障害において、末梢免疫細胞は、T細胞と同様に、ミクログリア機能を調節することができる15、16、17。したがって、免疫不全マウスで行われた実験は、インビボでのヒトミクログリアの真正な特性を表していない可能性がある。第二に、ミクログリアを移植するための侵襲的手術には、追加の機器とトレーニングが必要です。さらに、侵襲的移植中の脳損傷は、ミクログリア表現型を変化させ得る。
このプロトコールでは、免疫適格野生型マウスへのiPSMGの非侵襲的経鼻移植(Tsn)が記載されている18。内因性マウスミクログリア19とTsnを枯渇させるCSF1RアンタゴニストPLX5622の薬理学的ON/OFF を組み合わせることで、iPSMGをマウス脳に非侵襲的に移植することができる。さらに、外因性ヒトサイトカインの適用により、移植されたiPSMGは、免疫抑制剤なしで領域特異的な方法で60日間生存可能なままである。
プロトコル
本研究で使用したすべての動物は、日本生理学会発行の「生理科学分野における動物の世話と利用の指導原則」20に従い、山梨大学動物愛護委員会(山梨県、山梨県、山梨県、山梨県、 日本)。
細胞培地、移植用培地及び麻酔合剤の調製
- DMEMに10%ウシ胎児血清および0.1%ペニシリン/ストレプトマイシンを加えて細胞培地を調製する。
- 細胞培地にhCSF1(250ng/mL)およびhTGF-β1(100ng/mL)を加えて移植用培地を調製する。
- 11.8mLの通常の生理食塩水に0.45mLの塩酸メデトミジン、1.2mLのミダゾラム、および1.5mLの酒石酸ブトルファノールを混合することによって、腹腔内注射用の麻酔混合物を調製する。
2. iPSMGの調製
注:凍結iPSMG(材料表)は、使用時まで-80°Cで保持した。
- 凍結細胞を37°Cの水浴中で素早く解凍する。目に見えるすべての氷が溶けるまでサンプルを渦巻きます。
- 解凍したiPSMGを37°Cに加温した培養培地に加える。 10 mLの培地に1 mLの融解細胞含有培地(1×106 細胞)を加える。
- 細胞を300 x g で5分間遠心分離し、細胞ペレットを得た。
- 遠心分離後、細胞ペレットを乱すことなくすべての上清を除去する。上清の完全な除去は、移植培地中のサイトカイン濃度の希釈率を低下させるために望ましい。
- 移植用培地を加え、細胞濃度1 x105 細胞/μLを得た。
- iPSMGを氷の上に置き、直ちに移植に進む。
注:移植用のiPSMGの準備は、汚染を避けるためにクリーンベンチ上で行われます。
経鼻移植用マウス(Tsn)の調製
- 野生型雄マウス(C57BL/6J、8週齢)にPLX5622含有飼料を7日間給餌する。
- 7日目 の終わりに、PLXダイエットを中止し、研究の終わりまでマウスに通常の食事を与えてください。
注:PLX5622含有飼料は、1kgのAIN-93G(材料表)に1.2gのPLX5622を添加することによって調製される。
4. 細胞の経鼻移植
- PLX摂食の停止から24時間後、マウスの体重を量り、麻酔混合物(0.2mL/20g)の腹腔内注射を用いて麻酔する。
- ペダル離脱反射(しっかりしたつま先のピンチ)に対する無反応によって評価されるようにマウスを完全に麻酔した後、iPSMGのTsnの1時間前にPBS(100U/mL)中の2.5μLのヒアルロニダーゼを各鼻孔に10μLピペットチップを用いて2回投与し、鼻粘膜の透過性を高める。
- ヒアルロニダーゼの適用後、マウスを仰臥位に置く。
- iPSMGの経鼻移植の10分前にステップ4.2を繰り返します。
- 10 μLのピペットチップを使用して、マウスの1つの鼻孔に2.5 μLの細胞懸濁液を塗布します。
- マウスを仰臥位に置き、他の鼻孔に細胞懸濁液を投与する前に5分間置く。
- ステップ4.5および4.6を4回繰り返し、動物1匹あたり20μLの総容量を塗布する。
- 麻酔から回復するまで37°Cのヒートパッド上に仰臥位にマウスを置く。
- PLX供給の停止後48時間で、同じマウスでステップ4.1〜4.7をもう一度繰り返す。
注:iPSMGは移植中に氷上に置かれることに留意すべきである。
5. サイトカインの応用
- 麻酔混合物(0.2mL / 20g)の腹腔内注射によってマウスを麻酔する。
- 10 μLのピペットチップを使用して、マウスの1つの鼻孔に2.5 μLの移植培地を塗布する。
- マウスを仰臥位に置き、移植培地を他の鼻孔に投与する。
- ステップ5.2および5.3を4回繰り返し、動物1匹当たり20μLの全容量を塗布する。
注:移植培地(ヒトサイトカイン)の経鼻投与は、研究終了まで移植iPSMGの生存率のために12時間ごとに必要とされることに留意すべきである。
結果
この技術により、研究者はiPSMGを海馬および小脳に非侵襲的に移植することができるが、マウス脳の皮質には移植できない。研究を完了した後、麻酔をかけたマウスを氷冷PBS(−)の経心伝導灌流に供し、続いてPBS中の氷冷4%(w/v)パラホルムアルデヒドを投与した。脳を単離し、4%(w/v)パラホルムアルデヒドで一晩後固定し、30%(w/v)スクロースを含むPBS中で凍結保護した。さらに、脳を包埋化合物で凍結し、クライオスタット上で切片(厚さ20μmの冠状切片)した。切片をPBS(−)中で3回洗浄し(それぞれ10分)、透過処理し、10%正常ヤギ血清中の0.5%(v/v)Triton X-100で1時間ブロッキングした。次いで、切片を抗ヒト特異的細胞質マーカーであるSTEM121(1:100)および抗Iba1(1:1000)と共に5日間インキュベートした。次に、切片をPBS(−)でそれぞれ10分間3回洗浄し、二次抗体(Alexa Fluor 488-または546-結合マウス、またはウサギIgGs(1:1000)と室温で2時間インキュベートした。PBS(-)で3回洗浄した後、切片を退色防止マウント媒体を用いてスライドにマウントした。蛍光画像を取得するために、40倍の対物レンズを備えた共焦点顕微鏡を使用した。海馬および皮質における移植後2ヶ月におけるiPSMGの生存率を 図1に示す。移植細胞の数は、ヒト特異的抗体および汎ミクログリア/単球マーカーの両方に陽性である細胞をカウントすることによって決定することができるが、内因性マウスミクログリアは、前述のように汎ミクログリア/単球マーカーに対してのみ陽性である18。移植されたiPSMGはマウスミクログリアを置き換え、海馬においてラムナイズされた形態を示し、皮質18において検出されない。
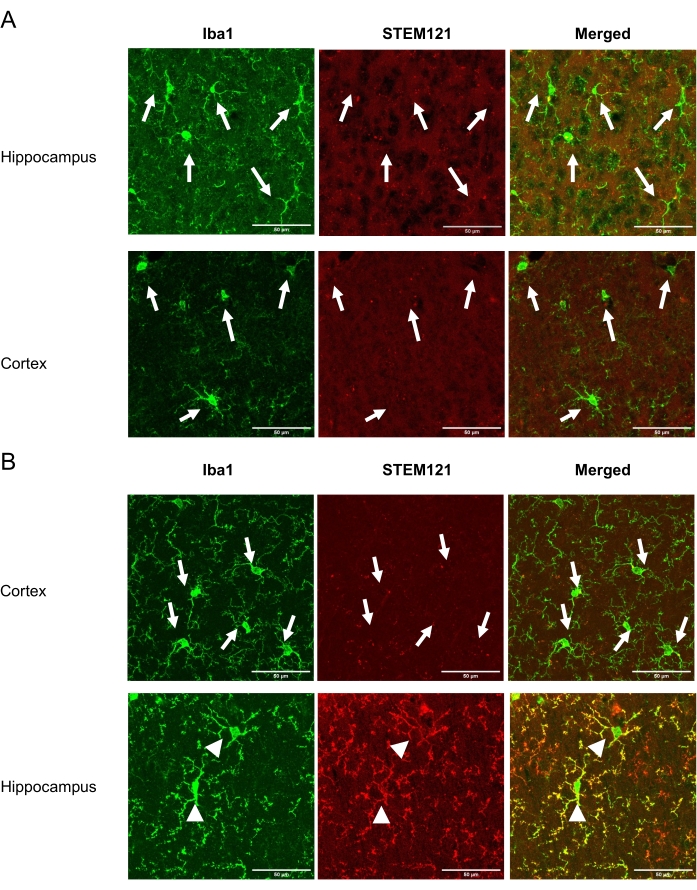
図1:Tsn後2ヶ月における皮質および海馬におけるiPSMGの生存率。左パネルは、汎ミクログリア/単球マーカーIba1(緑)による免疫染色を示しています。中央のパネルは、ヒト特異的細胞質マーカーSTEM121(赤色)による免疫染色を示す。右側のパネルは、Iba1とSTEM121免疫染色のマージ画像を示しています。(a)対照マウスでは、皮質と海馬の両方でマウスミクログリア(Iba1+/STEM121-)のみが検出された。(b)iPSMG移植マウスでは、皮質において、マウスミクログリア(Iba1+/STEM121-)のみが検出されたのに対し、海馬ではiPSMG(Iba1+/STEM121+)が検出された。画像の矢印はマウスミクログリアを示し、矢印はiPSMGを示す。蛍光画像取得には、40倍の対物レンズを搭載した共焦点顕微鏡を用いた。最大画像サイズ: 1024 x 1024 ピクセル.ズーム倍率: 2. スケールバー = 50 μm この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここでのプロトコールは、マウス脳へのiPSMGの非侵襲的移植について記述している。現在のプロトコールの独自性は、薬理学的PLX ON/OFF法と鼻腔内移植を組み合わせることで、免疫適格マウスの脳に非侵襲的に移植できることです。移植されたiPSMGは、空いているニッチを最大60日間占有することによって海馬および小脳におけるミクログリアの大部分を形成したが、皮質では形成しなかった。
iPSMGの効率的なTsnにとって重要な点は、(i)内因性マウスミクログリアの枯渇効率、(ii)12時間毎のヒトサイトカインの投与である。ミクログリアは脳内で独自の領域を維持します。マウスミクログリアの効率的な枯渇は、移植されたiPSMGの生着のためのニッチを提供するために必要とされる。内因性マウスミクログリアの枯渇が不十分であると、iPSMGによるマウス海馬および小脳のコロニー形成は観察されない。ミクログリアの生存率は、CSF1RおよびTGFBRシグナル伝達に依存する19、21、22。hCSF1はヒトミクログリアの生存率を選択的に増加させることが報告されており、hTGF-β1はミクログリアの生存率に必要であり、12時間ごとに投与された場合の炎症を抑制する21、23、24。外因性ヒトサイトカインの非存在下では、iPSMGはマウス脳において観察されない。さらに、iPSMGは、iPSMGの特性および移植効率を不可逆的に変化させるため、過度のピペッティングまたは他の手段によってiPSMGを機械的に活性化しないように注意しなければならない。iPSMGの満足のいくTsnが見られない場合は、移植前のiPSMGの生存率および内因性ミクログリアの枯渇を決定しなければならない。内因性マウスミクログリアの枯渇が90%以下の場合、PLX5622摂食時間は枯渇を増加させるように改変され得る。
侵襲的であり、追加の機器および訓練を必要とする従来の外科的移植方法と比較して、Tsnは、非侵襲的、単純、安定、かつ容易な方法での移植を可能にする。さらに、この方法は、免疫適格マウスの脳へのiPSMGの移植を可能にする。したがって、免疫適格疾患モデルマウスは、iPSMGの応答を研究するために使用することができる。
現在の方法の最大の欠点は、iPSMGの生着における局所的な不均一性である。脳領域特異的iPSMG移植が必要な場合、移植されたiPSMGは海馬および小脳にのみ60日間生着し、皮質には生着しないため、現在のプロトコルは適切ではない。さらに、外因性ヒトサイトカインを12時間ごとに鼻腔内に投与する必要性も、多大な労力を必要とし、高価であるため、現在のプロトコルの制限である。
結論として、免疫適格マウスの脳内へのiPSMGのTsnについての詳細なプロトコールが提供される。PLX5622によるマウスミクログリアの薬理学的ON/OFFと組み合わせると、このプロトコルはiPSMGの生着を成功させることを可能にする。移植細胞は、外因性サイトカインが適用されると持続的な期間、海馬および小脳において観察され得るので、現在の方法は、これらの領域における生理学的および病理学的状態の両方におけるヒトミクログリアの役割を評価するために価値がある可能性がある。
開示事項
著者らは開示するものは何もありません。
謝辞
助成助成:本研究は、日本学術振興会科学研究費補助金 17K14961 (PB), 20K15899 (PB), JP18K06481 (YS), JP20KK0366 (YS), 20H05902 (SK), 20H05060 (SK), 19H04746 (SK), 21H04786 (SK), 21K19309 (SK), AMED-CREST (SK), CREST (SK), 三菱科学財団 (SK), 武田科学財団 (SK), 山梨大学 Frontier Brain Science Grant (SK) の支援を受けた。
資料
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher Scientific | 10566 | |
| AIN 93G | Oriental Yeast Co | ||
| Anti-Iba1 antibody | FUJIFILM | 019–19741 | |
| Anti-STEM121 antibody | Takara Bioscience | Y40410 | |
| Butorphanol tartrate | Kyoritsu Seiyaku | 8019 | |
| Confocal microscope | Olympus | FV1200 | |
| Fetal bovine serum | GE Healthcare Life Sciences | SH30070.03 | |
| Frozen iPSMG | Shionogi & Co., Ltd | Laboratory for Drug Discovery and Disease Research | |
| Human colony stimulating factor 1 (hCSF1) | PeproTech | 300-25 | |
| Hyaluronidase | Sigma-Aldrich | H-3506 | |
| Medetomidine hydrochloride | Meiji Seika | VETLI5 | |
| Midazolam | Astellas | 18005A2 | |
| Paraformaldehyde | Wako Pure Chemical Industries | 162-16065 | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | |
| Pipette | Eppendorf | 3120000011 | |
| Pipette tip | Eppendorf | 30076028 | |
| PLX5622 | Amadis Chemical | A930097 | |
| Transforming growth factor-β1 (Tgf-b1) | PeproTech | 100-21 | |
| Triton X-100 | Sigma-Aldrich | X-100 | |
| VECTA SHIELD Hard Set Mounting Medium | Vector Laboratories | H-1400-10 | antifade mounting medium |
参考文献
- Hanisch, U. K., Kettenmann, H. Microglia: active sensor and versatile effector cells in the normal and pathologic brain. Nature Neuroscience. 10 (11), 1387-1394 (2007).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Paolicelli, R. C., et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 333 (6048), 1456-1458 (2011).
- Smith, A. M., Dragunow, M. The human side of microglia. Trends in Neurosciences. 37 (3), 125-135 (2014).
- Galatro, T. F., et al. Transcriptomic analysis of purified human cortical microglia reveals age-associated changes. Nature Neuroscience. 20 (8), 1162-1171 (2017).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science. 356 (6344), (2017).
- Abud, E. M., et al. iPSC-derived human microglia-like cells to study neurological diseases. Neuron. 94 (2), 278-293 (2017).
- Brownjohn, P. W., et al. Functional studies of missense TREM2 mutations in human stem cell-derived microglia. Stem Cell Reports. 10 (4), 1294-1307 (2018).
- Douvaras, P., et al. Directed differentiation of human pluripotent stem cells to microglia. Stem Cell Reports. 8 (6), 1516-1524 (2017).
- Haenseler, W., et al. A highly efficient human pluripotent stem cell microglia model displays a neuronal-co-culture-specific expression profile and inflammatory response. Stem Cell Reports. 8 (6), 1727-1742 (2017).
- Hasselmann, J., et al. Development of a chimeric model to study and manipulate human microglia in vivo. Neuron. 103 (6), 1016-1033 (2019).
- Mancuso, R., et al. Stem-cell-derived human microglia transplanted in mouse brain to study human disease. Nature Neuroscience. 22 (12), 2111-2116 (2019).
- Muffat, J., et al. Efficient derivation of microglia-like cells from human pluripotent stem cells. Nature Medicine. 22 (11), 1358-1367 (2016).
- Pandya, H., et al. Differentiation of human and murine induced pluripotent stem cells to microglia-like cells. Nature Neuroscience. 20 (5), 753-759 (2017).
- Schetters, S. T. T., Gomez-Nicola, D., Garcia-Vallejo, J. J., Van Kooyk, Y. Neuroinflammation: Microglia and T cells get ready to tango. Frontiers in Immunology. 8, 1905 (2017).
- Sulzer, D., et al. T cells from patients with Parkinson's disease recognize alpha-synuclein peptides. Nature. 546 (7660), 656-661 (2017).
- Togo, T., et al. Occurrence of T cells in the brain of Alzheimer's disease and other neurological diseases. Journal of Neuroimmunology. 124 (1), 83-92 (2002).
- Parajuli, B., et al. Transnasal transplantation of human induced pluripotent stem cell-derived microglia to the brain of immunocompetent mice. Glia. 69 (10), 2332-2348 (2021).
- Elmore, M. R., et al. Colony-stimulating factor 1 receptor signaling is necessary for microglia viability, unmasking a microglia progenitor cell in the adult brain. Neuron. 82 (2), 380-397 (2014).
- Zasshi, N. S. Guiding principles for the care and use of animals in the field of physiological sciences. Journal of the Physiologic Society of Japan. 64 (7-8), 143-146 (2002).
- Bohlen, C. J., et al. Diverse requirements for microglial survival, specification, and function revealed by defined-medium cultures. Neuron. 94 (4), 759-773 (2017).
- Butovsky, O., et al. Identification of a unique TGF-beta-dependent molecular and functional signature in microglia. Nature Neuroscience. 17 (1), 131-143 (2014).
- Regateiro, F. S., Howie, D., Cobbold, S. P., Waldmann, H. TGF-beta in transplantation tolerance. Current Opinion in Immunology. 23 (5), 660-669 (2011).
- Yoshimura, A., Muto, G. TGF-beta function in immune suppression. Current Topics in Microbiology and Immunology. 350, 127-147 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved